
中国海洋湖沼学会主办。
文章信息
- 王晓婷, 黄健, 刘云, 宋书群, 李才文. 2021.
- WANG Xiao-Ting, HUANG Jian, LIU Yun, SONG Shu-Qun, LI Cai-Wen. 2021.
- 不同氮浓度对红色赤潮藻(Akashiwo sanguinea)生长、孢囊形成和生源要素组成的影响
- EFFECTS OF NITROGEN NUTRITION ON THE GROWTH, ENCYSTMENT AND BIOGENIC ELEMENTS COMPOSITION OF AKASHIWO SANGUINEA
- 海洋与湖沼, 52(3): 665-672
- Oceanologia et Limnologia Sinica, 52(3): 665-672.
- http://dx.doi.org/10.11693/hyhz20201200339
文章历史
-
收稿日期:2020-12-23
收修改稿日期:2021-01-28
2. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Science, Qingdao 266071, China;
3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
红色赤潮藻(Akashiwo sanguinea)是一种在全球范围内广泛存在的海洋裸甲藻类, 常见于沿岸和河口地区, 属于广温广盐性物种, 营混合型营养生活, 并有较高的生长速率(吴玉霖等, 2001; Matsubara et al, 2007)。自2004年以来, 红色赤潮藻在我国厦门、烟台、深圳等地多次引起有害藻华(王金辉等, 2005; 喻龙等, 2009; 陈国斌, 2012; 马方方等, 2018)。红色赤潮藻藻华对无脊椎动物、鲍鱼幼虫、鱼类和海鸟危害显著(Horner et al, 1997; Botes et al, 2003; Jessup et al, 2009), 对渔业、水产养殖业造成了直接经济损失。
甲藻在不利于营养细胞生长的条件下, 通过产生孢囊来度过不良环境。在已知的大约2000种海洋甲藻中, 超过10%会产生孢囊(Bravo et al, 2014)。孢囊具有厚的囊壁, 能耐受不良环境条件和抵御病毒、寄生虫的侵袭(唐赢中等, 2016; Liu et al, 2020b)。Tang等(2015)首次记录了红色赤潮藻休眠孢囊形成与萌发全过程, 证实该藻可以通过有性生殖形成休眠孢囊, 但目前为止, 红色赤潮藻休眠孢囊形成机制仍未阐明。
前期, 我们在进行红色赤潮藻室内培养时, 发现氮营养对该藻生长特征、生化组成及光合特性产生显著影响(Liu et al, 2019, 2020a)。红色赤潮藻生理生化特征的改变, 必将对藻细胞生源要素组成产生影响。因此, 本文系统研究了不同氮浓度对红色赤潮藻生长、休眠孢囊形成及细胞内碳(C)、氮(N)、磷(P)含量的影响, 为揭示该藻对氮营养条件的适应机制提供参考。
1 材料与方法 1.1 藻种来源本实验所用红色赤潮藻藻种于2019年5月采集于青岛浮山湾海域, 经毛细管分离、纯化单细胞后, 于实验室内长期保种及培养。使用f/2 (不含Si)培养基, 培养温度(20±1) ℃, 光暗比为12 h : 12 h, 光照强度为3000 lx。培养所用海水取自青岛太平湾海域, 盐度为30±0.1, 经0.22 μm孔径混合纤维膜过滤后, 121 ℃高温灭菌30 min后使用。
1.2 培养实验实验组培养液体积为180 mL, 置于250 mL锥形瓶中, 取生长良好的指数期藻种, 按比例接种至培养液中, 接种后的初始藻密度约为500 cells/mL。实验共设6个氮浓度(NaNO3)处理组, 初始氮浓度分别为0、25、50、100、200、883 μmol/L, 其余营养盐按照f/2 (不含Si)配方添加。每个处理组设3个平行, 置于培养箱中进行一次性培养, 其他培养条件同1.1。培养过程中, 隔天取1 mL样品, 置于24孔板中, 在显微镜(Olympus, IX71)下观察、计数孢囊。然后向孔板中加入2.5 μL Lugol’s碘液, 混合均匀, 取100 μL样品在显微镜下计数营养细胞, 每个样品计数两次。
红色赤潮藻生长率(μ)用公式(1)计算:
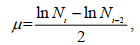 (1)
(1)式中, Nt表示t时刻细胞密度(cells/mL); Nt-2表示t-2时刻细胞密度(cells/mL)。
使用Olli等(2002)中描述的方法计算孢囊形成率S (%), 并使用以下公式(2)计算:
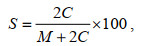 (2)
(2)式中, M表示营养细胞密度(cells/mL); C表示孢囊密度(cysts/mL)。
1.3 红色赤潮藻细胞生源要素组成分析 1.3.1 微藻培养实验组培养液体积为750 mL, 置于1 L锥形瓶中进行一次性培养, 初始藻密度约为800 cells/mL。实验设置3个氮浓度(NaNO3)处理组, 添加氮浓度分别为0、100、883 μmol/L, 每个处理组设3个平行, 其他培养条件同1.1。在培养的第16 d, 每个培养组随机选择30个细胞, 测量细胞大小。
1.3.2 藻体碳、氮含量测定微藻培养方法同1.3.1, 在培养的第0、2、4、6、8、12、16 d, 用GF/F滤膜(450 ℃, 10 h)低压(< 0.04 MPa)抽滤40—60 mL藻液。滤膜于60 ℃烘干24 h, 称重后, 使用元素分析仪(Elementar, vario Macro cube)测其碳、氮质量。
1.3.3 藻体磷含量测定微藻培养方法同1.3.1, 在培养的第0、2、4、6、8、12、16 d, 用GF/F滤膜(450 ℃, 10 h)低压(< 0.04 MPa)抽滤40—60 mL藻液。将滤膜置于10 mL样品瓶(450 ℃, 10 h)中, 加入2 mL 0.017 mol/L MgSO4溶液于60 ℃条件下烘干72 h, 马弗炉灼烧2 h, 降温后加入5 mL 0.2 mol/L HCl溶液, 85 ℃下烘烤30 min。采用磷钼蓝比色法测定溶液中磷含量(张海云等, 2013)。
1.4 数据统计与分析不同处理组藻生长率、孢囊形成率及生源要素组成差异采用单因素方差分析(one-way ANOVA)进行统计, 统计软件为SPSS 19.0; 以P < 0.01为差异极显著, P < 0.05为差异显著。采用Pearson相关性分析法对红色赤潮藻细胞生源要素组成与生长率及细胞干重进行相关性分析并制图, 软件为R 2.5.6。
2 结果 2.1 不同氮浓度对红色赤潮藻生长的影响不同氮浓度条件下红色赤潮藻的生长如图 1所示。结果表明, 培养第2 d, 所有氮处理组的细胞密度逐渐增加, 第4 d各处理组之间的细胞密度有显著性差异(P < 0.05)。培养第8 d时, 各处理组细胞生长逐步进入稳定期, 细胞密度随着初始氮浓度的增加而增大(883 μmol/L组除外), 中氮处理组(100和200 μmol/L)的细胞密度分别为(15737±844)、(18487±584) cells/mL, 是0 μmol/L氮添加组的2.3、2.6倍(图 1a)。
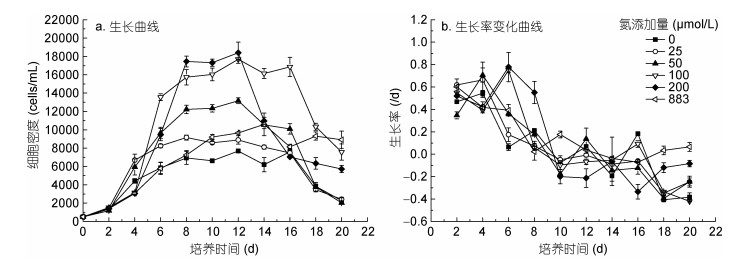 |
| 图 1 不同氮浓度条件下红色赤潮藻的生长状况 Fig. 1 Growth of A. sanguinea in different nitrogen concentrations |
不同氮浓度对红色赤潮藻的生长率有显著影响(P < 0.05)(图 1b)。低氮(0、25、50 μmol/L)、中氮(100和200 μmol/L)添加组的生长率分别在第4、6 d达到最大; 883 μmol/L氮添加组的生长率在培养前期呈下降趋势, 14 d后其生长率增加。在0—200 μmol/L范围内, 红色赤潮藻最大生长率随氮浓度的增加而增大, 0 μmol/L氮添加组最大生长率最小, 为0.56 /d; 200 μmol/L氮添加组的生长率最大, 为0.79 /d。883 μmol/L氮添加组的生长率要小于200 μmol/L处理组, 表明红色赤潮藻在200 μmol/L氮浓度条件下其生长率已达到较高水平。
2.2 不同氮浓度对红色赤潮藻休眠孢囊形成的影响不同氮浓度条件下红色赤潮藻休眠孢囊形成状况如图 2所示。在培养第4 d, 低氮处理组(25、50 μmol/L)首先观察到了休眠孢囊; 第6 d, 所有处理组均观察到休眠孢囊。培养第6—8 d, 各处理组休眠孢囊数量较低, 且各组之间没有显著差异(P > 0.05); 培养第10 d后, 各处理组之间孢囊密度出现显著性差异(P < 0.05), 且休眠孢囊数量随着培养时间的延长而逐渐增多; 第20 d时, 883 μmol/L处理组孢囊数量是其他处理组的2—3.5倍(图 2a)。
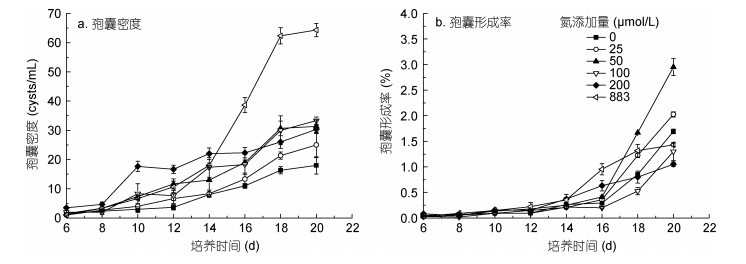 |
| 图 2 不同氮浓度条件下红色赤潮藻休眠孢囊的形成状况 Fig. 2 The formation of resting cysts of A. sanguinea in different nitrogen concentrations |
培养的第6—14 d, 各处理组的孢囊形成率没有显著差异(P > 0.05)。从16 d开始, 不同氮处理组孢囊形成率出现显著差异(P < 0.05); 第20 d时, 0—50 μmol/L氮添加组孢囊形成率随着初始氮浓度的升高逐渐增高, 50 μmol/L处理组最高, 为2.95%±0.16%; 随着氮浓度的进一步增加, 孢囊形成率降低, 200 μmol/L处理组的孢囊形成率最低, 为1.05%±0.04% (图 2b)。
2.3 不同氮浓度对红色赤潮藻细胞干重的影响不同氮浓度条件对红色赤潮藻细胞干重的影响如图 3所示。加氮处理组(100和883 μmol/L)的单位藻液体积干重明显高于0 μmol/L氮添加组。培养前6 d, 各处理组的单位藻液体积干重变化不大。第8 d开始, 883 μmol/L氮添加组的单位藻液体积干重呈增加趋势, 且明显高于其他两个处理组(图 3a)。0 μmol/L氮添加组的细胞干重在整个培养过程中持续减少; 加氮处理组的细胞干重呈先减小后增大的变化趋势, 第16 d时, 红色赤潮藻细胞干重随着初始氮浓度的增加而增大(图 3b)。
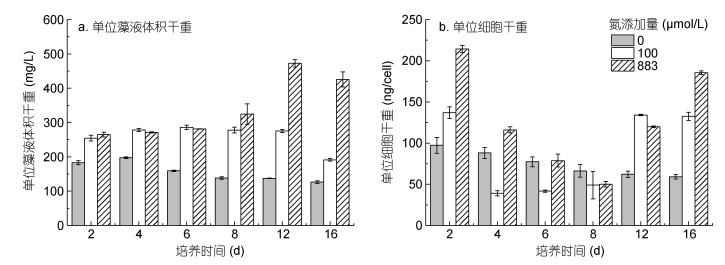 |
| 图 3 不同氮浓度对红色赤潮藻细胞干重的影响 Fig. 3 Effects of different nitrogen concentrations on cell dry weight of A. sanguinea |
此外, 不同氮浓度条件下, 红色赤潮藻细胞大小呈现显著差异(P < 0.05), 初始氮浓度越高, 细胞个体越大。高氮处理组(883 μmol/L)的藻细胞长(59.61± 1.95) μm, 宽(40.66±1.59) μm, 细胞个体明显大于0和100 μmol/L氮添加组(表 1)。
| 细胞大小(μm) | 氮添加量(μmol/L) | ||
| 0 | 100 | 883 | |
| 长度 | 42.74±1.10 | 49.22±0.73 | 59.61±1.95 |
| 宽度 | 25.30±0.86 | 29.79±0.56 | 40.66±1.59 |
不同氮浓度对红色赤潮藻的碳含量有显著影响(P < 0.05)。整个培养过程中, 0 μmol/L氮添加组的单位藻液体积碳含量处于较低水平且呈下降趋势; 加氮处理组(100和883 μmol/L)的单位藻液体积碳含量明显高于0 μmol/L氮添加组。883 μmol/L氮添加组的藻液体积碳含量逐渐增加, 在第12 d达到最大, 为(24.73±0.97) mg/L (图 4a)。0 μmol/L氮添加组的胞内碳含量在16 d内呈下降趋势; 100 μmol/L氮添加组的胞内碳含量先减少后增加, 在第16 d达到最大, 为(7.15±0.24) ng/cell; 883 μmol/L氮添加组的胞内碳含量始终高于其他两个处理组, 在第16 d达到最大, 为(10.94±0.004) ng/cell (图 4b)。
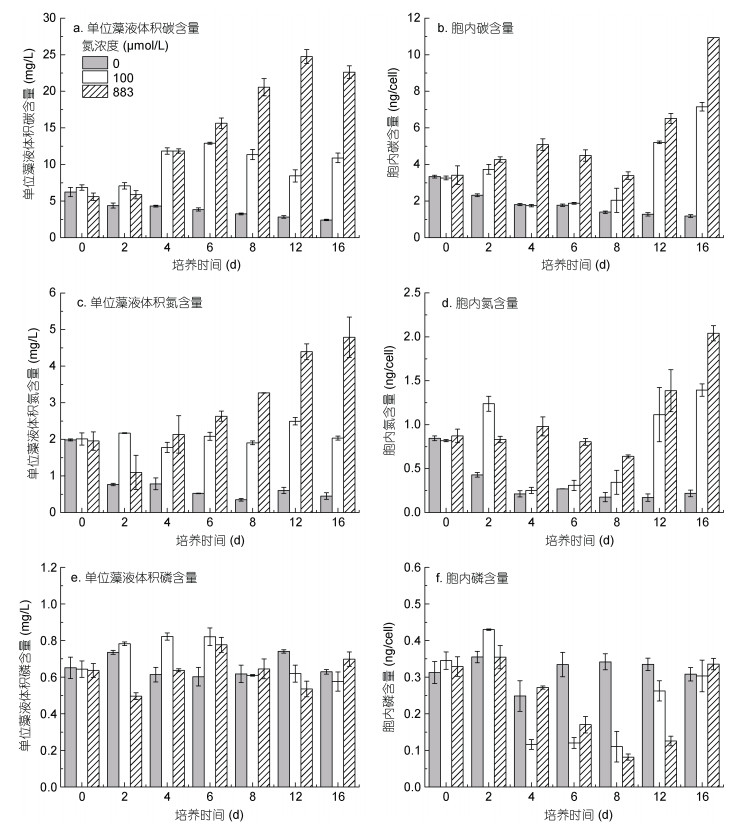 |
| 图 4 不同氮浓度对红色赤潮藻生源要素组成的影响 Fig. 4 Effects of different nitrogen concentrations on biogenic elements composition of A. sanguinea |
不同氮浓度对红色赤潮藻的氮含量有显著影响(P < 0.05)。整个培养过程中, 0 μmol/L氮添加组的单位藻液体积氮含量都处于较低水平; 加氮处理组(100和883 μmol/L)的单位藻液体积氮含量显著高于0 μmol/L氮添加组; 883 μmol/L氮添加组的单位藻液体积氮含量呈增加趋势, 在第16 d达到最大, 为(4.79± 0.55) mg/L (图 4c)。三个处理组的胞内氮含量在整个培养过程中都呈先减少后增加的趋势, 883 μmol/L氮添加组的胞内氮含量始终高于其他两个处理组, 第16 d达到最大, 为(2.04±0.087) ng/cell (图 4d)。
在整个培养过程中, 三个氮处理组的单位藻液体积磷含量无显著差异(P > 0.05) (图 4e)。红色赤潮藻生长6—12 d, 0 μmol/L氮添加组的胞内磷含量显著高于加氮处理组; 加氮处理组(100和883 μmol/L)的胞内磷含量先减少后增加; 第16 d, 各处理组的胞内磷含量无显著差异(P > 0.05) (图 4f)。
不同氮添加浓度对红色赤潮藻的C: N: P有显著的影响, 随着氮浓度的增加, 藻体C、N、P比率逐渐增大。在红色赤潮藻生长过程中, 含氮处理组的C: P、N: P随培养时间的延长而增大(表 2)。相关性分析表明, 单位细胞C、N、P含量与其生长率均呈显著负相关关系(P < 0.05), 与细胞干重呈极显著正相关关系(P < 0.01)。红色赤潮藻藻体N: P与细胞干重呈极显著正相关关系(P < 0.01)。
| 培养时间(d) | 0 μmol/L | 100 μmol/L | 883 μmol/L | |||||||||||
| C: N | C: P | N: P | C: N: P | C: N | C: P | N: P | C: N: P | C: N | C: P | N: P | C: N: P | |||
| 0 | 4:1 | 25:1 | 7:1 | 25:7:1 | 4:1 | 26:1 | 7:1 | 26:7:1 | 3:1 | 23:1 | 7:1 | 23:7:1 | ||
| 2 | 6:1 | 15:1 | 2:1 | 15:2:1 | 4:1 | 22:1 | 6:1 | 22:6:1 | 5:1 | 31:1 | 6:1 | 31:6:1 | ||
| 4 | 7:1 | 17:1 | 2:1 | 17:2:1 | 8:1 | 37:1 | 5:1 | 37:5:1 | 6:1 | 43:1 | 8:1 | 43:8:1 | ||
| 6 | 8:1 | 15:1 | 2:1 | 15:2:1 | 9:1 | 41:1 | 5:1 | 41:5:1 | 6:1 | 52:1 | 8:1 | 52:8:1 | ||
| 8 | 11:1 | 13:1 | 1:1 | 13:1:1 | 6:1 | 48:1 | 8:1 | 48:8:1 | 7:1 | 85:1 | 13:1 | 85:13:1 | ||
| 12 | 8:1 | 10:1 | 1:1 | 10:1:1 | 4:1 | 30:1 | 8:1 | 30:8:1 | 6:1 | 122:1 | 21:1 | 122:21:1 | ||
| 16 | 6:1 | 10:1 | 2:1 | 10:2:1 | 6:1 | 45:1 | 8:1 | 45:8:1 | 6:1 | 79:1 | 14:1 | 79:14:1 | ||
氮元素是浮游植物生长的必需元素, 参与合成浮游植物细胞的结构组分。本实验中, 氮添加浓度对红色赤潮藻的生长有显著影响, 在0—200 μmol/L浓度范围内, 最大细胞密度和生长率随着氮添加量的增加而增大。在氮限制条件下, 红色赤潮藻的细胞形态发生变化。刘云等人(2019)发现红色赤潮藻细胞体积随着培养液中氮的消耗而变小。本研究中, 0—50 μmol/L氮添加组在培养的第2—4 d细胞变小, 藻细胞分裂加快, 使得0—50 μmol/L氮添加组最先达到最大细胞密度和最大生长率。883 μmol/L氮添加组的生长率在培养的2—14 d逐渐下降, 培养一段时间后, 生长率开始增加, 但最大生长率仍低于200 μmol/L氮添加组。由于不同培养组细胞大小存在差异, 根据细胞密度计算得到的生长率不能完全反映生物量的变化, 由单位藻液体积干重或叶绿素a浓度变化评价红色赤潮藻的生长状况更合理。此外, 不同氮磷比对藻细胞的生长有明显的影响(孙军等, 2004), 883 μmol/L氮添加组过高的氮磷比可能不利于红色赤潮藻的生长, 该藻生长的最适氮磷比需要进一步实验验证。
甲藻通过有性生殖形成孢囊的特殊生活史, 为揭示有害藻华的成因提供了一种新的关键机理。孢囊的形成受多种因素的影响, 有研究证明, 氮限制或缺乏能促进孢囊形成, NH4+条件能促进红色赤潮藻孢囊的形成。本研究中, 氮添加量对孢囊形成率有显著的影响, 其中50 μmol/L氮添加组的孢囊形成率最大, 为2.95%±0.16%; 氮缺乏和氮浓度过高(> 50 μmol/L)均会降低红色赤潮藻休眠孢囊形成率。休眠孢囊的形成需要两个细胞进行有性融合, 藻密度越高, 藻细胞接触进行有性繁殖的概率越大, 越有利于孢囊的形成。0、25 μmol/L氮添加组休眠孢囊形成率低于50 μmol/L组, 可能与这两组细胞密度较低有关。而100和200 μmol/L氮添加组则是由于氮限制的程度低于50 μmol/L组, 不利于孢囊的形成。因此, 50 μmol/L氮添加组提供了适合孢囊形成的氮条件和细胞密度, 所以孢囊形成率最高。培养后期883 μmol/L氮添加组孢囊形成率的增加可能是受到磷限制的影响。
3.2 不同氮浓度对红色赤潮藻细胞生源要素组成的影响营养盐浓度不仅会影响藻类的生长状况和孢囊形成, 还会影响藻类细胞的生源要素组成。营养盐缺乏时, 细胞新陈代谢减缓, 藻细胞内的碳水化合物和蛋白质合成减少, 导致其碳、氮含量降低(Stramski et al, 2002; 王燕等, 2011)。本研究中, 不同氮浓度对红色赤潮藻碳、氮含量有显著的影响, 该藻的胞内碳、氮含量随氮浓度的升高而增加。在整个培养过程中, 0 μmol/L氮添加组的碳、氮含量显著低于加氮处理组(100和883 μmol/L)。培养后期(12、16 d), 加氮处理组藻细胞生长速率下降, 胞内碳、氮含量增加, 这可能与细胞内碳水化合物、蛋白质和脂肪酸的积累有关(Liu et al, 2019)。藻体生源要素含量的改变可引起藻细胞干重变化, 二者之间呈显著的正相关关系(图 5)。
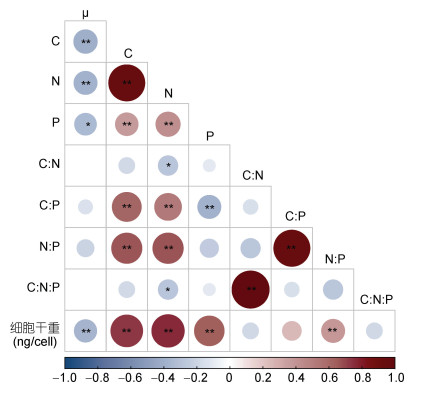 |
| 图 5 红色赤潮藻细胞生源要素与生长率及细胞干重的相关性分析 Fig. 5 Correlation analysis of biogenic elements composition with growth rate and cell dry weight of A. sanguinea 注: *P < 0.05; **P < 0.01; 红色: 正相关; 蓝色: 负相关 |
藻类对P的吸收方式为“奢侈”吸收, 当周围环境中磷含量充足时, 某些藻类能吸收环境中的磷酸盐并将其储存在胞内, 以维持低磷时的细胞繁殖(张胜花等, 2013)。本实验培养过程中, 不同处理组的单位藻液体积磷含量变化较小, 但胞内磷含量存在显著差异, 0 μmol/L氮添加组的胞内磷含量显著高于加氮处理组(100和883 μmol/L)。藻类对磷酸盐的吸收受细胞大小的影响, 小个体藻细胞的吸收速率高于大细胞(Shen et al, 2007)。0 μmol/L氮添加组藻细胞个体变小, 利于其对磷酸盐的吸收, 从而使该培养组胞内磷含量显著增高。此外, 有研究表明, 在缺氮条件下, 藻细胞会大量吸收P元素以达到体内的生化平衡, 这是藻类自我调整的策略之一(罗晓霞等, 2018)。
一直以来, 将浮游植物的P配额理解藻类元素化学计量学的基础, 在Redfield范式中, 其他主要的细胞成分都标准化为P含量(Fu et al, 2005)。经典Redfield定律认为藻类细胞组成的原子比率为C: N: P=106:16:1, 该比率随着藻类营养状况和藻种类群而变化。本实验中, 红色赤潮藻的C: P和N: P随氮浓度的增加而增加; 在培养过程中, 随培养时间的延长而增加; 该趋势与藻体C、N含量的变化趋势一致。藻体C: N: P与Redfield比值相差较大, 0与100 μmol/L两个处理组由于培养液中氮含量较低, N: P < 16:1, 从而导致藻细胞C: N: P小于Redfield值。而对于营养充足的883 μmol/L组, 在培养的前8 d, C: N: P也低于Redfield值, 可能是由于微藻对不同类型营养盐的贮存方式不同引起的(Zhao et al, 2009; 曲莹雪等, 2020)。有研究表明, 微藻磷库包括吸附于细胞表面的磷库和细胞内储存的磷库, 而碳、氮则无表面吸附现象, 受细胞表面吸附磷库的影响, C: N: P低于Redfield比值(Sañudo-Wilhelmy et al, 2004; Fu et al, 2005)。到了培养后期, 随着细胞表面吸附的磷库被藻细胞吸收, 藻体内含碳、氮化合物逐渐积累, 高氮处理组的C: N: P接近106:16:1。
红色赤潮藻属于广温广盐性种类, 在全球水体中广泛分布, 并在多地引发赤潮。本研究通过室内实验, 证实该种对低氮营养条件存在多种适应策略。首先, 该藻可通过减小细胞体积, 增大细胞比表面积, 增加藻细胞对营养盐尤其是磷酸盐的吸收; 其次, 低氮条件下, 该藻降低生长速率, 减少对氮营养的需求; 第三, 通过有性生殖形成休眠孢囊。休眠孢囊的形成有助于该藻度过不良环境条件, 为赤潮的年际复发提供种源, 且利于该藻扩大地理分布范围。
4 结论(1) 红色赤潮藻生长率随着初始氮浓度升高而增大, 200 μmol/L氮添加条件下该藻生长率最大。
(2) 不同氮浓度对红色赤潮藻休眠孢囊的形成有显著影响, 50 μmol/L氮添加组的孢囊形成率最高。
(3) 不同氮浓度对红色赤潮藻细胞生源要素组成变化有显著影响, 红色赤潮藻的胞内碳、氮含量随氮浓度的升高及藻的生长而增加。
(4) 红色赤潮藻的C: P和N: P随氮浓度的增加而增加, 随培养时间的延长而增加。
马方方, 郭翔宇, 徐丽君, 等. 2018. 深圳海域红色赤潮藻赤潮在线监测数据变化及其成因分析. 海洋技术学报, 37(4): 54-61 |
王燕, 李瑞香, 董双林, 等. 2011. 10种常见甲藻细胞体积与细胞碳、氮含量的关系. 生态学报, 31(21): 6540-6550 |
王金辉, 秦玉涛, 李志恩, 等. 2005. 南麂列岛自然保护区海域红色裸甲藻赤潮及其成因分析. 海洋科学, 29(2): 32-36 DOI:10.3969/j.issn.1000-3096.2005.02.007 |
曲莹雪, 金杰, 徐文琦, 等. 2020. 中国近岸海域优势藻种吸收利用磷的过程. 中国环境科学, 40(3): 1257-1265 DOI:10.3969/j.issn.1000-6923.2020.03.037 |
刘云, 陈田田, 宋书群, 等. 2019. 不同氮浓度条件下红色赤潮藻脂肪酸含量及组成特征. 海洋与湖沼, 50(2): 301-307 |
孙军, 刘东艳, 陈宗涛, 等. 2004. 不同氮磷比率对青岛大扁藻、新月柱鞘藻和米氏凯伦藻生长影响及其生存策略研究. 应用生态学报, 15(11): 2122-2126 DOI:10.3321/j.issn:1001-9332.2004.11.027 |
吴玉霖, 周成旭, 张永山, 等. 2001. 烟台四十里湾海域红色裸甲藻赤潮发展过程及其成因. 海洋与湖沼, 32(2): 159-167 DOI:10.3321/j.issn:0029-814X.2001.02.007 |
张胜花, 常军军, 孙珮石. 2013. 水体藻类磷代谢及藻体磷矿化研究进展. 生态环境学报, 22(7): 1250-1254 DOI:10.3969/j.issn.1674-5906.2013.07.027 |
张海云, 张庆, 韩海涛, 等. 2013. 海水中磷酸盐的检测方法研究进展. 海洋科学, 37(11): 116-125 |
陈国斌. 2012. 厦门海域一次冬季血红哈卡藻赤潮的初步分析. 福建水产, 34(5): 392-397 DOI:10.3969/j.issn.1006-5601.2012.05.008 |
罗晓霞, 刘锦上, 李长玲. 2018. 不同氮营养盐浓度对斜生栅藻生长及化学组成的影响. 广东农业科学, 45(1): 64-69 |
唐赢中, 胡章喜, 邓蕴彦. 2016. 休眠孢囊作为甲藻有害藻华年际频发和地理扩散一种关键机制的研究进展. 海洋科学集刊, (51): 132-154 DOI:10.12036/hykxjk20160730001 |
喻龙, 郝彦菊. 2009. 烟台四十里湾一次血红哈卡藻赤潮过程的分析. 海洋科学进展, 27(4): 516-522 DOI:10.3969/j.issn.1671-6647.2009.04.015 |
Botes L, Smit A J, Cook P A, 2003. The potential threat of algal blooms to the abalone (Haliotis midae) mariculture industry situated around the South African coast. Harmful Algae, 2(4): 247-259 DOI:10.1016/S1568-9883(03)00044-1 |
Bravo I, Figueroa R I, 2014. Towards an ecological understanding of dinoflagellate cyst functions. Microorganisms, 2(1): 11-32 DOI:10.3390/microorganisms2010011 |
Chen T T, Liu Y, Song S Q et al, 2015. The effects of major environmental factors and nutrient limitation on growth and encystment of planktonic dinoflagellate Akashiwo sanguinea. Harmful Algae, 46: 62-70 DOI:10.1016/j.hal.2015.05.006 |
Fu F X, Zhang Y H, Leblanc K et al, 2005. The biological and biogeochemical consequences of phosphate scavenging onto phytoplankton cell surfaces. Limnology and Oceanography, 50(5): 1459-1472 DOI:10.4319/lo.2005.50.5.1459 |
Horner R A, Garrison D L, Plumley F G, 1997. Harmful algal blooms and red tide problems on the U.S. west coast. Limnology and Oceanography, 42(5part2): 1076-1088 DOI:10.4319/lo.1997.42.5_part_2.1076 |
Jessup D A, Miller M A, Ryan J P et al, 2009. Mass stranding of marine birds caused by a surfactant-producing red tide. PLoS One, 4(2): e4550 DOI:10.1371/journal.pone.0004550 |
Liu Y, Chen T T, Song S Q et al, 2019. Variation in biochemical composition during encystment of the planktonic dinoflagellate Akashiwo sanguinea in N-limited cultures. Marine Biology, 166(9): 120 DOI:10.1007/s00227-019-3569-2 |
Liu Y, Chen T T, Wang X T et al, 2020a. Variation in the photosynthetic activities of the dinoflagellate Akashiwo sanguinea during formation of resting cysts. Marine Biology, 167(11): 341-357 DOI:10.1007/s00227-020-03774-y |
Liu Y Y, Hu Z X, Deng Y Y et al, 2020b. Evidence for production of sexual resting cysts by the toxic dinoflagellate Karenia mikimotoi in clonal cultures and marine sediments. Journal of Phycology, 56(1): 121-134 DOI:10.1111/jpy.12925 |
Matsubara T, Nagasoe S, Yamasaki Y et al, 2007. Effects of temperature, salinity, and irradiance on the growth of the dinoflagellate Akashiwo sanguinea. Journal of Experimental Marine Biology and Ecology, 342(2): 226-230 DOI:10.1016/j.jembe.2006.09.013 |
Olli K, Anderson D M, 2002. High encystment success of the dinoflagellate Scrippsiella cf. lachrymosa in culture experiments. Journal of Phycology, 38(1): 145-156 DOI:10.1046/j.1529-8817.2002.01113.x |
Sañudo-Wilhelmy S A, Tovar-Sanchez A, Fu F X et al, 2004. The impact of surface-adsorbed phosphorus on phytoplankton Redfield stoichiometry. Nature, 432(7019): 897-901 DOI:10.1038/nature03125 |
Shen H, Song L R, 2007. Comparative studies on physiological responses to phosphorus in two phenotypes of bloom-forming Microcystis. Hydrobiologia, 592(1): 475-486 DOI:10.1007/s10750-007-0794-3 |
Stramski D, Sciandra A, Claustre H, 2002. Effects of temperature, nitrogen, and light limitation on the optical properties of the marine diatom Thalassiosira pseudonana. Limnology and Oceanography, 47(2): 392-403 DOI:10.4319/lo.2002.47.2.0392 |
Tang Y Z, Gobler C J, 2015. Sexual resting cyst production by the dinoflagellate Akashiwo sanguinea: a potential mechanism contributing to the ubiquitous distribution of a harmful alga. Journal of Phycology, 51(2): 298-309 DOI:10.1111/jpy.12274 |
Zhao Y F, Yu Z M, Song X X et al, 2009. Biochemical compositions of two dominant bloom-forming species isolated from the Yangtze River Estuary in response to different nutrient conditions. Journal of Experimental Marine Biology and Ecology, 368(1): 30-36 DOI:10.1016/j.jembe.2008.09.023 |
 2021, Vol. 52
2021, Vol. 52


