
中国海洋湖沼学会主办。
文章信息
- 刘颖, 李进京, 陈晨, 刘懂, 焦海峰, 韩庆喜, 王一农, 尤仲杰. 2021.
- LIU Ying, LI Jin-Jing, CHEN Chen, LIU Dong, JIAO Hai-Feng, HAN Qing-Xi, WANG Yi-Nong, YOU Zhong-Jie. 2021.
- 浙江象山港岛屿春、夏季潮间带大型底栖生物的群落结构特征
- CHARACTERISTICS OF THE INTERTIDL MACROBENTHIC COMMUNITY STRUCTURE FROM NINE ISLANDS IN XIANGSHAN BAY, ZHEJIANG PROVINCE, IN SPRING AND SUMMER
- 海洋与湖沼, 52(3): 685-696
- Oceanologia et Limnologia Sinica, 52(3): 685-696.
- http://dx.doi.org/10.11693/hyhz20201000283
文章历史
-
收稿日期:2020-10-12
收修改稿日期:2020-12-23
2. 中国科学院城市环境研究所 厦门 361021;
3. 浙江万里学院 宁波 315100
2. The Institute of Urban Environment, Chinese Academy of Science, Xiamen 361021, China;
3. Zhejiang Wanli University, Ningbo 315100, China
象山港是位于浙江省北部沿海的半封闭式海湾, 港内地形复杂、岛礁众多、水产资源丰富(江志兵等, 2013), 是浙江省重要的渔业资源利用区、海水养殖区、海洋牧场示范区等多功能水域。近年来陆源污染(童晨等, 2018)、重金属污染(卢明龙等, 2015)、水产养殖污染(Han et al, 2013; 吴燕妮等, 2017)、电厂温排水污染(余晶等, 2017)等人为活动的干扰给原本较为脆弱的海湾生态系统造成巨大压力(毛硕乾等, 2016), 又有港内水体交换能力较弱、自净能力有限等原因(黄简易等, 2014), 象山港海域的生态环境问题日益突出。
潮间带作为陆地生态系统到海洋生态系统的过渡地带, 是人类活动和干扰最为严重的区域(金文育等, 2017), 大型底栖生物作为潮间带生态系统中的重要组成部分(Weis et al, 2003), 其物种组成、生物多样性、次级生产力等数值能准确地反映潮间带长期、宏观的变化(李新正, 2011), 作为物质循环与能量流动的主体也在潮间带生态系统中发挥着重要的作用(Rhoads et al, 1970)。因此可用于渔业资源增殖和养护(李亚芳等, 2018)、生态环境监测(Zhang et al, 2016)、海水质量及污染状况监测(刘迅等, 2017)等技术, 大型底栖生物群落结构的演变亦可反映潮间带的生态环境问题。
迄今为止, 未见象山港岛屿潮间带大型底栖生物群落结构、空间分布的详细报道。本文根据2015年4月(春季)及6月(夏季)在象山港主要岛屿潮间带调查获得的样本数据, 分析潮间带大型底栖生物群落结构特征, 探讨象山港岛屿潮间带大型底栖生物物种分布格局、季节动态变化以及空间分布特征, 以期为后续合理开发利用岛屿潮间带生物资源、环境修复和保护提供珍贵的历史资料和科学依据。
1 材料与方法 1.1 断面设置与采样时间分别于2015年4月(春季)和6月(夏季)对象山港主要岛屿进行潮间带生态调查, 包括港口区4个岛屿: 外干门岛(S1)、野龙山岛(S2)、大列山岛(S3)、小列山岛(S4)以及港中区5个岛屿: 缸山岛(S5)、双德山岛(S6)、悬山岛(S7)、白石山岛(S8)、中央山岛(S9)(图 1), 每个岛屿设置1个采样断面。
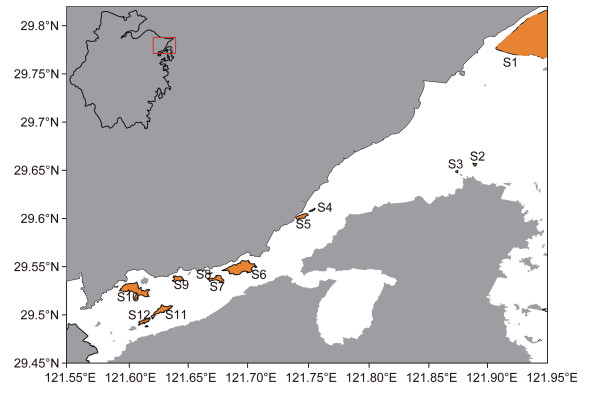 |
| 图 1 2015年象山港采样断面分布图 Fig. 1 Location of sampling section in Xiangshan Bay in 2015 注: 红色表示采样岛屿 |
于大潮汛期间在每个断面按照潮汐参数设置7个采样站点(分别为高潮带2个、中潮带3个、低潮带2个), 每个采样站点设置2个样方进行大型底栖生物的采集, 采样框内所有生物刮净置于标本瓶内带回实验室分析, 样本的采集、处理以及室内分析均按照《GB/T12763.6-2008. 海洋调查规范》执行(中华人民共和国国家质量监督检验检疫总局等, 2008)。物种鉴定参考相关书籍(黄宗国等, 2012), 所有物种鉴定到种。
1.3 数据计算 1.3.1 种类更替率与优势度运用种类更替率(R)计算春、夏季种类更替情况, 根据物种优势度(Y)筛选优势种(Pinkas et al, 1971; 刘迅等, 2017)。
种类更替率(R):
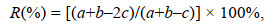 (1)
(1)物种优势度(Y):
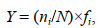 (2)
(2)其中, a、b分别为相邻2季种类数, c为相邻2季共有种类数; ni为第i个物种的个体数, N为各断面的总个体数, fi为该种在各断面出现的频率, 物种优势度(Y)≥0.02的物种作为优势种。
1.3.2 物种多样性指数使用Shannon-Weiner多样性指数(H′)、Margalef丰富度指数(d)与Pielou’s evenness均匀度指数(J′)对潮间带大型底栖生物多样性进行分析(Carlander, 1952; Pielou, 1975; Ulanowicz, 2001)。
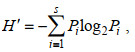 (3)
(3)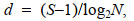 (4)
(4)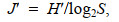 (5)
(5)式中, Pi为样本中第i种物种的个体数与样本中总个数的比值, N为样本中个体总数, S为样本中的种类总数。
1.3.3 次级生产力根据Brey经验公式计算次级生产力(Brey, 1990; Pielou, 1994; Mistri et al, 2001)。
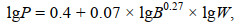 (6)
(6)式中, P为每站大型底栖生物次级生产力[单位: g/(m2·a)], B为每站大型底栖生物年平均去灰干重生物量[单位: g/m2], W为每站大型底栖生物个体年平均去灰干重[单位: g/ind.], A为每站大型底栖生物年平均栖息丰度[单位: ind./m2], 由于W=B/A, 转换后:
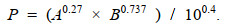 (7)
(7)P/B值是生产力与去灰干重生物量的比值, 被认为是种群最大可生产量的指示值, 该值指示了生物量的年度周转次数。
1.4 数据处理与分析利用Surfer 11软件对调查海域站位经纬度数据进行可视化标注处理; 使用Microsoft Excel 2013计算物种多样性指数。利用Past 3软件中的Bray-Curtis相似性系数聚类和非度量多维排序(Non-metric Multi- Dimensional Scaling, nMDS)进行聚类分析。为平衡优势种和非优势种的差异, 数据经二次方根转化后构建相似性矩阵, 并进行组间聚类分析(Group average cluster)和nMDS分析。在群落结构多变量分析中联合使用排序和聚类分析以相互验证分析结果是否可信(Schiel et al, 2004; 刘迅等, 2017)。根据各断面大型底栖生物丰度矩阵, 采用相似性百分比(SIMPER)分析每个聚类组组内贡献率超过3%的主要贡献种。
采用丰度/生物量比较曲线(ABC曲线)分析大型底栖生物群落扰动状况。当生物量曲线位于丰度曲线上方时表明群落结构近似平衡, 基本未受到人类活动或自然环境变化所引起的扰动; 当生物量曲线与丰度曲线之间出现相互交叉, 或者2曲线部分重叠在一起时, 群落受到中度扰动; 当丰度曲线整条位于生物量曲线上方时, 群落受到重度扰动(Warwick, 1986), 据此来判断象山港港内岛屿潮间带大型底栖生物群落的结构稳定性。
2 结果与分析 2.1 种类组成与时空分布 2.1.1 种类组成春、夏季共鉴定潮间带大型底栖生物52种, 隶属于9门35科, 包括大型底栖动物45种, 大型底栖藻类7种, 其中软体动物最多, 有28种(52.8%); 节肢动物次之, 有12种(23.1%)。
4月(春季)共采集到大型底栖生物42种, 其中软体动物最多, 有21种(50.0%); 节肢动物次之, 有11种(26.2%)。种类数最多的断面出现在缸山岛(22种); 最少的出现在白石山岛(8种)和中央山岛(8种)(图 2)。港中区物种数(33种) > 港口区(30种), 其中港中区软体动物、腔肠动物均多于港口区, 港口区各有1种脊索动物和棘皮动物, 港中区无此2类, 而港中区有2种环节动物, 港口区没有环节动物。
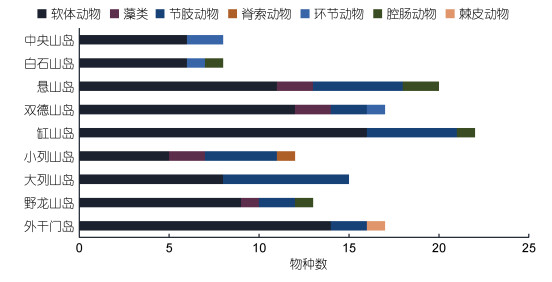 |
| 图 2 春季各断面大型底栖生物种类数 Fig. 2 The species number of macrobenthos collected from all sampling sections in spring |
6月(夏季)共采集大型底栖生物44种, 其中软体动物最多有25种(52.8%); 节肢动物次之, 有9种(20.9%); 没有采集到脊索动物和棘皮动物。种类数最多的断面出现在外干门岛(24种), 最少的出现在白石山岛(6种)和中央山岛(6种)(图 3)。港中区物种数(38种) > 港口区(30种), 其中软体动物港口区物种数(22种)多于港中区(19种), 港中区环节动物1种, 港口区没有环节动物。
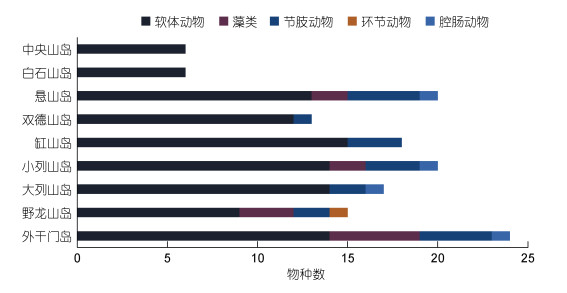 |
| 图 3 夏季各断面大型底栖生物种类数 Fig. 3 The species number of macrobenthos collected from all sampling sections in summer |
季节变化: 6月(夏季)物种数(44种)多于4月(春季)(42种), 其中软体动物所占比例最大, 棘皮动物所占比列最小。区域变化: 港中区物种数(46种)多于港口区(40种), 其中软体动物所占比例最大, 高于50%, 其次为藻类和节肢动物, 港口区没有脊索动物和棘皮动物(图 4)。
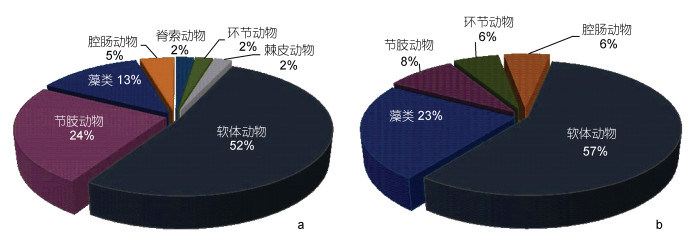 |
| 图 4 港口区和港中区大型底栖生物类群分布 Fig. 4 The species number and distribution of macrobenthos in Xiangshan port area and central area 注: a. 港口区; b. 港中区 |
大型底栖生物优势种共16种, 6月(夏季)15种多于4月(春季)12种, 其中短滨螺、中间拟滨螺、青蚶、齿纹蜒螺、熊本牡蛎、史氏背尖贝、疣荔枝螺、黑荞麦蛤、日本菊花螺、石莼、单齿螺为春、夏2季共有优势种(表 1)。春、夏季共有物种数34种, 季节间种类更替率为33.3%。
| 种中文名 | 种拉丁名 | 优势度(Y) | |
| 4月(春季) | 6月(夏季) | ||
| 短滨螺 | Littorina brevicula | 0.143 | 0.086 |
| 中间拟滨螺 | Littorinopsis intermedia | 0.100 | 0.096 |
| 齿纹蜒螺 | Nerita yoldi | 0.096 | 0.134 |
| 青蚶 | Barbatia virescens | 0.096 | 0.080 |
| 熊本牡蛎 | Crassostrea sikamea | 0.092 | 0.070 |
| 史氏背尖贝 | Notoacmea schrencki | 0.062 | 0.083 |
| 疣荔枝螺 | Thais clavigera | 0.050 | 0.047 |
| 黑荞麦蛤 | Xenostrobus atratus | 0.032 | 0.044 |
| 日本菊花螺 | Siphonaria japonica | 0.030 | 0.029 |
| 石莼 | Ulva lactuca | 0.027 | 0.022 |
| 海蟑螂 | Ligia oceanica | 0.027 | — |
| 单齿螺 | Monodonta labio | 0.026 | 0.037 |
| 长眼寄居蟹 | Paguristes pusillus | — | 0.031 |
| 短角双眼钩虾 | Ampelisca brevicornis | — | 0.024 |
| 鳞笠藤壶 | Tetraclita squamosa | — | 0.023 |
嫁 |
Cellana toreuma | — | 0.021 |
| 注: “—”表示该物种Y < 0.02 | |||
4月(春季)软体动物平均丰度最高744.01 ind./m2 (54.60%); 藻类次之463.37 ind./m2 (32.69%)。丰度最高的断面出现在小列山岛(2972.40 ind./m2), 占总丰度的14.94%; 最低的出现在外干门岛(1258.67 ind./m2), 占总丰度的6.33%。
6月(夏季)软体动物丰度最高783.57 ind./m2 (74.03%); 藻类次之150.02 ind./m2 (14.17%)。丰度最高的断面出现在大列山岛(7001.60 ind./m2), 占总丰度的32.77%。最低的出现在白石山岛(960 ind./m2), 占总丰度的4.49%, 该断面只有软体动物一个生物类群。
季节变化: 6月(夏季)平均丰度(2378.26 ind./m2)高于4月(春季)(2210.17 ind./m2)。其中软体动物所占丰度均为最高, 环节动物所占丰度均为最低。区域变化: 港口区平均丰度(2702.73 ind./m2)高于港中区(1963.35 ind./m2)。4月(春季)优势种中的日本菊花螺、黑荞麦蛤、疣荔枝螺、石莼、海蟑螂丰度高于6月(夏季); 6月(夏季)优势种中的短滨螺、短角双眼钩虾、鳞笠藤壶、嫁
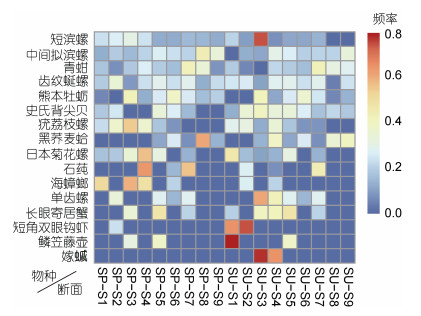 |
| 图 5 春、夏季各断面优势种的丰度分布 Fig. 5 The abundance distribution of dominant species collected from all sampling sections in spring and summer 注: SP. 4月(春季), SU. 6月(夏季); S1. 外干门岛, S2. 野龙山岛, S3. 大列山岛, S4. 小列山岛, S5. 缸山岛, S6. 双德山岛, S7. 悬山岛, S8. 白石山岛, S9. 中央山岛 |
4月(春季)软体动物平均生物量最高748.32 g/m2 (59.31%); 藻类次之253.20 g/m2 (20.07%)。生物量最高的断面出现在大列山岛(4607.78 g/m2), 占总生物量的21.78%。最低的出现在外干门岛(816.80 g/m2)。
6月(夏季)软体动物平均生物量最高458.98 g/m2 (63.92%); 节肢动物次之147.46 g/m2 (20.54%)。生物量最高的断面出现在悬山岛(3193.07 g/m2), 占总生物量的23.57%。最低的出现在白石山岛(410.56 g/m2), 占总生物量的13.74%, 该断面只有软体动物一个生物类群。
季节变化: 4月(春季)平均生物量(2074.85 g/m2)高于6月(夏季)(1505.23 g/m2), 其中软体动物所占生物量均为最高, 环节动物所占生物量均为最低。区域变化: 港中区平均生物量(2048.66 g/m2)高于港口区(1466.52 g/m2)。4月(春季)优势种中的短滨螺、疣荔枝螺、石莼、海蟑螂生物量高于6月(夏季); 6月(夏季)优势种中的黑荞麦蛤、日本菊花螺、短角双眼钩虾、鳞笠藤壶、嫁
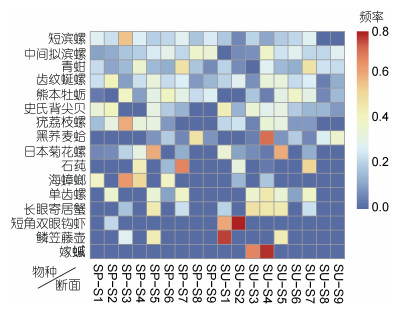 |
| 图 6 春、夏季各断面优势种的生物量分布 Fig. 6 The biomass distribution of dominant species collected from all sampling sections in spring and summer 注: SP. 4月(春季), SU. 6月(夏季); S1. 外干门岛, S2. 野龙山岛, S3. 大列山岛, S4. 小列山岛, S5. 缸山岛, S6. 双德山岛, S7. 悬山岛, S8. 白石山岛, S9. 中央山岛 |
4月(春季)次级生产力P值最大的断面出现在大列山岛(27.79 g/(m2·a)); 最小的出现在外干门岛(6.24 g/(m2·a))。6月(夏季)次级生产力P值最大的断面出现在双德山岛(17.91 g/(m2·a)); 最小的出现在野龙山岛(5.24 g/(m2·a))。
4月(春季)P/B值最大的断面出现在白石山岛(0.84/a); 最小的出现在大列山岛(0.57/a)。6月(夏季)P/B值最大的断面出现在大列山岛(1.22/a); 最小的出现在双德山岛(0.54/a)(表 2)。
| 断面 | 4月(春季) | 6月(夏季) | 平均值 | ||||||
| 次级生产力(g/(m2·a)) | P/B (/a) | 次级生产力(g/(m2·a)) | P/B (/a) | 次级生产力(g/(m2·a)) | P/B (/a) | ||||
| 外干门岛 | 6.24 | 0.72 | 8.70 | 0.67 | 7.47 | 0.68 | |||
| 野龙山岛 | 11.33 | 0.79 | 5.24 | 0.86 | 8.29 | 0.81 | |||
| 大列山岛 | 27.79 | 0.57 | 8.35 | 1.22 | 18.07 | 0.79 | |||
| 小列山岛 | 15.53 | 0.77 | 8.87 | 0.73 | 12.20 | 0.75 | |||
| 缸山岛 | 13.22 | 0.60 | 15.53 | 0.60 | 14.37 | 0.60 | |||
| 双德山岛 | 13.65 | 0.57 | 17.91 | 0.54 | 15.78 | 0.57 | |||
| 悬山岛 | 19.82 | 0.62 | 17.48 | 0.61 | 18.65 | 0.61 | |||
| 白石山岛 | 20.41 | 0.84 | 9.97 | 0.81 | 15.19 | 0.83 | |||
| 中央山岛 | 18.81 | 0.68 | 17.49 | 0.83 | 18.15 | 0.73 | |||
季节变化: 4月(春季)次级生产力(16.31 g/(m2·a))大于6月(夏季)(12.17 g/(m2·a)); 6月(夏季)P/B值(0.76/a)大于4月(春季)(0.68/a)。区域变化: 春、夏季次级生产力均是港中区大于港口区; P/B值均是港口区大于港中区。
2.3 群落结构稳定性 2.3.1 多样性指数Shannon-Weiner多样性指数(H′)4月(春季)(2.742) > 6月(夏季)(2.580)。4月(春季)H′最大的断面出现在缸山岛(3.396), 最小的出现在中央山岛(1.873)。6月(夏季)H′最大的断面出现在外干门岛(3.544), 最小的出现在中央山岛(1.000)(图 7)。H’春、夏季均是港口区高于港中区。
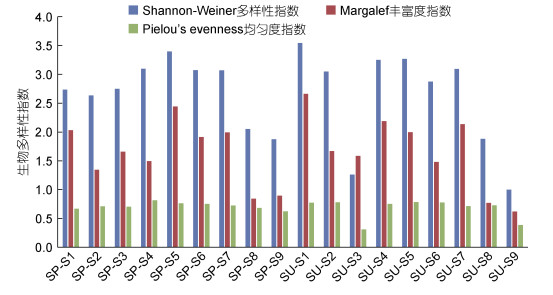 |
| 图 7 春、夏季各断面大型底栖生物多样性指数、丰富度指数和均匀度指数 Fig. 7 The diversity index, richness index, and evenness index of macrobenthos collected from all sampling sections in spring and summer 注: SP. 4月(春季), SU. 6月(夏季); S1. 外干门岛, S2. 野龙山岛, S3. 大列山岛, S4. 小列山岛, S5. 缸山岛; S6. 双德山岛, S7. 悬山岛, S8. 白石山岛, S9. 中央山岛 |
Margalef丰富度指数(d)6月(夏季)(1.678) > 4月(春季)(1.623)。4月(春季)d最大的断面出现在缸山岛(2.442), 最小的出现在白石山岛(0.844)。6月(夏季)d最大的断面出现在外干门岛(2.660), 最小的出现在中央山岛(0.618)(图 7)。d春、夏季均是港口区高于港中区。
Pielou’s evenness均匀度指数(J′)4月(春季)(0.716) > 6月(夏季)(0.667)。4月(春季)J′最大的断面出现在小列山岛(0.814), 最小的出现在中央山岛(0.624)。6月(夏季)J′最大的断面出现在缸山岛(0.783), 最小的出现在大列山岛(0.309)(图 7)。4月(春季)J′港口区高于港中区, 而6月(夏季)港中区略高于港口区。
季节变化: H′和J′均是4月(春季)大于6月(夏季), 而d是6月(夏季)大于4月(春季), 且中央山岛和白石山岛3种多样性指数均较低。区域变化: H′和d均是港口区高于港中区, 而J′均匀度指数是港中区高于港口区。
2.3.2 聚类分析4月(春季)和6月(夏季)Stress值分别为0.1165和0.022, 根据排序图中Stress参数值小于0.2判断分析结果可信(Warwick et al, 1994), 且认为聚类分析和nMDS分析相互印证, 图形具有解释意义。
根据聚类结果, 4月(春季)潮间带大型底栖生物在45%—52.5%之间的Bray-Curtis相似性水平上, 可划分为2个类群, 类群Ⅰ是包括4个断面(外干门岛、野龙山岛、大列山岛和小列山岛)的群落, 组内平均非相似性54.73%; 类群Ⅱ是包括5个断面(缸山岛、双德山岛、悬山岛、白石山岛和中央山岛)的群落, 组内平均非相似性57.70%(图 8)。其中类群Ⅰ为港口区岛屿, 类群Ⅱ为港中区岛屿, 港口区岛屿和港中区岛屿的平均非相似性为51.38%, 主要贡献种为黑荞麦蛤、疣荔枝螺、日本菊花螺、熊本牡蛎等(表 3)。
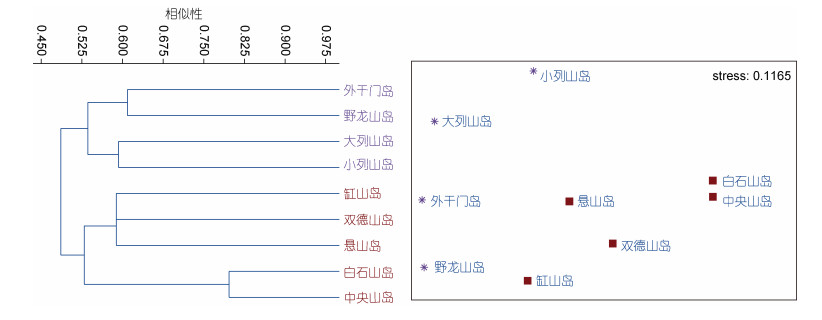 |
| 图 8 春季大型底栖生物聚类分析(Bray-Curtis)与非度量多位排序尺度分析(NMDS) Fig. 8 The cluster analysis and non-metric multi-dimensional scaling analysis of macrobenthos in spring 注: 星形. 类群Ⅰ; 实心正方形. 类群Ⅱ |
| 中文名 | 拉丁名 | 贡献率(%) | 累计贡献率(%) | 平均非相似性 |
| 黑荞麦蛤 | Xenostrobus atratus | 7.09 | 7.09 | 3.64 |
| 疣荔枝螺 | Thais clavigera | 6.07 | 13.17 | 3.12 |
| 日本菊花螺 | Siphonaria japonica | 4.61 | 17.77 | 2.37 |
| 熊本牡蛎 | Crassostrea sikamea | 4.57 | 23.35 | 2.35 |
| 石莼 | Ulva lactuca | 4.47 | 26.82 | 2.30 |
| 海蟑螂 | Ligia oceanica | 3.86 | 30.68 | 1.98 |
| 粗腿厚纹蟹 | Pachygrapsus crassipes | 3.52 | 34.20 | 1.81 |
| 短滨螺 | Littorina brevicula | 3.51 | 37.71 | 1.80 |
| 史氏背尖贝 | Notoacmea schrencki | 3.37 | 41.08 | 1.73 |
| 中间拟滨螺 | Littorinopsis intermedia | 3.01 | 44.09 | 1.55 |
| 注: 仅列出贡献率高于3%的主要贡献种 | ||||
6月(夏季)潮间带大型底栖生物在37.5%—45%之间的Bray-Curtis相似性水平上, 可划分为2个类群, 类群Ⅰ是包括2个断面(外干门岛、野龙山岛)的群落, 组内平均非相似性47.02%; 类群Ⅱ是包括7个断面(大列山岛、小列山岛, 缸山岛、双德山岛、悬山岛、白石山岛和中央山岛)的群落, 组内平均非相似性45.15%(图 9)。其中类群Ⅰ为港口区的岛屿, 类群Ⅱ中大列山岛和小列山岛为港口区岛屿; 其余为港中区岛屿。类群Ⅰ和类群Ⅱ的平均非相似性为61.97%, 主要贡献种为熊本牡蛎、黑荞麦蛤、小结节滨螺、蛎菜等(表 4)。
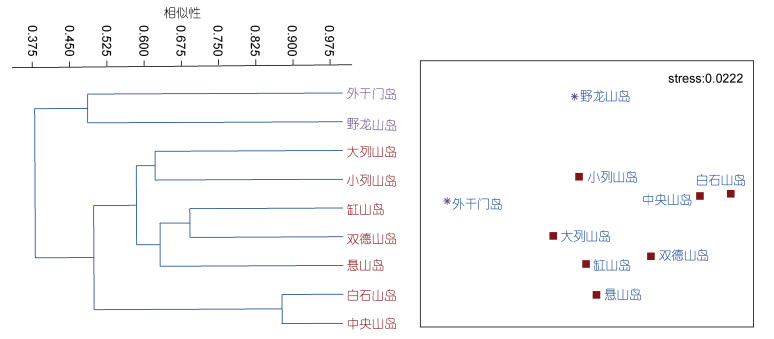 |
| 图 9 夏季大型底栖生物聚类分析(Bray-Curtis)与非度量多位排序尺度分析(NMDS) Fig. 9 The cluster analysis and non-metric multi-dimensional scaling analysis of macrobenthos in summer 注: 星形. 类群Ⅰ; 实心正方形. 类群Ⅱ |
| 中文名 | 拉丁名 | 贡献率(%) | 累计贡献率(%) | 平均非相似性 |
| 熊本牡蛎 | Crassostrea sikamea | 6.03 | 6.03 | 3.74 |
| 黑荞麦蛤 | Xenostrobus atratus | 5.78 | 11.81 | 3.58 |
| 小结节滨螺 | Nodilittorina exigua | 5.61 | 17.43 | 3.48 |
| 蛎菜 | Uluv conglobata | 4.72 | 22.14 | 2.92 |
| 中间拟滨螺 | Littorinopsis intermedia | 4.68 | 26.82 | 2.90 |
| 短角双眼钩虾 | Ampelisca brevicornis | 4.59 | 31.41 | 2.85 |
| 粒结节滨螺 | Nodilittorina exigua | 4.56 | 35.98 | 2.83 |
| 小石花菜 | Gelidium divaricatum | 4.41 | 40.39 | 2.74 |
| 短滨螺 | Littorina brevicula | 4.31 | 44.70 | 2.67 |
| 石莼 | Ulva lactuca | 3.53 | 48.23 | 2.19 |
| 单齿螺 | Monodonta labio | 3.10 | 51.33 | 1.92 |
| 疣荔枝螺 | Thais clavigera | 3.07 | 54.4 | 1.90 |
| 日本菊花螺 | Siphonaria japonica | 3.00 | 57.39 | 1.86 |
| 注: 仅列出贡献率高于3%的主要贡献种 | ||||
4月(春季)生物量/丰度比较曲线(ABC曲线)在种序10左右短暂相交后生物量曲线重新位于丰度曲线之上, 表明4月(春季)象山港岛屿潮间带大型底栖生物群落受到人类活动或自然环境变化所引起的轻度扰动(图 10a); 6月(夏季)生物量曲线在种序11之后与丰度曲线部分重叠在一起, 表明6月(夏季)象山港岛屿大型底栖生物群落受到轻度扰动(图 10b)。将春、夏季各岛屿大型底栖生物群落整合, 分析港口区和港中区岛屿受扰动状态; 港口区在种序为6前出现丰度曲线在生物量曲线之上, 而后生物量与丰度两曲线重合, 在种序为10之后生物量曲线位于丰度曲线之上, 表明港口区岛屿受到重度扰动(图 10c); 港中区在种序为9左右短暂相交后生物量曲线位于丰度曲线之上, 表明港中区岛屿受到轻度扰动(图 10d)。
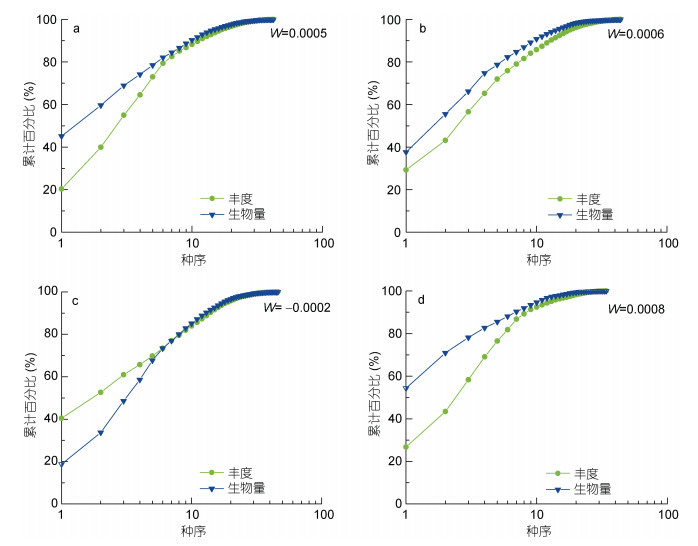 |
| 图 10 象山港岛屿潮间带大型底栖生物的丰度/生物量比较曲线 Fig. 10 The comparison curve of abundance/biomass of macrobenthos in the intertidal zone of islands in the Xiangshan Bay 注: a. 4月(春季)各断面; b. 6月(夏季)各断面; c. 春、夏季港口区各断面; d. 春、夏季港中区各断面 |
种类组成是群落结构最基本的特征, 可反映群落与生态环境的关系。象山港主要岛屿潮间带调查共获得大型底栖生物52种, 其中软体动物、节肢动物、藻类合计占比88.68%, 占有绝对的优势地位。象山港不同区域物种数表现为港中区多于港口区, 造成这一现象的原因可能是: 港口区填海造地、船厂建设、轮渡码头等海洋开发利用活动以及其他人类活动, 直接或者间接的影响了潮间带大型底栖生物的生活环境, 导致潮间带大型底栖生物种类数较少(毛硕乾等, 2016); 港中区悬山岛、白石山岛、中央山岛附近海洋牧场示范区的建设形成了保护区域, 人工鱼礁的投放致使周围海域浮游植物以及浮游动物的增加(王云龙等, 2019), 为大型底栖生物提供了丰富的饵料, 使得港中区潮间带大型底栖生物种类数较多。
象山港岛屿潮间带大型底栖生物相关研究未见报道, 没有历史数据进行直接对比, 与临近岛屿潮间带调查相比, 本次调查的物种数少于韭山保护区2016年调查的78种(徐开达等, 2018); 渔山列岛2014年调查的98种(金文育等, 2017); 洞头无居民列岛2011年调查的102种(彭茂潇等, 2013), 远少于南麂列岛2010年(张华伟等, 2018)调查所获的125种。主要原因是韭山列岛、渔山列岛和南麂列岛均为海洋自然保护区, 岛屿远离大陆海岸, 受到内陆影响较小, 生态环境保护较好。而象山港随着经济的快速发展, 多种形式的综合开发围绕港湾展开, 致使港内生态环境十分敏感; 且象山港海水交换能力较弱, 自净能力有限, 这些因素的持续影响引起象山港局部水域环境物理、化学环境参数的改变(陈涛等, 2014), 致使象山港岛屿潮间带大型底栖生物种类数较少、群落结构简单。
3.2 大型底栖生物次级生产力分析潮间带大型底栖生物次级生产力受到生物量、丰度、温度、盐度等多种环境因子的影响, 也受生物自身的影响(Brey et al, 1998; 储忝江等, 2016)。象山港岛屿潮间带大型底栖生物次级生产力与生物量显著相关(P=0.003 < 0.01), 与丰度相关性不显著(P > 0.05)。次级生产力4月(春季)高于6月(夏季), 平均生物量也是4月(春季)高于6月(夏季), 主要原因是每年的6月和7月软体动物门中的疣荔枝螺、熊本牡蛎大量出现补充群体, 因此6月(夏季)生物量较小, 同时这一结果也与渔山列岛调查结果次级生产力与生物量相关性极显著(P < 0.01), 与栖息密度相关程度不高的结论一致(焦海峰等, 2011)。象山港不同岛屿潮间带生态环境、地貌特征具有差异性, 同时由于港口区和港中区水域的陆源营养盐浓度以及人为活动影响等的不同, 岛屿潮间带大型底栖生物次级生产力的空间分布也存在差异。
种群最大可生产量的指示值即为P/B值, 该数值反映了种群的年龄结构和特异性群落组成, 其数值大小与生物的生命周期或发育速度密切相关(焦海峰等, 2011); 也反映了一个群落内物种的新陈代谢率的高低及世代更替的快慢(Tumbiolo et al, 1994); 个体小、生命周期短、对环境变化适应能力强的种类P/B值较高, 反之, 该值较低(Ceccherelli et al, 1991)。本文中P/B值(0.74/a)系数较低, 基本符合象山港岛屿潮间带以软体动物和节肢动物为主的群落分布特征, 大型底栖生物平均时代更替速度大约为每年0.74代(即平均每1.5年更替一代), 象山港岛屿潮间带大型底栖生物的新陈代谢率较低, 大型底栖生物群落更替时间较长, 群落结构相对稳定。
3.3 大型底栖生物群落结构稳定性分析大型底栖生物的群落结构稳定性由多种因素决定(刘迅等, 2017), 通常情况下可用聚类分析、ABC曲线、生物多样性指数来判断大型底栖生物群落稳定性和受扰动状况(Chainho et al, 2007; Specchiulli et al, 2010)。4月(春季)和6月(夏季)象山港岛屿潮间带大型底栖生物群落结构的聚类分析和nMDS分析结果表明, 4月(春季)可将各断面聚类为港口区岛屿和港中区岛屿2个类群; 6月(夏季)将外干门岛和野龙山岛聚类为一个类群; 其余岛屿聚类为一个类群。主要原因是4月(春季)差异性贡献率最大的黑荞麦蛤在港口区的4个岛屿中没有出现, 而6月(夏季)差异性贡献率较大的熊本牡蛎和黑荞麦蛤在外干门岛和野龙山岛没有出现, 且这些贡献率较大的物种均为两季节的优势种。利用Shannon-Weiner多样性指数(H')评价群落的稳定性状况, 根据4月(春季)H'(2.74)和6月(夏季)(2.58), 表明象山港岛屿潮间带大型底栖生物群落均受到轻度扰动, 这一结果与ABC曲线分析得出的结果一致。
4 结论象山港主要岛屿4月(春季)和6月(夏季)潮间带调查共采集大型底栖生物52种, 以软体动物、节肢动物、藻类为主; 夏季物种数多于春季, 港口区物种数多于港中区; 优势种以软体动物为主, 季节更替不明显; 平均丰度夏季高于春季, 平均生物量春季高于夏季; 春季和夏季生物多样性没有显著差异(P > 0.05); 大型底栖生物P/B值(0.74/a), 群落更替时间较长(平均每1.5年更替一代); ABC曲线则表明春季和夏季象山港岛屿潮间带大型底栖生物群落受到人类活动和自然环境变化所引起的轻度扰动; 综上所述, 相较于浙江沿海其他岛屿, 象山港主要岛屿潮间带大型底栖生物的物种数、生物多样性、丰度、生物量以及群落稳定性均较低。
王云龙, 李圣法, 姜亚洲, 等. 2019. 象山港海洋牧场建设与生物资源的增殖养护技术. 水产学报, 43(9): 1972-1980 |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008. GB/T 12763.6-2007海洋调查规范第6部分: 海洋生物调查. 北京: 中国标准出版社
|
毛硕乾, 林霞, 罗杨, 等. 2016. 象山港小型底栖动物群落结构及其与环境因子的相关性. 生态学报, 36(5): 1442-1452 |
卢明龙, 毛硕乾, 林霞, 等. 2015. 象山港表层沉积物6种重金属的污染特征及生态风险分析. 生物学杂志, 32(4): 30-34 DOI:10.3969/j.issn.2095-1736.2015.04.030 |
刘迅, 王莉, 顾晓英, 等. 2017. 浙江檀头山岛周围海域夏、秋季大型底栖动物群落结构特征. 海洋与湖沼, 48(3): 553-567 |
江志兵, 朱旭宇, 高瑜, 等. 2013. 象山港春季网采浮游植物的分布特征及其影响因素. 生态学报, 33(11): 3340-3350 |
李亚芳, 杜飞雁, 王亮根, 等. 2018. 粤西海陵湾养殖区邻近海域大型底栖动物生态学特征. 海洋与湖沼, 49(6): 1294-1307 |
李新正. 2011. 我国海洋大型底栖生物多样性研究及展望: 以黄海为例. 生物多样性, 19(6): 676-684 |
吴燕妮, 李冬玲, 叶林安, 等. 2017. 象山港海域水质与沉积物主要污染因子及污染源分析. 海洋环境科学, 36(3): 328-335 |
余晶, 朱艺峰, 戴美霞, 等. 2017. 电厂温排水增温对浮游动物粒径谱的影响. 应用生态学报, 28(5): 1687-1698 |
张华伟, 彭欣, 刘俊峰, 等. 2018. 南麂列岛冬夏季潮间带大型底栖生物群落结构. 上海海洋大学学报, 27(1): 133-140 |
陈涛, 王云龙, 廖勇. 2014. 象山港人工鱼礁区浮游动物种类组成及群落结构特征. 海洋科学, 38(7): 41-46 |
金文育, 彭欣, 王宁, 等. 2017. 渔山列岛夏季潮间带大型底栖生物群落结构研究. 海洋科学, 41(3): 17-25 |
徐开达, 戴乾, 卢衎尔, 等. 2018. 韭山保护区潮间带底栖生物种类组成与数量分布. 安徽农业科学, 46(26): 77-79 DOI:10.3969/j.issn.0517-6611.2018.26.024 |
黄宗国, 林茂. 2012. 中国海洋物种和图集上卷: 中国海洋物种多样性. 北京: 海洋出版社
|
黄简易, 朱艺峰, 王银, 等. 2014. 象山港浮游动物群落结构时空变化的定量驱动分析. 生态科学, 33(4): 713-722 |
彭茂潇, 钱培力, 张永普, 等. 2013. 洞头无居民海岛岩相潮间带夏季大型底栖动物群落格局. 生态学杂志, 32(9): 2469-2479 |
焦海峰, 施慧雄, 尤仲杰, 等. 2011. 浙江渔山列岛岩礁潮间带大型底栖动物次级生产力. 应用生态学报, 22(8): 2173-2178 |
储忝江, 盛强, 王思凯, 等. 2016. 沿潮沟级别大型底栖动物群落的次级生产力空间变异. 复旦学报(自然科学版), 55(4): 460-470 |
童晨, 李加林, 黄日鹏, 等. 2018. 陆源污染生态损害评估及其补偿标准研究——以象山港为例. 海洋通报, 37(6): 685-694 |
Brey T, 1990. Estimating productivity of macrobenthic invertebrates from biomass and mean individual weight. Archive of Fishery and Marine Research, 32: 329-343 |
Brey T, Gerdes D, 1998. High Antarctic macrobenthic community production. Journal of Experimental Marine Biology and Ecology, 231(2): 191-200 |
Carlander K D, 1952. Farm fish pond research in Iowa. The Journal of Wildlife Management, 16(3): 258-261 |
Ceccherelli V U, Mistri M, 1991. Production of the macrobenthic harpacticoid copepod Canuella perplexa. Marine Ecology Progress Series, 68: 225-234 |
Chainho P, Costa J L, Chaves M L et al, 2007. Influence of seasonal variability in benthic invertebrate community structure on the use of biotic indices to assess the ecological status of a Portuguese estuary. Marine Pollution Bulletin, 54(10): 1586-1597 |
Han Q X, Wang Y Q, Zhang Y et al, 2013. Effects of intensive scallop mariculture on macrobenthic assemblages in Sishili Bay, the northern Yellow Sea of China. Hydrobiologia, 718(1): 1-15 DOI:10.1007/s10750-013-1590-x |
Mistri M, Rossi R, Fano E A, 2001. Structure and secondary production of a soft bottom macrobenthic community in a Brackish Lagoon (Sacca di Goro, north-eastern Italy). Estuarine, Coastal and Shelf Science, 52(5): 605-616 |
Pielou E C, 1975. Ecological Diversity. New York: Wiley: 1-16 |
Pielou E C, 1994. Into the ecology breach. (book reviews: an introduction to mathematical ecology). An introduction to the mathematical theory of the Navier-Stokes equations. Springer-Verlag, 169-174
|
Pinkas L, Oliphamt M S, Iverson I L K, 1971. Food habits of albacore, Bluefin tuna, and bonito in California waters. California Department of Fish and Game Fish Bulletin, 152: 1-105 |
Rhoads D C, Young D K, 1970. The influence of deposit-feeding organisms on sediment stability and community trophic structure. Journal of Marine Research, 28: 150-178 |
Schiel D R, Steinbeck J R, Foster M S, 2004. Ten years of induced ocean warming causes comprehensive changes in marine benthic communities. Ecology, 85(7): 1833-1839 |
Specchiulli A, Renzi M, Scirocco T et al, 2010. Comparative study based on sediment characteristics and macrobenthic communities in two Italian lagoons. Environmental Monitoring and Assessment, 160(1-4): 237-256 |
Tumbiolo M L, Downing J A, 1994. An empirical model for the prediction of secondary production in marine benthic invertebrate populations. Marine Ecology Progress Series, 114: 165-174 |
Ulanowicz R E, 2001. Information theory in ecology. Computers & Chemistry, 25(4): 393-399 |
Warwick R M, 1986. A new method for detecting pollution effects on marine macrobenthic communities. Marine Biology, 92(4): 557-562 |
Warwick R M, Clarke K R, 1994. Relearning the ABC: taxonomic changes and abundance/biomass relationships in disturbed benthic communities. Marine Biology, 118(4): 739-744 |
Weis J S, Weis P, 2003. Is the invasion of the common reed, Phragmites australis, into tidal marshes of the eastern US an ecological disaster?. Marine Pollution Bulletin, 46(7): 816-820 |
Zhang J L, Zhang S P, Zhang S Q et al, 2016. What has happened to the benthic mollusks of the Yellow Sea in the near half century? Comparison on molluscan biodiversity between 1959 and 2007. Continental Shelf Research, 113: 21-29 |
 2021, Vol. 52
2021, Vol. 52


