
中国海洋湖沼学会主办。
文章信息
- 张荣良, 刘辉, 孙东洋, 侯朝伟, 赵建民. 2021.
- ZHANG Rong-Liang, LIU Hui, SUN Dong-Yang, HOU Chao-Wei, ZHAO Jian-Min. 2021.
- 烟台近岸人工鱼礁与自然岩礁底层渔业生物群落特征对比分析
- CHARACTERISTICS OF BENTHIC FISHERY COMMUNITY AT NATURAL REEFS AND ARTIFICIAL REEFS LOCATED IN YANTAI OFFSHORE AREA
- 海洋与湖沼, 52(3): 697-707
- Oceanologia et Limnologia Sinica, 52(3): 697-707.
- http://dx.doi.org/10.11693/hyhz20201000296
文章历史
-
收稿日期:2020-10-26
收修改稿日期:2021-02-06
2. 中国科学院烟台海岸带研究所牟平海岸带环境综合试验站 烟台 264100;
3. 中国科学院大学 北京 100049;
4. 烟台大学 烟台 264003
2. Muping Coastal Environment Research Station, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264100, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Yantai University, Yantai 264003, China
我国海域广阔, 海岸线漫长曲折, 拥有发展海洋经济的自然条件。然而, 随着沿海地区工业化和城市化的推进, 我国近岸局部海域正面临着水质污染、生态系统退化、多样性降低等多重问题, 严重威胁着我国的海洋生态安全的同时, 也阻碍了海洋生物资源的可持续开发利用。人工鱼礁作为海洋牧场建设的组成部分, 是当前改善近海海域生态环境、实现渔业资源修复的有效手段之一(Lima et al, 2019; 杨红生等, 2020)。一方面, 在泥沙底质海域人为构筑的“礁体”能够提高海底生境的复杂度, 为鱼类及底栖生物营造良好的栖息繁育场所, 促进生物的聚集和多样性的提高(Bohnsack, 1989; 汪振华等, 2010; Abecasis et al, 2013; Streich et al, 2018)。另一方面, 人工鱼礁能够阻止破坏性拖网, 有效地保障渔业资源的再生能力。
渔业生物群落的动态变化一直是人工鱼礁建设效果的重点评价内容。国内不少研究侧重于投礁前后、礁区内外渔业资源的对比, 以此反映“硬底质”的增加对当地生物资源的影响(董天威等, 2015; 刘鸿雁等, 2016; Chen et al, 2019)。相关研究结果普遍符合投礁预期, 凸显了人工鱼礁对于鱼类等生物的良好聚集或养护效果。然而, 或许是受限于地理条件不够理想, 国内关于人工鱼礁与临近自然岩礁生物群落对比的报道相对较少。在当前我国近海环境面临生境丢失或退化的大背景下, 人工鱼礁愈发被视为对自然岩礁的补充或代替, 其能否发挥与自然岩礁类似的生态功能, 早已成为人工鱼礁建设的期待及研究共识(Carr et al, 1997; Baine, 2001; Svane et al, 2001)。相比于人工鱼礁, 自然岩礁的生态系统往往更为成熟, 群落结构的复杂程度及生物多样性也普遍较高, 因而可以作为人工鱼礁生态效果评估的参考标准。由此, 开展人工与自然岩礁区生物群落的对比, 对于深入认识人工鱼礁当前的生态功能状况具有一定的积极意义。
已有研究发现, 影响人工鱼礁区群落时空格局的因素有很多, 如礁体沉放时间(Liu et al, 2017; Sanabria-Fernandez et al, 2018)、礁石材料与结构(Bohnsack et al, 1994; Marsden et al, 2016; Komyakova et al, 2019)、水深、水温等外部环境因子(Feyrer et al, 2011; França et al, 2012)、与自然礁区的距离(Strelcheck et al, 2005; Rosemond et al, 2018)、空间布局及位置(Folpp et al, 2013; Mills et al, 2017)等。这些因素会导致人工鱼礁可能会形成区别于自然岩礁生境的独特生物群落, 其当前及未来生态功能能否“模仿”甚至“超越”自然岩礁, 同样需要开展对比研究, 这对于人工鱼礁未来的建设及渔业管理政策的制定也能提供科学依据。
2016年开始, 人工鱼礁、海藻场和海草床的建设在国家级海洋牧场示范区重点开展, 以推动我国近岸生态环境的修复及渔业经济的健康发展。至今山东省已落实资金近8亿元, 支持32个海洋牧场建设, 项目和资金数量均占全国的三分之一以上(2019年农村农业部数据公布)。结合当前的政策导向, 本研究以烟台近岸的自然岩礁区、人工鱼礁区及泥沙区为研究区域, 根据2018—2019年4个季节的网具调查及同步环境监测数据, 对比分析了三个海域底层渔业生物群落的物种组成、CPUE、优势种、生物多样性等特征差异; 同时也探究了整个海域底层渔业生物群落与主要环境因子的相关性, 旨在为系统全面地评价山东省人工鱼礁的建设效果提供数据参考。
1 材料与方法 1.1 研究区域及站位布设本研究围绕山东半岛北部养马岛岩礁区及近岸人工鱼礁区开展, 研究区域共分为自然岩礁区(N区)、人工鱼礁区(A区域)及泥沙区(C区)3个区域(图 1)。其中, 自然岩礁区(N区)位于养马岛西北面; 人工鱼礁区(A区)位于养马岛东部的云溪人工鱼礁区, 其礁体材料以天然石块为主, 投放时间为5—9年; 泥沙区(C区)位于为人工鱼礁区东部毗邻区域, 底质为泥沙。三个调查区域的水深均为10—20 m, 各区域分别布设6个站位, 共计18个站位。
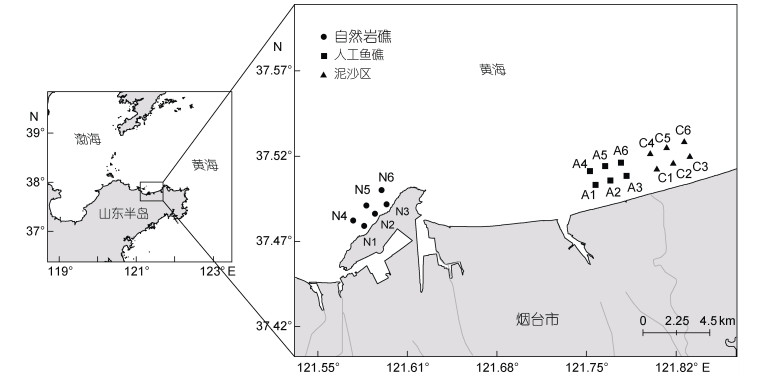 |
| 图 1 自然岩礁、人工鱼礁区及泥沙区采样站位 Fig. 1 Sampling sites at the natural reef, the artificial reef, and sand bottom areas 注: N. 自然岩礁区, A. 人工鱼礁区, C. 泥沙区 |
渔业生物调查于2018年5月(春)、8月(夏)、11月(秋)和2019年2月(冬) 共4个季度月开展。所用地笼网长8 m、宽40 cm、高25 cm, 笼网共分为20小节, 分别由相互间隔40 cm的21个钢筋框支撑, 网具进口纵深25 cm, 网目规格18.5 mm。将10个地笼网连接构成长80 m的网笼单元, 每个站位布放1个网笼单元, 布放时间为2个昼夜(48 h)。渔获物采集后带回实验室进行种类鉴定和生物学测量。采用多参数水质分析仪(RBR maestro)进行温度(℃)、溶氧(mg/L)、盐度、pH、叶绿素a (μg/L)等环境因子的测定。样品采集和数据分析方法参照《海洋调查规范GB/T 12763.1-2007》(国家质量监督检验检疫局, 2007)进行。
1.3 CPUE及群落结构多样性将渔业生物量数据标准化为单位捕捞努力量(catch per unit effort, CPUE), 定义为每天每网笼单元的渔获重量, 单位为g/(网·d)。
礁石区及对照区物种的季节更替率R(朱鑫华等, 1994), 计算公式为:
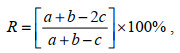 (1)
(1)式中, a与b分别为相邻季节的物种数, c为相邻季节共同的物种数。
物种的重要性程度利用相对重要性指数(index of relative importance, IRI)(Pinkas et al, 1971)分析。计算公式为:
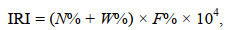 (2)
(2)式中, N%为渔获物中某物种的个数百分比; W%为渔获物中某物种的重量百分比; F%为物种出现频率, 即该物种出现的站位数占总调查站位数的比值。将IRI≥1000的物种设定为优势种。生物多样性特征采用Margalef种类丰富度指数D(Ulanowicz, 2001)、Shannon-Wiener多样性指数H′(Shannon, 1997)、Pielou均匀度指数J(Pielou, 1966)描述, 计算公式分别为:
Margalef种类丰富度指数D:
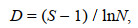 (3)
(3)Shannon-Wiener多样性指数H′:
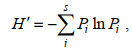 (4)
(4)Pielou均匀度指数J:
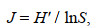 (5)
(5)式中, S为物种数, N为生物总个体数, Pi表示第i种生物在渔获总重量中的比例。
1.4 群落相似性分析及群落-环境相关性分析根据各站位CPUE经过平方根转换并计算得到的Bray-Curtis相似性矩阵, 采用相似性分析(analysis of similarities, ANOSIM)检验群落结构的区域间差异。采用相似性百分比(similarity percentage analysis, SIMPER)分析确定造成群落结构组间差异的歧化种(Clarke, 1993; Clarke et al, 2001)。
根据趋势对应分析(detrended correspondence analysis, DCA)第一个轴的梯度长度(length of gradient)选择最佳排序方法。若轴长大于4, 选用典范对应分析(canonical correspondence analysis, CCA); 若轴长小于3, 选用冗余分析(redundancy analysis, RDA); 若轴长介于3与4之间, 两者均可(Lepš et al, 2003)。结合蒙特卡洛(Monte Carlo)置换检验, 通过前向选择(forward selection)的方式, 筛选对群落结构有显著影响的环境变量(Lepš et al, 2003)。
采用单因素方差分析(One-way ANOVA)或非参数检验(Kruskal-Wallis test)分析不同区域、季节间的群落结构相关参数值是否存在显著差异, 显著性水平为α=0.05。所有数据统计、分析及绘图均使用R 3.6.3软件, ANOSIM分析、SIMPER分析及RDA分析均通过R中的“vegan”包完成。
2 结果 2.1 物种组成、CPUE与优势种四次调查共采集到渔业生物种类15目37科53种, 包括鱼类28种(其中鲈形目物种数最多, 共计17种); 甲壳类13种(虾类10种, 蟹类3种); 棘皮类2种, 腹足类4种, 头足类4种。自然岩礁区、人工鱼礁区及泥沙区全年采集到的渔业生物种分别为45、45和35种, 其中共有生物31种, 不同季节各区域采集到的生物门类及物种数如图 2所示。从物种数的季节均值来看, 自然岩礁区(30.8 ± 5.7)和人工鱼礁区(25.8 ± 3.4)均显著高于泥沙区(18.3 ± 1.0) (Kruskal-Wallis test, P < 0.05), 但两礁石区差异不显著(Kruskal-Wallis test, P > 0.05)。三个区域均表现出较为明显的物种季节更替, 自然岩礁、人工鱼礁及对照区更替率R的季节均值分别为0.42 ± 0.11、0.55 ± 0.14、0.54 ± 0.10。
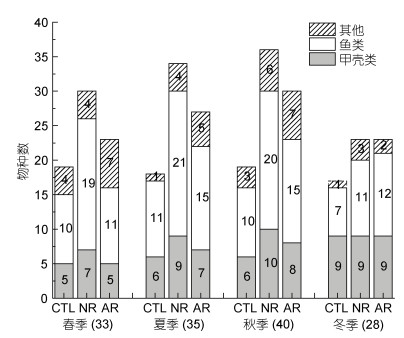 |
| 图 2 自然岩礁(NR)、人工鱼礁(AR)及泥沙区(CTL)物种数的季节波动 Fig. 2 The species number in different categories across seasons at the natural reef (NR), the artificial reef (AR), and the sand bottom area (CTL) |
两类礁石区及泥沙区的CPUE结果如图 3所示, 两礁石区在4个季节的CPUE均显著高于泥沙区(ANOVA, P < 0.05)。泥沙区CPUE的季节均值为(595.6 ± 318.4) g/(网·d), 其中鱼类的CPUE均值为(313.7 ± 231.4) g/(网·d), 占51.27%。人工鱼礁CPUE季节均值为(1412.7 ± 782.6) g/(网·d), 为泥沙区的2.37倍, 其中鱼类CPUE的均值为(794.4 ± 607.5) g/(网·d), 为泥沙区的2.53倍, 占CPUE总量的55.71%。自然岩礁CPUE在春夏季节明显高于人工鱼礁, 其季节均值为(1955.7 ± 1002.7) g/(网·d), 为人工鱼礁的1.38倍, 其中鱼类为(1029.9 ± 508.9) g/(网·d), 为人工鱼礁的1.29倍, 占CPUE总量的52.66%。春、夏、秋三季, 自然岩礁及泥沙区CPUE的季节波动不明显(Kruskal-Wallis test, P > 0.05), 人工鱼礁区秋季CPUE明显高于其他季节(Kruskal-Wallis test, P < 0.05)。冬季时, 三个区域的CPUE均处于全年最低。
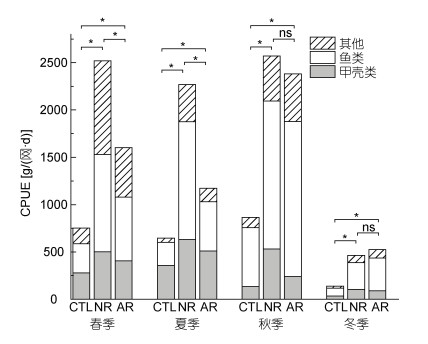 |
| 图 3 自然岩礁(NR)、人工鱼礁(AR)和泥沙区(CTL)不同生物门类CPUE的季节变化 Fig. 3 Seasonal variation in CPUE of different categories at the natural reef (NR), the artificial reef (AR), and the sand bottom area (CTL) 注: *为差异显著(P < 0.05), ns为差异不显著 |
根据IRI的全年计算结果(表 1), 自然岩礁区的优势种为大泷六线鱼(Hexagrammos otakii)、长蛸(Octopus variabilis)、许氏平鲉(Sebastes schlegelii)、日本蟳(Charybdis japonica)及细条天竺鲷(Apogon lineatus), 所占重量百分比合计55.25%。人工鱼礁的整体优势种为大泷六线鱼、许氏平鲉、日本蟳以及多棘海盘车(Asterias amurensis), 所占重量百分比合计62.34%; 泥沙区的优势种仅为许氏平鲉、日本蟳以及钝吻黄盖鲽(Pseudopleuronectes yokohamae), 所占重量百分比合计56.33%。优势种CPUE的区域对比显示, 人工鱼礁区许氏平鲉的CPUE季节均值分别为自然岩礁及泥沙区的1.59及4.59倍; 大泷六线鱼、日本蟳的CPUE在两礁石区的差异不明显, 自然岩礁及人工鱼礁大泷六线鱼CPUE的季节均值分别为泥沙区的3.21、2.58倍, 日本蟳的CPUE季节均值分别为泥沙区的1.35、1.25倍; 泥沙区钝吻黄盖鲽的CPUE季节均值分别为自然岩礁及人工鱼礁的1.92、2.92倍。根据IRI在各季节的单独计算结果, 优势种组成同样存在的区域差异和季节变化(图 4)。例如, 泥沙区的全年优势种为钝吻黄盖鲽; 人工鱼礁的全年优势种为许氏平鲉; 除冬季外, 自然岩礁区的季节优势种均为长蛸、日本蟳。春、夏季时, 日本蟳在三个区域均为优势种, 但其优势度存在区域差异; 细条天竺鲷仅在自然岩礁表现出优势地位。进入秋冬季, 日本蟳的优势地位明显降低, 而长足七腕虾、多棘海盘车的优势地位提高。
| 优势种 | 拉丁名 | CPUE(g/(网·d)) | IRI(%) | ||||
| 泥沙区 | 自然岩礁 | 人工鱼礁 | 泥沙区 | 自然岩礁 | 人工鱼礁 | ||
| 大泷六线鱼 | Hexagrammos otakii | 205.9 ± 135.9 | 166 ± 186.5 | 8.89 | 10.81 | ||
| 多棘海盘车 | Asterias amurensis | 117.9 ± 103.3 | 9.57 | ||||
| 钝吻黄盖鲽 | Pseudopleuronectes yokohamae | 79.8 ± 44.3 | 22.84 | ||||
| 日本蟳 | Charybdis japonica | 180.3 ± 120.7 | 243.2 ± 150.2 | 226 ± 207.1 | 27.42 | 11.82 | 26.42 |
| 细条天竺鲷 | Apogon lineatus | 171 ± 146.1 | 14.79 | ||||
| 许氏平鲉 | Sebastes schlegelii | 89.8 ± 74.1 | 231.4 ± 153.7 | 367.4 ± 281.7 | 10.18 | 9.75 | 19.34 |
| 长蛸 | Octopus variabilis | 271.7 ± 188.8 | 9.60 | ||||
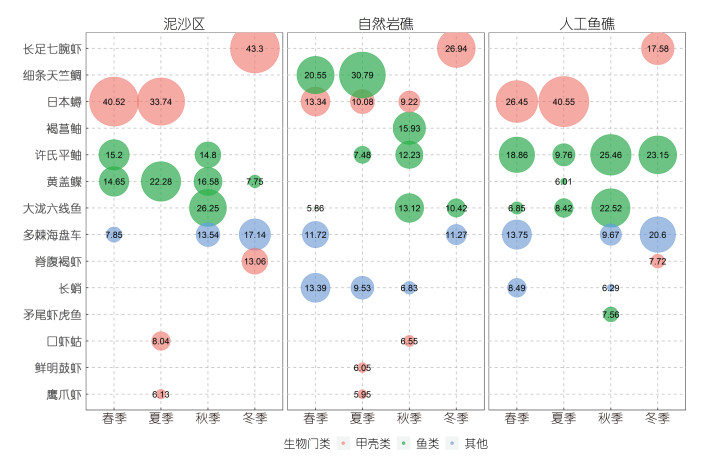 |
| 图 4 各季节自然岩礁、人工鱼礁及泥沙区的优势种及其重要性百分比(IRI) Fig. 4 Dominate species and the respective IRI percentage at the natural reef, the artificial reef, and the sand bottom area in season |
多样性相关参数在自然岛礁、人工鱼礁与泥沙区的季节变动, 如图 5所示。物种多样性指数H′的季节波动不大, 整体呈现出自然岩礁(季节均值为H′ = 2.39) > 人工鱼礁(H′ = 1.96) > 泥沙区(H′ = 1.76)的趋势。自然岩礁区渔业生物的均匀度指数(J = 0.83)显著高于人工鱼礁区(J = 0.74) (ANOVA, P < 0.05), 而两礁石区与泥沙区(J = 0.79)的差异均不显著。丰富度指数D在自然岩礁区及人工鱼礁区都呈现出冬季前逐渐上升, 冬季后逐渐下降的趋势; 而泥沙区的种类丰富度指数D呈现出进入秋冬季逐渐下降的趋势。另外, 自然岩礁(D = 2.97)与人工鱼礁(D = 2.91)的丰富度指数差异不大, 但均显著高于泥沙区(D = 2.19) (ANOVA, P < 0.05)。
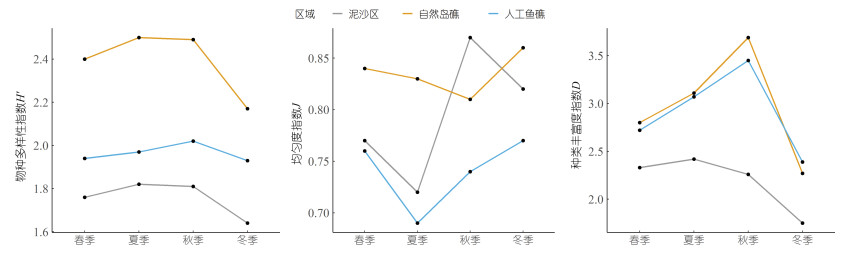 |
| 图 5 多样性相关参数在自然岛礁、人工鱼礁与泥沙区的季节变动 Fig. 5 Seasonal fluctuation of diversity indices at in the natural reef, the artificial reef, and the sand bottom area |
三个区域渔业生物群落结构的配对ANOSIM分析发现, 除冬季外, 人工鱼礁与自然岩礁的渔业群落结构都存在显著性差异(P < 0.05), 其中夏季差异最大(R = 0.659)。除春季外, 人工鱼礁区与泥沙区的渔业群落结构都存在显著性差异(P < 0.05), 其中冬季差异最大(R = 0.719)。自然岩礁区与泥沙区在4个季节均差异显著(P < 0.05), 其中夏季差异最大(R = 0.907)。
根据SIMPER分析结果, 各季节引起群落结构区域间差异的主要歧化种如图 6所示, 自然岩礁与人工鱼礁群落结构差异的主要歧化种为许氏平鲉, 其差异贡献率的季节均值为8.13%, 其次为长蛸(7.17%)和细条天竺鲷(6.69%)。引起自然岩礁与泥沙区的主要歧化种为长蛸(10.17%)、细条天竺鲷(8.03%)、多棘海盘车(7.97%)和褐菖鲉(7.30%)。引起人工鱼礁与泥沙区的主要歧化种为许氏平鲉(15.28%)、日本蟳(9.72%)和多棘海盘车(9.71%)。结合歧化种的CPUE和优势度, 可以得出优势种的资源量和分布是引起群落结构区域间差异的直接原因。这也反映出了优势种的生活习性及生境选择对于当地生物群落结构的塑造作用。
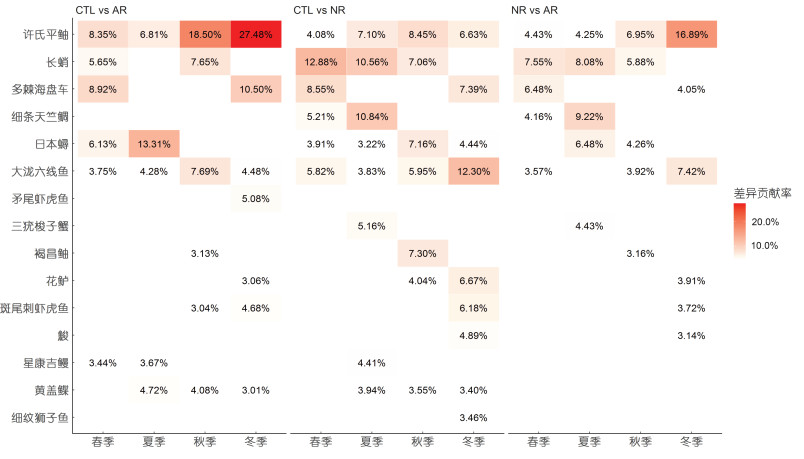 |
| 图 6 各季节引起区域间群落结构差异的主要物种及贡献百分比(> 5%) Fig. 6 Major species resulting in community structures differences among three areas, and the respective contribution percentages (> 5%) 注: NR. 自然岩礁区; AR. 人工鱼礁区; CTL. 泥沙区 |
DCA的排序结果发现, 第一排序轴的长度小于2, 因而选用RDA排序分析。根据前向变量选择(forward selection)的结果, 环境因子选定为水深(Depth)、溶氧(DO)、温度(Temp)、叶绿素a(Chl a)及浊度(Turbidity)。4个季节群落组成与环境因子的RDA分析结果显示, 典范轴1和典范轴2对群落结构异质性的解释率分别为64.56% (P < 0.05)和15.54% (P < 0.05)。与第一排序轴相关性最大的为温度(R = 0.35), 其次为溶氧(R = 0.10)及水深(R = –0.08)。RDA排序图(图 7)显示, 许氏平鲉、大泷六线鱼与水深呈正相关, 而钝吻黄盖鲽的分布与水深呈负相关, 日本蟳的分布则主要受温度的影响。
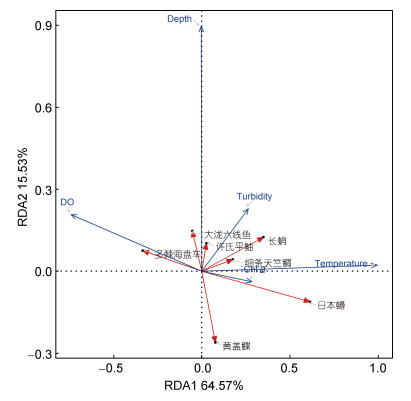 |
| 图 7 烟台近岸底层渔业优势种RDA排序图 Fig. 7 RDA ordination of dominate species in Yantai offshore area 注: 仅显示优势种; DO. 溶氧; Temperature. 温度; Depth. 水深; Turbidity. 浊度; Chl a. 叶绿素a |
本研究采集的渔业生物以底层鱼类和甲壳类为主, 均为黄渤海近海海域的常见物种。人工鱼礁区的物种数和生物量均显著高于泥沙区, 反映出人工鱼礁对于渔业资源的恢复效果良好。尤其是许氏平鲉和大泷六线鱼在人工鱼礁区的生物量优势明显高于泥沙区, 凸显人工鱼礁对于岩礁性鱼类资源的聚集效果, 这一结果也与之前的不少研究一致(吴忠鑫等, 2012; Lowry et al, 2014; Mills et al, 2017)。此外, 人工鱼礁区的生物多样性指数和丰富度指数同样高于泥沙区, 两区域的群落结构也存在显著差异。类似现象在墨西哥湾(Tessier et al, 2014)、日照前三岛(董天威等, 2015)、澳大利亚菲利普湾(Mills et al, 2017)等地的人工鱼礁区也有报道, 证实了人工鱼礁能够有效地提高当地生物多样性水平。
钝吻黄盖鲽在泥沙区的优势地位明显, 其CPUE值分别达到自然岩礁及人工鱼礁的1.92倍和2.92倍, 表明并非所有生物都受益于人工礁体的投放。钝吻黄盖鲽偏好泥沙底质环境(刘静等, 2015), 礁石的投放可能会挤压其原有的生存空间。Able等(1999)也曾报道过人工鱼礁可能对美洲拟鲽(Pseudopleuronectes americanus)及蚝隆头鱼(Tautoga onitis)幼体阶段的成长存在不利影响。这也提醒今后人工鱼礁的设计和建设应充分考虑不同物种的生活习性, 尽量实现决策的兼顾性。
3.2 人工鱼礁区与自然岛礁群落结构对比关于人工与自然礁区渔业群落结构的对比, 有研究发现人工鱼礁在物种丰富度、种群密度、多样性方面均高于自然岩礁(汪振华等, 2010; Folpp et al, 2013; Granneman et al, 2015); 也有报道指出人工鱼礁的物种组成数及生物量距离自然岩礁仍有差距(Carr et al, 1997; Rooker et al, 1997; Mills et al, 2017)。本研究中, 自然岩礁区的物种多样性指数明显高于人工鱼礁区, 两区域渔获量CPUE、优势种组成及群落结构也存在季节性差异, 反映出两类礁石区渔业生物群落格局的不一致性。结合研究区域的地理特征, 分析认为两类礁石区渔业生物群落产生差异的主要原因是:
(1) 成熟稳定的生物群落在人工鱼礁区的构建或复原往往存在滞后性和不确定性。人工鱼礁放置后, 定群种由生长迅速、生命周期短的机会种逐步向生长相对较慢、生命周期长的高营养级物种过渡, 群落也会出现相应演替, 但这一过程往往时间较长(Aseltine-Neilson et al, 1999; Perkol-Finkel et al, 2007), 也不能保证最终形成的稳定群落与周围自然岩礁一致(Svane et al, 2001; Perkol-Finkel et al, 2006)。
(2) 自然岩礁的底质环境与人工鱼礁存在差异。研究发现, 礁体结构的复杂程度会决定岩礁生境中的物种组成, 进而影响群落结构(Folpp et al, 2013; Rosemond et al, 2018)。礁体物理特征的差异, 会促使生物因空间或摄食偏好而做出“趋向”或“远离”的选择。例如, 表面积更大、粗糙度更高的岩石附着基更能提高固着型生物(海绵动物、海鞘等)的覆盖率与物种组成(Carvalho et al, 2013; Walker et al, 2014); 孔洞、缝隙较多的礁石结构对岩礁性鱼类发挥“吸引”作用的同时, 也能够提高低营养级生物的“避敌”能力(Connell, 1998; Mills et al, 2017)。本研究中, 自然岩礁区面积更大, 礁石自然连接成片并呈现出较大的垂直起伏, 大型海藻分布范围较大; 而人工鱼礁区域面积较小, 礁石相互堆叠且排布较规则, 礁堆之间为泥沙底, 大型海藻分布范围较小。由此, 两类礁石区因物理环境特征差异而形成的庇护所效应、竞争强度、食物供给能力可能存在差异, 使物种因生境偏好而做出区域选择。例如, 许氏平鲉在人工鱼礁平均CPUE为自然岩礁的1.59倍, 可能原因为人工鱼礁为该物种提供的生境质量要优于自然岩礁, 不仅生存空间有利, 食物供应也充足; 长蛸、细条天竺鲷为自然岩礁的优势种, 而在人工鱼礁为非优势种, 甚至人工鱼礁的细条天竺鲷的CPUE不及自然岩礁区的1%, 可推断此两种生物在自然岩礁的生境可能更适宜。此外, 大型海藻分布范围的空间差异同样不可忽视。大型藻类不仅能为作为食物源的小型无脊椎生物及附生藻类提供附着基质, 也能为一些小型鱼类提供庇护场所(Sánchez-Botero et al, 2007; Thomaz et al, 2008; Schneck et al, 2011)。限于采样次数及站位布设较少, 本研究中, 自然岩礁与人工鱼礁在某些群落结构相关参数上的差异不显著。但总体上, 自然岩礁的群落结构整体表现出复杂程度优于人工鱼礁的态势, 一定程度上反映出目前自然岩礁区的生境多元化程度高于人工鱼礁区。
3.3 群落结构的季节变化自然岩礁区渔业群落的物种更替率明显低于其他两个区域, 表明自然岩礁区物种的迁入迁出率较低。自然岩礁区优势种组成、CPUE的季节性波动小于人工鱼礁区, 一定程度反映了自然岩礁的生境多样性程度高, 受环境的影响程度相对小。例如, 夏季水温升高, 水体溶解氧含量降低, 人工鱼礁区的某些物种因环境不适宜而离开, 并造成物种数及生物量较春季时的下降程度明显, 同时, 礁体布局密度过大导致水流交换不畅也有可能放大环境的不利影响。相比之下, 自然岩礁区面积更大, 空间的丰富度更高, 即使外部环境变化, 可能依然存在适宜生物栖息的微型生境。此外, 本研究发现冬季时, 三个区域的物种数、生物量、多样性指数处于全年最低值, 分析原因为该季节水温低, 不少生物会减少活动量以降低能量消耗, 例如钝吻黄盖鲽、日本蟳等; 也有暖温性物种会向其他区域迁移, 如细条天竺鲷等(刘静等, 2015)。
3.4 群落-环境相关性RDA结果显示温度、溶氧和水深是影响群落组成的重要环境因子。研究发现, 温度是渔业生物赖以生存的必要条件, 连同溶氧因子主导生物的新陈代谢。水深是一个综合的环境因子, 会间接影响温度、溶氧及其他环境因子, 进而改变游泳生物的空间分布(吴忠鑫等, 2012; 翟璐等, 2015; Embarek et al, 2017)。然而, 3个主控环境因子与第一典范轴的相关系数均较低, 表明溶氧、温度及水深只能部分解释群落结构形成差异的原因。结合前文关于底质环境对物种生境选择影响的论述, 分析认为底质生境的复杂度同样是影响本研究群落结构主要因素。底质生境涉及的物理结构特征参数(如礁石大小、构造、产生的缝隙数、藻类区域覆盖率)往往难以精确量化, 因而无法作为定量参数与群落结构进行精确的相关性分析。另外, 人工鱼礁区开展的网具调查普遍适用于活动能力较强、个体较大的鱼类及大型底栖等渔业资源的变动分析, 而浮游生物(陈涛等, 2013; 戴媛媛等, 2018)、底表生物、小型底栖生物(廖一波等, 2014; Semprucci et al, 2017; Yang et al, 2019)等类群的数量和分布却往往关注较少。这些低营养级生物大多作为鱼类等高营养级生物的饵料, 会通过“上行”效应影响群落结构, 对生态系统的结构和功能起到一定的调控作用。今后人工鱼礁的研究, 应汇总不同生态类群的调查数据并综合分析, 以更全面地认知鱼礁生态功能运转的内在机理及其群落演替的动态过程。
4 结论人工鱼礁区底层渔业资源的物种组成、CPUE、生物多样性明显优于泥沙区, 反映出人工鱼礁区对于以岩礁性鱼类为主的底层渔业生物的良好恢复效果。然而, 与自然岩礁区相比, 人工鱼礁区生物多样性水平较低, 其物种组成、CPUE、群落结构整体上也存在不一致性, 整体表现出群落结构复杂度及稳定性不及自然岩礁的现状。分析认为, 一方面生物群落在人工鱼礁区的演替往往存在滞后性及不确定; 另一方面, 自然岩礁区面积更大, 底层环境复杂度高, 能提供更多适宜多种生物栖息及应及对环境季节变化的微型生境。综合来看, 人工鱼礁生物群落的结构复杂度、生物多样性水平能否赶上或超越自然岩礁仍需较长时间的积累和观察。
朱鑫华, 吴鹤洲, 徐凤山, 等. 1994. 黄渤海沿岸水域游泳动物群落多样性及其相关因素的研究. 海洋学报, 16(3): 102-112 |
刘静, 陈咏霞, 马琳. 2015. 黄渤海鱼类图志. 北京: 科学出版社: 337 |
刘鸿雁, 杨超杰, 张沛东, 等. 2016. 青岛崂山湾人工鱼礁区底层游泳动物群落结构特征. 生物多样性, 24(08): 896-906 |
杨红生, 许帅, 林承刚, 等. 2020. 典型海域生境修复与生物资源养护研究进展与展望. 海洋与湖沼, 51(4): 809-820 |
吴忠鑫, 张磊, 张秀梅, 等. 2012. 荣成俚岛人工鱼礁区游泳动物群落特征及其与主要环境因子的关系. 生态学报, 32(21): 6737-6746 |
汪振华, 章守宇, 王凯. 2010. 三横山鱼礁生境鱼类和大型无脊椎动物群落特征. 生态学报, 30(8): 2026-2035 |
陈涛, 廖勇, 王云龙, 等. 2013. 象山港人工鱼礁海域浮游动物群落生态变化. 海洋通报, 32(6): 710-716 |
国家质量监督检验检疫局, 2007. GB/T 12763-2007海洋调查规范. 北京: 中国标准出版社
|
董天威, 黄六一, 唐衍力, 等. 2015. 日照前三岛人工鱼礁对渔业资源影响的初步评价. 中国海洋大学学报, 45(8): 38-45 |
廖一波, 曾江宁, 寿鹿, 等. 2014. 象山港人工鱼礁投放对大型底栖动物群落结构的影响. 海洋与湖沼, 45(3): 487-495 |
翟璐, 徐宾铎, 纪毓鹏, 等. 2015. 黄河口及其邻近水域夏季鱼类群落空间格局及其与环境因子的关系. 应用生态学报, 26(9): 2852-2858 |
戴媛媛, 侯纯强, 杨森, 等. 2018. 天津海域人工鱼礁区浮游动物群落结构及其与环境因子的相关性研究. 海洋湖沼通报, (5): 163-170 |
Abecasis D, Bentes L, Lino P G et al, 2013. Residency, movements and habitat use of adult white seabream (Diplodus sargus) between natural and artificial reefs. Estuarine, Coastal and Shelf Science, 118: 80-85 DOI:10.1016/j.ecss.2012.12.014 |
Able K W, Manderson J P, Studholme A L, 1999. Habitat quality for shallow water fishes in an urban estuary: the effects of man-made structures on growth. Marine Ecology Progress Series, 187: 227-235 DOI:10.3354/meps187227 |
Aseltine-Neilson D A, Bernstein B B, Palmer-Zwahlen M L et al, 1999. Comparisons of turf communities from Pendleton Artificial Reef, Torrey Pines Artificial Reef, and a natural reef using multivariate techniques. Bulletin of Marine Science, 65(1): 37-57 |
Baine M, 2001. Artificial reefs: a review of their design, application, management and performance. Ocean & Coastal Management, 44(3-4): 241-259 |
Bohnsack J A, 1989. Are high densities of fishes at artificial reefs the result of habitat limitation or behavioral preference?. Bulletin of Marine Science, 44(2): 631-645 |
Bohnsack J A, Harper D E, McClellan D B et al, 1994. Effects of reef size on colonization and assemblage structure of fishes at artificial reefs off Southeastern Florida, U.S.A. Bulletin of Marine Science, 55(2-3): 796-823 |
Carr M H, Hixon M A, 1997. Artificial reefs: the importance of comparisons with natural reefs. Fisheries, 22(4): 28-33 DOI:10.1577/1548-8446(1997)022<0028:ARTIOC>2.0.CO;2 |
Carvalho S, Moura A, Cúrdia J et al, 2013. How complementary are epibenthic assemblages in artificial and nearby natural rocky reefs?. Marine Environmental Research, 92: 170-177 DOI:10.1016/j.marenvres.2013.09.013 |
Chen Q, Yuan H R, Chen P M, 2019. Short-term effects of artificial reef construction on the taxonomic diversity and eco-exergy of the macrobenthic faunal community in the Pearl River Estuary, China. Ecological Indicators, 98: 772-782 DOI:10.1016/j.ecolind.2018.12.001 |
Clarke K R, 1993. Non-parametric multivariate analyses of changes in community structure. Australian Journal of Ecology, 18(1): 117-143 DOI:10.1111/j.1442-9993.1993.tb00438.x |
Clarke K R, Warwick R M, 2001. Changes in marine communities: an approach to statistical analysis and interpretation. Mount Sinai Journal of Medicine New York, 40(5): 689-692 |
Connell S D, 1998. Effects of predators on growth, mortality and abundance of a juvenile reef-fish: evidence from manipulations of predator and prey abundance. Marine Ecology Progress Series, 169: 251-261 DOI:10.3354/meps169251 |
Embarek R, Amara R, Kara M H, 2017. Fish assemblage structure in shallow waters of the mellah Lagoon (Algeria): seasonal and spatial distribution patterns and relation to environmental parameters. Acta Ichthyologica et Piscatoria, 47(2): 133-144 DOI:10.3750/AIEP/02080 |
Feyrer F, Newman K, Nobriga M et al, 2011. Modeling the effects of future outflow on the abiotic habitat of an imperiled estuarine fish. Estuaries and Coasts, 34(1): 120-128 DOI:10.1007/s12237-010-9343-9 |
Folpp H, Lowry M, Gregson M et al, 2013. Fish assemblages on estuarine artificial reefs: natural rocky-reef mimics or discrete assemblages?. PLoS One, 8(6): e63505 DOI:10.1371/journal.pone.0063505 |
França S, Vasconcelos R P, Fonseca V F et al, 2012. Predicting fish community properties within estuaries: influence of habitat type and other environmental features. Estuarine, Coastal and Shelf Science, 107: 22-31 DOI:10.1016/j.ecss.2012.04.013 |
Granneman J E, Steele M A, 2015. Effects of reef attributes on fish assemblage similarity between artificial and natural reefs. ICES Journal of Marine Science, 72(8): 2385-2397 DOI:10.1093/icesjms/fsv094 |
Komyakova V, Swearer S E, 2019. Contrasting patterns in habitat selection and recruitment of temperate reef fishes among natural and artificial reefs. Marine Environmental Research, 143: 71-81 DOI:10.1016/j.marenvres.2018.11.005 |
Lepš J, Šmolauer P, 2003. Multivariate Analysis of Ecological Data Using CANOCO. Cambridge: Cambridge University Press
|
Lima J S, Zalmon I R, Love M, 2019. Overview and trends of ecological and socioeconomic research on artificial reefs. Marine Environmental Research, 145: 81-96 DOI:10.1016/j.marenvres.2019.01.010 |
Liu G S, Li W T, Zhang X M, 2017. Assessment of the benthic macrofauna in an artificial shell reef zone in Shuangdao Bay, Yellow Sea. Marine Pollution Bulletin, 114(2): 778-785 DOI:10.1016/j.marpolbul.2016.11.004 |
Lowry M B, Glasby T M, Boys C A et al, 2014. Response of fish communities to the deployment of estuarine artificial reefs for fisheries enhancement. Fisheries Management and Ecology, 21(1): 42-56 DOI:10.1111/fme.12048 |
Marsden J E, Binder T R, Johnson J et al, 2016. Five-year evaluation of habitat remediation in Thunder Bay, Lake Huron: comparison of constructed reef characteristics that attract spawning lake trout. Fisheries Research, 183: 275-286 DOI:10.1016/j.fishres.2016.06.012 |
Mills K A, Hamer P A, Quinn G P, 2017. Artificial reefs create distinct fish assemblages. Marine Ecology Progress Series, 585: 155-173 DOI:10.3354/meps12390 |
Perkol-Finkel S, Benayahu Y, 2007. Differential recruitment of benthic communities on neighboring artificial and natural reefs. Journal of Experimental Marine Biology and Ecology, 340(1): 25-39 DOI:10.1016/j.jembe.2006.08.008 |
Perkol-Finkel S, Shashar N, Benayahu Y, 2006. Can artificial reefs mimic natural reef communities? The roles of structural features and age. Marine Environmental Research, 61(2): 121-135 DOI:10.1016/j.marenvres.2005.08.001 |
Pielou E C, 1966. Species-diversity and pattern-diversity in the study of ecological succession. Journal of Theoretical Biology, 10(2): 370-383 DOI:10.1016/0022-5193(66)90133-0 |
Pinkas L, Oliphant M S, Iverson I L K, 1971. Food habits of albacore, bluefin tuna, and bonito in California waters. Long Beach: The Resources Agency: 1-105 |
Rooker J R, Dokken Q R, Pattengill C V et al, 1997. Fish assemblages on artificial and natural reefs in the Flower Garden Banks National Marine Sanctuary, USA. Coral Reefs, 16(2): 83-92 DOI:10.1007/s003380050062 |
Rosemond R C, Paxton A B, Lemoine H R et al, 2018. Fish use of reef structures and adjacent sand flats: implications for selecting minimum buffer zones between new artificial reefs and existing reefs. Marine Ecology Progress Series, 587: 187-199 DOI:10.3354/meps12428 |
Sanabria-Fernandez J A, Lazzari N, Riera R et al, 2018. Building up marine biodiversity loss: artificial substrates hold lower number and abundance of low occupancy benthic and sessile species. Marine Environmental Research, 140: 190-199 DOI:10.1016/j.marenvres.2018.06.010 |
Sánchez-Botero J I, Leitão R P, Caramaschi É P et al, 2007. The aquatic macrophytes as refuge, nursery and feeding habitat for freshwater fish from Cabiúnas lagoon, Restinga de Jurubatiba National Park, Rio de Janeiro, Brazil. Acta Limnologica Brasiliensia, 19(2): 143-153 |
Schneck F, Schwarzbold A, Melo A S, 2011. Substrate roughness affects stream benthic algal diversity, assemblage composition, and nestedness. Journal of the North American Benthological Society, 30(4): 1049-1056 DOI:10.1899/11-044.1 |
Semprucci F, Sbrocca C, Baldelli G et al, 2017. Is meiofauna a good bioindicator of artificial reef impact?. Marine Biodiversity, 47(2): 511-520 DOI:10.1007/s12526-016-0484-3 |
Shannon C E, 1997. The mathematical theory of communication. 1963. M.D. Computing: Computers in Medical Practice, 14(4): 306-317 |
Streich M K, Ajemian M J, Wetz J J et al, 2018. Habitat-specific performance of vertical line gear in the western Gulf of Mexico: A comparison between artificial and natural habitats using a paired video approach. Fisheries Research, 204: 16-25 DOI:10.1016/j.fishres.2018.01.018 |
Strelcheck A J, Cowan J H, Shah A, 2005. Influence of reef location on artificial-reef fish assemblages in the northcentral Gulf of Mexico. Bulletin of Marine Science, 77(3): 425-440 |
Svane I, Petersen J K, 2001. On the problems of epibioses, fouling and artificial reefs, a review. Marine Ecology, 22(3): 169-188 DOI:10.1046/j.1439-0485.2001.01729.x |
Tessier A, Verdoit-Jarraya M, Blouet S et al, 2014. A case study of artificial reefs as a potential tool for maintaining artisanal fisheries in the French Mediterranean Sea. Aquatic Biology, 20: 255-272 DOI:10.3354/ab00563 |
Thomaz S M, Dibble E D, Evangelista L R et al, 2008. Influence of aquatic macrophyte habitat complexity on invertebrate abundance and richness in tropical lagoons. Freshwater Biology, 53(2): 358-367 |
Ulanowicz R E, 2001. Information theory in ecology. Computers & Chemistry, 25(4): 393-399 |
Walker S J, Schlacher T A, 2014. Limited habitat and conservation value of a young artificial reef. Biodiversity and Conservation, 23(2): 433-447 DOI:10.1007/s10531-013-0611-4 |
Yang X Y, Lin C G, Song X Y et al, 2019. Effects of artificial reefs on the meiofaunal community and benthic environment-a case study in Bohai Sea, China. Marine Pollution Bulletin, 140: 179-187 DOI:10.1016/j.marpolbul.2018.12.031 |
 2021, Vol. 52
2021, Vol. 52


