中国海洋湖沼学会主办。
文章信息
- 李伟业, 徐志进, 殷小龙, 陈爽, 马雪彬, 章霞, 邱豪军, 张晓林, 蒋霞敏. 2021.
- LI Wei-Ye, XU Zhi-Jin, YI Xiao-Long, CHEN Shuang, MA Xue-Bin, ZHANG Xia, QIU Hao-Jun, ZHANG Xiao-Lin, JIANG Xia-Min. 2021.
- 温度对美洲黑石斑(Centropristis striata)幼鱼生长和免疫因子活力与相关基因表达的影响
- EFFECTS OF TEMPERATURE ON GROWTH, IMMUNE FACTOR ACTIVITY AND RELATED GENE EXPRESSION OF JUVENILE CENTROPRISTIS STRIATA
- 海洋与湖沼, 52(3): 708-717
- Oceanologia et Limnologia Sinica, 52(3): 708-717.
- http://dx.doi.org/10.11693/hyhz20200900257
文章历史
-
收稿日期:2020-09-25
收修改稿日期:2020-10-22
2. 浙江省舟山市水产研究所 舟山 316000;
3. 浙江海洋大学 舟山 316022
2. Zhoushan Fisheries Research Institute of Zhejiang Province, Zhoushan 316000, China;
3. Zhejiang Ocean University, Zhoushan 316022, China
美洲黑石斑(Centropristis striata), 又称条纹锯鮨和黑锯鮨, 通称黑石斑, 商品名为翡翠斑或珍珠斑, 属鮨科(Serranidae)、石斑鱼亚科(Serraninae)、锯鮨属(Centropristis), 原产于墨西哥湾水域、美国东岸及加拿大东南近海(雷霁霖等, 2007)。因其肉质丰腴、口感清爽, 适应性强、且易于接受配合饲料、养殖生长速度要比自然界快, 因此备受养殖界青睐, 美国水产养殖界将其定位为高价值鱼类和美洲杰出的候选养殖品种(卢继武等, 2006; 雷霁霖等, 2007)。从20世纪70年代开始, 国外相继对美洲黑石斑的地理分布、生物学特性、生殖习性等方面进行研究(Kendall, 1977; Link, 1980), 随后开展了美洲黑石斑繁育养殖方面的研究, 并发现在人工养殖条件下, 其生长速度比自然栖息地的鱼快许多倍, 认为养殖优势和市场优势非常突出, 养殖潜力巨大, 值得大力推广(Kim, 1987; Tucker, 1989)。国内在美洲黑石斑增养殖方面的研究起步稍晚, 首先由青岛三高大菱鲆研究所有限公司于2003年从美国东北沿岸引进美洲黑石斑鱼苗, 开启了美洲黑石斑增养殖研究的序幕, 并于2006年取得苗种规模化繁育的成功, 为我国美洲黑石斑养殖业的发展奠定了基础(王波等, 2003; 雷霁霖等, 2007)。目前, 美洲黑石斑已在我国温带海域, 尤其是浙江、福建海区开展了池塘、网箱、工厂化养殖(褚衍伟, 2004)。
温度是养殖水环境中重要的环境因子, 不仅影响水生动物的生长、发育和存活等, 还能显著影响其免疫系统(An et al, 2010)。不适的温度条件不仅抑制水生动物的生长, 也会破坏其免疫系统, 从而引发疾病, 造成养殖业严重损失(Wyban et al, 1995; Le Moullac et al, 2000)。国内外学者在鱼类方面开展了广泛的研究, 诸多研究表明温度对鱼类的生长、存活和抗病力均会产生显著的影响(Martı́nez-Palacios, 2002; Partridge, 2002; 李文龙等, 2017)。同样, 在养殖过程中发现, 温度对美洲黑石斑的生长、疾病也存在显著的影响, 在15—30 ℃下表现出较好的生长性能, 但在高温养殖环境下又极易染病。然而, 目前关于温度对美洲黑石斑的生长和免疫因子的研究鲜见报道。因此, 本文在15—30 ℃范围内选取了4个不同的温度, 研究美洲黑石斑幼鱼的生长、免疫相关酶活力及HSP70、HSP90基因表达的影响, 以期探究出美洲黑石斑适宜的养殖温度, 为美洲黑石斑的健康养殖提供数据支持。
1 材料与方法 1.1 实验材料实验时间为2020年6—8月, 实验地点在浙江省舟山市水产研究所朱家尖基地。实验用鱼为人工繁育的美洲黑石斑幼鱼, 挑选健康、活力强、无畸形、大小相近, 体重(73.74±3.76) g, 体长(14.06±0.13) cm的美洲黑石斑幼鱼, 放于恒温实验房的圆形实验桶内, 实验桶规格为直径80 cm、高100 cm。实验用水为经消毒沉沙滤后的自然海水, 实验期间, 每天换水2次, 日换水率50%, 每天投喂2次配合饲料(天邦海水鱼配合饲料3号料), 投喂时间为09:00和16:00, 并于投喂后1 h吸污清底。水质条件为: 盐度26—28, pH 8.4±0.1, 氨氮 < 0.3 mg/L, 亚硝酸盐 < 0.1 mg/L, 溶解氧保持在5 mg/L以上。
1.2 实验方法 1.2.1 实验设计实验现设18、22、26、30 ℃四个温度梯度组, 每个温度梯度设3个平行, 各实验桶放30尾实验鱼。实验开始前, 将实验鱼在实验桶进行暂养, 暂养水温24 ℃, 暂养7 d后按照1 ℃/d升温或降温, 至各温度梯度后, 开始实验, 实验进行60 d。
实验期间, 观察并记录实验鱼的日常行为状态, 并在实验第1 d和第60 d测量鱼的体重、全长, 统计成活率; 再从各梯度组中随机取3尾鱼, 取血清和肝脏, 用于相关酶活力和基因表达测定。
1.2.2 样品制备从每个实验组中随机取3尾鱼, 用MS-222麻醉后, 用一次性注射器(1 mL)从美洲黑石斑幼鱼尾静脉取血, 血液置于1.5 mL离心管中, 4 ℃下静置4 h后, 以12000 r/min离心30 min, 取上清液, 即为血清样品。剪取鱼肝脏, 用预冷蒸馏水洗净, 滤纸吸干, 置于1.5 mL离心管中, 迅速液氮冷冻。所取样品均置于冰箱(–80 ℃)中, 用于酶活和基因检测。
1.2.3 酶活测定使用购自南京建成生物工程研究所试剂盒测定样品酶活力。碱性磷酸(AKP)和酸性磷酸酶(ACP)活力采用微量酶标法, 活力单位为U/L; 溶菌酶(LSZ)活力采用比浊法测定, 活力单位为U/mL; 超氧化物歧化酶(SOD)活力采用比色法, 活力单位为U/mL。
1.2.4 基因表达检测使用RNA提取试剂盒(天根)提取总RNA, 采用反转录试剂盒(TaKaRa), 按说明步骤合成cDNA。根据NCBI数据库中HSP70、HSP90基因序列, 使用primer 5.0设计两对特异性引物(表 1)。用于荧光定量分析(qPCR), 选取β-actin作为内参基因(黄左安等, 2011)。使用TransStart Top Green qPCR Super Mix试剂盒(全式金)试剂盒对cDNA在实时荧光定量PCR仪(ABI 7300plus)上进行检测。
| 基因 | 引物序列 |
| HSP70-F | 5′-TCGTCTCAGCAAGGAGGACA-3′ |
| HSP70-R | 5′-TACGACTCCAGGCCGTCTT-3′ |
| HSP90-F | 5′-AAAACCCAGGGTGTGGGTG-3′ |
| HSP90-R | 5′-GCAGTTGCTCCACACTGAAA-3′ |
| β-actin-F | 5′-GTGCTGTCTTTCCCTCCATC-3′ |
| β-actin-R | 5′-CTCTTGCTCTGGGCTTCATC-3′ |
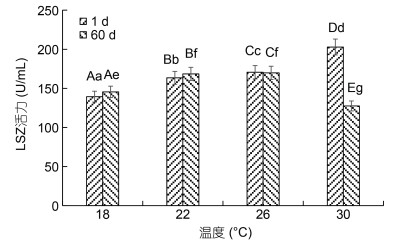
实验期间美洲黑石斑幼鱼特定增长率(SGR)、日增重(DWG)、增长率(GBL)、增重率(GBW)、饲料系数(FCR)计算如下:
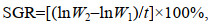 (1)
(1)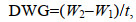 (2)
(2)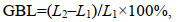 (3)
(3)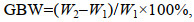 (4)
(4)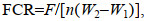 (5)
(5)式中, W1、W2为时间t1、t2时的体重(g); L1、L2为时间t1、t2时的全长(cm); t为实验天数; n为实验个体尾数; F为总投饵量(g)。
采用SPSS19.0统计软件对数据进行处理和分析, 用Duncan氏和T检验法进行显著性分析和多重比较, 数据结果采用平均值±标准误差(Mean±S.D.)表示, P < 0.05为差异显著, P < 0.01为差异极显著。
2 结果 2.1 温度对美洲黑石斑幼鱼行为状态的影响由表 2可以看出, 不同温度下美洲黑石斑幼鱼的游动、摄食等行为状态相似。18、22和26 ℃组的幼鱼活力强, 游动迅捷, 摄食凶猛, 抢食明显, 多分布于水体下层; 而30 ℃组幼鱼活力和摄食均一般, 分布于水体各层。实验期间, 实验鱼的成活率较高, 除30 ℃组的成活率为82.2%外, 显著低于其他组(P < 0.05), 其他组的成活率均高于90%。
| 温度(℃) | 活动状况 | 摄食情况 | 成活率(%) |
| 18 | 活力强, 多分布于水体下层 | 抢食 | 91.1±1.9a |
| 22 | 活力强, 多分布于水体下层 | 抢食 | 93.3±3.4a |
| 26 | 活力强, 多分布于水体下层 | 抢食 | 90.2±1.9a |
| 30 | 活力一般, 水体各层均有分布 | 抢食一般 | 82.2±1.9b |
| 注: 同一列数据中上标字母不同表示显著差异(P < 0.05) | |||
由表 3可见, 美洲黑石斑幼鱼的最终体重、最终体长、特定增长率(SGR)、日增重(DWG)、增长率(GBL)和增重率(GBW)随温度的升高呈先升高后降低的趋势。且部分温度组间差异显著(P < 0.05), 其中22 ℃组最终体重、特定增长率(SGR)、日增重(DWG)、增长率(GBL)和增重率(GBW)均最大, 与26 ℃组差异不显著(P > 0.05), 而与温度18 ℃、30 ℃组存在显著性差异(P < 0.05); 而温度30 ℃组的上述各项指标均最低, 与18 ℃组差异不显著(P > 0.05), 但与22 ℃和26 ℃组差异显著(P < 0.05)。美洲黑石斑幼鱼的饲料系数(FCR)随温度升高呈先降低后升高的趋势, 且部分温度组间差异显著(P < 0.05), 30 ℃组的饲料系数(FCR)最高为1.835±0.044, 22 ℃组的饲料系数(FCR)最低为1.443±0.033。
| 生长指标 | 温度(℃) | |||
| 18 | 22 | 26 | 30 | |
| 初始体重(g) | 74.36±0.13a | 72.92±3.67a | 73.24±3.74a | 74.45±3.66a |
| 最终体重(g) | 119.90±8.76a | 133.87±10.54b | 132.53±9.62b | 118.82±7.96a |
| 初始体长(cm) | 14.10±0.13a | 13.99±0.11a | 14.07±0.11a | 14.09±0.11a |
| 最终体长(cm) | 16.18±0.84a | 16.98±0.99a | 16.92±1.05a | 16.15±0.80a |
| 特定增长率SGR(%) | 0.794±0.056a | 1.012±0.035b | 0.988±0.026b | 0.780±0.010a |
| 日增重DWG(g/d) | 0.753±0.061a | 1.051±0.040b | 0.988±0.025b | 0.740±0.002a |
| 增长率GBL(%) | 14.81±1.84a | 21.38±2.23b | 20.18±2.19b | 14.65±1.71a |
| 增重率GBW(%) | 61.24±3.08a | 83.58±4.21b | 80.95±4.17b | 44.37±3.651a |
| 饲料系数FCR | 1.772±0.033a | 1.443±0.033b | 1.457±0.034b | 1.835±0.044a |
| 注: 同一行数据中上标字母不同表示显著差异(P < 0.05) | ||||
不同温度下美洲黑石斑幼鱼血清中的AKP活力见图 1。由图 1可知, 实验第1 d美洲黑石斑幼鱼血清中的AKP活力随温度的升高逐渐升高, 30 ℃组最高为(28.42±0.99) U/L, 显著高于其他组(P < 0.05), 18 ℃最低为(19.59±0.99) U/L, 显著低于其他组(P < 0.05), 而22 ℃和26 ℃两组间差异不显著(P > 0.05)。实验第60 d美洲黑石斑幼鱼血清中的AKP活力随温度的升高呈先升高后下降的趋势, 26 ℃组最高为(26.26±1.04) U/L, 且与22 ℃组差异不显著(P > 0.05)。18 ℃和30 ℃组实验第60 d的AKP活力均低于实验第1 d, 且存在显著性差异(P < 0.05); 而22 ℃和26 ℃组实验第60 d的AKP活力均高于第1 d, 但差异不显著(P > 0.05)。
 |
| 图 1 不同温度下美洲黑石斑幼鱼血清中的AKP活力 Fig. 1 Effect of temperature on serum AKP activity of juvenile C. striata 注: 图中不同小写字母代表同一时间下不同温度组间的表达差异(P < 0.05), 不同大写字母代表同一温度组不同时间下的表达差异(P < 0.05) |
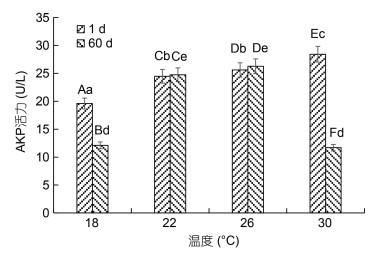
不同温度下美洲黑石斑幼鱼血清中的ACP活力见图 2。由图 2可知, 实验第1 d美洲黑石斑幼鱼血清中的ACP活力随温度的升高逐渐升高, 30 ℃组最高为(18.21±0.83) U/L, 显著高于18 ℃和22 ℃组(P < 0.05), 18 ℃最低为(14.63±0.60) U/L, 显著低于其他组(P < 0.05), 而22 ℃和26 ℃两组间差异不显著(P > 0.05)。实验第60 d美洲黑石斑幼鱼血清中的ACP活力随温度的升高呈先升高后下降的趋势, 26 ℃组最高为(16.70±0.62) U/L, 且与22 ℃组差异不显著(P > 0.05)。各实验组第60 d的ACP活力均低于实验第1 d, 其中18 ℃和30 ℃组实验第60 d的ACP活力显著低于第1 d (P < 0.05); 而22 ℃和26 ℃组实验第60 d的ACP活力与第1 d差异不显著(P > 0.05)。
 |
| 图 2 不同温度下美洲黑石斑幼鱼血清中的ACP活力 Fig. 2 Effect of temperature on serum ACP activity of juvenile C. striata 注: 图中不同小写字母代表同一时间下不同温度组间的表达差异(P < 0.05), 不同大写字母代表同一温度组不同时间下的表达差异(P < 0.05) |
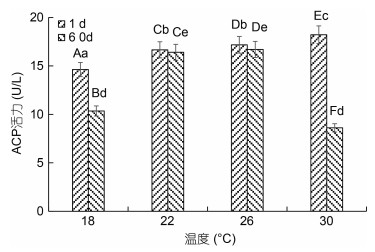
不同温度下美洲黑石斑幼鱼血清中的LSZ活力见图 3。由图 3可知, 实验第1 d美洲黑石斑幼鱼血清中的LSZ活力随温度的升高逐渐升高, 且各组间存在显著性差异(P < 0.05), 其中30 ℃组最高为(202.85±4.00) U/mL, 18 ℃组最低为(163.47±1.93) U/mL。实验第60 d美洲黑石斑幼鱼血清中的LSZ活力随温度的升高呈先升高后下降的趋势, 26 ℃组最高为(169.82±2.26) U/mL, 与其他组差异显著(P < 0.05)。18 ℃和22 ℃组实验第60 d的LSZ活力均高于实验第1 d, 但差异不显著(P > 0.05); 而26 ℃和30 ℃组实验第60 d的LSZ活力均低于第1 d, 其中26 ℃组差异不显著(P > 0.05), 而30 ℃组存在显著性差异(P < 0.05)。
 |
| 图 3 不同温度下美洲黑石斑幼鱼血清中的LSZ活力 Fig. 3 Effect of temperature on serum LSZ activity of juvenile C. striata 注: 图中不同小写字母代表同一时间下不同温度组间的表达差异(P < 0.05), 不同大写字母代表同一温度组不同时间下的表达差异(P < 0.05) |
不同温度下美洲黑石斑幼鱼血清中的SOD活力见图 4。由图 4可知, 实验第1 d美洲黑石斑幼鱼血清中的SOD活力随温度的升高呈先下降后上升的趋势, 30 ℃组最高为(174.44±1.25) U/mL, 显著高于其他组(P < 0.05), 22 ℃组最低为(152.89±0.60) U/mL, 显著低于其他组(P < 0.05)。实验第60 d美洲黑石斑幼鱼血清中的SOD活力随温度的升高逐渐上升, 30 ℃组最高, 为(195.54±4.21) U/mL, 且显著高于其他组(P < 0.05); 18 ℃组最低, 为(145.48±2.76) U/mL, 且显著低于其他组(P < 0.05)。22、26和30 ℃组实验第60 d的SOD活力均高于实验第1 d, 其中30 ℃组实验第60 d的SOD活力显著高于第1 d (P < 0.05), 而22 ℃和26 ℃组实验第60 d的SOD活力与第1 d差异不显著(P > 0.05)。18 ℃组实验第60 d的SOD活力均低于实验第1 d, 且存在显著性差异(P < 0.05)。
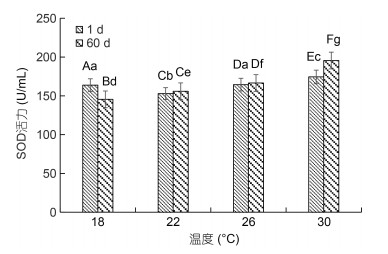 |
| 图 4 不同温度下美洲黑石斑幼鱼血清中的SOD活力 Fig. 4 Effect of temperature on serum SOD activity of juvenile C. striata 注: 图中不同小写字母代表同一时间下不同温度组间的表达差异(P < 0.05), 不同大写字母代表同一温度组不同时间下的表达差异(P < 0.05) |
不同温度下美洲黑石斑幼鱼肝脏中HSP70基因的表达量见图 5。由图 5可知, 实验第1 d美洲黑石斑幼鱼肝脏中HSP70基因的表达量随温度的升高呈逐渐上升的趋势, 30 ℃组最高, 且与其他组差异显著(P < 0.05)。实验第60 d美洲黑石斑幼鱼肝脏中HSP70基因的表达量随温度的升高呈先下降后上升的趋势, 其中30 ℃组显著高于其他组(P < 0.05), 而22 ℃组显著低于其他组(P < 0.05)。18、22和26 ℃组实验第60 d的HSP70基因的表达量均高于实验第1 d, 且各组差异显著(P < 0.05), 而30 ℃组实验第60 d的HSP70基因的表达量低于第1 d, 但差异不显著(P > 0.05)。
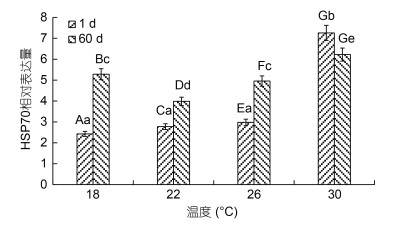 |
| 图 5 不同温度下美洲黑石斑幼鱼肝脏中的HSP70基因的相对表达量 Fig. 5 Relative expression levels of HSP70 gene in liver of juvenile C. striata at different temperature 注: 图中不同小写字母代表同一时间下不同温度组间的表达差异(P < 0.05), 不同大写字母代表同一温度组不同时间下的表达差异(P < 0.05) |
不同温度下美洲黑石斑幼鱼肝脏中HSP90基因的表达量见图 6。由图 6可知, 实验第1 d美洲黑石斑肝脏中HSP90基因的表达量随温度的升高呈逐渐上升的趋势, 30 ℃组最高, 且与其他组差异显著(P < 0.05)。实验第60 d美洲黑石斑幼鱼肝脏中HSP90基因的表达量随温度的升高也呈先下降后上升的趋势, 其中30 ℃组显著高于其他组(P < 0.05), 而22 ℃组显著低于其他组(P < 0.05)。22 ℃和26 ℃组实验第60 d的HSP90基因的表达量均低于实验第1 d, 且各组差异显著(P < 0.05), 而18 ℃组实验第60 d的HSP90基因的表达量高于第1 d, 但差异不显著(P > 0.05)。
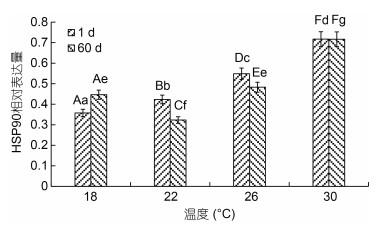 |
| 图 6 不同温度下美洲黑石斑幼鱼肝脏中的HSP90基因的相对表达量 Fig. 6 Relative expression levels of HSP70 gene in liver of juvenile C. striata at different temperature 注: 图中不同小写字母代表同一时间下不同温度组间的表达差异(P < 0.05), 不同大写字母代表同一温度组不同时间下的表达差异(P < 0.05) |
温度是影响鱼类最重要的环境因素之一, 它能直接影响养殖动物的新陈代谢、生长和存活, 同样也对鱼类的免疫机能和抗病能力有显著影响(Imsland et al, 1996; An et al, 2010)。探究出鱼类适宜的温度范围对提升鱼类生长速度、有效预防病害发生、提升养殖效益具有显著的作用(雷霁霖等, 2007)。研究人员在探寻鱼类生长适温方面做了大量的研究工作, 主要从鱼类的表型性状、生理生化指标及基因表达变化等方面进行了研究。鱼类的生长性能、摄食和存活情况可直观反映自身的生存状态, 因此研究人员多通过上述指标探寻鱼类的适温范围, 如大菱鲆(Scophthalmus maximus)、大泷六线鱼(Hexagrammos otakii)、点篮子鱼(Siganus guttatus)、斑点叉尾
适宜的水温变化对鱼类生长促进作用, 一定范围内升温有利于鱼类的生长发育, 而水温超过适宜温度后, 则往往会抑制鱼类的生长, 同时也会对摄食、成活造成影响(王小磊, 2001; 高淳仁等, 2006)。研究人员在温度对鱼类的影响方面已开展了大量的研究工作, 并发现温度变化对鱼类的生长性能有显著的影响。刘鉴毅等(2015)对点篮子鱼(Siganus guttatus)的研究发现, 在19—31 ℃范围内幼鱼的特定生长率(SGR)和相对增重率(WGR)随温度的升高而显著增加, 摄食率(FR)随着温度的升高而显著升高(P < 0.05), 认为点篮子鱼幼鱼快速生长的适宜温度范围为29.89—31.74 ℃。胡发文等(2012)对大泷六线鱼(Hexagrammos otakii)的研究结果表明, 温度变化对大泷六线鱼4月龄幼鱼存活与生长的影响显著(P < 0.05), 4月龄幼鱼存活与生长适宜水温为14—23 ℃, 最适水温为17—23 ℃, 在适温范围内幼鱼具有较高的存活率和生长率, 温度过高或过低均对其生长发育有抑制作用。高淳仁等(2006)研究发现不同温度对大菱鲆(Scophthalmus maximus)幼鱼生长、成活率具有显著影响, 结果表明, 12—16 ℃时, 其生长速度随温度的升高而加快, 且在此温度范围内摄食、生长较好, 成活率高也不易染病。曾本和等(2018)研究了水温对异齿裂腹鱼(Schizothorax oconnori)存活、摄食和生长的影响, 结果表明水温与饲料系数、体质量增长率、体长增长率、特定生长率均为抛物线关系, 异齿裂腹鱼幼鱼在12—22 ℃水温范围内均可存活、摄食及生长, 最适温度15.15—17.24 ℃。李勇等(2011)研究发现高密度封闭循环海水养殖条件下大菱鲆摄食、生长和消化的适宜温度范围为16—18 ℃, 适温范围内的最大摄食率为0.52%—0.55%。Buentello等(2000)研究发现, 斑点叉尾
温度不仅影响鱼类的生长, 对其免疫功能也有显著的影响(Bly et al, 1992)。诸多研究表明, AKP、ACP、LSZ和SOD等酶是鱼类免疫防御体系中重要的酶, 可反映出鱼类机体的免疫状态(陈昌福等, 1990; Möck et al, 1990)。
AKP和ACP是鱼类免疫防御体系中比较重要的水解酶, 也是重要的代谢调控酶, 在防御异物侵入的机制中直接参与磷酸基团的转移和代谢, 形成水解酶体系, 在免疫反应中发挥作用(Muta et al, 1996; Yokota et al, 1982)。目前, 有关温度度变化对鱼类AKP和ACP活力的影响已研究较多。研究人员对大菱鲆(Huang et al, 2011)、草鱼(Ctenopharyngodon idellus)(张继平等, 2005)、施氏鲟(Acipenser schrenckii)(刘红柏, 2004)、花
LSZ是吞噬细胞杀菌的物质基础, 对机体的抗炎、修复和再生等过程中具有重要作用, 溶菌酶(LSZ)活力是衡量水生动物免疫状态的一个重要指标(Möck et al, 1990)。温度对鱼类机体内LSZ的变化有显著的影响, 研究人员对大西洋庸鲽(Hippoglossus hippoglossus L.) (Langston et al, 2002)、草鱼(陈昌福等, 1990; 杨先乐等, 1997)、虹鳟(Oncorhynchus mykiss) (向建国等, 2008)的研究发现, 在适宜范围内, LSZ活力随温度的升高而升高, 超过适宜温度, LSZ活力有下降趋势。本研究发现, 实验第60 d美洲黑石斑幼鱼血清中的LSZ活力与上述研究结果一致, 随温度升高呈先升高后降低的趋势, 而实验第1 d美洲黑石斑幼鱼血清中的LSZ活力呈逐渐升高的趋势。这可能在实验开始时, 在高温刺激下, 美洲黑石斑幼鱼血清中的LSZ的活力增强, 以提升自身的免疫力, 这也与Huang对大菱鲆的研究结果一致(Huang et al, 2011); 而实验第60 d的研究结果表明, 当美洲黑石斑幼鱼长期处于不适的温度下, 由于其免疫能力的下降, LSZ活力也降低。
SOD是鱼类机体重要的抗氧化酶, 可有效清除机体内的氧自由基, 在提升吞噬细胞防御能力和机体免疫功能中发挥重要作用, 通过检测SOD的活力能够比较准确地反映机体内自由基的代谢及组织的氧化损伤情况(Nichols et al, 2000; 覃川杰等, 2011)。目前, 有关温度变化对鱼类SOD酶活力的影响已研究较多, 而不同鱼类SOD酶活力的变化情况却不尽相同。对大菱鲆(Huang et al, 2011; 李文龙等, 2017)、罗非鱼(Oreochromis mossambicus) (强俊等, 2012)、褐牙鲆(Paralichthys olivaceus) (徐冬冬等, 2010)等鱼类的研究发现, SOD活力随温度的升高先上升后下降; 而对军曹鱼(Rachycentron canadum) (杨健等, 2007)、金鱼(Carassius auratus) (Lushchak et al, 2006)、大弹涂鱼(Boleophthalmus pectinirostris) (Liu et al, 2006)等鱼类的研究发现, SOD活力随温度的升高先逐渐上升。本研究发现, 实验第60 d美洲黑石斑幼鱼血清中的SOD活力与后者研究结果一致, 随温度升高逐渐上升, 而实验第1 d美洲黑石斑幼鱼血清中的SOD活力呈先下降后升高的趋势。这可能在实验开始时, 实验鱼为适应温度的变化, 通过提升SOD活力, 增强对环境的适应性。而实验第60 d的不同温度组实验鱼的SOD变化趋势, 可能是因为实验温度范围内, 美洲黑石斑幼鱼的耗氧率随环境温度的升高而升高, 氧自由基的产生也随之增加, 机体SOD活力的增强可降低氧化氢, 从而消除氧化损伤。
3.4 温度对美洲黑石斑幼鱼免疫相关基因的影响HSP是生物机体内的一种分子伴侣, 调节细胞的生理功能, 提高细胞对应激反应的耐受性, 避免生物体遭受氧化应激伤害, 常作为反映机体细胞功能态和抗应激能力的指标之一(Bond et al, 1987; Parsell et al, 1993)。HSP70和HSP90是HSP重要的家族成员(冯起国, 1998)。诸多研究表明温度变化对鱼类机体内HSP的表达具有显著的影响, 如研究人员对大西洋鲑(Salmo salar) (Takle et al, 2005)、西伯利亚鲟(Acipenserbaerii) (田照辉等, 2013)、鲤鱼(Cyprinus carpio) (王云彪, 2008)、黄姑鱼(Nibea albiflora) (罗胜玉, 2016)等研究发现, 在温度急性刺激下, HSP70或HSP90基因均有显著的变化。但上述研究, 多为短时间的温度刺激, 而长时间实验对象的养殖条件下的研究报道鲜见。本研究发现, 实验第0 d和第60 d, 各实验组美洲黑石斑幼鱼的HSP70和HSP90基因的表达变化未呈现明显的规律性, 但30 ℃组美洲黑石斑幼鱼的HSP70和HSP90基因的表达量在实验第0 d和第60 d均显著高于其他组, 表明美洲黑石斑幼鱼在30 ℃条件下机体反应强烈, 通过提高HSP70和HSP90基因的表达量, 以提升自身的抗高温能力, 但HSP70和HSP90基因长时间的上调表达耗能巨大, 导致美洲黑石斑幼鱼免疫力下降, 也致使成活率降低, 从实验结果来看, 也发现30 ℃组实验鱼的成活率最低。这与周鑫等(2013)对草鱼的研究结果较为一致。
4 结论本研究结果表明, 温度对美洲黑石斑幼鱼的生长和免疫因子活力均有一定的影响。根据实验鱼的生长和免疫因子实验数据, 结合美洲黑石斑幼鱼的实际生活环境, 本文作者认为美洲黑石斑幼鱼最适的生长温度应为22—26 ℃。
王波, 朱明远, 毛兴华. 2003. 养殖新品种——美洲黑石斑鱼. 河北渔业, (5): 26-27 DOI:10.3969/j.issn.1004-6755.2003.05.011 |
王小磊, 2001. 热冲击、pH、盐度及饥饿对黄颡鱼早期发育阶段的影响. 武汉: 华中农业大学硕士学位论文
|
王云彪, 2008. 热影响下鲤鱼Hsp70组织特异性表达和应激反应. 长春: 东北师范大学博士学位论文
|
方美娟, 刘凯, 李智强, 2010. 花  血清免疫酶活力对水温耐受性的研究. 浙江海洋学院学报(自然科学版), 29(4): 336-339 血清免疫酶活力对水温耐受性的研究. 浙江海洋学院学报(自然科学版), 29(4): 336-339
|
卢继武, 刘敏, 李豪. 2006. 美洲黑石斑鱼的生物学特性与养殖潜力. 渔业现代化, 28(6): 21-22, 28 DOI:10.3969/j.issn.1007-9580.2006.06.009 |
田照辉, 徐绍刚, 王巍, 等. 2013. 急性热应激对西伯利亚鲟HSP70 mRNA表达、血清皮质醇和非特异性免疫的影响. 水生生物学报, 37(2): 344-350 |
白海文, 张颖, 李雪, 等. 2012. 温度对施氏鲟幼鱼摄食、生长和肠道消化酶活性的影响. 中国水产科学, 19(5): 799-805 |
冯起国. 1998. 热休克蛋白. 医学综述, 4(9): 468-469 |
向建国, 何福林, 钟蕾. 2008. 不同水温下虹鳟血清酶的活性. 淡水渔业, 38(2): 74-75, 63 DOI:10.3969/j.issn.1000-6907.2008.02.017 |
刘红柏, 2004. 史氏鲟免疫学研究. 哈尔滨: 东北林业大学博士学位论文
|
刘鉴毅, 宋志明, 王妤, 等. 2015. 温度对点篮子鱼幼鱼生长、摄食和消化酶活性的影响. 海洋渔业, 37(5): 442-448 DOI:10.3969/j.issn.1004-2490.2015.05.007 |
李勇, 孙国祥, 柳阳, 等. 2011. 温度对高密度循环海水养殖大菱鲆摄食、生长及消化酶的影响. 渔业科学进展, 32(6): 17-24 DOI:10.3969/j.issn.1000-7075.2011.06.003 |
李文龙, 梁兴明, 梁萌青, 等. 2017. 温度对大菱鲆幼鱼生长及免疫相关酶活性的影响. 水产科学, 36(3): 311-316 |
杨健, 陈刚, 黄建盛, 等. 2007. 温度和盐度对军曹鱼幼鱼生长与抗氧化酶活性的影响. 广东海洋大学学报, 27(4): 25-29 DOI:10.3969/j.issn.1673-9159.2007.04.006 |
杨先乐, 左文功. 1997. 水温与草鱼免疫应答关系的研究. 动物学报, 43(1): 42-48 DOI:10.3321/j.issn:0001-7302.1997.01.006 |
张继平, 林建成, 谢进金, 等. 2005. 草鱼碱性磷酸酶的分离纯化与部分性质研究. 厦门大学学报(自然科学版), 44(5): 684-687 DOI:10.3321/j.issn:0438-0479.2005.05.024 |
陈昌福, 纪国良. 1990. 鱼类的某些"自然抗体(非特异性免疫物质)"的特性及其功能. 鱼类病害研究, 12(2): 42-48 |
罗胜玉, 2016. 低温胁迫对黄姑鱼生理生化指标和Hsp70基因表达模式的影响. 舟山: 浙江海洋大学硕士学位论文
|
周鑫, 董云伟, 王芳, 等. 2013. 草鱼hsp70和hsp90对温度急性变化的响应. 水产学报, 37(2): 216-221 |
胡发文, 潘雷, 高凤祥, 等. 2012. 温度和盐度变化对大泷六线鱼幼鱼存活与生长的影响. 海洋科学, 36(7): 44-48 |
徐冬冬, 楼宝, 詹炜, 等. 2010. 高温胁迫对褐牙鲆生长及肝脏抗氧化酶活性的影响. 水产学报, 34(7): 1099-1105 |
高淳仁, 王印庚, 马爱军, 等. 2006. 温度对大菱鲆幼鱼生长、成活率和体内蛋白酶活性的影响. 海洋水产研究, 27(6): 33-36 |
黄左安, 陈炯, 陆新江, 等. 2011. 香鱼凝血因子X基因表达与鳗利斯顿氏菌感染的相关性. 动物学研究, 32(5): 492-498 |
覃川杰, 杨川, 陈昌福. 2011. 水温对鱼类免疫活动的影响. 河南师范大学学报(自然科学版), 39(5): 129-133 DOI:10.3969/j.issn.1000-2367.2011.05.035 |
曾本和, 周建设, 王万良, 等. 2018. 水温对异齿裂腹鱼幼鱼存活、摄食和生长的影响. 淡水渔业, 48(6): 77-82 DOI:10.3969/j.issn.1000-6907.2018.06.012 |
强俊, 任洪涛, 徐跑, 等. 2012. 温度与盐度对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化酶活力的协同影响. 应用生态学报, 23(1): 255-263 |
雷霁霖, 卢继武. 2007. 美洲黑石斑鱼的品种优势和养殖前景. 海洋水产研究, 28(5): 110-115 |
褚衍伟. 2004. 美洲黑石斑鱼的育苗与养成技术. 齐鲁渔业, 21(1): 12 |
An M I, Choi C Y, 2010. Activity of antioxidant enzymes and physiological responses in ark shell, Scapharca broughtonii, exposed to thermal and osmotic stress: effects on hemolymph and biochemical parameters. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 155(1): 34-42 DOI:10.1016/j.cbpb.2009.09.008 |
Bly J E, Clem W, 1992. Temperature and teleost immune functions. Fish & Shellfish Immunology, 2(3): 159-171 |
Bond U, Schlesinger M J, 1987. Heat-shock proteins and development. Advances in Genetics, 24: 1-29 |
Buentello J A, Gatlin III D M, Neill W H, 2000. Effects of water temperature and dissolved oxygen on daily feed consumption, feed utilization and growth of channel catfish (Ictalurus punctatus). Aquaculture, 182(3-4): 339-352 DOI:10.1016/S0044-8486(99)00274-4 |
Huang Z H, Ma A J, Wang X A, 2011. The immune response of turbot, Scophthalmus maximus (L.), skin to high water temperature. Journal of Fish Diseases, 34(8): 619-627 DOI:10.1111/j.1365-2761.2011.01275.x |
Imsland A K, Sunde L M, Folkvord A et al, 1996. The interaction of temperature and fish size on growth of juvenile turbot. Journal of Fish Biology, 49(5): 926-940 DOI:10.1111/j.1095-8649.1996.tb00090.x |
Kendall A W, 1977. Biological and fisheries data on black sea bass, Centropristis striata (Linnaeus). U.S. Dept. Commerce, Tech Ser Rep, 7: 29 |
Kim J W, 1987. Growth potential of young black sea bass, centropristis striata, in artificial environments. Norfolk: Doctor Dissertation of Old Dominion University
|
Langston A L, Hoare R, Stefansson M et al, 2002. The effect of temperature on non-specific defence parameters of three strains of juvenile Atlantic halibut (Hippoglossus hippoglossus L.). Fish & Shellfish Immunology, 12(1): 61-76 |
Le Moullac G, Haffner P, 2000. Environmental factors affecting immune responses in Crustacea. Aquaculture, 191(1-3): 121-131 DOI:10.1016/S0044-8486(00)00422-1 |
Link G W Jr, 1980. Age, growth, reproduction, feeding, and ecological observations on the three species of Centropristis (Pisces: Serranidae) in North Carolina waters. Chapel Hill: Doctor Dissertation of University of North Carolina, 277
|
Liu W C, Li M Y, Huang F Y et al, 2006. Effects of cadmium stress on xanthine oxidase and antioxidant enzyme activities in Boleophthalmus pectinirostris liver. Chinese Journal of Applied Ecology, 17(7): 1310-1314 |
Lushchak V I, Bagnyukova T V, 2006. Temperature increase results in oxidative stress in goldfish tissues. 2. Antioxidant and associated enzymes. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 143(1): 36-41 |
Martínez-Álvarez R M, Morales A E, Sanz A, 2005. Antioxidant defenses in fish: biotic and abiotic factors. Reviews in Fish Biology and Fisheries, 15(1-2): 75-88 DOI:10.1007/s11160-005-7846-4 |
Martı́nez-Palacios C A, Barriga Tovar E, Taylor J F et al, 2002. Effect of temperature on growth and survival of Chirostoma estor estor, Jordan 1879, monitored using a simple video technique for remote measurement of length and mass of larval and juvenile fishes. Aquaculture, 209(1-4): 369-377 DOI:10.1016/S0044-8486(01)00873-0 |
Möck A, Peters G, 1990. Lysozyme activity in rainbow trout, Oncorhynchus mykiss (Walbaum), stressed by handling, transport and water pollution. Journal of Fish Biology, 37(6): 873-885 DOI:10.1111/j.1095-8649.1990.tb03591.x |
Muta T, Iwanaga S, 1996. The role of hemolymph coagulation in innate immunity. Current Opinion in Immunology, 8(1): 41-47 DOI:10.1016/S0952-7915(96)80103-8 |
Nichols T L, Whitehouse C A, Austin F E, 2000. Transcriptional analys is of a superoxide dismutase gene of Borrelia burgdorferi. FEMS Microbiology Letters, 183(1): 37-42 DOI:10.1111/j.1574-6968.2000.tb08930.x |
Parsell D A, Lindquist S, 1993. The function of heat-shock proteins in stress tolerance: degradation and reactivation of damaged proteins. Annual Review of Genetics, 27: 437-496 DOI:10.1146/annurev.ge.27.120193.002253 |
Partridge G J, Jenkins G I, 2002. The effect of salinity on growth and survival of juvenile black bream (Acanthopagrus butcheri). Aquaculture, 210(1-4): 219-230 DOI:10.1016/S0044-8486(01)00817-1 |
Takle H, Baeverfjord G, Lunde M et al, 2005. The effect of heat and cold exposure on Hsp70 expression and development of deformities during embryogenesis of Atlantic salmon (Salmo salar). Aquaculture, 249(1-4): 515-524 DOI:10.1016/j.aquaculture.2005.04.043 |
Tucker J W Jr, 1989. Energy utilization in bay anchovy, Anchoa mitchilli, and black sea bass, Centropristis striata striata, eggs and larvae. Fishery Bulletin, 87(2): 279-293 |
Wyban J, Walsh W A, Godin D M, 1995. Temperature effects on growth, feeding rate and feed conversion of the Pacific white shrimp (Penaeus vannamei). Aquaculture, 138(1-4): 267-279 DOI:10.1016/0044-8486(95)00032-1 |
Yokota Y, Nakano E, 1982. Comparative studies on particulate acid phosphatases in sea urchin eggs. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 71(4): 563-567 DOI:10.1016/0305-0491(82)90463-1 |
 2021, Vol. 52
2021, Vol. 52


