
中国海洋湖沼学会主办。
文章信息
- 吕孙建, 焦锦彪, 刘莉, 袁雪梅, 于喆, 张海琪, 杭小英, 施伟达, 吴颖蕾. 2021.
- LYU Sun-Jian, JIAO Jin-Biao, LIU Li, YUAN Xue-Mei, YU Zhe, ZHANG Hai-Qi, HANG Xiao-Ying, SHI Wei-Da, WU Ying-Lei. 2021.
- 白芍(Radix paeoniae alba)提取物对中华绒螯蟹(Eriocheir sinensis)造血组织发育及造血因子Astakine的影响
- EFFECTS OF RADIX PAEONIAE ALBA EXTRACTION ON HEMATOPOIETIC TISSUE AND HEMATOPOIETIC FACTOR ASTAKINE IN ERIOCHEIR SINENSIS
- 海洋与湖沼, 52(3): 754-761
- Oceanologia et Limnologia Sinica, 52(3): 754-761.
- http://dx.doi.org/10.11693/hyhz20200900251
文章历史
-
收稿日期:2020-09-09
收修改稿日期:2020-10-17
2. 西南大学水产学院 重庆 400715;
3. 浙江省农业科学院水生生物研究所 杭州 310021
2. College of Fisheries, Southwest University, Chongqing 400715, China;
3. Institute of Hydrobiology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China
中华绒螯蟹(Eriocheir sinensis), 又名河蟹、大闸蟹, 是我国的主要淡水养殖品种, 具有较高的经济价值, 其2019年养殖总产量达到了778682 t (Sun et al, 2013; Lv et al, 2015; 于秀娟等, 2020)。随着人工养殖的迅速发展, 中华绒螯蟹病害问题越来越突出, 由于目前养殖过程中缺乏对幼蟹的病原检测, 且饲养密度过高以及抗菌药物的滥用, 病毒、细菌、寄生虫和真菌等各类病原微生物引起的疾病的暴发愈发剧烈, 严重影响了中华绒螯蟹的养殖效益, 给养殖户造成了巨大的经济损失(Lv et al, 2014)。目前针对中华绒螯蟹的疾病防控没有特别有效的办法, 仍然是以使用抗生素和消毒剂为主, 而这又会导致耐药菌的产生和疫病防控难度的进一步加大(Franz et al, 2020)。由于病原菌的复杂性和抗病药物的不可持续性, 免疫增强剂作为一种新型药物, 可以增强机体的免疫功能, 是提高中华绒螯蟹抗病能力的有效途径。
甲壳动物的免疫属于非特异性免疫, 血淋巴细胞随着血液循环分布到身体各处, 在其免疫反应中起着重要的作用(Söderhäll et al, 2003)。在机体感染病原菌过程中, 血细胞的多种免疫功能被激活, 包括黑化、吞噬、包被和细胞因子的释放, 如抗菌肽、凝集素、过氧化物酶和酚氧化酶等(Jiravanichpaisal et al, 2006)。多糖类物质被认为是一种广谱型免疫增强剂, 有研究表明, 多糖类物质能够引起甲壳动物血细胞的剧烈变化(Lv et al, 2014)。在前期的研究中, 我们也发现中华绒螯蟹受病原菌, 如嗜水气单胞菌、枯草芽孢杆菌以及脂多糖(Lipopolysaccharide, LPS)刺激后, 血淋巴中的透明细胞、颗粒细胞和半颗粒细胞数量会急剧降低, 而后逐渐恢复(Lv et al, 2014)。同样地, Söderhäll等(2003)也发现注射β-1, 3-葡聚糖可以影响甲壳动物血细胞的数量, 从而刺激血细胞的生成和释放。研究表明, 甲壳动物血细胞的生成、存储和释放等生物学过程主要是由造血组织(Hematopoietic tissue, HPT)负责(Lin et al, 2011a)。中华绒螯蟹的造血组织位于胃的背腹侧, 是一层薄且不透明的组织(Jia et al, 2016)。该组织由一系列结缔组织连接的卵形小叶组成, 含有丰富的造血干细胞和各分裂期血细胞的前体细胞(Jia et al, 2016; Söderhäll, 2016)。Söderhäll(2016)研究发现, 克氏原螯虾在受病原微生物或细菌多糖刺激后, 造血组织会启动血细胞生成的功能, 该过程包括血细胞的增殖、分化及最终从造血组织释放到血腔中。因此, 我们相信造血组织在甲壳动物整个生活史, 尤其是在抵御外来病原微生物的过程中发挥着重要的作用。
中草药富含多糖、甙类、生物碱、苦味素、生物类黄酮等多种有效成分, 不仅可以提高营养物质的利用效率、增强机体新陈代谢、促进机体生长, 还能调节机体的免疫功能, 并且拥有价格低廉、来源丰富、不易污染环境等优点, 因而已成为水产养殖中非常适宜的免疫增强剂(Xu et al, 2019)。刘红柏等(2004)研究发现, 在鲤鱼饲料中添加由黄芪、板蓝根、茯苓和鱼腥草组成的复方制剂可以改善鲤鱼的肠道菌群; 郭永军等(2005)也报道了草本植物饲料添加剂(主要是黄芪)可以增强机体免疫功能和提高存活率。在传统的中草药制剂中, 白芍(Radix paeoniae alba, RPA)被认为具有显著的生血和止痛功效, 且被广泛用于临床治疗超过2000年(Xu et al, 2019)。因此, 本研究旨在探究白芍提取物对中华绒螯蟹造血组织和造血因子Astakine的影响, 确定其是否也会影响甲壳动物血细胞的生成等。
1 材料与方法 1.1 实验动物本实验所用中华绒螯蟹(Eriocheir sinensis), 每只规格约为10 g, 购于上海崇明岛某养殖场。中华绒螯蟹被放置于循环水养殖箱中, 水温控制在22 ℃。养殖期间, 按比例定时投喂商品化饲料, 并于饲喂2 h后清除残饵及粪便。
1.2 造血组织细胞培养中华绒螯蟹造血组织的分离参考北美淡水鳌虾造血组织分离的方法进行(Lin et al, 2011b)。用于造血组织消化的消化液由抗凝剂(100 mmol/L葡萄糖, 26 mmol/L柠檬酸, 415 mmol/L氯化钠, 30 mmol/L柠檬酸钠, 30 mmol/L EDTA, pH 7.0)配制而成, 并含有0.1%的Ⅰ型和Ⅳ型胶原酶(索莱宝, 中国)。分离的造血组织迅速置于1 mL的消化液中, 在37 ℃条件下孵育45 min。将含造血组织细胞的消化液置于40 μm的细胞筛中过滤, 随后在1000 r/min速度下离心15 min。收集的造血组织细胞经L-15培养基(赛默飞, 美国)清洗2遍后, 重新在1000 r/min速度下离心15 min, 用L-15培养基重悬造血组织细胞并调整细胞浓度至1×105个/mL。
1.3 白芍提取物安全浓度分析取1×105个/mL浓度的造血组织细胞悬液200 μL, 接种到96孔细胞培养板后在24 ℃的培养箱中培养, 每隔3 d更换一次培养基。将购自陕西森弗天然制品有限公司的白芍(Radix paeoniae alba)提取物溶解在L-15培养基中, 并通过0.2 μm滤膜过滤后备用。用L-15培养基将白芍提取物终浓度调整至100、50、25、12.5、6.7、3.4、1.7和0.85 mg/mL, 并将调整好的含各浓度白芍提取物的培养基添加到96孔细胞培养板中进行孵育, 每个浓度3孔重复。连续孵育7 d, 每天用荧光DNA结合染料4′, 6-二脒基-2-苯基吲哚(DAPI)(碧云天生物技术, 中国)对细胞进行染色。用磷酸盐缓冲液(Phosphate buffer solution, PBS)清洗细胞2遍后, 室温下用4%多聚甲醛固定细胞15 min, 随后用PBS继续清洗2遍, 并添加终浓度为1 μg/mL的DAPI 200 μL, 室温孵育15 min后在荧光显微镜(莱卡, 德国)下拍照以观察细胞形态。
1.4 造血组织细胞造血因子Astakine mRNA的检测将造血组织细胞以1×105个/mL的终浓度接种到96孔板中, 向细胞中添加含0.85 mg/mL白芍提取物的L-15培养基200 μL。在孵育的第0、1、2、3、4、5、6和7天, 取造血组织细胞并用RNAiso Plus (TaKaRa, 日本)提取总RNA, 随后用PrimeScriptTMRT Master Mix (Perfect Real Time) (TaKaRa, 日本)将总RNA反转录成cDNA第一链。使用LightCyclerⓇ480 SYBR Green I Master (Roche, 瑞士)对各时间点造血组织细胞的Astakine mRNA进行检测。表 1列出了用于扩增中华绒螯蟹Astakine和β-actin基因的特定引物序列。qRT-PCR反应混合物包含2.5 μL cDNA第一链, 1 μL (10 nmol/L)正向引物, 1 μL (10 nmol/L)反向引物, 3 μL水和5 μL Master Mix, 并根据已有扩展程序进行反应(Lyu et al, 2020)。每组实验重复三次, 最后根据2–ΔΔCt法计算造血因子Astakine mRNA的相对表达量。
| 引物名称 | 序列(5′—3′) |
| Es-ast-F | GTGGTGGTGTTGGTGCTG |
| Es-ast-R | ATGTCGTTGGGGTAGTGC |
| β-actin-F | GCATCCACGAGACCACTTACA |
| β-actin-R | CTCCTGCTTGCTGATCCACATC |
含1%的白芍提取物中华绒螯蟹颗粒饲料由中大饲料集团有限公司制备并提供。实验蟹被分成两组, 每组100只。实验组和对照组分别提供含白芍提取物和不含白芍提取物的饲料, 每日饲喂两次, 饲养5周, 每周取5只蟹用于造血组织的采集及Astakine mRNA的检测。
1.6 白芍提取物对造血组织的影响分析饲养5周后, 各组取10只蟹, 对个体和造血组织进行称重, 并计算造血组织体重百分比(造血组织重量/蟹重量)。另外, 从实验组和对照组中分离造血组织, 用4%多聚甲醛室温固定15 min, 然后进行石蜡包埋切片。H.E染色过程如下: 石蜡切片经苏木精处理5 min, 冲洗3 min, 再用伊红染色1 min, 切片用盖玻片固定, 显微镜下拍照并观察。
1.7 造血组织的免疫荧光分析将石蜡切片置于封闭液(0.5% Triton X-100, 2% BSA, 0.5%兔血清PBS)中室温孵育1 h, 后续步骤则是在前述方法(Jia et al, 2016)基础上修改后进行。吸走封闭液, 加入本实验室保存的兔源Astakine多克隆抗体(1︰200)进行孵育, 清洗后用带有FITC标记的羊抗兔二抗(1︰1000)进一步孵育, 最后采用Pannoramic 250系统进行观察及拍照, 使用Indica labs HALO系统进行分析。
1.8 白芍提取物对中华绒螯蟹抗急性刺激的影响分析用脂多糖模拟革兰氏阴性菌的感染进行急性刺激, 从实验组和对照组中取40只蟹, 使用1 mL注射器向血腔中注射50 μL生理盐水溶解的脂多糖(100 μg/mL), 每天统计各组死亡数并计算最终的存活率。
1.9 统计分析数据以平均值±标准差表示, 使用SPSS11.0软件进行数据显著性分析, 采用单因素方差分析(ANOVA)进行统计分析, P < 0.05为差异显著。
2 结果 2.1 白芍提取物对造血组织细胞的影响为确定白芍安全剂量, 我们在原代培养的造血组织细胞里添加不同终浓度(100, 50, 25, 12.5, 6.7, 3.4, 1.7和0.85 mg/mL)的白芍提取物, 并于作用不同天数后用DAPI对细胞进行染色和显微观察。由图 1可见, 白芍终浓度大于6.7 mg/mL时对细胞有明显的毒性, 细胞表现出类似于甲壳动物黑化作用的生物学反应。DAPI染色结果显示, 当白芍终浓度高于0.85 mg/mL时, 造血组织细胞的细胞核不完整、且无法被染成蓝色荧光。
 |
| 图 1 不同终浓度白芍提取物作用下的造血组织细胞形态观察 Fig. 1 Microexamination of HPT cells incubated in the medium with different concentrations of RPA |
我们进一步用qRT-PCR检测在终浓度为0.85 mg/mL的白芍提取物的作用下, 造血因子Astakine在不同作用时间下的表达量。结果显示前6天Astakine mRNA的表达量在白芍提取物作用下稳步上升, 到第7天时则下降(图 2a)。在白芍提取物作用的第2天, Astakine mRNA的表达量达到了初始浓度的8.73倍, 显著高于对照组的表达量(P < 0.05); 在作用后的第6天, 白芍组Astakine mRNA的表达量达到最高值, 且也显著高于对照组(P < 0.05)。
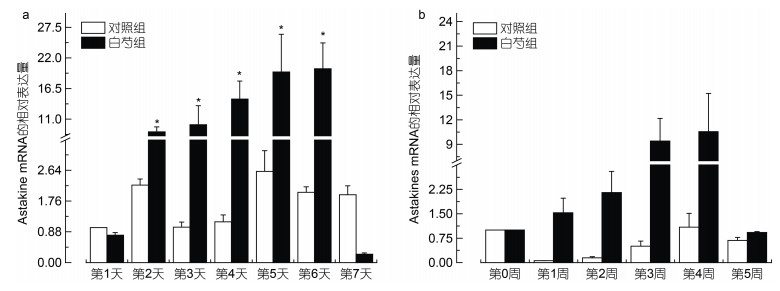 |
| 图 2 造血组织细胞(a)和造血组织(b)Astakine mRNA的表达量 Fig. 2 qRT-PCR analysis of Astakine mRNA in HPT cells (a) and HPT (b) 注: “*”标注表示组间存在显著性差异(P < 0.05) |
在饲喂含有白芍提取物的饲料后, 我们解剖并获取中华绒螯蟹的造血组织, 检测组织内的Astakine mRNA的表达量。由图 2b可见, 在饲喂含有白芍提取物的饲料后, 中华绒螯蟹造血组织Astakine mRNA的表达量有一定上升, 但在第5周时出现下降。在喂食的第1周, 该基因表达量达到了初始的1.5倍, 在第4周时达到了初始的10.6倍, 但差异性分析显示白芍组与对照组无显著性差异(P > 0.05)。
2.3 白芍提取物对造血组织发育的影响在经过了5周的饲喂后, 我们检测了饲喂含白芍提取物及对照组的中华绒螯蟹造血组织的发育情况, 检测指标包括造血组织体重百分比和造血组织卵形小叶数量。由图 3a可知, 饲喂含白芍提取物饲料的中华绒螯蟹造血组织器官要明显大于对照组, 称重结果显示实验组造血组织体重百分比初始为8.13%, 5周后达到了14.77%(增长了6.64%), 而对照组5周后只有9.73%(增长了1.60%)(图 3b)。H.E染色结果显示实验组和对照组的造血组织卵形小叶中都含有大量的血细胞前体细胞, 其中饲喂含白芍提取物饲料的中华绒螯蟹的造血组织较对照组含有更多的卵形小叶(图 3c)。
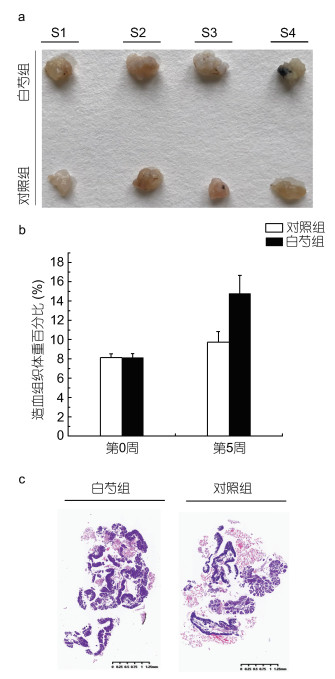 |
| 图 3 造血组织的形态(a)、造血组织体重百分比(b)和H.E染色结果(c) Fig. 3 Morphological observation (a), hematopoietic tissue body index analysis (b) and H.E staining (c) of HPT 注: S1—S4分别为分离的实验组和对照组造血组织样品 |
利用免疫荧光技术对饲喂含白芍提取物饲料及对照组中华绒螯蟹的造血组织Astakine蛋白进行检测。结果如图 4所示, 饲喂含白芍提取物饲料的中华绒螯蟹造血组织的Astakine蛋白含量较对照组要高。
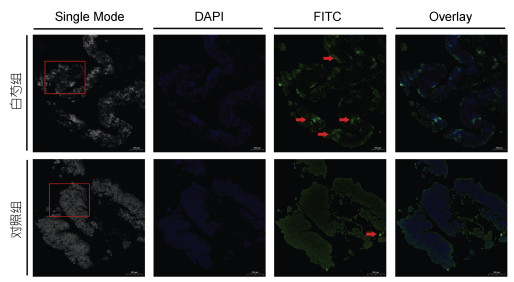 |
| 图 4 造血组织Astakine蛋白的定位及荧光强度 Fig. 4 Localization and quantification of Astakine protein in HPT 注: DAPI标记为细胞核染色的蓝色荧光; FITC绿色荧光信号为Astakine蛋白; 红色矩形框标注的为造血组织卵形小叶; 红色箭头指示的为强荧光信号的Astakine蛋白 |
为确定白芍提取物对中华绒螯蟹抗性的影响, 本研究用100 μg/mL脂多糖模拟革兰氏阴性菌感染对中华绒螯蟹进行急性刺激。7 d的统计结果显示, 饲喂含白芍提取物的中华绒螯蟹的存活率为77.5%, 而对照组只有57.5%, 实验组较对照组成活率提高了20%(表 2)。
| 分组 | 注射剂量(μL) | 总数(只) | 死亡数(只) | 存活率(%) |
| 对照组 | 100 | 40 | 17 | 57.5 |
| 白芍组 | 100 | 40 | 9 | 77.5 |
中华绒螯蟹是我国的主要淡水养殖品种, 但近年来该品种深受多种病原微生物的危害(Lv et al, 2014), 如白斑综合征病毒、呼肠孤病毒、弧菌和气单胞菌等(徐海圣等, 2001; 薛仁宇等, 2005; 房海等, 2008; 雷燕等, 2017)。目前针对以上疾病, 养殖户采用的主要防控手段仍然以抗生素和消毒剂为主, 这将不可避免地导致耐药菌的产生, 加重疾病的防控难度(Franz et al, 2020)。
植物提取物富含多糖、甙类、生物碱、苦味素、生物类黄酮等多种有效成分, 不仅可以提高营养物质的利用效率、增强机体新陈代谢、促进机体生长, 还能调节机体的免疫功能, 并且拥有价格低廉、来源丰富、不易污染环境等优点, 已成为水产养殖中非常适宜的免疫增强剂(Gong et al, 2014)。目前已有相关研究涉及植物提取物在中华绒螯蟹养殖中的应用, 如Zhao等(2018)发现金银花茎乙醇提取物能够提高中华绒螯蟹血细胞的吞噬率和吞噬指数、酚氧化酶活性和一氧化氮合成酶活性。同样地, Zheng等(2019)也发现饲料中添加淫羊藿苷可以显著提高中华绒螯蟹的抗氧化能力和非特异性免疫力。白芍作为传统中药材, 具有多种生物学活性, 如生血、保肝和止痛等(Xu et al, 2019)。在本研究中, 我们通过在造血组织细胞培养液和饲料中添加白芍提取物, 来评估其对中华绒螯蟹造血因子和造血组织的影响。为确定白芍的安全剂量, 我们在原代培养的造血组织细胞中添加不同浓度白芍提取物。通过对细胞核的染色及形态学观察, 我们发现6.7 mg/mL的终浓度会导致造血组织细胞出现类似细胞黑化作用的生物学反应。黑化反应是甲壳动物血细胞一种常见的免疫反应, 是指细胞合成黑色素外壳和细胞毒性效应物(Charoensapsri et al, 2014)。白芍提取物能诱导造血组织细胞发生黑化反应意味着过量添加该物质极有可能诱导细胞产生高氧化性的物质并导致细胞死亡。通过进一步比较DAPI染色的荧光显微结果, 我们发现0.85 mg/mL以上的白芍提取物终浓度无法使细胞核显示蓝色荧光, 这意味着高浓度的白芍提取物有可能对造血组织细胞的细胞核也产生了损伤。综合以上, 本次选用终浓度为0.85 mg/mL的白芍提取物作为后续评估的实验用浓度。
qRT-PCR结果显示添加0.85 mg/mL的白芍提取物能够诱导造血组织细胞的Astakine mRNA表达量发生变化, 主要变现为各时间点该基因表达量的显著提高。与初始表达量相比, 在添加0.85 mg/mL的白芍提取物后, 该基因的表达量显著提高并在最高值时达到了初始时的8.73倍。Astakine作为一种新发现的造血因子, 由Lin与Söderhäll等人首次从北美淡水鳌虾中发现(Lin et al, 2011a), 并被证实与甲壳动物血细胞的增殖和分化息息相关(Lin et al, 2010)。与细胞实验结果相似的是, 在饲喂含有白芍提取物的饲料后, 中华绒螯蟹造血组织的Astakine mRNA表达量相对对照组也有升高。同样地, 免疫荧光检测结果也显示饲喂含有白芍提取物的饲料的中华绒螯蟹造血组织含有更强的Astakine蛋白荧光信号, 这说明白芍能够诱导蟹造血组织中释放造血因子。进一步通过评估造血组织体重百分比和组织切片, 我们发现白芍提取物对造血组织发育有明显的促进作用, 实验组造血组织体重比较饲喂前提高了6.64%, 而对照组仅提高了1.6%, 且实验组造血组织含有较多的卵形小叶。血细胞是甲壳动物免疫功能主要载体, 能够行使包括吞噬、包囊、黑化和裂解外来病原菌等多种生物学功能(Jiravanichpaisal et al, 2006)。我们前期的研究结果显示用脂多糖、嗜水气单胞菌和枯草芽孢杆菌注射中华绒螯蟹, 能够导致蟹的血细胞数量急剧下降, 后又缓慢恢复(Lv et al, 2014)。这个现象说明外来刺激在导致血细胞数量下降的同时可能也会诱导血细胞的增殖和释放。Söderhäll(2016)推测该过程主要包括3部分, 分别是血细胞干细胞的增殖、分化和释放, 成熟的血细胞会从造血组织卵形的小叶中释放并进入开放的血淋巴循环系统(Lin et al, 2011a)。虽然目前尚无关于白芍对甲壳动物造血组织影响的报道, 但高等动物关于造血因子的研究发现可以佐证我们的实验结果。Fang等(2013)研究发现含有白芍的植物提取物可以显著提高血细胞生成相关通路基因的表达量, 主要是造血因子。Zhu等(2016)也发现含有白芍的植物提取物促进了小鼠骨髓基质细胞和血淋巴中的白细胞数量。脂多糖是一类革兰氏阴性细菌细胞壁的免疫刺激物, 能够诱导中华绒螯蟹血细胞的急剧下降, 甚至死亡(Lv et al, 2014)。本研究发现饲喂含有白芍提取物饲料的中华绒螯蟹对脂多糖的耐受力要优于对照组, 主要表现为蟹的成活率较高, 以上说明白芍提取物可能提高了蟹对脂多糖急性刺激的抗性。
4 结论本研究以中华绒螯蟹为实验对象, 初步探索了白芍提取物对甲壳类造血组织及造血因子Astakine的影响。结果显示在细胞培养基中添加低浓度(0.85 mg/mL)的白芍提取物可以提高造血组织细胞Astakine mRNA的表达量。同样地, 用含1%白芍提取物的饲料饲喂中华绒螯蟹也提高了中华绒螯蟹造血组织的Astakine mRNA和蛋白的表达量, 而且实验组造血组织相较对照组也有明显变化, 主要变现为组织增大及组织内卵形小叶数量增多。另外, 本研究还发现饲喂含白芍提取物的饲料可以提高蟹对脂多糖急性刺激的抗性。以上研究结果表明白芍提取物对中华绒螯蟹造血因子表达及造血组织发育有一定促进作用, 该结果可为其他甲壳动物造血组织的发育及免疫增强剂的筛选提供参考。
于秀娟, 徐乐俊, 吴反修, 等. 2020. 2020年中国渔业统计年鉴. 北京: 中国农业出版社, 34
|
刘红柏, 张颖, 杨雨辉, 等. 2004. 5种中草药作为饲料添加剂对鲤肠内细菌及生长的影响. 大连水产学院学报, 19(1): 16-20 DOI:10.3969/j.issn.1000-9957.2004.01.004 |
房海, 陈翠珍, 张晓君, 等. 2008. 中华绒螯蟹弧菌病及病原检验. 河北科技师范学院学报, 22(2): 1-6 |
徐海圣, 黄立峰, 王淑霞. 2001. 中华绒螯蟹豚鼠气单胞菌的分离和鉴定. 浙江大学学报(农业与生命科学版), 27(6): 677-681 DOI:10.3321/j.issn:1008-9209.2001.06.024 |
郭永军, 邢克智, 陈成勋, 等. 2005. 几种中草药对鲤鱼诱食效果的研究. 天津农学院学报, 12(3): 1-5 DOI:10.3969/j.issn.1008-5394.2005.03.001 |
雷燕, 肖洋, 王娟, 等. 2017. 中华绒螯蟹白斑症病毒病的诊断. 安徽农业科学, 45(5): 89-91 DOI:10.3969/j.issn.0517-6611.2017.05.033 |
薛仁宇, 曹广力, 魏育红, 等. 2005. 中华绒螯蟹呼肠孤病毒病组织病理学观察. 苏州大学学报(自然科学版), 21(1): 84-87 DOI:10.3969/j.issn.1000-2073.2005.01.019 |
Charoensapsri W, Amparyup P, Suriyachan C et al, 2014. Melanization reaction products of shrimp display antimicrobial properties against their major bacterial and fungal pathogens. Developmental & Comparative Immunology, 47(1): 150-159 |
Fang Z, Lu B X, Liu M Y et al, 2013. Evaluating the pharmacological mechanism of Chinese medicine Si-Wu-Tang through multi-level data integration. PLoS One, 8(11): e72334 DOI:10.1371/journal.pone.0072334 |
Franz C M, Baser K H C, Hahn-Ramssl I, 2020. Herbs and aromatic plants as feed additives: aspects of composition, safety, and registration rules. In: Florou-Paneri P, Christaki E, Giannenas I eds. Feed Additives. Cambridge: Elsevier, 35-56
|
Gong J, Yin F, Hou Y et al, 2014. Review: chinese herbs as alternatives to antibiotics in feed for swine and poultry production: potential and challenges in application. Canadian Journal of Animal Science, 94(2): 223-241 DOI:10.4141/cjas2013-144 |
Jia Z H, Kavungal S, Jiang S et al, 2016. The characterization of hematopoietic tissue in adult Chinese mitten crab Eriocheir sinensis. Developmental & Comparative Immunology, 60: 12-22 |
Jiravanichpaisal P, Lee B L, Söderhäll K, 2006. Cell-mediated immunity in arthropods: hematopoiesis, coagulation, melanization and opsonization. Immunobiology, 211(4): 213-236 DOI:10.1016/j.imbio.2005.10.015 |
Lin X H, Novotný M, Söderhäll K et al, 2010. Ancient cytokines, the role of astakines as hematopoietic growth factors. Journal of Biological Chemistry, 285(37): 28577-28586 DOI:10.1074/jbc.M110.138560 |
Lin X H, Söderhäll I, 2011a. Crustacean hematopoiesis and the astakine cytokines. Blood, 117(24): 6417-6424 DOI:10.1182/blood-2010-11-320614 |
Lin X H, Söderhäll K, Söderhäll I, 2011b. Invertebrate hematopoiesis: an astakine-dependent novel hematopoietic factor. The Journal of Immunology, 186(4): 2073-2079 DOI:10.4049/jimmunol.1001229 |
Lv S J, Lu B J, Xu J H et al, 2015. Immune response of peroxinectin of Chinese mitten crab Eriocheir sinensis to exterior stimulation. Developmental & Comparative Immunology, 51(1): 56-64 |
Lv S J, Xu J H, Zhao J et al, 2014. Classification and phagocytosis of circulating haemocytes in Chinese mitten crab (Eriocheir sinensis) and the effect of extrinsic stimulation on circulating haemocytes in vivo. Fish & Shellfish Immunology, 39(2): 415-422 |
Lyu S J, Yuan X M, Zhang H Q et al, 2020. Transcriptome profiling analysis of lung tissue of chinese soft-shell turtle infected by Trionyx sinensis hemorrhagic syndrome virus. Fish & Shellfish Immunology, 98: 653-660 |
Söderhäll I, 2016. Crustacean hematopoiesis. Developmental & Comparative Immunology, 58: 129-141 |
Söderhäll I, Bangyeekhun E, Mayo S et al, 2003. Hemocyte production and maturation in an invertebrate animal; proliferation and gene expression in hematopoietic stem cells of Pacifastacus leniusculus. Developmental & Comparative Immunology, 27(8): 661-672 |
Sun R, Yue F, Qiu L M et al, 2013. The CpG ODNs enriched diets enhance the immuno-protection efficiency and growth rate of Chinese mitten crab, Eriocheir sinensis. Fish & Shellfish Immunology, 35(1): 154-160 |
Xu Y, Li X, Chen T et al, 2019. Incompatibility mechanism between Radix paeoniae alba and Veratrum nigrum focusing on estrogen-estrogen receptor pathway in immature/ovariectomized mice. Rejuvenation Research, 22(6): 465-477 DOI:10.1089/rej.2017.2026 |
Zhao Z L, Zhang H J, Wang M Q et al, 2018. The ethanol extract of honeysuckle stem modulates the innate immunity of Chinese mitten crab Eriocheir sinensis against Aeromonas hydrophila. Fish & Shellfish Immunology, 82: 304-311 |
Zheng X C, Chi C, Xu C Y et al, 2019. Effects of dietary supplementation with icariin on growth performance, antioxidant capacity and non-specific immunity of Chinese mitten crab (Eriocheir sinensis). Fish & Shellfish Immunology, 90: 264-273 |
Zhu N, Lv X C, Wang Y Y et al, 2016. Comparison of immunoregulatory effects of polysaccharides from three natural herbs and cellular uptake in dendritic cells. International Journal of Biological Macromolecules, 93: 940-951 DOI:10.1016/j.ijbiomac.2016.09.064 |
 2021, Vol. 52
2021, Vol. 52


