中国海洋湖沼学会主办。
文章信息
- 李淑君, 崔志松, 包木太, 栾晓, 李颖超, 郑立. 2021.
- LI Shu-Jun, CUI Zhi-Song, BAO Mu-Tai, LUAN Xiao, LI Ying-Chao, ZHENG Li. 2021.
- 南极菲尔德斯半岛土壤微生物在富集传代培养中对菲的响应
- RESPONSES OF SOIL MICROORGANISMS TO PHENANTHRENE IN ENRICHMENT CULTURES AND SUBCULTURES FROM FILDES PENINSULA, ANTARCTICA
- 海洋与湖沼, 52(4): 895-903
- Oceanologia et Limnologia Sinica, 52(4): 895-903.
- http://dx.doi.org/10.11693/hyhz20210200032
文章历史
-
收稿日期:2021-02-02
收修改稿日期:2021-03-16
2. 自然资源部第一海洋研究所海洋生物资源与环境研究中心 青岛 266061;
3. 中国科学院生态 环境研究中心环境水质学国家重点实验室 北京 100085
2. Marine Bioresources and Environment Research Center, First Institute of Oceanography, Ministry of Natural Resources of China, Qingdao 266061, China;
3. State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
南极长年为冰雪所覆盖, 被认为是最后一块原始的大陆。但随着人类科考、旅游活动的增加, 南极环境不可避免的受到污染, 其中石油烃是最主要的污染物之一(Bargagli, 2008)。石油烃中结构稳定、毒性强、难降解的有机污染物以多环芳烃类化合物(polycyclic aromatic hydrocarbons, PAHs)为主。譬如, 南极考察站通常使用柴油作为燃料, 而柴油中含有高达20%的PAHs (Lee et al, 1992)。同时, PAHs还具有半挥发性, 容易随大气传输, 即所谓的“全球蒸馏”效应(又称“蚱蜢跳”效应) (Gouin et al, 2004), 从低纬度地区长距离迁移到偏远的极地地区。PAHs因其结构稳定性和热力学稳定性可在环境中广泛持久地存在, 不易被降解(Phillips, 1983)。但通过前期研究发现极端环境中蕴藏着具有污染物分解能力的微生物资源, 土著微生物能够更好地适应本地生态环境条件, 可以被有效应用于原生环境的污染物修复和处理(曾献春等, 2016)。
菲尔德斯半岛位于南设德兰群岛的乔治王岛西南端(58°57′51.9″W, 62°12′59.7″S), 具有独特的气候及地理特征, 没有大型植物生长, 形成了以地衣、苔原和微生物为优势物种的生态系统(Campbell et al, 2004)。与其他地区相比, 微生物是该生态系统的主要组成部分, 有时甚至是唯一的组成部分(Chong et al, 2009; Levin, 2013)。因此, 南极菲尔德斯半岛是研究微生物多样性的理想场所之一, 以该地区的土壤为研究对象有利于丰富对南极特殊环境中PAHs降解菌多样性的认识。
目前对南极PAHs降解菌的研究大多数是“快照式(snapshot)”的, 按研究方法分为依赖培养的技术体系和不依赖培养的技术体系。例如, Ma等(2006)多次利用可培养方法对南极PAHs降解菌进行分离和鉴定, 并获取了一些新属或新种的纯培养物。Muangchinda等(2015)利用常规PCR、real-time PCR、克隆和测序等分子生物学方法, 对南极土壤和沉积物中芳烃降解功能基因的丰度和多样性进行了研究。然而, 大家对南极PAHs降解菌群在时间序列上的动态变化却知之甚少。研究富集传代培养过程中PAHs降解菌群的物种组成及其动态变化, 不仅可以揭示富集传代培养过程中PAHs降解菌群随时间变化的规律, 还可分析确定南极土壤中降解PAHs的关键微生物类群, 有利于指导依赖培养的方法体系进行靶向性筛选, 提高南极特殊环境中菲降解菌的菌种分离效率, 为南极污染环境的生物修复提供有效的技术支持。
本研究以典型PAHs化合物菲为唯一碳源和能源对中国第35次南极科学考察采自菲尔德斯半岛6个站点的土壤样本进行富集传代培养获得菲降解菌群。通过16S rRNA基因高通量测序对菲降解菌群富集传代培养过程中的群落组成动态变化及多样性进行研究, 分析菲降解菌群代际微生物群落结构的差异, 揭示南极土壤微生物群落结构对PAHs暴露的动态响应和菲降解过程中具有显著性差异的物种, 为后续深入开发利用南极土壤功能微生物资源提供参考依据。
1 材料与方法 1.1 南极土壤样本采集2019年1月从南极菲尔德斯半岛采集土壤样品, 包括企鹅岛、生物湾、长城站、乌拉圭站、俄罗斯站和油库等6个站位(图 1)。上述6个站位的分布遵循随机和等量原则, 具有良好的代表性, 可较为客观地反映菲尔德斯半岛区域的微生物多样性。采用无菌铲取距离表层约2—5 cm深度的土壤样本, 置于无菌密封塑料袋中低温保存(杨晓等, 2016)。所有样本在-20 ℃条件下运输至国内, 并立即转移至-80 ℃低温冰箱中保存。
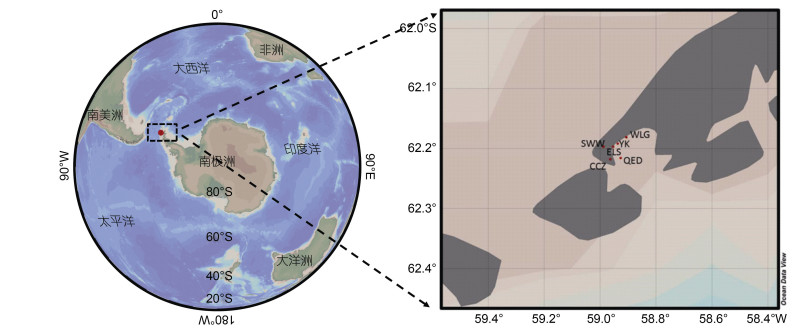 |
| 图 1 南极菲尔德斯半岛6个站位的地理位置 Fig. 1 Distribution of the six sampling stations in the Fildes Peninsula, Antarctica 注: QED表示企鹅岛, SWW表示生物湾, CCZ表示长城站, WLG表示乌拉圭站, ELS表示俄罗斯站, YK表示油库 |
基础盐培养基(minimal salt medium, MSM): KH2PO4 0.4 g/L, K2HPO4 0.2 g/L, (NH4)2SO4 0.4 g/L, NaCl 0.1 g/L, MgSO4 0.1 g/L, MnSO4·H2O 0.01 g/L, Fe2(SO4)3·H2O 0.01 g/L, Na2MoO4·H2O 0.01 g/L, pH 7.2 (Jiao et al, 2016)。
菲降解菌群富集转接培养基: 先将菲溶于二氯甲烷, 采用0.22 μm孔径的一次性无菌耐有机溶剂滤膜对其过滤除菌, 然后添加到MSM培养基中, 振荡使二氯甲烷充分挥发。该培养基中菲的终浓度为0.2 g/L。
1.3 菲降解菌群的富集、转接与菌群样品准备在100 mL菲降解菌群富集转接培养基中分别加入不同站位的南极土壤样品约5 g, 在25 ℃、150 r/min、避光的条件下摇床培养约30 d至对数生长后期, 此为富集培养物RT0。以未添加土壤样品的培养基在相同的条件下进行培养作为阴性对照。将10 mL富集培养物RT0接种于新配制的100 mL菲降解菌群富集转接培养基中(接种量为10%), 在上述相同条件下继续培养至对数生长后期, 如此转接5次, 此为传代培养物RT1—RT5。在每次转接后, 从富集、传代培养物RT0—RT5每个样品中取约10 mL菌液, 在4 ℃、10 000 r/min的条件下离心, 弃上清, 菌体于-80 ℃保存。上述每个站位各设置4个平行样。将富集传代培养过程(RT0—RT5)划分为两个阶段: 富集培养阶段(RT0)和传代培养阶段(RT1—RT5), 以便研究菲降解菌群在富集传代培养过程中的微生物群落结构变化规律。
1.4 细菌总DNA提取及16S rRNA基因高通量测序按照E.Z.N.A. Bacterial DNA Kit操作说明提取1.3所述细菌样品的总DNA。采用NanoDrop 2000超微量紫外分光光度计检测DNA的纯度和浓度。
以富集传代培养过程中细菌样品的总DNA为模板, 分别采用通用引物341F (5′-ACTCCTACGGGA GGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWT CTAAT-3′)对细菌16S rRNA基因的V3—V4区目标序列进行扩增(杜璨等, 2017)。PCR扩增条件如下: 94 ℃预变性3 min; 94 ℃变性30 s, 56 ℃退火45 s, 72 ℃延伸45 s, 循环30次; 72 ℃延伸10 min。使用Agencourt AMPure XP磁珠对PCR扩增产物进行纯化并溶于洗脱缓冲液, 添加标签序列, 完成建库。使用Agilent 2100生物分析仪(美国安捷伦)对文库的片段范围及浓度进行检测。检测合格的文库采用Illumina HiSeq 2500平台(BGI, 中国深圳)进行测序。
原始数据过滤后用FLASH软件包将双末端测序得到的成对reads(读序)组装成一条序列。然后, 利用软件USEARCH (v7.0.1090)将拼接好的Tags在97%相似度下进行聚类, 得到OTU的代表序列。注释数据库为Greengene, 方法分类器为RDP Classifier v.2.2 (置信度阈值=0.6), 最终得到注释的OTU结果序列表。
1.5 数据分析利用MOTHUR (v1.31.2)和QIIME (v1.8.0)对OTU数据进行Alpha和Beta多样性分析。采用Microsoft Excel 2013对Alpha多样性指数结果进行数据处理, 应用单因素方差分析法(One-Way ANOVA)对菌群代际Alpha多样性指数进行差异显著性分析。利用R (v3.1.1)软件包对代际菲降解菌群进行偏最小二乘判别分析(partial least squares discriminant analysis, PLS-DA)和菌群相似性分析(analysis of similarities, ANOSIM), 以判断富集传代培养过程中菌群结构的差异显著性。通过Galaxy在线分析平台(http://huttenhower.sph.harvard.edu/galaxy/)对属水平物种的相对丰度矩阵进行线性判别分析(linear discriminant analysis effect size, LEfSe), 从而筛选出菲降解菌群在富集传代培养过程中具有显著性差异的物种。
2 结果和讨论 2.1 富集传代培养过程中菲降解菌群的生长状况静置观察富集培养30 d后的RT0富集培养物, 阴性对照无任何浊度或颜色变化, 而南极各个站位的富集培养物均有明显的浊度和颜色变化。从富集阶段进入传代阶段后, 阴性对照RT1仍无任何生长现象, 培养基中的底物菲亦无明显降解, 菌液在600 nm波长处的吸光值(OD600)为0.05—0.10。当菲降解菌群RT1培养至对数生长后期, 各个站位的培养物浊度明显增加, 细胞密度增大, 其OD600为0.60—0.90。此外, 与无任何颜色变化的阴性对照RT1相比, 对数生长后期的菲降解菌群RT1培养物变为黄色, 这是由菲代谢中间产物在280 nm波长附近的光吸收造成的(Kweon et al, 2014)。在随后的传代培养物中均出现了与上述培养物类似的细菌生长和底物降解现象, 表明菲的添加为菲降解菌提供了碳源, 促进了菲降解菌的生长增殖。
2.2 富集传代培养过程中菲降解菌群的Alpha多样性根据物种丰富度(Observed species, Ace和Chao1)、物种多样性(Simpson和Shannon)和物种覆盖度(Good-coverage)对富集传代培养过程中菲降解菌群的Alpha多样性及其代际差异显著性进行分析(表 1, 表 2)。Good-coverage指数结果显示各代菲降解菌群的覆盖度均接近100 %, 说明测序数据足以真实反映菲尔德斯半岛菲降解菌群的多样性。从Observed species、ACE和Chao1等三项指数结果判断, RT0物种丰富度较高, RT1—RT5的物种丰富度较低。南极各站位的富集培养阶段培养物RT0在Observed species指数、ACE指数和Chao1指数上均显著高于传代培养阶段的第一代培养物RT1 (P < 0.05), 但传代培养阶段相邻两代之间(RT1 vs RT2、RT2 vs RT3、RT3 vs RT4和RT4 vs RT5)微生物群落的物种丰富度无显著性差异(P > 0.05)。富集传代培养过程中物种丰富度显著下降可能有两方面的原因: 首先, 实验室培养条件不利于部分种群的存活; 其次, 以菲为唯一碳源和能源对南极土壤微生物进行富集培养, 对菌群产生选择压力, 不能利用菲的微生物在该选择压力下被淘汰。而在传代培养阶段, 菲降解菌群已适应了该选择压力, 其物种丰富度变化相对较小。
| 分组 | Observed species | Chao1 | Ace | Shannon | Simpson | Good-coverage |
| RT0 | 280 | 367 | 409 | 1.99 | 0.29 | 0.998 |
| RT1 | 135 | 174 | 191 | 1.62 | 0.37 | 0.999 |
| RT2 | 99 | 134 | 141 | 1.79 | 0.29 | 0.999 |
| RT3 | 85 | 108 | 113 | 1.80 | 0.27 | 0.999 |
| RT4 | 90 | 117 | 121 | 1.89 | 0.27 | 0.999 |
| RT5 | 93 | 113 | 118 | 2.05 | 0.24 | 0.999 |
| 注: RT0表示富集培养物, RT1表示第1次转接培养物, RT2表示第2次转接培养物, RT3表示第3次转接培养物, RT4表示第4次转接培养物, RT5表示第5次转接培养物, Observed species表示观察到的物种数, Ace和Chao1表示物种总数, Simpson和Shannon表示物种多样性, Good-coverage表示物种覆盖度。 | ||||||
| P | RT0 vs RT1 | RT1 vs RT2 | RT2 vs RT3 | RT3 vs RT4 | RT4 vs RT5 |
| 物种丰富度 | 0.01 | 0.12 | 0.22 | 0.60 | 0.92 |
| 物种多样性 | 0.90 | 0.97 | 0.99 | 0.97 | 0.96 |
| 注: P表示概率, RT0表示富集培养物, RT1表示第1次转接培养物, RT2表示第2次转接培养物, RT3表示第3次转接培养物, RT4表示第4次转接培养物, RT5表示第5次转接培养物。 | |||||
从Simpson指数和Shannon指数结果判断, 富集传代培养过程中RT0—RT5的物种多样性无显著差异(P > 0.05)。丰富度和均匀度是物种多样性的重要组成部分, 且一般情况下物种丰富度越低, 其均匀度越高(Gosselin, 2006)。在富集传代培养过程中, 物种丰富度虽有所下降, 但其均匀度升高, 致使物种多样性变化不大。在相同的选择压力和培养条件下, 各存活物种的数目和生存权重之和越来越接近, 这可能是导致物种均匀度升高的原因。此外, 原始土壤微生物多样性较高, 被淘汰微生物的生态位易于被群落内其他微生物替代, 以维持生态系统的稳定与平衡(严彬, 2014)。
2.3 富集传代培养过程中菲降解菌群的Beta多样性采用PLS-DA分析了富集传代培养过程中菲降解菌的群落结构差异。如图 2所示, 图中两点之间的距离表示相应样品间微生物群落结构的差异。RT0各个站位的菲降解菌群形成较为独立的一簇, 而RT1—RT5各个站位的菲降解菌群则相互重叠, 表明富集培养阶段RT0的群落结构与传代培养RT1—RT5各个阶段的群落结构差异较大, 而传代培养阶段代际群落结构差异较小。代际菲降解菌群的ANOSIM结果(表 3)进一步表明RT0和RT1的群落结构存在显著差异(P < 0.01), 而在传代培养阶段的相邻两代之间(RT1 vs RT2、RT2 vs RT3、RT3 vs RT4和RT4 vs RT5)的群落结构无显著差异(P > 0.05)。综上, 富集培养阶段RT0的微生物群落结构经历了一次显著变化后, 在传代培养阶段RT1—RT5趋于相对稳定。Jiao等(2016)的研究发现, 有机污染物作为降解基质和环境因子能够影响土壤微生物的群落结构和功能, 触发微生物群落的定向演替。且不同的污染物对微生物群落演替的方向有不同的影响, 形成不同的微生物群落结构特征。本研究中富集培养阶段的群落结构与传代培养各个阶段的群落结构有显著差异, 主要是来源于菲作为唯一碳源和选择压力的驱动, 而这种在生长支持底物和生态位方面的选择可能与微生物的生物化学进化(biochemical evolution)有关(De Gannes et al, 2013)。Dini-Andreote等(2014)的研究结果表明富集培养阶段微生物群落的高复杂性可能是由初始土壤内在的高丰度和随机性微生物输入引起的。此外, Jiao等(2016)发现烃类物质越难降解, 微生物间的协同作用越强, 且微生物群落的合作强度随着胁迫的增加而增加。因此, 在持续选择压力菲的作用下, 传代培养阶段微生物群落不断演化并适应该选择压力, 且参与菲降解的成员之间相关性不断加强, 逐渐形成了相对稳定的菲降解菌群。
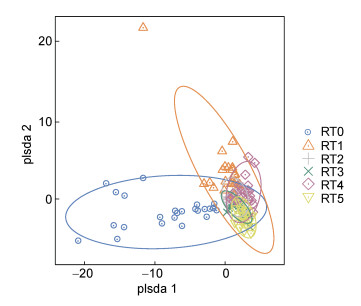 |
| 图 2 富集传代培养过程中南极菲降解菌群的差异 Fig. 2 The dissimilarity of bacterial community structure among the subcultures of phenanthrene-degrading bacterial consortia from Antarctica 注: RT0表示富集培养物, RT1表示第1次转接培养物, RT2表示第2次转接培养物, RT3表示第3次转接培养物, RT4表示第4次转接培养物, RT5表示第5次转接培养物。 |
| RT0 Vs RT1 | RT1 Vs RT2 | RT2 Vs RT3 | RT3 Vs RT4 | RT4 Vs RT5 | |
| P | 0.001 | 0.46 | 0.71 | 0.77 | 0.71 |
| 注: P表示概率, RT0表示富集培养物, RT1表示第1次转接培养物, RT2表示第2次转接培养物, RT3表示第3次转接培养物, RT4表示第4次转接培养物, RT5表示第5次转接培养物。 | |||||
OTU数据显示某些微生物在各个富集培养物RT0中的丰度较高, 但在传代培养物RT1中的丰度却降为0。例如地杆菌属(Geobacter)、类芽孢杆菌属(Paenibacillus)、罗河杆菌属(Rhodanobacter)、溶杆菌属(Lysobacter)、栖热菌属(Thermus)、丰收神菌属(Opitutus)和纤维单胞菌属(Cellulomonas)等。这些细菌可能不适应实验室培养条件或以菲为唯一碳源和能源的选择压力, 或不能利用菲作为生长底物, 因此在富集传代培养过程中被逐渐淘汰。
从属水平来看, 假单胞菌属(Pseudomonas) (5.3%—29.4%)、鞘氨醇菌属(Sphingobium) (6.9%—34.4%)和贪噬菌属(Variovorax)(1.4%—6.2%)在传代培养过程中始终为菌群中的优势种(图 3)。其中, Pseudomonas和Sphingobium为常见的PAHs降解菌(Singleton et al, 2011; 申国兰等, 2018), 沈方圆等(2016)的研究进一步表明它们均通过中间裂解途径对PAHs进行生物降解。Variovorax基因组中具有PAHs降解途径中的关键酶芳香环羟化双加氧酶(aromatic cyclohydroxylated dioxygenase, ARHD) (De Sousa et al, 2017), 参与了PAHs的催化降解。因此, 在菲作为唯一碳源和能源的选择性压力下, 富集培养物RT0中的菲降解菌和参与菲降解的微生物成为菌群中的优势种, 并且保持了物种丰度的动态平衡。
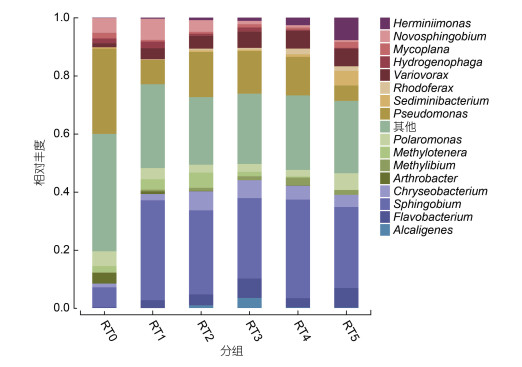 |
| 图 3 富集传代培养过程中菲降解菌群在属水平上的物种组成和相对丰度 Fig. 3 The species composition and relative abundance of phenanthrene-degrading bacterial consortia from Antarctica in enrichment culture and subcultures (at the level of genus) 注: RT0表示富集培养物, RT1表示第1次转接培养物, RT2表示第2次转接培养物, RT3表示第3次转接培养物, RT4表示第4次转接培养物, RT5表示第5次转接培养物。 |
Pseudomonas、新鞘氨醇菌属(Novosphingobium)、枝动菌属(Mycoplana)、噬氢菌属(Hydrogenophaga)和节杆菌属(Arthrobacter)在菲降解过程中起到重要作用, 可能为菲的降解提供初始动力(Pinyakong et al, 2003; Muangchinda et al, 2015)。譬如, 孟建宇等(2017)对Hydrogenophaga的萘降解特性进行了研究, 发现该菌在适宜的条件下培养48 h后进入稳定期, 60 h时萘降解率已高达91.43%。上述物种均为菲降解的先锋物种, 但随着传代培养其丰度有所下降。Sphingobium、Variovorax、金黄杆菌属(Chryseobacterium)、黄杆菌属(Flavobacterium)、Herminimononas和红育菌属(Rhodoferax)等促进了菲的降解或参与了菲降解过程(黄星云等, 2017; Chen et al, 2019; Geng et al, 2019), 致使它们的丰度随着传代培养而升高。然而, 沉积物杆状菌属(Sediminibacterium)的相对丰度增加可能是因为利用了菲的降解中间产物作为生长基质, 因为该菌并不具有降解菲的能力(Singleton et al, 2016)。上述微生物互养(cross-feeding)现象在有机污染物降解菌群中是一种普遍存在的物种互作机制。例如, Pseudomonas可以分泌生物表面活性剂, 提高PAHs的生物利用度, 为其他细菌降解PAHs提供条件(Desai et al, 1997)。最后, 产碱杆菌属(Alcaligenes)和甲基娇养杆菌属(Methylotenera)等混合营养型细菌也具有潜在的PAHs降解能力。譬如, Alcaligenes可以作为双功能菌用于PAHs和亚砷酸盐共污染系统的生物修复(Tang et al, 2013)。Methylotenera也曾被报道具有纤维素降解和PAHs共代谢的功能(Guo et al, 2020)。综上, 添加菲作为唯一碳源和能源可以显著改变富集培养过程中微生物群落的组成, 且不同的微生物在菲降解过程中通过复杂的微生物互作共同促进了菲的降解, 形成了相对稳定的功能菌群(Guo et al, 2020)。
2.5 富集传代培养过程中具有显著性差异的物种通过Lefse分析确定了富集传代培养过程中具有显著性差异的物种(LDA值> 4) (图 4)。在属水平上, 富集培养阶段RT0中具有显著性差异的物种为Pseudomonas、Arthrobacter、细小棒状菌属(Parvibaculum)和Proteiniclasticum。在传代培养阶段, RT1中具有显著性差异的物种为Sphingobium。RT4中具有显著性差异的物种为Variovorax。RT5中具有显著性差异的物种为Flavobacterium和Sediminibacterium。以菲为唯一碳源和能源的持续性选择压力和物种的生态位差异可能是上述物种成为代际间具有显著性差异物种的原因。据文献报道, 一些显著性差异物种(譬如Pseudomonas、Sphingobium和Variovorax)不但在原位环境中是优势种(Lopatina et al, 2013; Geng et al, 2019; 李桂秀等, 2020), 而且具有降解菲的能力(Singleton et al, 2011; De Sousa et al, 2017; Guo et al, 2020)。综上, 菲降解菌群中具有显著性差异的物种在菲降解菌群中可能占据重要的生态位, 并可能是南极土壤环境中菲降解的主要驱动者, 对维持群落的动态平衡具有重要的作用。
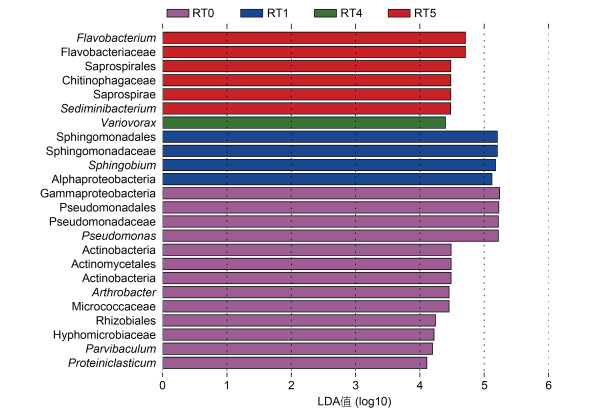 |
| 图 4 南极菲降解菌群在富集传代培养过程中具有显著性差异的物种 Fig. 4 The species of significant difference in phenanthrene-degrading bacterial consortia from Antarctica in enrichment culture and subcultures 注: RT0表示富集培养物, RT1表示第1次转接培养物, RT4表示第4次转接培养物, RT5表示第5次转接培养物, RT2和RT3无具有显著性差异的物种, 不在图中显示 |
本研究以菲为唯一碳源和能源对南极土壤微生物进行富集和连续传代培养, 并利用高通量测序技术对微生物群落结构进行分析, 揭示了富集传代培养过程中南极菲降解菌的动态变化规律。研究表明南极土壤微生物群落响应了菲的暴露和选择性压力, 富集培养阶段与传代培养阶段的群落结构具有显著性差异, 但传代培养阶段代际群落结构间无显著性差异。大量微生物因不能适应实验室培养条件或不能利用菲而在传代培养阶段被淘汰。Pseudomonas、Sphingobium、Variovorax、Methylotenera和Alcaligenes等适应了该选择压力并在传代培养阶段形成了动态平衡的优势物种群体。它们在富集传代培养中可能通过复杂的物种互作促进菲的降解利用。此外, Pseudomonas、Sphingobium、Variovorax等代际间具有显著性差异的物种不仅是南极土壤环境中菲降解的主要驱动者, 还在维持群落的动态平衡中发挥着重要的作用。该研究为后续深入开发利用南极土壤功能微生物资源提供了参考依据。
致谢 本研究得到中国南极第35次科考队以及南极长城极地生态国家野外观测研究站的支持,特此致谢。
申国兰, 李利, 陈莎. 2018. 微生物降解石油源多环芳香烃的研究进展. 土壤, 5(1): 16-27 |
严彬. 2014. 效用管理研究. 北京: 北京邮电大学出版社
|
杜璨, 许晨阳, 王强, 等. 2017. 秦岭红桦林土壤细菌群落剖面分布特征及其影响因素. 环境科学, 38(7): 3010-3019 |
李桂秀, 宋易洋, 赵芯, 等. 2020. 基于高通量测序对南极菲尔德斯半岛土壤微生物多样性的初步研究. 渔业研究, 42(3): 195-204 |
杨晓, 丁慧, 臧家业, 等. 2016. 南极菲尔德斯半岛土壤可培养细菌多样性分析. 极地研究, 28(1): 34-41 |
沈方圆, 孙明明, 焦加国, 等. 2016. 四环素对芘污染农田土壤微生物修复的影响及响应过程. 土壤, 48(5): 954-963 |
孟建宇, 李蘅, 唐凯, 等. 2017. 两株氢噬胞菌的萘降解特性分析. 化工环保, 37(3): 300-303 DOI:10.3969/j.issn.1006-1878.2017.03.008 |
黄星云, 张泽宇, 熊苏雅, 等. 2017. 菲反硝化降解菌群的富集及其群落结构解析. 环境科学学报, 37(11): 4314-4321 |
曾献春, 郑李娟, 葛风伟, 等. 2016. 新疆石油污染土壤苯并(a)芘降解微生物多样性研究. 生态科学, 35(4): 79-85 |
Bargagli R, 2008. Environmental contamination in Antarctic ecosystems. Science of the Total Environment, 400(1-3): 212-226 DOI:10.1016/j.scitotenv.2008.06.062 |
Campbell I B, Claridge G G C, Balks M R, 2004. The effect of human activities on moisture content of soils and underlying permafrost from the McMurdo Sound region, Antarctica. Antarctic Science, 6(3): 307-314 DOI:10.1017/S0954102094000477 |
Chen C M, Ming J, Yoza B A et al, 2019. Characterization of aerobic granular sludge used for the treatment of petroleum wastewater. Bioresource Technology, 271: 353-359 DOI:10.1016/j.biortech.2018.09.132 |
Chong C W, Dunn M J, Convey P et al, 2009. Environmental influences on bacterial diversity of soils on Signy Island, maritime Antarctic. Polar Biology, 32(11): 1571-1582 DOI:10.1007/s00300-009-0656-8 |
De Gannes V, Eudoxie G, Hickey W J, 2013. Prokaryotic successions and diversity in composts as revealed by 454-pyrosequencing. Bioresource Technology, 133: 573-580 DOI:10.1016/j.biortech.2013.01.138 |
De Sousa S T P, Cabral L, Júnior G V L et al, 2017. Diversity of aromatic hydroxylating dioxygenase genes in mangrove microbiome and their biogeographic patterns across global sites. MicrobiologyOpen, 6(4): e00490 DOI:10.1002/mbo3.490 |
Desai J D, Banat I M, 1997. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews, 61(1): 47-64 DOI:10.1128/.61.1.47-64.1997 |
Dini-Andreote F, De Cássia Pereira e Silva M, Triadó-Margarit X et al, 2014. Dynamics of bacterial community succession in a salt marsh chronosequence: evidences for temporal niche partitioning. The ISME Journal, 8(10): 1989-2001 DOI:10.1038/ismej.2014.54 |
Geng Y C, Zhang Y M, Qin K et al, 2019. Sphingomonas paeninsulae sp. nov., isolated from soil sampled at Fildes Peninsula, Antarctica. International Journal of Systematic and Evolutionary Microbiology, 69(12): 3702-3709 DOI:10.1099/ijsem.0.003504 |
Gosselin F, 2006. An assessment of the dependence of evenness indices on species richness. Journal of Theoretical Biology, 242(3): 591-597 DOI:10.1016/j.jtbi.2006.04.017 |
Gouin T, Mackay D, Jones K C et al, 2004. Evidence for the "grasshopper" effect and fractionation during long-range atmospheric transport of organic contaminants. Environmental Pollution, 128(1-2): 139-148 DOI:10.1016/j.envpol.2003.08.025 |
Guo Y T, Rene E R, Wang J J et al, 2020. Biodegradation of polyaromatic hydrocarbons and the influence of environmental factors during the co-composting of sewage sludge and green forest waste. Bioresource Technology, 297: 122434 DOI:10.1016/j.biortech.2019.122434 |
Jiao S, Chen W M, Wang E T et al, 2016. Microbial succession in response to pollutants in batch-enrichment culture. Scientific Reports, 6(1): 21 791 DOI:10.1038/srep21791 |
Kweon O, Kim S J, Kim D W et al, 2014. Pleiotropic and epistatic behavior of a ring-hydroxylating oxygenase system in the polycyclic aromatic hydrocarbon metabolic network from Mycobacterium vanbaalenii PYR-1. Journal of Bacteriology, 196(19): 3503-3515 DOI:10.1128/JB.01945-14 |
Lee L S, Hagwall M, Delfino J J et al, 1992. Partitioning of polycyclic aromatic hydrocarbons from diesel fuel into water. Environmental Science & Technology, 26(11): 2104-2110 DOI:10.1021/es00035a005 |
Levin S A, 2013. Encyclopedia of Biodiversity. 2nd ed. San Diego: Elsevier Science & Technology
|
Lopatina A, Krylenkov V, Severinov K, 2013. Activity and bacterial diversity of snow around Russian Antarctic stations. Research in Microbiology, 164(9): 949-958 DOI:10.1016/j.resmic.2013.08.005 |
Ma Y F, Wang L, Shao Z Z, 2006. Pseudomonas, the dominant polycyclic aromatic hydrocarbon-degrading bacteria isolated from Antarctic soils and the role of large plasmids in horizontal gene transfer. Environmental Microbiology, 8(3): 455-465 DOI:10.1111/j.1462-2920.2005.00911.x |
Muangchinda C, Chavanich S, Viyakarn V et al, 2015. Abundance and diversity of functional genes involved in the degradation of aromatic hydrocarbons in Antarctic soils and sediments around Syowa Station. Environmental Science and Pollution Research, 22(6): 4725-4735 DOI:10.1007/s11356-014-3721-y |
Phillips D H, 1983. Fifty years of benzo(a)pyrene. Nature, 303(5917): 468-472 DOI:10.1038/303468a0 |
Pinyakong O, Habe H, Omori T, 2003. The unique aromatic catabolic genes in sphingomonads degrading Polycyclic Aromatic Hydrocarbons (PAHs). Journal of General and Applied Microbiology, 49(1): 1-19 DOI:10.2323/jgam.49.1 |
Singleton D R, Adrion A C, Aitken M D, 2016. Surfactant-induced bacterial community changes correlated with increased polycyclic aromatic hydrocarbon degradation in contaminated soil. Applied Microbiology and Biotechnology, 100(23): 10165-10177 DOI:10.1007/s00253-016-7867-z |
Singleton D R, Richardson S D, Aitken M D, 2011. Pyrosequence analysis of bacterial communities in aerobic bioreactors treating polycyclic aromatic hydrocarbon-contaminated soil. Biodegradation, 22(6): 1061-1073 DOI:10.1007/s10532-011-9463-3 |
Tang J Z, Feng T C, Cui C Z et al, 2013. Simultaneous biodegradation of phenanthrene and oxidation of arsenite by a dual-functional bacterial consortium. International Biodeterioration & Biodegradation, 82: 173-179 DOI:10.1016/j.ibiod.2013.02.012 |
 2021, Vol. 52
2021, Vol. 52


