中国海洋湖沼学会主办。
文章信息
- 宋吉雪, 明红霞, 石婷婷, 苏洁, 陈泉睿, 金媛, 樊景凤. 2021.
- SONG Ji-Xue, MING Hong-Xia, SHI Ting-Ting, SU Jie, CHEN Quan-Rui, JIN Yuan, FAN Jing-Feng. 2021.
- 辽河口沉积物中参与主要生物地化循环的微生物功能基因分析
- ANALYSIS OF MICROBIAL FUNCTIONAL GENES INVOLVED IN MAJOR BIOGEOCHMICAL CYCLES IN SEDIMENTS OF LIAOHE RIVER ESTUARY
- 海洋与湖沼, 52(4): 904-916
- Oceanologia et Limnologia Sinica, 52(4): 904-916.
- http://dx.doi.org/10.11693/hyhz20201200341
文章历史
-
收稿日期:2020-12-25
收修改稿日期:2021-04-25
2. 国家海洋环境保护近岸海域生态环境重点实验室 大连 116023;
3. 厦门大学海洋与地球学院 厦门 361005
2. National Key Laboratory of Coastal Ecological Environment, Marine Environmental Protection, Dalian 116023, China;
3. School of Ocean and Earth Science, Xiamen University, Xiamen 361005, China
辽河口位于渤海辽东湾北部, 是辽宁省最大的入海河流, 每年向辽东湾输入大量营养盐和泥沙, 具有明显的丰水期与枯水期两个季节性变化, 是研究元素生物地球化学循环的热点区域(Canuel et al, 2016; 赵美训等, 2017)。辽河口又作为一个淡咸水过渡区域, 大量陆源元素输入和环境因子的共同影响使得沉积物中的微生物更加复杂多样。目前对河口细菌群落的组成已经有了大量的研究, 包括德国派克河口(Crump et al, 2004)、法国罗纳河口(Troussellier et al, 2002)、葡萄牙阿维罗河口(Henriques et al, 2006)、中国长江口(Sekiguchi et al, 2002)和美国切萨皮克湾(Kan et al, 2008)。以研究较多的美国切萨皮克湾为例, 其细菌群落呈现出显著的季节性变化和周期性的年际变化特征; 这些变化除了受水的滞留时间和细菌生长速度影响外, 还可能受其他许多环境因子的影响(Kan et al, 2008; 阚金军等, 2011)。近年来, 科学家们正在利用高通量基因组学、转录组学和蛋白质组学等技术去研究自然条件下微生物群落错综复杂的基因多样性和表达, 提供了揭示水环境中微生物群落组成和新功能基因的途径。国内目前对于辽河口区域的研究也多集中于反硝化相关功能基因的丰度和多样性分析。因此研究辽河口表层沉积物中功能基因多样性及其变化, 对了解和预测辽河口沉积物微生物的功能代谢潜力和受环境变化的影响具有重要意义。
近年来, 高通量基因组学技术的快速发展, 极大地促进了微生物群落的相关研究。与高通量测序技术相比, 微生物功能基因芯片“GeoChip”的优势是根据微生物相关的各类功能基因独立设计特异性探针, 极大地降低了特殊样品中动植物宿主基因组对微生物群落功能检测的影响(Yang et al, 2014)。GeoChip 4.0是由周集中教授(Bai et al, 2013; Gao et al, 2014)及其团队研发, 包括570 042多种寡聚核酸探针, 靶向与生物地球化学循环相关的代谢途径(如碳、氮、硫和磷循环、金属电阻、抗生素耐药性和有机修复等)中2 433多种功能基因家族及268 059多种编码基因。目前关于微生物的功能特征如与代谢途径相关的功能基因、基因在生态系统过程中的代谢潜力等方面开展的研究已有很多(Rui et al, 2015; 张欣等, 2017)。例如利用包含24 243个寡核苷酸探针(10 000多个与氮、碳、硫和磷循环和有机污染物降解相关的功能基因)的功能基因芯片研究了不同纬度上的南极土壤微生物群落变化等(Zhang et al, 2017)。
本研究利用GeoChip 4.0技术, 以辽河口为研究区域, 研究其表层沉积物微生物功能基因多样性, 进而了解影响微生物功能基因多样性的主要环境因子, 为揭示和预测辽河口表层沉积物微生物介导的生物地球化学循环提供科学依据, 同时为辽河口区域生态环境治理提供了理论支撑。
1 材料与方法 1.1 样品采集根据辽河口水文特征及相关地理信息, 于2018年6月12日至15日期间在辽河口海域进行表层沉积物样品采集。共设置6个站位(图 1), 分别表示海相区(S1、S2, 水深7—14 m), 混合区(S3、S4, 水深4—5 m), 河相区(S5、S6, 水深3—6 m)。使用抓斗采泥器采集沉积物表层0—10 cm处样品, 采样面积为0.1 m2, 且每个站位重复采样3次, 混匀均质化后保存于无菌自封袋中, -20 ℃条件下运回实验室。
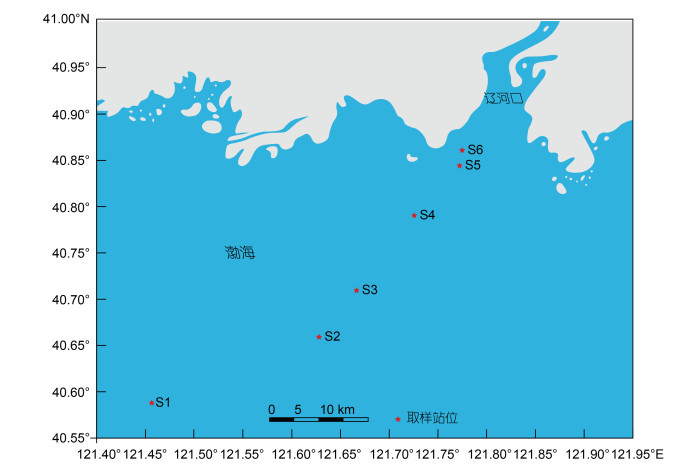 |
| 图 1 采样站位图 Fig. 1 Deployment of sampling stations |
环境因子中水体盐度、酸碱度(pH)、溶解氧浓度(DO)、温度、电导率通过美国YSI 556MPS便携式多参数水质测量仪现场测定。硝酸盐(NO3-)、亚硝酸盐(NO2-)和氨盐(NH4+)浓度通过使用氯化钾溶液提取后进行分光光度法测定, 参照2012年中华人民共和国环境保护标准(HJ 634-2012)“土壤, 氨氮, 亚硝酸盐氮, 硝酸盐氮的测定: 氯化钾溶液提取-分光光度法”。磷酸盐(PO43-)采用磷钼蓝分光光度法测定, 参照2007年中华人民共和国国家标准(GB 17378.4—2007) “海洋监测规范, 第4部分: 海水分析”。
沉积物中总磷(TP)通过分光光度法测定(姜峰等, 2017), 总有机碳(TOC)通过重铬酸钾氧化-还原容量法测定(李旭冉, 2015), 总氮(TN)通过凯氏定氮法测定(高一亮等, 2015), 沉积物中粒度使用激光衍射粒度分析仪(LS13320SW, 美国)测定, 参照2007年中华人民共和国国家标准(GB 17378.5-2007)“海洋监测规范, 第5部分: 沉积物分析”。
1.3 基因芯片测试与数据分析将每个站位沉积物样品解冻混匀后, 称取约0.30 g, 使用DHeasy PowerSoil Kit试剂盒(QIAGEN公司)进行DNA提取, 各站位取3组平行样品。用微量紫外分光光度计测定DNA浓度, 并使用1.5%的琼脂糖凝胶进行电泳检验。将检测合格的DNA样品进行荧光标记、芯片杂交、芯片扫描与成像(基因芯片实验每组进行三个重复)。
基因芯片具体步骤如下, 采用随机引物法用荧光染料Cy-5对DNA样品进行荧光标记(Tu et al, 2014)。采用QIA试剂盒(Qiagen, Valencia, CA)纯化荧光标记后的DNA, 将标记成功的放入真空干燥机, 45 ℃下干燥45 min; 接着在标记后的DNA样品中加入120 μL杂交缓冲液(40%甲酰胺, 3×SSC, 0.1% SDS, 10 μg未标记的Herring Sperm DNA), 待完全溶解后95 ℃下变性5 min, 然后置于50 ℃培养箱中保存; 在MAUI杂交平台(Bio Micro, Salt Lake City, UT, USA) 42 ℃培养箱中进行杂交16 h; 用Nimble Gen MS 200扫描仪(Roche, Madison, WI, USA)对杂交后的芯片进行扫描。扫描得到的图像由ImaGene (Biodiscovery Inc, El Segundo, CA, USA)进行预处理后, 进行信号强度的标准化。
数据的标准化处理包括片间归一化和去假阳性。把各个样本光强总和调整到同一批次光强最高的样本的水平。去掉信噪比(SNR)小于2.0的低质量点; 将信号值标准化, 即先将每个点的信号值除以相应微阵列的所有信号值的总和, 再乘以所有微阵列的平均值; 最后转化为自然对数(Zhang et al, 2017)。采用Excel和SPSS 21.0等软件对功能微生物基因类群进行统计分析。使用生物统计学软件R软件中的Vegan软件包对表层沉积物微生物功能基因与环境因子的关系进行RDA分析。
2 结果与分析 2.1 环境因子的理化特征辽河口各环境因子的理化参数如表 1所示。水体温度相对恒定(26—27 ℃), 溶氧量相对稳定(6.1— 6.3 mg/L), 水体偏碱性(pH 7.72—8.00), 盐度在S1站位最高, S6站位最低。从S1至S6站位, 电导率逐渐降低; 铵盐(NH4+)浓度逐渐增大; 亚硝酸盐(NO2-)和硝酸盐(NO3-)、磷酸盐(PO43-)浓度逐渐增大。
| 站位 | 温度(℃) | 盐度 | 电导率(ms/cm) | pH | 溶解氧(mg/L) | 铵盐μmol/L) | 亚硝酸盐(μmol/L) | 硝酸盐(μmol/L) | 磷酸盐(μmol/L) | 总有机碳(%) | 总磷(μg/g) | 总氮(μg/g) | 黏土(%) | 淤泥(%) | 砂(%) |
| S1 | 26.2 | 31.5 | 47.3 | 8.00 | 6.3 | 1.08 | 0.24 | 0.80 | 0.11 | 0.82 | 185.0 | 34.7 | 31.18 | 58.48 | 10.34 |
| S2 | 27.0 | 28.7 | 44.6 | 7.99 | 6.3 | 1.11 | 0.32 | 7.27 | 0.13 | 0.43 | 57.2 | 40.2 | 23.53 | 51.55 | 24.92 |
| S3 | 26.7 | 25.5 | 40.0 | 7.94 | 6.1 | 1.49 | 0.48 | 12.32 | 0.01 | 0.56 | 90.3 | 60.5 | 31.01 | 60.13 | 8.85 |
| S4 | 27.0 | 20.7 | 33.1 | 7.92 | 6.1 | 5.61 | 0.35 | 15.27 | 0.20 | 0.70 | 99.6 | 298.0 | 14.57 | 56.67 | 28.76 |
| S5 | 26.5 | 13.1 | 21.8 | 7.72 | 6.3 | 9.50 | 0.61 | 15.23 | 0.27 | 0.14 | 117.0 | 76.5 | 12.60 | 59.54 | 27.87 |
| S6 | 25.9 | 2.4 | 4.5 | 7.54 | 6.2 | 13.61 | 0.94 | 21.98 | 0.31 | 0.46 | 84.4 | 90.5 | 18.47 | 53.82 | 27.71 |
辽河口表层沉积物的粒径主要是由淤泥(Silt)、黏土(Clay)和砂(Sand)三种物质组成, 其中S1站位的黏土(Clay)含量占比最高为31.18%, S3站位的淤泥(Silt)含量占比最高为60.13%, S4站位的砂(Sand)含量占比最高为28.76%。总有机碳(TOC)含量在海相区高于河相区; 总磷(TP)浓度在海相区(57.2—185 μg/g) > 河相区(84.4—117 μg/g) > 混合区(90.3—99.6 μg/g); 总氮(TN)浓度在混合区(60.5—298 μg/g) > 河相区(76.5—90.5 μg/g) > 海相区(34.7—40.2 μg/g)。
2.2 辽河口表层沉积物微生物功能基因多样性Geochip检测到辽河口表层沉积物中各类型功能基因48 742个, 反映了9个微生物介导的关键生物过程。其中, 碳循环相关的功能基因有22 320个、氮循环相关的功能基因有6 154个、磷循环相关的功能基因有2 003个、硫循环相关的功能基因有4 282个(表 2)。统计6个站位的沉积物在功能大类(gene_category)层级的探针检出数及信号强度(图 2, 3), 发现与碳循环相关的探针数量最多、信号强度最强, 氮、硫和磷相关的探针数量较少、信号强度较弱。这表明, 在功能大类层级中, 与碳循环相关的功能基因最多, 且每个站位参与不同生物地化循环的功能基因数量变化趋势基本相同。
| 功能基因 | 基因数量(个) |
| 碳循环 | 22 320 |
| 金属稳态 | 3 400 |
| 氮循环 | 6 154 |
| 有机修复 | 9 403 |
| 毒力 | 769 |
| 磷循环 | 2 003 |
| 次级代谢 | 86 |
| 硫循环 | 4 282 |
| 其他 | 325 |
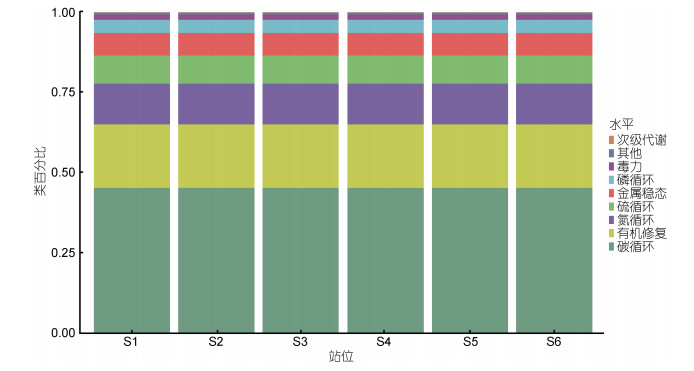 |
| 图 2 功能大类层级各大类所包含探针的检出数百分比柱状图 Fig. 2 Histogram of the percentage of detections of the probes contained in each category at the Gene_category level |
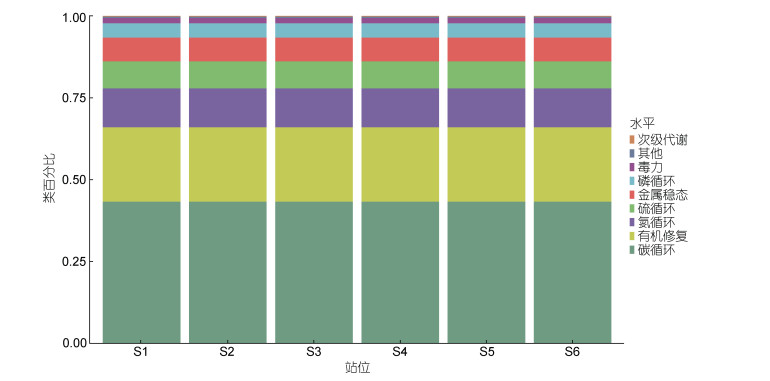 |
| 图 3 功能大类层级各大类所包含探针的信号强度柱状图 Fig. 3 Signal strength histogram of probes contained in each category at the Gene category level |
对不同站位检测到的功能基因进行了特有和共有基因数量比较, 发现不同站位含有的特有基因数量和所占总数量的比例不一致。如图 4可知, 6个站位共有的基因数量一共42 722个, S4站位特有的基因数量最多, 具有386个, 占总量0.80%; S3站位特有的基因数量最少, 具有16个, 占总量的0.03%。
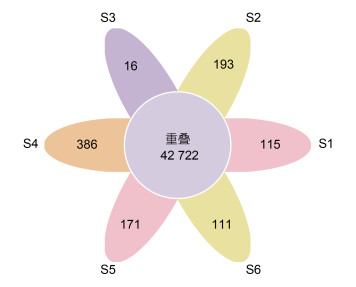 |
| 图 4 不同站位特有和共有功能基因数目分布花瓣图 Fig. 4 Petal map of the number of unique and shared functional genes at different sites |
碳循环相关的功能基因中, Geochip检测到与总有机碳降解相关的功能基因最多, 有16 421个, 其次是碳固定功能基因5 422个和产甲烷功能基因477个。鉴于碳循环功能基因的复杂性, 本研究筛选了部分关键基因进行讨论(图 5)。总有机碳降解中的乙酰木聚糖酯酶(axe)基因的平均基因芯片荧光信号值在所有基因中最高, α-淀粉酶(amyA)和碳固定中的乙酰辅酶A (acc_arch)基因、转酮醇酶(tktA)基因较高。其中acc_arch基因是3HP/4HB途径中的关键功能基因; tktA基因是芳香族氨基酸生物合成中心途径的关键酶基因。甲烷氧化过程中的可溶性甲烷单加氧酶(mmoX)基因的平均基因芯片荧光信号值从远海到近海是逐渐上升的, 并在S6站位达到最大值。而对于铁氧化还原蛋白基因酶(oorA)基因来说, 它的平均基因芯片荧光信号值在不同站位中无明显变化。实验选取6个站位中的最远点S1站位和最近点S6站位, 比较分析碳循环功能基因的荧光信号值差异。结果显示(图 6), axe基因、protease_aspartate_fungi、amyA、mmoX基因、pmoA基因、mcrA基因在S1和S6站位的荧光信号值差异性显著(P < 0.05)。
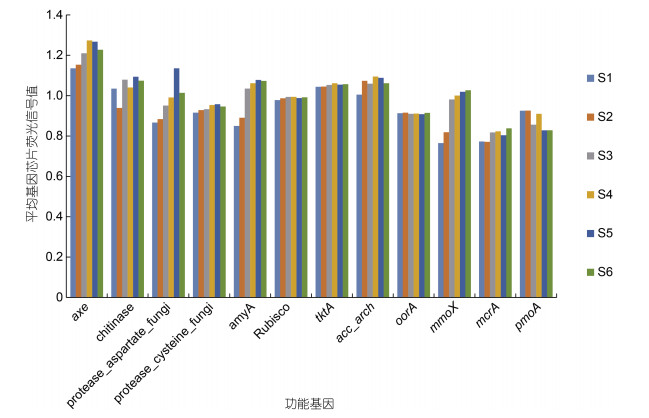 |
| 图 5 碳循环功能基因的平均基因芯片荧光信号值 Fig. 5 Average Gene Chip Fluorescence Signal Values for Carbon Cycle Functional Genes 注: axe: 乙酰木聚糖酯酶基因; chitinase: 几丁质酶; protease_aspartate_fungi: 天冬氨酸蛋白酶; protease_cysteine_fungi: 半胱氨酸蛋白酶; amyA: α-淀粉酶; Rubisco: 核酮糖-1, 5-二磷酸羧化酶/加氧酶; tktA: 转酮醇酶基因; acc_arch: 乙酰辅酶A基因; oorA: 铁氧化还原蛋白酶基因; mmoX: 可溶性甲烷单加氧酶基因; mcrA: 产甲烷菌甲基辅酶M还原酶α亚基基因; pmoA: 颗粒性甲烷单加氧酶基因 |
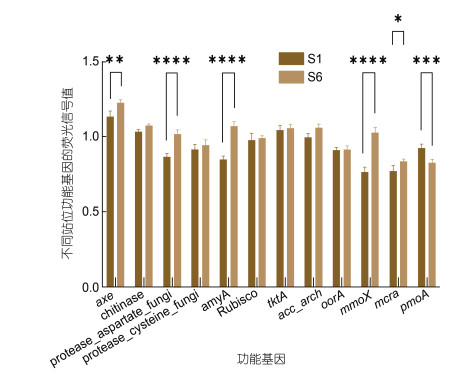 |
| 图 6 碳循环不同功能基因在不同站位间的差异性分析 Fig. 6 Analysis of the difference of different functional genes of carbon cycle among different stations 注: axe: 乙酰木聚糖酯酶基因; chitinase: 几丁质酶; protease_aspartate_fungi: 天冬氨酸蛋白酶; protease_cysteine_fungi: 半胱氨酸蛋白酶; amyA: α-淀粉酶; Rubisco: 核酮糖-1, 5-二磷酸羧化酶/加氧酶; tktA: 转酮醇酶基因; acc_arch: 乙酰辅酶A基因; oorA: 铁氧化还原蛋白酶基因; mmoX: 可溶性甲烷单加氧酶基因; mcrA: 产甲烷菌甲基辅酶M还原酶α亚基基因; pmoA: 颗粒性甲烷单加氧酶基因 |
Geochip检测到与氮循环相关的功能基因, 从远岸点S1向近岸点S6靠近时, 所有功能基因的平均基因芯片荧光信号值均呈现出由远海向近海上升的趋势(图 7)。即在河相区的近海点拥有更为丰富的氮循环微生物群落。厌氧氨氧化的联氨合成酶(hzsA)基因的荧光信号值在所有氮循环功能基因中相对较弱, 但其荧光信号值在S1和S6站位中差异性显著(P<0.05)(图 8)。反硝化功能基因中, 编码硝酸盐还原酶(narG)基因的荧光信号值最高, 其余依次是编一氧化氮还原酶(norB)基因、编码含铜亚硝酸还原酶(nirK)基因、编码氧化亚氮还原酶(nosZ)基因和编码含细胞色素的亚硝酸盐还原酶(nirS)基因, 且narG基因的荧光信号强度是氮循环所有功能基因中最高的。
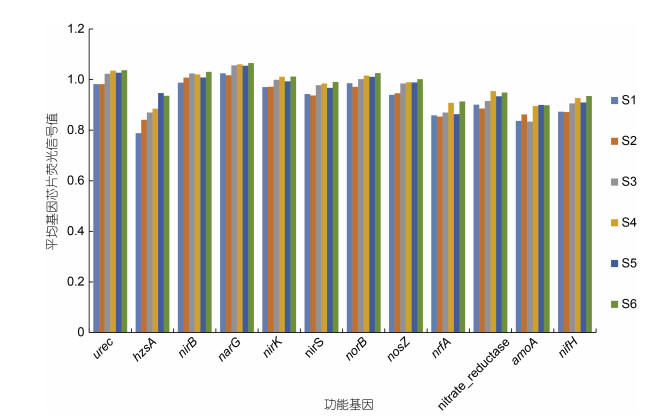 |
| 图 7 氮循环功能基因的平均基因芯片荧光信号值 Fig. 7 Average gene chip fluorescence signal value of nitrogen cycle function genes 注: urec: 脲酶基因; hzsA: 厌氧氨氧化的联氨合成酶基因; nirB: N减少同化作用的基因; narG: 硝酸盐还原酶基因; nirK: 含铜亚硝酸还原酶基因; nirS: 含细胞色素cdI的亚硝酸盐还原酶; norB: 一氧化氮还原酶基因; nosZ: 氧化亚氮还原酶基因; nrfA: 根瘤菌固氮作用的基因; nitrate_reductase: 硝酸还原酶; amoA: 氨单加氧酶基因; nifH: 土壤微生物固氮基因 |
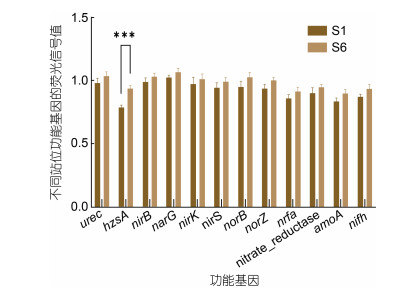 |
| 图 8 氮循环不同功能基因在不同站位间的差异性分析 Fig. 8 Analysis on the Difference of Different Functional Genes of Nitrogen Cycle in Different Stations 注: urec: 脲酶基因; hzsA: 厌氧氨氧化的联氨合成酶基因; nirB: N减少同化作用的基因; narG: 硝酸盐还原酶基因; nirK: 含铜亚硝酸还原酶基因; nirS: 含细胞色素cdI的亚硝酸盐还原酶; norB: 一氧化氮还原酶基因; nosZ: 氧化亚氮还原酶基因; nrfA: 根瘤菌固氮作用的基因; nitrate_reductase: 硝酸还原酶; amoA: 氨单加氧酶基因; nifH: 土壤微生物固氮基因 |
硫循环相关的功能基因中, Geochip检测到所有功能基因的平均基因芯片荧光信号值均呈现由远海向近海上升的趋势(图 9), 说明较于海相区和混合区, 河相区拥有更为丰富的硫循环微生物群落。亚硫酸盐还原酶中的Sir基因是硫循环功能基因中荧光信号强度最高的。硫氧化过程中, SoxC的荧光信号值最高, SoxB、SoxA、SoxV、SoxY依次之, 它们的平均基因芯片荧光信号值从远海到近海均呈现出上升的趋势。统计学分析发现(图 10), 除了SoxC基因, 其余功能基因的荧光信号值都在S1和S6站位中差异性显著(P<0.05)。
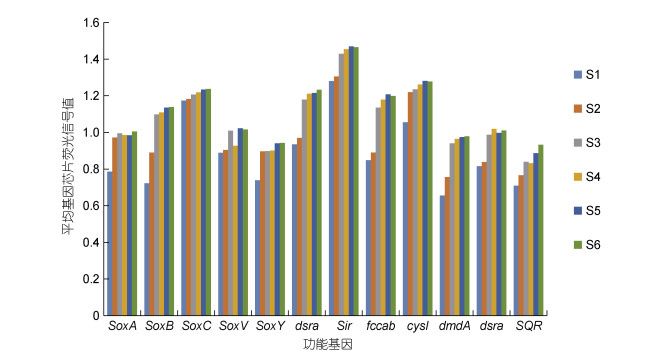 |
| 图 9 硫循环功能基因的平均基因芯片荧光信号值 Fig. 9 Average Gene Chip Fluorescence Signal Values for Sulfur Cycle Functional Genes 注: SoxA, SoxB, SoxC, SoxV, SoxY: 硫氧化功能基因; dsra, Sir: 亚硫酸盐还原酶基因; fccab: 硫化物氧化的基因; cysI: 硫循环中的其他基因; dmdA: DMSP(二甲基巯基丙酸内盐)降解酶基因; SQR: 硫化物-醌氧化还原酶基因 |
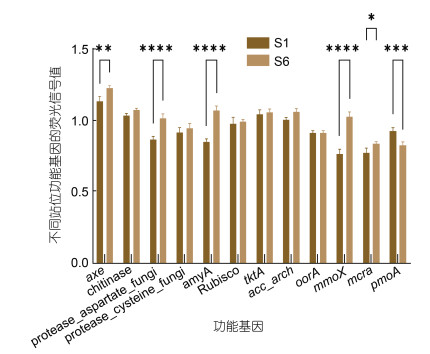 |
| 图 10 硫循环不同功能基因在不同站位间的差异性分析 Fig. 10 Analysis on the Difference of Different Functional Genes of Sulfur Cycle in Different Stations 注: axe: 乙酰木聚糖酯酶基因; chitinase: 几丁质酶; protease_aspartate_fungi: 天冬氨酸蛋白酶; protease_cysteine_fungi: 半胱氨酸蛋白酶; amyA: α-淀粉酶, Rubisco: 核酮糖-1, 5-二磷酸羧化酶/加氧酶; tktA: 转酮醇酶基因; acc_arch: 乙酰辅酶A基因; oorA: 铁氧化还原蛋白酶基因; mmoX: 可溶性甲烷单加氧酶基因; mcrA: 产甲烷菌甲基辅酶M还原酶α亚基基因; pmoA: 颗粒性甲烷单加氧酶基因 |
磷循环相关的功能基因中, Geochip只检测到三个基因种类, 分别是植酸水解中的植酸酶(phytase)基因、多磷酸盐合成中的多聚磷酸盐激酶(ppk)基因和多磷酸盐降解中的多聚磷酸盐水解酶(ppx)基因。如图 11可知, 除了ppx基因的平均基因芯片荧光信号值在不同站位中并没有表现出较大变化外, phytase和ppk基因的荧光信号值均呈现出由远海向近海依次上升的趋势, 其中ppk基因的荧光信号值最高。且从图 12可知, phytase和ppk基因的荧光信号值在S1和S6站位中差异性显著(P<0.05)。
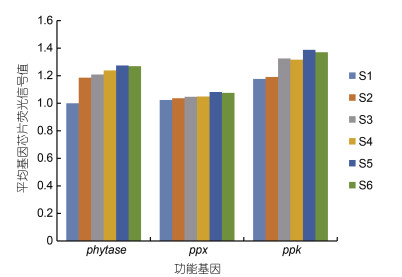 |
| 图 11 磷循环功能基因的平均基因芯片荧光信号值 Fig. 11 Average Gene Chip Fluorescence Signal Value of Phosphorus Cycle Functional Genes 注: phytase: 植酸酶基因; ppx: 多聚磷酸盐水解酶基因; ppk: 多聚磷酸盐激酶基因 |
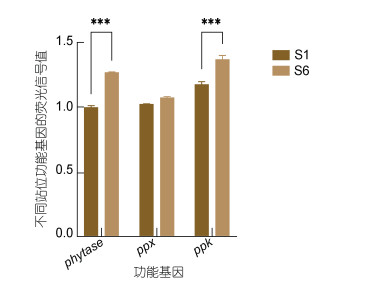 |
| 图 12 磷循环不同功能基因在不同站位间的差异性分析 Fig. 12 Analysis on the Differences of Different Functional Genes of Phosphorus Cycle in Different Stations 注: phytase: 植酸酶基因; ppx: 多聚磷酸盐水解酶基因; ppk: 多聚磷酸盐激酶基因 |
基于各环境因子与Gene_category层级间Spearman相关系数的R值和P值, 挑选|R|>0.8, P<0.05的结果制作热图, 如图 13可知, 碳循环、氮、磷、硫化物等各类功能基因均与pH、盐度(Salinity)、电导率(Cond)、黏土(Clay)显著负相关, 与TN、NH4+、硝酸盐(NO3-)、亚硝酸盐(NO2-)、PO43-显著正相关, 与淤泥(Silt)、溶解氧(DO)、总磷(TP)等无显著相关性。
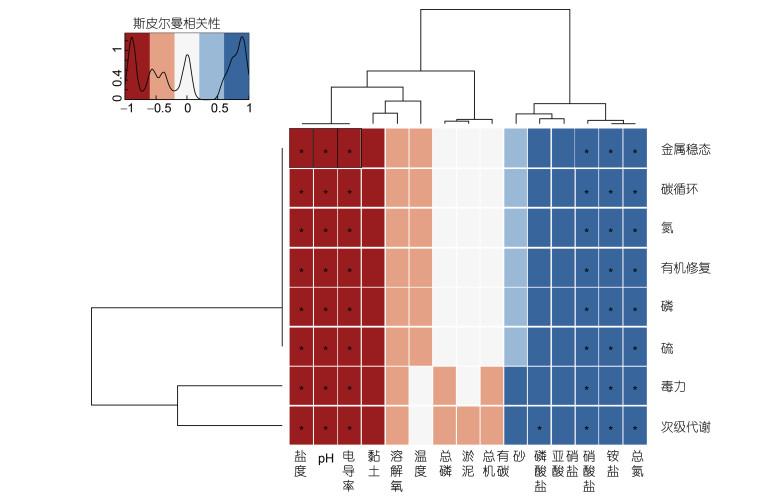 |
| 图 13 环境因子与功能大类(Gene_category)基础相关性热图 Fig. 13 Heatmap of the basic correlation between environmental factors and functional category (Gene_category) |
利用冗余图(RDA)和BioEnv法共同进一步探究环境因子变量与各站位功能基因组成的关系。RDA(图 14)共解释70.91 %的功能基因变化, 结果发现, 主要影响因子因站位不同而有所差异, 主要是总磷(TP), 其次是硝酸盐(NO3-)。采用BioEnv法(表 3)归纳出与各站位功能基因组成相关性最高的环境因子组合为NO3-、TP、TOC、Silt。
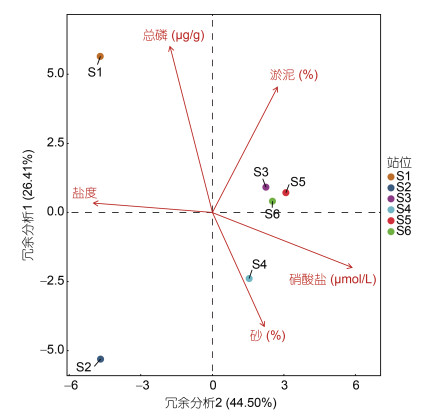 |
| 图 14 各站位功能基因与环境因子的冗余度(RDA)分析 Fig. 14 Analysis of Redundancy(RDA)of Functional Genes and Environmental Factors at Each Station |
| 因子 | 大小 | 相关性 |
| 总磷 | 1 | 0.732 1 |
| 硝酸盐 总磷 | 2 | 0.675 0 |
| 硝酸盐 总磷 总有机碳 | 3 | 0.685 7 |
| 硝酸盐 总磷 总有机碳 淤泥 | 4 | 0.700 0 |
| 硝酸盐 总磷 温度 总有机碳 淤泥 | 5 | 0.685 7 |
| 盐度 硝酸盐 总磷 总氮 总有机碳 淤泥 | 6 | 0.667 9 |
| 盐度 铵盐 硝酸盐 总磷 总氮 总有机碳 淤泥 | 7 | 0.635 7 |
| 盐度 硝酸盐 总磷 总氮 温度 溶解氧 总有机碳 淤泥 | 8 | 0.571 4 |
| 盐度 亚硝酸盐 硝酸盐 总磷 总氮 温度 总有机碳 淤泥 砂 | 9 | 0.564 3 |
| 铵盐 亚硝酸盐 硝酸盐 总磷 总氮 温度 溶解氧 总有机碳 黏土 淤泥 | 10 | 0.525 0 |
| 盐度 亚硝酸盐 硝酸盐 总磷 总氮 温度 溶解氧 总有机碳 黏土 淤泥 砂 | 11 | 0.475 0 |
| 盐度 铵盐 亚硝酸盐 硝酸盐 总磷 总氮 温度 溶解氧 总有机碳 黏土 淤泥 砂 | 12 | 0.378 9 |
| 盐度 pH 铵盐 硝酸盐 总磷 总氮 温度 电导率 溶解氧 总有机碳 黏土 淤泥 砂 | 13 | 0.314 3 |
| 盐度 铵盐 亚硝酸盐 硝酸盐 磷酸盐 总磷 总氮 温度 电导率 溶解氧 总有机碳 黏土 淤泥 砂 | 14 | 0.253 6 |
| 盐度 pH 铵盐 亚硝酸盐 硝酸盐 磷酸盐 总磷 总氮 温度 电导率 溶解氧 总有机碳 黏土 淤泥 砂 | 15 | 0.132 1 |
基因芯片的杂交信号强度与微生物群落基因组DNA和细胞总量均有良好的线性正相关性(Rhee et al, 2004)。因此, 杂交信号强度能在一定程度上直接反映环境微生物的丰富度, 还能够有效地将生态系统过程与微生物群落的功能结构联系起来。在本研究中, 共检测到辽河口表层沉积物中各类型功能基因48 742个, 包括有机碳降解、碳固定、硫还原、氮固定、磷利用等, 表明在辽河口表层沉积物中含有复杂的微生物介导的生物地球化学循环过程。其中, 与碳循环相关的功能基因数目及荧光信号强度在所有站位检测到的基因中为最高, 表明辽河口表层沉积物的微生物群落具有强大的碳代谢潜力。在对东海陆架区域的研究中, 王煜(2018)利用Geochip技术发现东海表层海水微生物群落的功能基因多样性远高于底层海水, 且碳降解中的功能基因对应的微生物群落也更加复杂。这说明海洋沉积物中碳代谢的潜力不可忽视, 其丰富的微生物信息值得深入挖掘。
3.2 辽河口表层沉积物中碳循环的微生物多样性辽河口沉积物中的固碳微生物在整个辽河生态系统碳循环中起着十分重要的作用, 不同途径针对沉积物中CO2的利用能力不同。卡尔文循环是辽河口沉积物中自养生物固碳的主要途径, 3HP/4HB循环则是一种存在于严格厌氧环境的微生物固碳途径。共同点是, 它们不仅是辽河口生态系统执行初级生产过程的主要动力, 还在调控大气中CO2浓度方面扮演重要角色。碳固定中的Rubisco酶是被经常报道的关键酶之一(Alfreider et al, 2009)。本文针对辽河口区域检测出的碳循环功能基因进行分析, 发现Rubisco基因的平均基因芯片荧光信号值远低于3HP/4HB途径中关键功能基因acc_arch的平均荧光信号值, 且后者的荧光信号值为最高。这为研究者们提供了一个新的思路, 可以对辽河口沉积物中微生物acc_arch基因的多样性展开研究, 由于此过程一般发生在古菌中, 所以可进一步分析辽河口沉积物中古菌参与碳循环的多样性。
微生物介导的各类化学反应是地球生物化学循环的基础, 这些生物化学之间的关联性也预示着微生物之间存在的相互性。实验发现辽河口沉积物中与有机碳降解有关的功能基因很多, 说明辽河口沉积物中活跃着大量参与有机碳降解的微生物, 这对揭示辽河口沉积物中有机碳的生产与消耗有一定的参考意义。为了进一步了解河口乃至近海有机碳(DOC)的行为特征, 研究者一般通过建立DOC与盐度的关系, 发现DOC在近岸及河口区通常表现为净消耗、净生产或者保守混合的行为(吴凯, 2017)。盐分对辽河口湿地土壤DOC浓度及CO2释放具有显著影响, 具体表现为, 盐分升高降低了土壤CO2的释放, 土壤CO2的释放与DOC浓度显著正相关(肖颖, 2016)。而在珠江口中、下游的中、髙盐度区域会出现DOC的保守或净添加行为。同样地, 在密西西比河口、亚马逊河口和特拉华河口等大河流影响的区域, 人们都发现了DOC净生产的行为(Meador et al, 2014)。所以正确认识辽河口沉积物中有机碳的行为特征, 对陆地和海洋这两个生态系统的碳循环都有着重要意义。
3.3 辽河口表层沉积物中氮循环的微生物多样性河口区域是氮元素生物地球化学循环最活跃、最复杂的地区, 而微生物是驱动氮素生物地球化学循环的重要牵引者。本研究中, 发现辽河口表层沉积物氮循环途径中反硝化功能基因的平均荧光信号值较高, 且在反硝化功能基因中, 编码硝酸盐还原酶(narG)基因的荧光信号值最高。这个检测结果与明红霞等(2020)发现narG基因丰度(1.63×108—1.13×109 copies/g)最高的结果一致。说明辽河口表层沉积物中具有更为丰富的参与反硝化作用的微生物。反硝化微生物大部分为异养兼性厌氧细菌。目前来说, 樊景凤团队对辽河口沉积物中反硝化细菌进行了大量研究(樊景凤等, 2011; 李博超, 2017; Chen et al, 2020), 以nirK基因作为标记分子, 得出辽河口沉积物中反硝化细菌主要为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)类细菌, 其中变形菌门类细菌占主导地位。
3.4 辽河口表层沉积物中硫、磷循环的微生物多样性在硫氧化过程中, 本文检测到SoxA、SoxB、SoxC、SoxV、SoxY功能基因对应的菌属在门水平上都为变形杆菌, 其中以α-变形菌纲最为丰富。目前, 编码关键酶的功能基因被广泛应用于跟踪硫循环相关的生物分子标记。定量分析显示, 珠江流域中具有SoxB功能基因的SOB比具有SQR和dsrA功能基因的SOB更丰富, 是硫氧化的主要贡献者(Luo et al, 2018)。在辽河口沉积物中, 本文也检测到硫氧化途径的关键功能基因SQR、SoxB和dsrA, 但其分布情况还待进一步揭示。磷是地球化学循环中的另一个重要元素。大量研究表明, 氮和磷是限制水体富营养化最重要的营养元素(张晋华等, 2014)。因此, 沉积物中的磷循环对上覆水体富营养化的发生具有重要的意义。磷循环还可以耦合碳、氮、硫和金属元素循环(Burgin et al, 2011), 在辽河口表层沉积物积微生物地球化学循环中起着举足轻重的作用。
3.5 辽河口表层沉积物中功能基因与环境因子的关系辽河口沉积物中各类微生物功能基因与pH、Salinity、Cond、TN、NH4+、NO3-显著相关, 说明功能基因与环境因子的响应是多种复杂因素共同作用的结果。辽河口位于辽宁省盘锦市河流入海的过渡地带, 受入海淡水影响, 有着水体盐度相对较低、季节性变化较大的特点。有研究表明(张敏等, 2015), 夏季丰水期时, 海水盐度明显降低, 局部河口区盐度可低至16.28; 而在枯水期, 海水的表层盐度在29—32之间。此外, 2017年的中国海洋环境状况公报中指出辽河携带了5 209 t氨氮、45 659 t硝酸盐氮以及5 515 t的亚硝酸盐氮输入到渤海辽东湾海域, 污染物输入量在全国入海河流中位居前列。如此巨大的氮素输入对于河口环境中参与氮循环的微生物群落结构组成无疑是具有重要影响的。沉积物粒径与原位水文条件密切相关, 可以通过河流径流、淡咸水混合强度, 对其他物理化学特性的动态控制(Dang et al, 2010)。但在本研究中, 各类功能基因与其并无显著相关性。总磷与硝酸盐是影响辽河口微生物功能基因多样性分布格局的重要因素。辽河口区域作为优质水稻和中华绒毛蟹的主要产地, 每年氮肥和磷肥施用量高达11.8万t, 且该区域N/P值的变化较大(李璐等, 2018)。杨志等(2020)最新发现, 辽河口近年来N/P值偏高并逐年上升, 处于一种磷限制潜在性富营养状态。这一发现与本实验结果: 辽河口近岸沉积物中含有大量的N、P元素且总磷的浓度远高于总氮的浓度相一致。同时, 除了环境因素以外, 人为因素的影响也是造成该区域N/P失衡的原因之一(Liu et al, 2015)。
总之, 本研究利用微生物功能基因芯片技术检测了辽河口表层沉积物微生物功能基因的组成, 分析了参与碳、氮、磷、硫循环微生物功能基因的多样性和环境因子, 有助于了解环境变化对辽河口表层沉积物生态系统结构、功能产生的影响, 能为辽河口生态系统的保护和管理提供理论依据, 也为碳氮耦合、磷硫耦合以及其他生物介导的生物地球化学循环过程提供了重要依据, 对了解辽河口土壤微生物的代谢潜力和预测渤海区域受全球变化的影响有重要意义。
4 结论在6个沉积物样品中, 利用GeoChip 4.0检测到各类型功能基因48 742个, 反映了9个微生物介导的关键生物过程。碳循环的功能基因数量在所有站位检测到基因中为最高, 表明辽河口表层沉积物微生物群落具有强大的碳代谢潜力。其次是氮循环, 氮循环中反硝化功能基因narG的荧光信号值最高, 说明辽河口表层沉积物中具有更为丰富的参与反硝化作用的微生物。对于硫循环来说, 河相区检测到的功能基因数量远大于混合区和海相区的功能基因数量。较于海相区和混合区, 河相区拥有更为丰富的硫循环微生物群落, 硫循环中功能基因SoxC的荧光信号值最高。检测到磷循环的功能基因数量最少, 只有三个基因种类, 以功能基因ppk的荧光信号值最高。环境因子总磷与硝酸盐是影响微生物功能基因多样性分布格局的重要因素。
王煜, 2018. 典型近岸海洋环境微型生物群落种类和功能多样性研究. 厦门: 厦门大学博士学位论文
|
中华人民共和国环境保护部. 2012. HJ 634-2012土壤氨氮、亚硝酸盐氮、硝酸盐氮的测定氯化钾溶液提取-分光光度法. 北京: 中国环境科学出版社
|
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 2008. GB 17378.5-2007海洋监测规范第5部分: 沉积物分析. 北京: 中国标准出版社
|
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 2008. GB 17378.4-2007海洋监测规范第4部分: 海水分析. 北京: 中国标准出版社
|
李璐, 邹立, 杨阳, 等. 2018. 辽河口芦苇湿地积水营养盐组成和结构的周日变化特征. 海洋湖沼通报, (2): 80-87 |
李旭冉. 2015. 重铬酸钾氧化-还原容量法测定海洋沉积物中有机碳的不确定度评定. 现代农业科技, (24): 207-208, 221 DOI:10.3969/j.issn.1007-5739.2015.24.122 |
李博超, 2017. 辽河口沉积物反硝化相关功能基因丰度和多样性分析. 大连: 大连海洋大学硕士学位论文
|
杨志, 叶金清, 杨青, 等. 2020. 辽河口海域浮游动物多样性及对河口环境的指示. 海洋环境科学, 39(1): 25-30 |
肖颖, 2016. 盐分对辽河口湿地土壤有机碳矿化的影响. 沈阳: 沈阳大学硕士学位论文
|
吴凯, 2017. 近海环境中溶解有机物的生产和生物降解过程. 厦门: 厦门大学博士学位论文
|
张欣, 刘静, 沈国平, 等. 2017. 基于高通量测序研究青藏高原茶卡盐湖微生物多样性. 微生物学通报, 44(8): 1834-1846 |
张敏, 陶然, 杨扬, 等. 2015. 环境因素对不同工艺人工湿地反硝化功能基因丰度影响. 环境工程学报, 9(6): 2645-2652 |
张晋华, 于立霞, 姚庆祯, 等. 2014. 不同季节辽河口营养盐的河口混合行为. 环境科学, 35(2): 569-576 |
明红霞, 陈泉睿, 史银银, 等. 2020. 辽河口沉积物反硝化过程研究-以反硝化功能基因丰度及nirK型细菌群落结构分析为例. 海洋学报, 42(12): 82-92 |
赵美训, 丁杨, 于蒙. 2017. 中国边缘海沉积有机质来源及其碳汇意义. 中国海洋大学学报, 47(9): 70-76 |
姜峰, 李亮. 2017. 沉积物中总磷的测定方法对比. 广东化工, 44(10): 197-198 DOI:10.3969/j.issn.1007-1865.2017.10.098 |
高一亮, 黎小鹏, 邓桂添, 等. 2015. 全自动凯氏定氮仪测定土壤全氮含量不确定度的评定. 现代农业科技, (10): 221-222 DOI:10.3969/j.issn.1007-5739.2015.10.134 |
阚金军, 孙军. 2011. 河口细菌群落多样性及其控制因素: 以切萨皮克湾为例. 生物多样性, 19(6): 770-778 |
樊景凤, 陈佳莹, 陈立广, 等. 2011. 辽河口沉积物反硝化细菌数量及多样性的研究. 海洋学报, 33(3): 94-102 DOI:10.3969/j.issn.1009-5470.2011.03.015 |
Alfreider A, Vogt C, Geiger-Kaiser M et al, 2009. Distribution and diversity of autotrophic bacteria in groundwater systems based on the analysis of RuBisCO genotypes. Systematic and Applied Microbiology, 32(2): 140-150 DOI:10.1016/j.syapm.2008.11.005 |
Burgin A J, Yang W H, Hamilton S K et al, 2011. Beyond carbon and nitrogen: how the microbial energy economy couples elemental cycles in diverse ecosystems. Frontiers in Ecology and the Environment, 9(1): 44-52 DOI:10.1890/090227 |
Bai S, Li J, He Z et al, 2013. GeoChip-based analysis of the functional gene diversity and metabolic potential of soil microbial communities of mangroves. Appl Microbiol Biotechnol, 97(15): 7035-7048 DOI:10.1007/s00253-012-4496-z |
Canuel E A, Hardison A K, 2016. Sources, ages, and alteration of organic matter in estuaries. Annual Review of Marine Science, 8(1): 409-434 DOI:10.1146/annurev-marine-122414-034058 |
Chen Q R, Fan J F, Ming H X et al, 2020. Effects of environmental factors on denitrifying bacteria and functional genes in sediments of Bohai Sea, China. Marine Pollution Bulletin, 160: 111621 DOI:10.1016/j.marpolbul.2020.111621 |
Crump B C, Hopkinson C S, Sogin M L et al, 2004. Microbial biogeography along an estuarine salinity gradient: combined influences of bacterial growth and residence time. Applied and Environmental Microbiology, 70(3): 1494-1505 DOI:10.1128/AEM.70.3.1494-1505.2004 |
Dang T V, Roger D A, Peter W G et al, 2010. Phosphorus availability for three crop species as a function of soil type and fertilizer history. Plant and Soil, 337(1/2): 497-510 |
Gao Y, Wang S P, Xu D P et al, 2014. GeoChip as a metagenomics tool to analyze the microbial gene diversity along an elevation gradient. Genomics Data, 2: 132-134 DOI:10.1016/j.gdata.2014.06.003 |
Henriques I S, Alves A, Tacão M et al, 2006. Seasonal and spatial variability of free-living bacterial community composition along an estuarine gradient (Ria de Aveiro, Portugal). Estuarine, Coastal and Shelf Science, 68(1/2): 139-148 |
Kan J J, Evans S E, Chen F et al, 2008. Novel estuarine bacterioplankton in rRNA operon libraries from the Chesapeake Bay. Aquatic Microbial Ecology, 51(1): 55-66 |
Liu D Y, Li X, Emeis K C et al, 2015. Distribution and sources of organic matter in surface sediments of Bohai Sea near the Yellow River Estuary, China. Estuarine, Coastal and Shelf Science, 165: 128-136 DOI:10.1016/j.ecss.2015.09.007 |
Luo J F, Tan X Q, Liu K X et al, 2018. Survey of sulfur-oxidizing bacterial community in the Pearl River water using soxB, sqr, and dsrA as molecular biomarkers. Biotech, 8(1): 73 DOI:10.1007/s13205-017-1077-y |
Meador T B, Aluwihare L I, 2014. Production of dissolved organic carbon enriched in deoxy sugars representing an additional sink for biological C drawdown in the Amazon River Plume. Global Biogeochemical Cycles, 28(10): 1149-1161 DOI:10.1002/2013GB004778 |
Rhee S K, Liu X D, Wu L Y et al, 2004. Detection of genes involved in biodegradation and biotransformation in microbial communities by using 50-Mer oligonucleotide microarrays. Applied and Environmental Microbiology, 70(7): 4303-4317 DOI:10.1128/AEM.70.7.4303-4317.2004 |
Rui J P, Li J B, Wang S P et al, 2015. Responses of bacterial communities to simulated climate changes in alpine meadow soil of the Qinghai-Tibet Plateau. Applied and Environmental Microbiology, 81(17): 6067-6077 |
Sekiguchi H, Koshikawa H, Hiroki M et al, 2002. Bacterial distribution and phylogenetic diversity in the Changjiang estuary before the construction of the Three Gorges Dam. Microbial Ecology, 43(1): 82-91 DOI:10.1007/s00248-001-0034-8 |
Troussellier M, Schäfer H, Batailler N et al, 2002. Bacterial activity and genetic richness along an estuarine gradient (Rhone River plume, France). Aquatic Microbial Ecology, 28(1): 13-24 |
Tu Q C, Yu H, He Z L et al, 2014. GeoChip 4:a functional gene-array-based high-throughput environmental technology for microbial community analysis. Molecular Ecology Resources, 14(5): 914-928 |
Yang Y F, Gao Y, Wang S P et al, 2014. The microbial gene diversity along an elevation gradient of the Tibetan grassland. The ISME Journal, 8(2): 430-440 DOI:10.1038/ismej.2013.146 |
Zhang Y G, Liu X, Cong J et al, 2017. The microbially mediated soil organic carbon loss under degenerative succession in an alpine meadow. Molecular Ecology, 26(14): 3676-3686 DOI:10.1111/mec.14148 |
 2021, Vol. 52
2021, Vol. 52


