
中国海洋湖沼学会主办。
文章信息
- 朱春月, 孙志宾, 马爱军, 刘志峰, 杨敬昆, 赵亭亭. 2021.
- ZHU Chun-Yue, SUN Zhi-Bin, MA Ai-Jun, LIU Zhi-Feng, YANG Jing-Kun, ZHAO Ting-Ting. 2021.
- 大菱鲆(Scophthalmus maximus)热休克蛋白SmHsp47相互作用蛋白His-pull down和质谱鉴定
- IDENTIFICATION OF PROTEINS INTERACTION WITH SCOPHTHALMUS MAXIMUS HEAT SHOCK PROTEIN SmHsp47 BY HIS-PULL DOWN COMBINED WITH MASS SPECTROMETRY
- 海洋与湖沼, 52(4): 971-982
- Oceanologia et Limnologia Sinica, 52(4): 971-982.
- http://dx.doi.org/10.11693/hyhz20201200331
文章历史
-
收稿日期:2020-12-12
收修改稿日期:2021-02-19
2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东省海洋渔业生物技术与遗传育种重点实验室 青岛市海水鱼类种子工程与生物技术重点实验室 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋生物学与生物技术功能实验室 青岛 266237
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Shandong Key Laboratory of Marine Fisheries Biotechnology and Genetic Breeding; Qingdao Key Laboratory for Marine Fish Breeding and Biotechnology, Qingdao 266071, China;
3. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
热休克蛋白(heat shock protein, Hsp)是有机体受到高温胁迫后大量合成的一类蛋白, 普遍存在于各类生物中(Feder et al, 1999)。热休克蛋白主要功能是分子伴侣, 具有多种功能, 能够辅助新合成肽链正确折叠、消除变性或者错误折叠的肽链, 避免应激状态下蛋白质的变性, 减少因疏水基团暴露而导致的蛋白质聚集等(田倪妮, 2014)。根据相对分子量、氨基酸序列特征以及功能可以划分为如下几类: Hsp110、Hsp90、Hsp70、Hsp60和小分子量HSP (Hsp47, Hsp27, Hsp22等)等(陈鹏宇等, 2020)。
Hsp47属于丝氨酸蛋白酶抑制剂(serine proteinase inhibitor, Serpin)家族进化枝H (Serpin H), 具有丝氨酸蛋白酶抑制剂折叠和抑制剂环, 但不具备抑制活性(Hirayoshi et al, 1991)。Hsp47是一种内质网(ER)驻留的分子伴侣, 与其他分子伴侣(如Hsp60, Hsp70和Hsp90)具有广泛的底物特异性(Niwa et al, 2012)不同, 通常认为Hsp47特异识别前胶原蛋白, 对于胶原蛋白分子的成熟是必不可少的。已有研究表明, Hsp47在胶原蛋白合成途径中起两种作用: 抑制原胶原的局部展开, 以及抑制三螺旋形成后的原胶原聚集(高辉等, 2020)。因此Hsp47在胶原蛋白的生物合成、结构装配以及分泌中发挥着重要作用。最近的研究表明, Hsp47还可以与多种蛋白相互作用, 如: 核心蛋白聚糖(decorin)、纤维调节素(fibromodulin)和光蛋白聚糖(lumican)等, 进而促进这些蛋白的分泌(Ishikawa et al, 2018), 以及与KDEL内质网蛋白驻留受体2(KDELR2)相互作用(van Dijk et al, 2020)。
Hsp47在鱼类中的研究相对较少, 已有研究发现Hsp47可能在斑马鱼(Lele et al, 1997a; Murtha et al, 2003)、青鳉(Hirayama et al, 2006)、大西洋鳕(Hori et al, 2010)、硬头鳟(Narum et al, 2013)、虹鳟(Wang et al, 2016)、鲱形白鲑(Stefanovic et al, 2016)、斑尾小鲃(Mahanty et al, 2017)、三刺鱼(Li et al, 2018)等鱼的高温应激或热适应中发挥重要作用。这些研究都集中在Hsp47基因在不同鱼类胁迫后的表达模式分析检测上, 而更进一步的功能研究未见报道, 并且迄今未见对大菱鲆Hsp47的研究报道。大菱鲆(Scophthalmus maximus)是我国北方沿海重要的经济鱼类, 由于是冷温性鱼类, 其养殖业的进一步发展受到养殖环境温度的严重影响。为减少不利环境因素对大菱鲆养殖产业的影响, 科研工作者开展了一些基础生理性研究、分子标记辅助育种等研究, 其目的是提高大菱鲆的优良种质, 解决生产实际问题(Yang et al, 2020; 高进等, 2021)。本文克隆了大菱鲆SmHsp47基因cDNA全长, 检测了SmHsp47基因在大菱鲆肝脏、皮肤、肠和鳃等组织中mRNA的表达水平以及在皮肤中温度胁迫前后的诱导表达情况, 获得了该基因的体外原核重组表达蛋白, 利用His-pull down技术, 筛查与SmHsp47具有相互作用的蛋白, 有助于进一步了解温度胁迫下SmHsp47在鱼体中发挥作用的机制, 为大菱鲆温度胁迫应答机制提供新的理论参考。
1 材料与方法 1.1 试验用鱼实验选用平均体重为(100.0±12.3) g的大菱鲆幼鱼, 饲养于烟台开发区天源水产有限公司室内养殖水泥池。实验用鱼先在水温(14.0±0.5) ℃的实验水池内驯化暂养一周。驯化暂养和实验期间每天上午9:00投喂一次饵料, 每天上午10:00换水1次, 静水养殖通气供氧。
1.2 试验方法 1.2.1 温度胁迫实验随机挑选经过1周驯化的大菱鲆幼鱼, 将其分为2组: 对照组(14 ℃)和实验组(25 ℃)。升温方法参考Ndong等(2007), 略有修改: 首先按照每6 h提升1 ℃的速度将水温逐步从14 ℃升至20 ℃, 接着按每12 h提升1 ℃的速度将水温从20 ℃提升至25 ℃为实验组。对照组和实验组分别设制3个平行, 每个平行组均随机投放15尾幼鱼。在25 ℃温度胁迫6 h后, 在每个平行随机选取3尾幼鱼, 放置于下方为冰块的预冷解剖盘中迅速解剖, 取皮肤、肝脏、鳃、肠道等组织冻存于液氮中, 用于后续mRNA的提取。
1.2.2 总RNA的提取及cDNA的合成提取方法参照天根生化科技(北京)有限公司动物组织总RNA提取试剂盒(RNAprep pure Tissue Kit)说明书, 提取完成后利用Thermo NanoDrop 2000微量紫外分光光度计检测RNA的含量和纯度, 再用1%琼脂糖凝胶电泳检测RNA的完整度。使用北京全式金生物技术(TransGen Biotech)有限公司反转录试剂盒(TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix)合成cDNA, 存放于–20 ℃冰箱保存。将提取的肝脏总RNA, 按照宝日医生物技术(北京)有限公司RACE试剂盒(SMARTerTM RACE cDNA Amplification Kit)说明书分别合成用于3′和5′末端PCR扩增的RACE模板, –20 ℃冰箱保存。
1.2.3 大菱鲆SmHsp47基因cDNA全长克隆根据本实验室已有的Hsp47基因部分序列, 利用Primer Premier5.0软件在保守区域设计引物Hsp47-F与Hsp47-R (表 1), 扩增大菱鲆SmHsp47基因的开放阅读框(ORF)序列。测序验证后, 再依据获得的ORF序列设计3′RACE和5′RACE引物(表 1), 扩增得到3′和5′片段后, 再进行测序验证, 最终获得SmHsp47基因cDNA全长序列。
| 引物名称 | 引物序列(5′—3′) | 用法 |
| Hsp47-F | AACACACTCAGCACCAGGAC | 中心片段 |
| Hsp47-R | GTAATTTCACAACGCTAAGCC | |
| UPM(long) | CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT | 通用引物 |
| UPM(short) | CTAATACGACTCACTATAGGGC | |
| RACE-F | GATTACGCCAAGCTTCCACGACGGGGGAGATGAGGATGTT | RACE |
| RACE-R | GTGAAGCCCAAGGGAGACAAGATGCG | |
| MPF | CGCGGATCCATGGAGGACAGGAAGCTGAG | 原核表达 |
| MPR | CCCAAGCTTTAGCTCGTCGCGCATCTTGT | |
| Hsp47-RTF | ACAAGGAGAACCGCATCTTCGTG | 荧光定量 |
| Hsp47-RTR | GCCAAGTGTCCACCTGCTTCC | |
| β-actF | GTGGAGCGATTTGTCTGGTT | β-action |
| β-actR | CTCAATCTCGTGTGGCTGAA |
分别利用软件ORF Finder、EditSeq、ExPASy (compute_pi)、SignalP、SOPMA、SWISS-MODEL等进行开放阅读框、氨基酸序列、分子量、信号肽、等电点以及二/三级结构等生物信息学分析预测(唐启政等, 2019); 利用软件DNAMAN进行序列同源性比对分析, 从GenBank (https://blast.ncbi.nlm.nih.gov/Blast.cgi)中获取其他鱼类Hsp47基因编码的氨基酸序列, 利用MAGE 7.0软件构建该其NJ系统进化树。
1.2.5 实时荧光定量PCR根据SmHsp47基因cDNA全长设计引物Hsp47-RTF和Hsp47-RTR (表 1), 以β-actin基因为内参, 利用ABI StepOnePlus实时荧光定量PCR仪检测大菱鲆SmHsp47基因的表达量。反应程序为: 94 ℃ 30 s; 94 ℃ 5 s, 60 ℃ 30 s, 40个循环; 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s。利用2–ΔΔCt法计算SmHsp47基因的相对表达量, 依据软件SPSS 19进行数据差异显著性统计分析。
1.2.6 SmHsp47基因成熟肽原核表达载体构建及表达菌株转化综合分析SmHsp47成熟肽编码区和pET-28a载体中的限制性内切酶位点, 分别设计带有BamH Ⅰ和Hind Ⅲ酶切位点序列的表达引物MPF和MPR (表 1), 以1.3.3中提取的质粒作为模板进行PCR扩增, 经琼脂糖凝胶电泳分离后, 切取目的条带用试剂盒回收。将目的条带与BamH Ⅰ和Hind Ⅲ双酶切后纯化的pET-28a载体相连接, 将连接产物转化大肠杆菌Trans5α感受态细胞, 在含终浓度为100 μg/mL的卡那霉素LB固体培养基平板上培养并挑选单克隆菌斑, 经PCR检测后, 将符合条件的菌液送公司测序。将测序结果正确的菌落扩大培养, 提取质粒保存于–20 ℃备用, 命名为pET-28a-Hsp47。取1 μL pET-28a-Hsp47重组质粒转化到50 μL刚解冻的大肠杆菌E. coil transettea (DE3)感受态细胞中, 涂布在含终浓度为100 μg/mL的卡那霉素LB固体培养基平板上, 将平板以石蜡膜封口后倒置于37 ℃恒温培养箱中过夜培养, 挑取单菌落并进行PCR验证, 保存阳性克隆菌株。
1.2.7 SmHsp47重组蛋白诱导表达、纯化及复性将目的菌液接种于含终浓度为100 μg/mL的卡那霉素LB液体培养基中, 接种比例按体积分数为1︰100, 37 ℃ 200 r/min震荡培养至菌液的OD600约为0.6时, 加入终浓度为0.5 mm IPTG, 37 ℃ 200 r/min震荡培养过夜。随后在室温条件下, 将菌液以5 000 r/min离心10 min, 弃掉上清, 收集菌体。加入30 mL预冷的裂解液重悬菌体, 利用超声破碎仪裂解菌体。将超声破碎后的菌体在4 ℃条件下12 000 r/min离心30 min, 分别收集上清和沉淀, 沉淀即为包涵体。沉淀通过几次重复的洗涤、离心过程进一步进行纯化。将洗涤后的包涵体沉淀溶解于20mL溶解液中, 再转移到至50 mL小烧杯中, 放置于4 ℃条件下磁力搅拌器搅拌过夜, 使包涵体充分溶解。随后在4 ℃下12 000 r/min离心20 min, 去掉沉淀, 收集上清并用0.22 µm孔径的滤膜去除细菌和杂质。得到的包涵体加入装有镍离子螯合亲和层析树脂填料的柱壳中, 反复上样四次后, 将柱壳堵口于4 ℃静置30 min, 使目的蛋白和填料充分结合。然后分别用30 mL预冷的20、30、50 mmol/L的咪唑溶液清洗杂蛋白, 最后用10 mL预冷的250 mmol/L咪唑溶液进行目的蛋白洗脱, 收集流出溶液获得目的蛋白。SDS-PAGE检测洗脱情况。将收集的目的蛋白液体加到预先处理好的透析袋中, 透析袋用透析夹加紧两端。透析袋放入提前预冷的透析液Ⅰ中, 在4 ℃条件下用磁力搅拌器搅拌, 透析12 h。按照相同的方法, 每隔12 h更换一次透析液, 直至完成透析液Ⅶ中的透析。为避免其他透析液成分的残留, 可以适当延长目的蛋白在透析液Ⅶ中的透析时间。透析结束后, 收集透析袋中的液体, 于4 ℃条件下12 000 r/min离心20 min, 收集上清, 上清即为复性后的大菱鲆SmHsp47蛋白, 随后采用BCA蛋白定量试剂盒测定蛋白浓度。
1.2.8 大菱鲆鱼体总蛋白提取将100 mg大菱鲆组织剪切成小块, 尽量去除脂肪组织和结缔组织等非目的组织, 加入适量的预冷的1×PBS, 在4 ℃条件下3 000 r/min离心3 min, 弃掉上清, 重复洗涤组织块两次。将洗涤后的组织加入1 mL预冷的抽提试剂, 转移至玻璃匀浆器中在冰上均质30—50次直至组织完全成匀质状液体无明显组织小块。放置在涡旋振荡器上最大速度涡旋10 s, 然后在冰上放置20 min, 期间取出振荡3—5次, 随后于4 ℃条件下12 000 r/min离心10 min去除组织或细胞碎片, 收集上清, 上清即为大菱鲆组织活性总蛋白, 分装并保存于–80 ℃, 用于后续实验。
1.2.9 His-pull down实验及质谱鉴定先将1 mg SmHsp47重组蛋白加入镍柱中4 ℃堵口静置30 min, 收集上样后溶液, 再将1 mg鱼体总蛋白加入镍柱中, 4 ℃堵口孵育30 min, 孵育完成后进行纯化。鱼体总蛋白作空白对照, 其他条件均相同。取样后进行SDS-PAGE检测, 对比差异性条带。将差异条带切下来送北京诺禾致源科技股份有限公司进行基于Thermo Q Exactive质谱仪的液相色谱-串联质谱法鉴定样品中的肽段, 进而鉴定蛋白种类。
2 结果 2.1 大菱鲆SmHsp47基因的cDNA克隆及序列分析大菱鲆SmHsp47基因, GenBank登录号: MW115941。其cDNA序列全长为1 927 bp, 包含一个1 218 bp开放阅读框, 5′端非编码区核苷酸长度143 bp, 3′端非编码区长度566 bp (图 1)。SmHsp47基因ORF可编码一个长度为405个氨基酸残基的肽段, 其预测分子质量为43.50 kDa, 理论等电点为8.72, 氨基端有信号肽序列长度为18个氨基酸, 羧基端带有内质网靶向序列(RDEL)。
 |
| 图 1 大菱鲆SmHsp47 cDNA及其编码的氨基酸序列 Fig. 1 The cDNA and deduced amino acids sequence of SmHsp47 from S. maximus 注: 起始密码子ATG和终止密码子TAA均用粗下划线标出, 信号肽与反应中心环(RCL)分别用青色和深青色阴影标出 |
经SOPMA在线软件预测显示, SmHsp47含有三种二级结构, 其中α螺旋(alpha helix)占44.44%, β折叠(extended strand)占17.28%, 无规则卷曲(random coil)占38.27%。如图 2所示, 蓝线表示α螺旋, 红线表示β折叠, 紫线表示无规则卷曲。
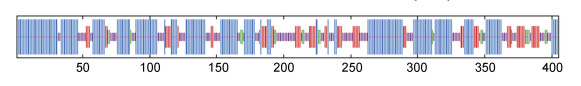 |
| 图 2 SmHsp47蛋白质的二级结构预测 Fig. 2 The secondary structure of SmHsp47 protein |
利用SWISS-MODEL分析软件根据同源蛋白建模的方法构建蛋白质三维结构, 推测出大菱鲆SmHsp47蛋白的高级结构, 如图 3所示。
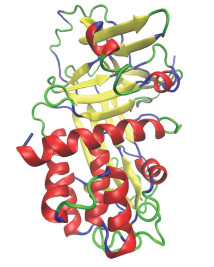 |
| 图 3 SmHsp47蛋白质的三级结构预测 Fig. 3 The deduced tertiary structure of SmHsp47 subunit protein |
利用DNAMAN软件进行SmHsp47与其他鱼类同源基因蛋白的多序列比对, 其结果显示: 大菱鲆与狭鳞庸鲽和赤锯鳞鱼的Hsp47最为相似, 相似度分别为89.54%、85.43%; 与半滑舌鳎Hsp47相似度最低为76.73%。利用MEGA7.0以邻接法(Neighbor-Joining)构建大菱鲆SmHsp47蛋白的系统进化树, 结果显示, 大菱鲆SmHsp47与狭鳞庸鲽和赤锯鳞鱼Hsp47亲缘关系最为接近(图 4)。
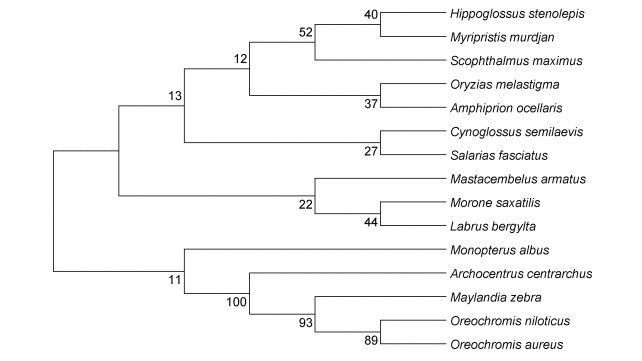 |
| 图 4 使用NJ构建的Hsp47的进化树 Fig. 4 The phylogenetic tree of Hsp47 constructed using the Neighbor-Joining method 注: Oreochromis niloticus: 尼罗罗非鱼; Oreochromis aureus: 奥尼罗非鱼; Maylandia zebra: 斑马拟丽鱼; Archocentrus centrarchus: 尼加拉瓜湖始丽鱼; Mastacembelus armatus: 大刺鳅; Morone saxatilis: 条纹鲈; Labrus bergylta: 贝氏隆头鱼; Monopterus albus: 黄鳝; Scophthalmus maximus: 大菱鲆; Hippoglossus stenolepis; 狭鳞庸鲽; Myripristis murdjan: 赤锯鳞鱼; Cynoglossus semilaevis: 半滑舌鳎; Salarias fasciatus: 细纹凤鳚; Oryzias melastigma: 海洋青鳉鱼; Amphiprion ocellaris: 眼斑双锯鱼 |
利用荧光实时定量PCR技术检测大菱鲆SmHsp47基因分别在肝脏、皮肤、肠和鳃等4个组织中的表达情况(图 5), 结果显示, SmHsp47基因在上述4种组织中均有表达, 并且不同组织中的表达水平存在显著差异。其在肝脏中表达水平最高(P < 0.05), 皮肤次之, 鳃和肠中较低。水温25 ℃处理组在处理后6 h时SmHsp47在皮肤中的表达显著上调(图 6), 为对照组(14 ℃)的164.23±70.19倍(P < 0.05)。
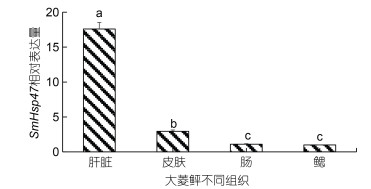 |
| 图 5 大菱鲆SmHsp47基因在不同组织中的表达情况 Fig. 5 The expression of the SmHsp47 gene in different tissues |
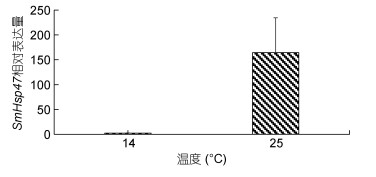 |
| 图 6 大菱鲆SmHsp47基因在皮肤组织中25 ℃胁迫6 h后的表达变化情况 Fig. 6 The expression of SmHsp47 gene in the skin after thermal stress for 6 h |
以转化原核表达载体pET-28a空载的大肠杆菌细胞蛋白作为空白对照, 以转化有pET-28a-SmHsp47载体的大肠杆菌在ITPG诱导前的细胞蛋白作为阴性对照, 泳道4为细胞破碎液上清样, 泳道5为细胞破碎液沉淀样, 可以看出SmHsp47蛋白主要以包涵体形式存在, 并且分子量大小符合预期值(图 7)。随后对SmHsp47蛋白包涵体用镍离子树脂进行纯化, 反复上样后, 利用咪唑浓度梯度洗脱, 洗脱浓度分别为20、30、50、250 mmol/L (图 8)。由结果可以看出20 mmol/L咪唑可以洗脱下来杂质蛋白和极少量目的蛋白, 含250 mmol/L咪唑的缓冲液可以洗脱下来大量的目的蛋白, 并且条带蛋白单一, 可以得到比较纯的蛋白, 显示出很好的洗脱效果。利用酶标仪和BCA蛋白定量试剂盒测得纯化后的蛋白质量浓度为0.38 mg/mL。
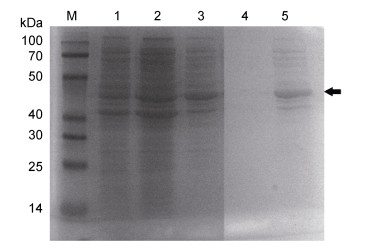 |
| 图 7 SmHsp47蛋白表达SDS-PAGE结果 Fig. 7 SDS-PAGE result of SmHsp47 protein expression 注: M. 蛋白Marker; 1. 全菌蛋白(pET-28a, 未诱导); 2. 全菌蛋白(pET-28a-Hsp47, 未诱导); 3. 全菌蛋白(pET-28a-Hsp47, 诱导); 4. 细胞破碎液上清(pET-28a-Hsp47, 诱导); 5. 细胞破碎液沉淀(pET-28a-Hsp47, 诱导); 黑色箭头指示位置为SmHsp47融合蛋白目的条带 |
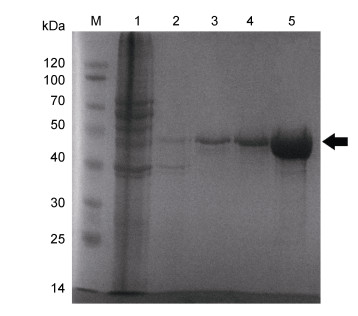 |
| 图 8 SmHsp47蛋白咪唑梯度洗脱SDS-PAGE结果 Fig. 8 SDS-PAGE result of SmHsp47 protein after imidazole gradient elution 注: M. 蛋白Marker; 1. 上样流穿溶液; 2. 20 mmol/L咪唑洗脱液; 3. 30 mmol/L咪唑洗脱液; 4. 50 mmol/L咪唑洗脱液; 5. 250 mmol/L咪唑洗脱液; 黑色箭头指示位置为SmHsp47融合蛋白目的条带 |
利用酶标仪和BCA蛋白定量试剂盒测得提取的大菱鲆鱼体总蛋白质量浓度为3 mg/mL。取1 mg SmHsp47重组蛋白和1 mg鱼体总蛋白混合孵育, 获得his-Hsp47-鱼体总蛋白相互作用复合体, 以鱼体总蛋白作为空白对照。用250 mmol/L的咪唑洗脱出的未加鱼体蛋白的SmHsp47重组蛋白作为阴性对照, 用250 mmol/L的咪唑洗脱液将捕获到的含有his标签的蛋白复合体洗脱下来, 并进行SDS-PAGE分离, 结果如图 9所示。通过比较泳道2与泳道3, 发现泳道3中多出1条比较明显的条带, 此条带中所含蛋白则很可能与Hsp47具有相互作用。
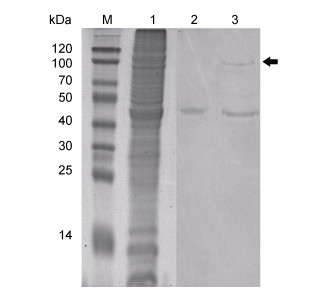 |
| 图 9 His-pull down实验SDS-PAGE结果 Fig. 9 The SDS-PAGE result of His-pull down experiment 注: M. 蛋白maker; 1. 鱼体总蛋白; 2. SmHsp47重组蛋白; 3. His-pull down孵育后蛋白; 黑色箭头指示位置为获得的SmHsp47可能的相互作用蛋白条带 |
将2.5中获得的差异蛋白条带切下后, 经质谱分析后共鉴定得到31种候选蛋白, 具体信息如表 2所示。通过搜索COG数据库对鉴定到的肽段进行功能注释, 用于了解不同蛋白质的功能特性。从COG注释结果(图 10)可以看出, 大部分蛋白为参与翻译后修饰, 蛋白转换, 分子伴侣, 此外, 还包括参与能量产生与转换、脂质转运与代谢、防御机制、一般功能预测等过程的蛋白质。
| 蛋白编号 | 蛋白描述 | 肽段数 | 特异性肽段数 | 分值 | |
| A0A2U9B8D8 | Putative ADP/ATP translocase 2-like | 1 | 1 | 2.89 | |
| A0A2U9BY38 | Putative keratin type Ⅱ cytoskeletal 8-like | 3 | 2 | 10.92 | |
| A0A2U9BGS9 | Putative intermediate filament protein ON3-like | 2 | 1 | 7.02 | |
| A0A6A4TFV0 | Uncharacterized protein | 15 | 5 | 110.20 | |
| A0A6A4S4T0 | Voltage-dependent anion-selective channel protein 2 | 1 | 1 | 2.43 | |
| A0A6A4RQE9 | Uncharacterized protein | 1 | 1 | 0.00 | |
| A0A6A4SK40 | ATP synthase lipid-binding protein | 1 | 1 | 3.83 | |
| A0A2U9B608 | Collagen-binding protein | 11 | 11 | 41.85 | |
| A0A6A4SWR2 | EGF-like domain-containing protein | 2 | 1 | 8.03 | |
| A0A6A4TS79 | Integrase_H2C2 domain-containing protein | 1 | 1 | 1.91 | |
| A0A6A4SKG7 | PKS_ER domain-containing protein | 1 | 1 | 0.00 | |
| A0A2U9B6J0 | Histone H4 | 1 | 1 | 2.48 | |
| A0A6A4SXD0 | Voltage-dependent anion-selective channel protein 1 | 1 | 1 | 4.35 | |
| A0A6A4S5Y4 | 60kDa chaperonin | 1 | 1 | 1.69 | |
| A0A2U9BWC3 | Putative membrane-associated guanylate kinase WW and PDZ domain-containing protein 2-like | 1 | 1 | 3.41 | |
| A0A2U9C388 | Fetuin B | 11 | 1 | 65.69 | |
| A0A2U9CW74 | Putative mitogen-activated protein kinase kinase kinase 8 | 1 | 1 | 0.00 | |
| A0A6A4RNZ7 | Elongation factor 1-alpha | 1 | 1 | 2.23 | |
| A0A2U9CHT8 | Enoyl-CoA hydratase | 1 | 1 | 0.00 | |
| A0A2U9C5S5 | Putative alpha-2-HS-glycoprotein-like | 4 | 4 | 11.98 | |
| A0A068F5K8 | Hemopexin | 2 | 2 | 5.34 | |
| A0A2U9BRX5 | Putative keratin type Ⅰ cytoskeletal 14-like | 2 | 2 | 5.05 | |
| A0A6A4TKC5 | Uncharacterized protein | 4 | 3 | 7.83 | |
| A0A6A4TD61 | Glyceraldehyde-3-phosphate dehydrogenase | 1 | 1 | 0.00 | |
| A0A2U9AVE8 | ATP synthase subunit beta | 1 | 1 | 2.34 | |
| A0A6A4TGX0 | Uncharacterized protein | 1 | 1 | 0.00 | |
| A0A2U9CED1 | Putative histone H1.5-like | 1 | 1 | 1.60 | |
| A0A2U9CV00 | Heat shock protein HSP 90-alpha 1 | 1 | 1 | 1.79 | |
| A0A6A4RMV6 | SERPIN domain-containing protein | 2 | 2 | 1.97 | |
| A0A2U9CRB9 | Alpha-type globin isoform 2 | 1 | 1 | 1.85 | |
| 注: 分值是对蛋白匹配度的打分, 是肽段分数的加和, 分数越高可信度越高 | |||||
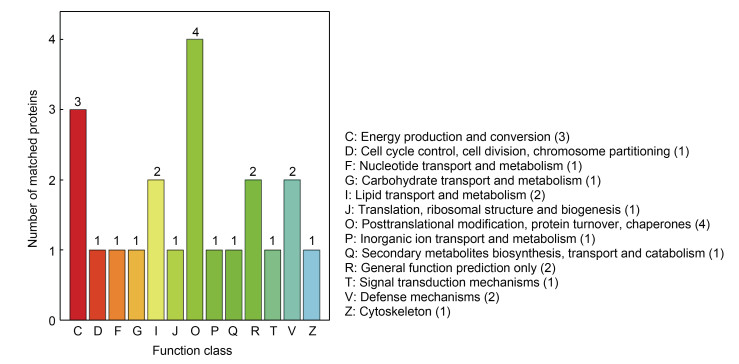 |
| 图 10 COG数据库注释结果 Fig. 10 The COG database annotation results 注: 横坐标为注释的功能分类, 纵坐标为注释到相应功能的蛋白数目 |
然后根据蛋白的预测分子量(MW)、鉴定到的肽段数量(Peptides)、特有肽段数量(Unique Peptides)以及得分值(Score)等参数对质谱鉴定结果进行了严格筛选, 结果见表 3。
| 蛋白编号 | 蛋白描述 | 分子量(kDa) | 肽段数 | 特异性肽段数 | 分值 |
| A0A6A4TFV0 | Uncharacterized protein | 73.9 | 15 | 5 | 110.20 |
| A0A2U9C388 | Fetuin B | 45.8 | 11 | 1 | 65.69 |
| A0A2U9B608 | Collagen-binding protein | 54.4 | 11 | 11 | 41.85 |
| 注: 分值是对蛋白匹配度的打分, 是肽段分数的加和, 分数越高可信度越高 | |||||
本研究中, 基因SmHsp47在大菱鲆的肝脏、皮肤、肠和鳃等4种组织中都有表达, 养殖水温14 ℃时SmHsp47在肝脏中的表达量最高, 25 ℃处理6 h后皮肤中的表达量较14 ℃急剧升高150多倍, 而肝脏中的变化幅度很小(未展示)。鱼类的肝脏在鱼体中发挥着不可替代的解毒等代谢功能, 还是具有重要吞噬功能的免疫器官, 并且几乎所有的凝血因子都由肝脏制造, 因此健康鱼类的肝脏一直保持着旺盛的自我修复能力。有研究表明Hsp70在多种鱼类的肝脏中发挥重要的作用, 且表达水平明显受外界胁迫诱导而升高(Forsyth et al, 1997; Eddie et al, 2004)。本研究中Hsp47在正常条件下的肝脏组织中有极高的表达水平, 表明在大菱鲆中Hsp47也可能与其他热激蛋白一样参与肝脏的各项重要机能, 以发挥其对肝脏的保护作用。目前Hsp47在鱼类皮肤中的作用还没有研究, 已有研究发现Hsp47在斑马鱼胚胎发育期参与热激应答反应, 并且还有组织部位特异性(Pearson et al, 1996; Krone et al, 1997; Lele et al, 1997a, 1997b), 也参与成熟斑马鱼的热应答反应, 同样具有组织特异性(Murtha et al, 2003)。研究还发现Hsp47基因在虹鳟(Wang et al, 2016)及其性腺细胞系(Ojima et al, 2005)、青鳉(Hirayama et al, 2006)、大西洋鳕(Hori et al, 2010)、硬头鳟(Narum et al, 2013)、鲱形白鲑(Stefanovic et al, 2016)、斑尾小鲃(Mahanty et al, 2017)、三刺鱼(Li et al, 2018)等鱼的高温应激或者不同地理群体的热适应中发挥重要作用。因此可以推断, 大菱鲆SmHsp47在高温胁迫后的皮肤组织中高表达, 是其高温诱导表达的组织特异性的一种表现, 这种时空特异的诱导表达对鱼体的高温应激具有重要意义。
本研究中构建了大菱鲆SmHsp47基因成熟肽不包含羧基端内质网靶向序列片段的重组表达载体, 尝试了多个温度、摇床转速、IPTG诱导浓度和时间等诱导条件(未展示), 始终得到的都是包涵体蛋白, 并且在本报道中提及的诱导条件下能够大量地表达重组蛋白。因该基因的体外原核重组蛋白的表达未见研究报道, 猜测可能是由于人工诱导条件下蛋白快速合成, 蛋白本身又含有强疏水氨基酸残基, 例如第368位的亮氨酸、第370位的酪氨酸(图 1), 使得重组蛋白在原核表达系统中不能正确折叠而形成包涵体。
胶原蛋白是哺乳动物中最丰富的蛋白质, 约占人体所有蛋白质的三分之一。迄今为止, 已经鉴定出29种胶原蛋白(Söderhäll et al, 2007)。Hsp47瞬时结合到ER中的胶原蛋白上, 以pH依赖的方式在顺式高尔基体或ER-高尔基体中隔室(ERGIC)中解离, 然后通过其RDEL保留序列运回ER(Satoh et al, 1996)。Hsp47可以识别三螺旋原胶原蛋白上的Gly-Xaa-Arg重复序列(Koide et al, 2002, 2006), 可以防止原胶原蛋白的局部展开和/或聚集(Thomson et al, 2000)。小鼠的Hsp47基因破坏由于基底膜受损和胶原原纤维形成而导致胚胎致死率。在Hsp47基因敲除细胞中, Ⅰ型胶原三螺旋结构异常形成, 可导致纤细。Ⅰ型胶原蛋白的分泌缓慢且合理, 可在敲除Hsp47的成纤维细胞的ER中产生前胶原蛋白的聚集体, 这些聚集体最终会被自噬降解。Hsp47中的突变与成骨不全症有因果关系(Sillence et al, 1979; Thomson et al, 2005; Drögemüller et al, 2009)。Hsp47的表达与多种类型的细胞和组织中的胶原蛋白表达密切相关。因此, Hsp47代表了治疗胶原蛋白相关疾病(包括肝、肺和其他器官纤维化)的有希望的靶标。关于Hsp47与胶原蛋白关系的研究多应用于哺乳动物, 对于鱼体两者之间的作用于关系还知之甚少, 仅有的研究表明Hsp47在斑马鱼鳍条再生过程中的骨骼生长和模式化中必不可少(Bhadra et al, 2015), 而在鱼类热应激中Hsp47与胶原蛋白相互作用的生理学意义需要进行更深一步的探讨。
胎球蛋白(fetuin)分为胎球蛋白-A (Fetuin-A) (基因符号: AHSG/FETUA)和胎球蛋白-B (Fetuin-B) (FETUB), 以及富含组氨酸的糖蛋白(HRG)和激肽原(KNG), 是胱抑素(半胱氨酸蛋白酶抑制剂)超家族的3型家族成员蛋白质(Lee et al, 2009; Jahnen-Dechent et al, 2011)。3型家族成员均为分泌型和二硫键结合型的多结构域糖蛋白, 具有多个半胱氨酸蛋白酶抑制剂结构域(Abrahamson, 1994)。胎球蛋白-A最早分离于1944年, 因其在牛胎血中含量最高而被命名为“胎球蛋白”(Pedersen, 1944)。在2000年发现了第二种胎球蛋白, 称为胎球蛋白-B。至此, 将原来的“胎球蛋白”被重命名为胎球蛋白-A (Olivier et al, 2000)。Fetuin-B蛋白大小大约50—60 kDa, 主要在肝脏中表达(Olivier et al, 2000; Denecke et al, 2003), 并分泌到血液中, 从而到达所有软组织。最近的研究表明Fetuin-B在皮肤鳞状细胞癌细胞中的过度表达导致裸鼠体内肿瘤生长受到抑制(Hsu et al, 2004), 而且Fetuin-B缺陷小鼠表现出自发性肿瘤发生的趋势增加(Dietzel et al, 2013), 有研究指出, 人体中的Fetuin-B对于受精是必不可少的(Jahnen-Dechent et al, 1997; Dietzel et al, 2013), 并且参与糖脂代谢过程。从本研究结果来看, Fetuin-B与Hsp47之间也可能存在相互作用关系, 提示Fetuin-B可能参与鱼体高温胁迫某些代谢过程, 后续可再进一步展开深入研究探讨。
4 结论本研究首次克隆了大菱鲆SmHsp47基因cDNA全长, 研究发现14 ℃时其在大菱鲆肝脏组织中具有较高的表达量, 而在25 ℃处理6 h后其在皮肤中的表达量升高了150多倍; 然后构建了大菱鲆SmHsp47基因的原核表达载体, 获得了去掉信号肽和内质网靶向序列的重组蛋白, 重组蛋白主要以包涵体形式表达; 又通过His-pull down实验获得了SmHsp47可能的相互作用蛋白, 最后通过质谱分析得到31种可能与SmHsp47蛋白发生互作的蛋白。通过严格筛选得到3种最有可能的相互作用蛋白, 分别为: 未知蛋白(uncharacterized protein, A0A6A4TFV0)、胎球蛋白B (Fetuin B, A0A2U9C388)和胶原结合蛋白(collagen-binding protein, A0A2U9B608)。本研究为Hsp47在鱼体中的作用研究提供了新的参考, 也为大菱鲆高温胁迫应答机制提供了新的理论基础和研究方向。
田倪妮, 2014. 慢性心力衰竭患者心肌HSP47的表达及其与纤维化的相关性研究. 昆明: 昆明医科大学硕士学位论文
|
陈鹏宇, 李德臣, 吴凡. 2020. 家蚕热激蛋白的研究进展. 生命科学, 32(2): 155-161 |
高进, 杨润清. 2021. 大菱鲆体重和体尺性状联合GWAS分析. 渔业科学进展, 42(02): 63-70 |
高辉, 王艺琛, 张昌军, 等. 2020. 热休克蛋白47与哺乳动物生殖. 生殖医学杂志, 29(10): 1393-1398 DOI:10.3969/j.issn.1004-3845.2020.10.026 |
唐启政, 孙志宾, 王新安, 等. 2019. 大菱鲆(Scophthalmus maximus)蛋白质二硫键异构酶SmPDIA3的表达分析和功能验证. 海洋与湖沼, 50(2): 409-419 |
Abrahamson M, 1994. Cystatins. Methods in Enzymology, 244: 685-700 |
Bhadra J, Iovine M K, 2015. Hsp47 mediates Cx43-dependent skeletal growth and patterning in the regenerating fin. Mechanisms of Development, 138: 364-374 DOI:10.1016/j.mod.2015.06.004 |
Denecke B, Gräber S, Schäfer C et al, 2003. Tissue distribution and activity testing suggest a similar but not identical function of fetuin-B and fetuin-A. Biochemical Journal, 376(Pt 1): 135-145 |
Dietzel E, Wessling J, Floehr J et al, 2013. Fetuin-B, a liver-derived plasma protein is essential for fertilization. Developmental Cell, 25(1): 106-112 DOI:10.1016/j.devcel.2013.03.001 |
Drögemüller C, Becker D, Brunner A et al, 2009. A missense mutation in the SERPINH1 gene in dachshunds with osteogenesis imperfecta. PLoS Genetics, 5(7): e1000579 DOI:10.1371/journal.pgen.1000579 |
Eddie E D, Jun L, Norman Y S W, 2004. Modulated heat shock protein expression during pathogenic Vibrio alginolyticus stress of sea bream. Diseases of Aquatic Organisms, 62(3): 205-215 |
Feder M E, Hofmann G E, 1999. Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology. Annual Review of Physiology, 61: 243-282 DOI:10.1146/annurev.physiol.61.1.243 |
Forsyth R B, Candido E P M, Babich S L et al, 1997. Stress protein expression in coho salmon with bacterial kidney disease. Journal of Aquatic Animal Health, 9(1): 18-25 DOI:10.1577/1548-8667(1997)009<0018:SPEICS>2.3.CO;2 |
Hirayama M, Mitani H, Watabe S, 2006. Temperature-dependent growth rates and gene expression patterns of various medaka Oryzias latipes cell lines derived from different populations. Journal of Comparative Physiology B, 176(4): 311-320 DOI:10.1007/s00360-005-0053-8 |
Hirayoshi K, Kudo H, Takechi H et al, 1991. HSP47:a tissue-specific, transformation-sensitive, collagen-binding heat shock protein of chicken embryo fibroblasts. Molecular and Cellular Biology, 11(8): 4036-4044 |
Hori T S, Gamperl A K, Afonso L O B et al, 2010. Heat-shock responsive genes identified and validated in Atlantic cod (Gadus morhua) liver, head kidney and skeletal muscle using genomic techniques. BMC Genomics, 11: 72 DOI:10.1186/1471-2164-11-72 |
Hsu S J, Nagase H, Balmain A, 2004. Identification of Fetuin-B as a member of a cystatin-like gene family on mouse chromosome 16 with tumor suppressor activity. Genome, 47(5): 931-946 DOI:10.1139/g04-043 |
Ishikawa Y, Rubin K, Bächinger H P et al, 2018. The endoplasmic reticulum-resident collagen chaperone Hsp47 interacts with and promotes the secretion of decorin, fibromodulin, and lumican. Journal of Biological Chemistry, 293(35): 13707-13716 DOI:10.1074/jbc.RA117.000758 |
Jahnen-Dechent W, Heiss A, Schäfer C et al, 2011. Fetuin-A regulation of calcified matrix metabolism. Circulation Research, 108(12): 1494-1509 DOI:10.1161/CIRCRESAHA.110.234260 |
Jahnen-Dechent W, Schinke T, Trindl A et al, 1997. Cloning and targeted deletion of the mouse fetuin gene. Journal of Biological Chemistry, 272(50): 31496-31503 DOI:10.1074/jbc.272.50.31496 |
Koide T, Nishikawa Y, Asada S et al, 2006. Specific recognition of the collagen triple helix by chaperone HSP47. Ⅱ. The HSP47-binding structural motif in collagens and related proteins. Journal of Biological Chemistry, 281(16): 11177-11185 DOI:10.1074/jbc.M601369200 |
Koide T, Takahara Y, Asada S et al, 2002. Xaa-Arg-Gly triplets in the collagen triple helix are dominant binding sites for the molecular chaperone HSP47. Journal of Biological Chemistry, 277(8): 6178-6182 DOI:10.1074/jbc.M106497200 |
Krone P H, Sass J B, Lele Z, 1997. Heat shock protein gene expression during embryonic development of the zebrafish. Cellular and Molecular Life Sciences CMLS, 53(1): 122-129 DOI:10.1007/PL00000574 |
Lee C, Bongcam-Rudloff E, Sollner C et al, 2009. Type 3 cystatins; fetuins, kininogen and histidine-rich glycoprotein. Frontiers in Bioscience, 14: 2911-2922 |
Lele Z, Engel S, Krone P H, 1997a. Hsp47 and hsp70 gene expression is differentially regulated in a stress- and tissue-specific manner in zebrafish embryos. Developmental Genetics, 21(2): 123-133 DOI:10.1002/(SICI)1520-6408(1997)21:2<123::AID-DVG2>3.0.CO;2-9 |
Lele Z, Krone P H, 1997b. Expression of genes encoding the collagen-binding heat shock protein (Hsp47) and type Ⅱ collagen in developing zebrafish embryos. Mechanisms of Development, 61(1/2): 89-98 |
Li J, Levitan B, Gomez-Jimenez S et al, 2018. Development of a gill assay library for ecological proteomics of threespine sticklebacks (Gasterosteus aculeatus). Molecular & Cellular Proteomics, 17(11): 2146-2163 |
Mahanty A, Purohit G K, Yadav R P et al, 2017. hsp90 and hsp47 appear to play an important role in minnow Puntius sophore for surviving in the hot spring run-off aquatic ecosystem. Fish Physiology and Biochemistry, 43(1): 89-102 DOI:10.1007/s10695-016-0270-y |
Murtha J M, Keller E T, 2003. Characterization of the heat shock response in mature zebrafish (Danio rerio). Experimental Gerontology, 38(6): 683-691 DOI:10.1016/S0531-5565(03)00067-6 |
Narum S R, Campbell N R, Meyer K A et al, 2013. Thermal adaptation and acclimation of ectotherms from differing aquatic climates. Molecular Ecology, 22(11): 3090-3097 DOI:10.1111/mec.12240 |
Ndong D, Chen Y Y, Lin Y H et al, 2007. The immune response of tilapia Oreochromis mossambicus and its susceptibility to Streptococcus iniae under stress in low and high temperatures. Fish & Shellfish Immunology, 22(6): 686-694 |
Niwa T, Kanamori T, Ueda T et al, 2012. Global analysis of chaperone effects using a reconstituted cell-free translation system. Proceedings of the National Academy of Sciences of the United States of America, 109(23): 8937-8942 DOI:10.1073/pnas.1201380109 |
Ojima N, Yamashita M, Watabe S, 2005. Quantitative mRNA expression profiling of heat-shock protein families in rainbow trout cells. Biochemical and Biophysical Research Communications, 329(1): 51-57 DOI:10.1016/j.bbrc.2005.01.097 |
Olivier E, Soury E, Ruminy P et al, 2000. Fetuin-B, a second member of the fetuin family in mammals. Biochemical Journal, 350(Pt 2): 589-597 |
Pearson D S, Kulyk W M, Kelly G M et al, 1996. Cloning and characterization of a cDNA encoding the collagen-binding stress protein hsp47 in zebrafish. DNA and Cell Biology, 15(3): 263-272 DOI:10.1089/dna.1996.15.263 |
Pedersen K O, 1944. Fetuin, a new globulin isolated from serum. Nature, 154(3914): 575 |
Satoh M, Hirayoshi K, Yokota S et al, 1996. Intracellular interaction of collagen-specific stress protein HSP47 with newly synthesized procollagen. Journal of Cell Biology, 133(2): 469-483 DOI:10.1083/jcb.133.2.469 |
Sillence D O, Senn A, Danks D M, 1979. Genetic heterogeneity in osteogenesis imperfecta. Journal of Medical Genetics, 16(2): 101-116 DOI:10.1136/jmg.16.2.101 |
Söderhäll C, Marenholz I, Kerscher T et al, 2007. Variants in a novel epidermal collagen gene (COL29A1) are associated with atopic dermatitis. PLoS Biology, 5(9): e242 DOI:10.1371/journal.pbio.0050242 |
Stefanovic D I, Manzon L A, McDougall C S et al, 2016. Thermal stress and the heat shock response in embryonic and young of the year juvenile lake whitefish. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 193: 1-10 |
Thomson C A, Ananthanarayanan V S, 2000. Structure-function studies on Hsp47:pH-dependent inhibition of collagen fibril formation in vitro. Biochemical Journal, 349(Pt 3): 877-883 |
Thomson C A, Atkinson H M, Ananthanarayanan V S, 2005. Identification of small molecule chemical inhibitors of the collagen-specific chaperone Hsp47. Journal of Medicinal Chemistry, 48(5): 1 680-1 684 DOI:10.1021/jm049148+ |
van Dijk F S, Semler O, Etich J et al, 2020. Interaction between KDELR2 and HSP47 as a key determinant in osteogenesis imperfecta caused by bi-allelic variants in KDELR2. The American Journal of Human Genetics, 107(5): 989-999 DOI:10.1016/j.ajhg.2020.09.009 |
Wang Y N, Liu Z, Li Z et al, 2016. Effects of heat stress on respiratory burst, oxidative damage and SERPINH1 (HSP47) mRNA expression in rainbow trout Oncorhynchus mykiss. Fish Physiology and Biochemistry, 42(2): 701-710 DOI:10.1007/s10695-015-0170-6 |
Yang S S, Zhao T T, Ma A J et al, 2020. Metabolic responses in Scophthalmus maximus kidney subjected to thermal stress. Fish & Shellfish Immunology, 103: 37-46 DOI:10.1016/j.fsi.2020.04.003 |
 2021, Vol. 52
2021, Vol. 52


