中国海洋湖沼学会主办。
文章信息
- 李旋, 冯艳微, 袁波, 姜绪, 何金霞, 刘相全. 2021.
- LI Xuan, FENG Yan-Wei, YUAN Bo, JIANG Xu, HE Jin-Xia, LIU Xiang-Quan. 2021.
- 皱纹盘鲍(Haliotis discus hannai)WNT4基因生物信息学分析及与性腺发育相关性的研究
- BIOINFORMATICS ANALYSIS OF WNT4 GENE OF HALIOTIS DISCUS HANNAI AND ITS CORRELATION TO GONADAL DEVELOPMENT
- 海洋与湖沼, 52(4): 1019-1028
- Oceanologia et Limnologia Sinica, 52(4): 1019-1028.
- http://dx.doi.org/10.11693/hyhz20201200349
文章历史
-
收稿日期:2020-12-31
收修改稿日期:2021-02-07
2. 上海海洋大学 上海水产养殖工程技术 研究中心 上海 201306;
3. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 烟台 264006;
4. 鲁东大学农学院 烟台 264025
2. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China;
3. Shandong Provincial Key Laboratory of Restoration for Marine Ecology, Shandong Marine Resource and Environment Research Institute, Yantai 264006, China;
4. Ludong University, College of Agriculture, Yantai 264025, China
皱纹盘鲍(Haliotis discus hannai)隶属于软体动物门(Mollusca)、腹足纲(Gastropoda) (王如才等, 2008), 在我国主要分布于山东、辽宁、福建、台湾、广东等沿海区域(黎中宝等, 2005), 具有个头大、产量高、营养丰富、味道鲜美等特点, 被誉为海产品中的“海珍之冠”, 备受养殖户喜爱。近年来, 我国鲍养殖规模不断扩大, 产量逐年递增, 但在养殖过程中发现种鲍性腺发育不均衡, 对后续的苗种繁育与养殖产生不利影响。目前, 性别决定与分化调控基因及性腺发育调控机制在许多动物中相继被发现, 但对皱纹盘鲍性腺发育相关的分子机制研究较少。
WNT (Wingless-type MMTV integration site family)是一类可以编码分泌性糖蛋白的基因家族(Smolich et al, 1993), 具有高度保守性, 能够激活多种信号通路, 参与动物体内多种生物学过程的调控, 同时对早期器官形成和发育具有一定的影响(Logan et al, 2004; 韩琳等, 2008; 杨梅等, 2015)。WNT家族重要成员之一的WNT4 (wingless-type MMTV intergration site family, member 4)基因, 已经在小鼠(Mus musculus)、栉孔扇贝(Chlamys farreri)、乌贼(Euprymna scolopes)、果蝇(Drosophila melanogaster)、人(Homo sapiens)等多个物种中进行了不同程度的功能研究(Nusse et al, 1982; van Ooyen et al, 1984; 李海龙等, 2013)。研究发现, WNT4在性别决定与性腺发育过程中发挥重要作用。在小鼠中, WNT4基因影响卵巢发育, 参与缪勒氏管的形成(Stark et al, 1994); 在人类中, WNT4基因与DAX1基因协同调控女性卵巢发育并阻止睾丸的形成, 表明其参与性别决定(Jordan et al, 2001); 在黑鲷中, WNT4基因参与了卵巢的早期发育、生长和成熟过程的调控(Wu et al, 2009); 在栉孔扇贝中, WNT4基因在不同组织(外套膜、鳃、闭壳肌、肝胰腺、精巢和卵巢)中均有表达, 且在成熟期的精卵巢中表达量最高, 表明其在两性性腺成熟过程中起到重要作用(李海龙等, 2013); 在长牡蛎中, WNT4基因表达量最高的阶段为胚胎发育早期, 说明其在早期发育阶段与某些器官的形成有关(杨梅等, 2015)。
WNT4作为一种重要的信号分子, 在脊椎动物中已有深入研究, 但在软体动物中研究还非常有限。本研究以皱纹盘鲍为研究对象, 从前期构建的转录组文库中获得WNT4基因序列, 通过荧光定量PCR技术检测其在雌雄个体不同月份不同组织中的表达规律, 并通过原位杂交技术, 定位分析其在不同月份雌雄性腺中的分布情况, 初步探究WNT4基因在性腺发育中的作用, 为进一步研究WNT4基因的表达特点和功能及软体动物腹足类WNT基因家族提供一定的基础。
1 材料与方法 1.1 材料本实验所用皱纹盘鲍均采自山东省威海市寻山养殖基地。5—9月每月底(恢复期、生长期\成熟前期、成熟期、放卵末期\放精末期; 刘永峰等, 1985)各取雌雄个体各五只作为实验个体, 解剖取其鳃、肌肉、性腺、肝胰腺和外套膜组织置于液氮中, 后转移到–80 ℃冰箱保存, 依次进行总RNA的提取。
1.2 WNT4基因序列的获得与验证从皱纹盘鲍前期构建的转录组文库中获得WNT4基因序列, 设计验证引物(表 1)。采用Trizol试剂提取成熟性腺组织总RNA, 通过核酸定量仪和1.0%的琼脂糖凝胶检测其质量。反转录试剂盒采用PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit (TaKaRa, Dalian, China), 反应体系(10 μL): 1 μL Oligo dT Primer, 1 μL Random 6 mers, 1 μL dNTP Mixture, 1 μg模板RNA, 6 μL RNase Free dH2O, 反应程序: 65 ℃ 5 min; 冰上迅速冷却2 min。反应体系(20 μL): 10 μL上述变性后反应液, 4 μL 5×PrimerScriptⅡ Buffer, 0.5 μL RNase Inhibitor, 1 μL PrimerScriptⅡ RTase, 4.5 μL RNase Free dH2O, 反应程序: 30 ℃ 10 min; 42 ℃ 60 min; 70 ℃ 15 min。扩增试剂盒采用Tks GflexTM DNA Polymerase (TaKaRa, Dalian, China), 反应体系(50 μL): 1 μL cDNA, 25 μL 2×Glef PCR Buffer (Mg2+, dNTP plus), 1 μL Tks Glef DNA Polymerase, 1 μL W-F, 1 μL W-R, 21 μL RNase Free dH2O, 反应程序: 94 ℃ 1 min; 98 ℃ 10 s, 55 ℃ 15 s, 68 ℃ 90 s, 35个循环。扩增产物用1.0%琼脂糖凝胶检测, 送上海生物工程有限公司测序。
| 引物名称 | 序列(5′—3′) | 用途 |
| W-F | AAGTAGCGAGGAGGATTTTACC | 验证 |
| W-R | TAGTTCCTGTCACCAAATGGC | 验证 |
| β-actin-F | CACGGGTATTGTTCTGGACTCTG | qRT-PCR |
| β-actin-R | ATGAGGTAGTCTGTGAGGTCACGTC | qRT-PCR |
| W-RT-F | GCTGGCTTGCCCTGATGTCTTC | qRT-PCR |
| W-RT-R | GCTTTGCTCCAACTTTCACACTTTCC | qRT-PCR |
| W-ISH-F | CGCCATAGAAGAATGCCAGTT | 原位杂交 |
| W-ISH-R | TTCGCAGGATCCAGATACTCC | 原位杂交 |
| M13-F | CGCCAGGGTTTTCCCAGTCACGAC | 原位杂交 |
| M13-R | TCACACAGGAAACAGCTATGAC | 原位杂交 |
预测WNT4基因的开放阅读框使用ORF Finder软件(http://www.ncbi.nlm.nih.gov/projects/gorf/orfig.cgi); 同源分析利用NCBI Blastx软件(https://blast.ncbi.nlm.nih.gov/Blast.cg)进行; 预测氨基酸结构使用SMART软件(http://smart.embl-heidelberg.de/); 预测其分子量和等电点使用ExPASy软件(http://web.expasy.org/compute_pi/); 预测信号肽序列利用SingalP 5.0 Server软件(http://www.cbs.dtu.dk/services/SignalP/); 多序列比对使用DNAMAN软件进行; 邻接法(Neighbor-joining)构建系统进化树使用MAGE 5.0软件; 利用Phyre2软件预测二级结构; 利用SWISS-MODEL软件(https://swissmodel.expasy.org/)预测三级结构。
1.4 不同月份各组织表达分析通过Trizol试剂提取不同月份各组织中的总RNA, 并利用1.5%的琼脂糖凝胶电泳和NanoDrop Onec分光光度计(Thermo, USA)检测其质量和浓度。荧光定量反转录试剂盒使用PrimeScriptTM RT Reagent Kit with gDNA Eraser (TaKaRa, Dalian, China), 反应体系为20 μL, 添加试剂如下: 2 μL的5×gDNA Eraser Buffer, 1 μL的gDNA Eraser, 适量(500 ng)的total RNA, 加入RNase Free dH2O补足至10 μL, 42 ℃反应2 min; 在上述反应液中依次加入PrimeScript RT Enzyme Mix I试剂1 μL, RT Primer Mix试剂1 μL, 5×PrimeScript Buffer 2试剂4 μL, RNase Free dH2O试剂4 μL, 37 ℃反应15 min, 85 ℃反应5 s, 反应样品4 ℃保存。
根据已获得的WNT4基因的开放阅读框序列, 设计qRT-PCR引物, 皱纹盘鲍β-actin基因作为内参(表 1)。使用TB GreenTM Premix Ex TaqTM (TaKaRa, Dalian, China)试剂和LightCyclerⓇ 480ⅡReal Time instrument (Roche Switzerland)测定其在不同月份不同组织(鳃、肝胰腺、肌肉、外套膜、卵巢和精巢)的相对表达水平, 每个样品设置3个重复。反应体系为20 μL: 加入10 μL的2×TB Green Premix Ex Taq试剂, 7.2 μL的RNase Free水, 0.4 μL的上游引物和0.4 μL的下游引物, 2 μL的cDNA模板。反应程序为95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 40个循环, 95 ℃ 5 s; 60 ℃ 1 min; 95 ℃, 50 ℃ 30 s。使用2–ΔΔCt法计算相对表达量。
1.5 原位杂交用Primer Premier 5.0设计特异性ISH引物, RT-PCR扩增产物纯化后连接到PGEM-T easy载体上转化大肠杆菌感受态, 菌落PCR筛选阳性克隆, 之后以通用引物T7 (TAATACGACTCACTATAGGG)送上海生物工程有限公司测序; 利用DIG RNA Labeling Mix (Roche, Germany)试剂盒得到WNT4基因标记探针, 并将合成的探针保存在–80 ℃冰箱。将不同月份雌雄皱纹盘鲍性腺组织通过4%多聚甲醛固定, 并在4 ℃的条件下放置24 h后保存在70%酒精中。把组织进行梯度脱水、包埋制片处理, 后用石蜡切片机(Leica, Germany)切片, 厚度在3—8 μm之间。然后使用DIG nucleic acid detection kit (SP6/T7; Roche, Germany)试剂盒进行原位杂交实验, 并使用显色剂避光显色, 使用显微镜(Tokyo, Japan)观察杂交信号并拍照。
1.6 数据分析使用SPSS 18.0软件分析WNT4基因在皱纹盘鲍不同月份不同组织的表达数据, P < 0.05具有统计学意义, 根据WNT4基因表达数据使用Origin 8.5软件绘制条形图。
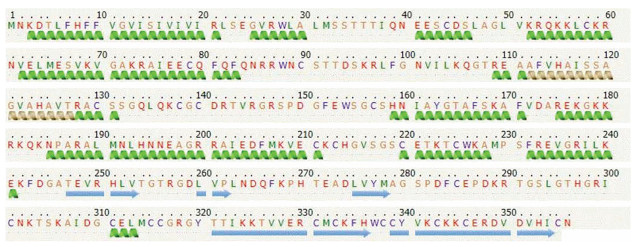
2 结果与分析 2.1 WNT4基因序列特征从皱纹盘鲍转录组数据库获得WNT4基因序列, 该序列长2002 bp, 包括5′非编码区(5′UTR) 342 bp, 3′非编码区(3′UTR) 595 bp, 开放阅读框(ORF)长度为1071 bp, 能够编码356个氨基酸。预测其蛋白分子质量为39.85 kDa, 理论等电点为9.21。其氨基酸序列中含有23个WNT家族蛋白最重要的半胱氨酸保守序列(图 1)以及172个WNT家族蛋白保守位点(图 2), 同时还具有一段长为27个氨基酸的信号肽序列和310个氨基酸的WNT1结构域(图 1)。
 |
| 图 1 皱纹盘鲍WNT4基因的cDNA序列及其推导出的氨基酸序列 Fig. 1 The cDNA sequence of H. discus hannai WNT4 gene and the deduced amino acids sequence 注: 图中下划线标出的是起始密码子ATG和终止密码子TGA, 阴影部分为WNT4保守区域氨基酸序列, 保守的半胱氨酸残基(C)用双下划线标出, 信号肽用波浪用下划线标出 |
 |
| 图 2 不同物种WNT4氨基酸序列多重比对分析 Fig. 2 Multiple alignment of the deduced amino acid sequence of WNT4 among different species 注: 阴影区域显示的是同源性氨基酸, 其中氨基酸的同源性是100%为黑色区域, 氨基酸的同源性是75%以上的为灰色区域。各物种缩写如下: 栉孔扇贝(Azumapecten farreri, Af), 长牡蛎(Crassostrea gigas, Cg), 皱纹盘鲍(Haliotis discus hannai, Hd), 人(Homo sapiens, Hs), 厚壳贻贝(Mytilus coruscus, Mc), 高山倭蛙(Nanorana parkeri, Np), 树袋熊(Phascolarctos cinereus, Pc), 福寿螺(Pomacea canaliculata, Po) |
NCBI blastx分析结果显示, 皱纹盘鲍WNT4与福寿螺(Pomacea canaliculata)、长牡蛎(Crassostrea gigas)、栉孔扇贝(Azumapecten farreri)和厚壳贻贝(Mytilus coruscus)的同源性分别为71.86%、70.92%、67.51%和65.32% (图 2)。
根据皱纹盘鲍WNT4氨基酸序列构建的系统进化树得出, 其WNT4基因首先与福寿螺(P. canaliculata)聚为一支, 之后与栉孔扇贝(A. farreri)、长牡蛎(C. gigas)和厚壳贻贝(M. coruscus)聚为一类, 表明该基因的系统进化关系与传统的物种进化地位基本一致(图 3)。根据SWISS-MODEL建模结果可得, 同源模版与WNT4蛋白序列的相似性为52.29%, QMEAN为–1.98, GMQE为0.73 (图 4), 结果说明该蛋白与模版蛋白的匹配度较高, 其中α螺旋占比为43%, 无规则卷曲占比为30%, β折叠占比为13%, TM螺旋占比为4% (图 5)。
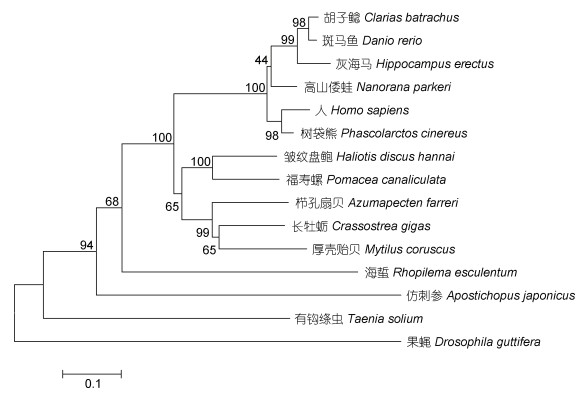 |
| 图 3 基于WNT4氨基酸序列的系统进化树 Fig. 3 Phylogenetic tree based on WNT4 amino acid sequence 注: 节点上的数字表示重复1000次的自举(Bootstrap)检验置信值 |
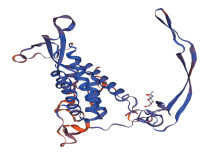 |
| 图 4 WNT4三级结构预测 Fig. 4 Prediction of the WNT4 tertiary structure |
 |
| 图 5 WNT4二级结构预测 Fig. 5 Prediction of the WNT4 secondary structure |
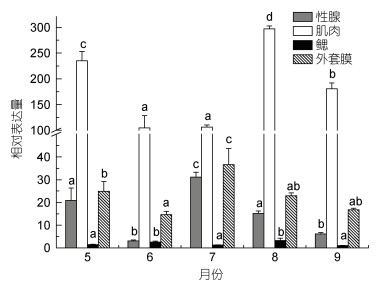
利用实时荧光定量方法分析WNT4基因在皱纹盘鲍雌雄个体不同月份不同组织中的相对表达量(图 6, 7)。实验结果显示, 除肝胰腺外, WNT4基因在雌雄个体不同月份的外套膜、肌肉、性腺和鳃中均有表达; 在雌性个体不同月份中, 肌肉的表达量均最高; 在雄性个体中, 5、6、8、9月肌肉表达量最高, 7月性腺表达量最高; 不同月份雌雄个体鳃中的表达量均为最低。
 |
| 图 6 雌性皱纹盘鲍中WNT4基因在不同月份不同组织中的表达 Fig. 6 The expression of the WNT4 gene in different tissues of female H. discus hannai in different months 注: 不同字母(a, b, c, d)表示不同月份相同组织表达存在显著性差异(P < 0.05), 相同字母表示组间无显著性差异。下同 |
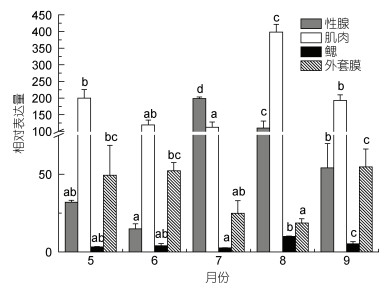 |
| 图 7 雄性皱纹盘鲍中WNT4基因在不同月份不同组织中的表达 Fig. 7 The expression of the WNT4 gene in different tissues of male H. discus hannai in different months |
在雌雄个体中, 肌肉在8月份表达量均最高, 显著高于其他月份; 7月份表达量均最低。外套膜在雌性个体中7月表达量最高, 显著高于其他月份, 在雄性个体中9月表达量最高, 显著高于7、8月, 与5、6月差异不显著。在雌性个体性腺中, WNT4基因的表达量以7月份为最高, 显著高于其他月份; 其次为5、8月, 显著高于6、9月的表达量; 5月与8月、6月与9月之间均差异不显著。在雄性个体性腺中, 不同月份WNT4的表达量7月> 8月> 9月> 5月> 6月; 7、8月的表达量均显著高于其他月份, 9月显著高于6月的表达量, 与5月差异不显著, 5月表达量与6月差异不显著。此外, WNT4基因在精巢的表达量均高于卵巢。
2.4 原位杂交结果分析对WNT4基因在雌雄皱纹盘鲍不同月份性腺进行定位分析。原位杂交结果(图 8)显示在实验组中, 雌性不同月份性腺中均存在明显的蓝紫色杂交信号, 主要位于卵母细胞的细胞质和细胞核中; 在雄性不同月份性腺中也存在蓝紫色杂交信号, 主要位于结缔组织上。雌雄性腺均为7月份杂交信号最强。对照组中均无信号。
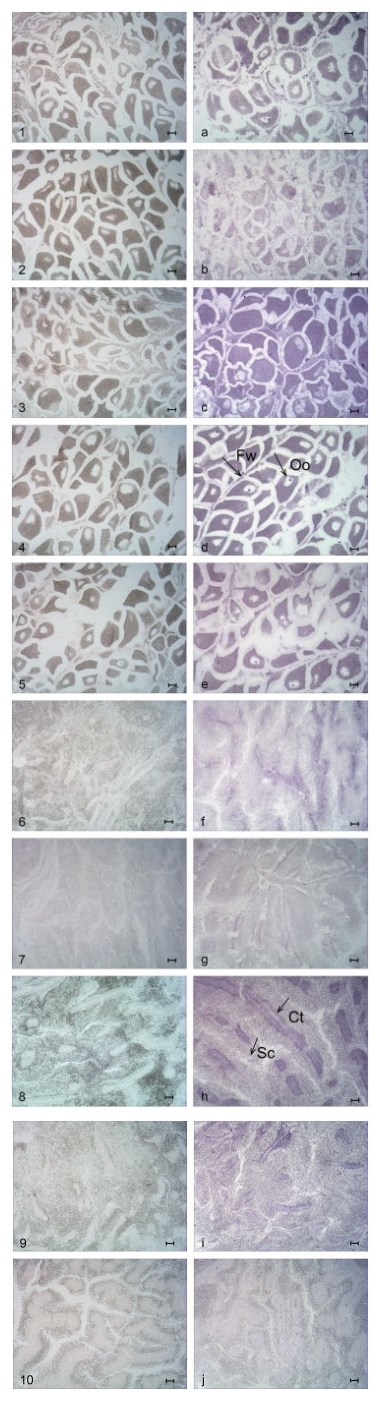 |
| 图 8 皱纹盘鲍WNT4基因雌雄性腺原位杂交 Fig. 8 In situ hybridization of male and female gonads of the WNT4 gene in H. discus hannai 注: 实验组(a—e为5—9月份雌性性腺, f—j为5—9月份雄性性腺), 阴性对照(1—5为雌性, 6—10为雄性); Oo. 卵母细胞, Fw. 滤泡壁, Sc. 精原细胞, Ct. 结缔组织, 标尺为50 μm |
WNT信号通路作为一条极其保守的信号传导途径, 在生物体内具有广泛调控多种生物学过程的作用(Niehrs, 2012)。WNT4基因是WNT家族成员的重要一员。Nusse等(1992)研究发现, WNT家族成员是由350—380个氨基酸构成的分泌型糖蛋白, 具有23或24个保守的半胱氨酸残基, 并分布着100多个保守位点。本研究发现, 皱纹盘鲍的WNT4基因可以编码356个氨基酸, 氨基酸序列含有23个WNT家族蛋白最重要的半胱氨酸保守序列以及172个WNT家族蛋白保守位点, 同时还含有一段长为27个氨基酸的信号肽序列, 这与Nusse等(1992)的研究结果一致, 表明WNT4基因具有高度保守性。
WNT4基因作为一种信号分子普遍存在于生物体中, 并参与多种生命过程。刘斐斐等(2020)通过荧光定量qRT-PCR分析发现, WNT4基因在雌雄三角帆蚌的斧足、外套膜、肝脏、闭壳肌、鳃、精巢和卵巢中均有表达; 虹鳟(Oncorhynchus mykiss)、斑马鱼、青鳉等鱼类中存在WNT4a和WNT4b两种基因(Liu et al, 2000; Inohaya et al, 2010; Nicol et al, 2012)。在虹鳟中, WNT4a基因与人、小鼠等哺乳动物的WNT4序列同源性在80%以上, 并在其卵黄发生晚期的卵巢、Ⅱ期精巢、皮肤、鳃、肌肉和肝等多种组织中均有表达; 其WNT4b基因与人、小鼠等哺乳动物的WNT4序列同源性小于60%, 在神经系统中表达(Nicol et al, 2012); 此外, WNT4基因在栉江珧、厚壳贻贝的外套膜、闭壳肌、性腺和鳃中也均有表达(王昌勃等, 2016; 徐跃峰等, 2016)。与以上研究结果类似, 本研究中WNT4基因在皱纹盘鲍雌雄个体肌肉、性腺、外套膜和鳃中均有表达, 具有广泛的组织表达特点, 推测WNT4基因参与了皱纹盘鲍多种组织细胞的生命过程。
WNT4基因在动物性腺发育过程中发挥重要作用。在小鼠中, WNT4基因通过调节下游基因(fst)表达, 参与小鼠卵巢发育调控(Yao et al, 2004)。Prunskaite-Hyyrylainen等(2014)研究发现, WNT4基因缺失导致卵巢卵泡发育受阻, 雌性小鼠生育能力严重下降, 最终导致卵巢早衰, WNT4基因影响小鼠卵巢卵泡细胞的发育。在牙鲆中, 翁申达(2013)发现WNT4基因在卵巢和精巢中均有表达, 有卵巢强于精巢1.5倍的性别二态性, 与性腺分化发育相关。在栉孔扇贝中, 李海龙等(2013)发现WNT4基因在性腺的不同发育时期中均有表达, 在性腺的成熟期中的表达量为最高, 且精巢表达量显著高于卵巢。在本研究中, 荧光定量PCR表明皱纹盘鲍WNT4基因在雌雄个体不同月份性腺组织中均有表达, 其中7月份表达量最高; 原位杂交结果也显示在雌雄皱纹盘鲍不同月份性腺中均呈现出明显的蓝紫色杂交信号, 7月份信号最强。据刘永峰等(1985)研究发现, 皱纹盘鲍的精巢与卵巢在7月底均处于成熟期, 说明WNT4基因参与了皱纹盘鲍两性性腺的发育和生殖细胞的成熟过程。WNT4基因在皱纹盘鲍精巢的表达量高于同时期卵巢的表达量, 与对栉孔扇贝、虹鳟的研究结果一致(Nicol et al, 2012; 李海龙等, 2013)。
4 结论本研究获得了皱纹盘鲍WNT4基因的cDNA序列。qRT-PCR结果显示, WNT4基因在不同月份的不同组织中均有表达, 表明其组织表达具有广泛性, 推测其参与了各种组织细胞的生命过程; ISH结果显示, 在皱纹盘鲍雌雄性腺中WNT4基因在不同月份均有明显的杂交信号, 与荧光定量结果一致, 推测其可能在两性性腺发育过程中发挥作用。
王如才, 王昭萍. 2008. 海水贝类养殖学. 青岛: 中国海洋大学出版社, 116-140
|
王昌勃, 李琪, 于瑞海, 等. 2016. 栉江珧wnt4基因cDNA的克隆表达及调控. 中国水产科学, 23(5): 1041-1051 |
刘永峰, 刘永襄, 隋锡林, 等. 1985. 大连海区皱纹盘鲍生殖周期的研究. 水产学报, 9(4): 312-319 |
刘斐斐, 崔晓羽, 董赛赛, 等. 2020. 三角帆蚌中WNT4基因克隆及表达分析. 上海海洋大学学报, 29(6): 801-810 |
李海龙, 刘建国, 刘晓玲, 等. 2013. 栉孔扇贝wnt4基因cDNA克隆及表达分析. 中国水产科学, 20(2): 260-268 |
杨梅, 许飞, 刘俊, 等. 2015. 长牡蛎(Crassostrea gigas)Wnt4基因cDNA克隆与表达分析. 海洋与湖沼, 46(1): 35-42 |
徐跃峰, 李一峰, 梁箫, 等. 2016. 厚壳贻贝Wnt4基因时空表达. 水产学报, 40(10): 1567-1575 |
翁申达, 2013. 牙鲆性别相关基因的克隆与表达分析. 青岛: 中国科学院研究生院(海洋研究所)硕士学位论文, 63
|
韩琳, 冯新港. 2008. Wnt信号通路及其在动物生长发育过程中的作用. 中国兽医寄生虫病, 16(3): 47-52 DOI:10.3969/j.issn.1674-6422.2008.03.012 |
黎中宝, 刘文彪, 韩芳, 等. 2005. 4种经济鲍遗传多样性与分化的研究. 中国生态农业学报, 13(4): 15-19 |
Inohaya K, Takano Y, Kudo A, 2010. Production of Wnt4b by floor plate cells is essential for the segmental patterning of the vertebral column in medaka. Development, 137: 1807-1813 DOI:10.1242/dev.051540 |
Jordan B K, Mohammed M, Ching S T et al, 2001. Up-regulation of WNT-4 signaling and dosage-sensitive sex reversal in humans. The American Journal of Human Genetics, 68(5): 1102-1109 DOI:10.1086/320125 |
Liu A P, Majumdar A, Schauerte H E et al, 2000. Zebrafish wnt4b expression in the floor plate is altered in sonic hedgehog and gli-2 mutants. Mechanisms of Development, 91(1/2): 409-413 |
Logan C Y, Nusse R, 2004. The WNT signaling pathway in development and disease. Annual Review of Cell and Developmental Biology, 20(1): 781-810 DOI:10.1146/annurev.cellbio.20.010403.113126 |
Nicol B, Guerin A, Fostier A et al, 2012. Ovary-predominant wnt4 expression during gonadal differentiation is not conserved in the rainbow trout (Oncorhynchus mykiss). Molecular Reproduction and Development, 79(1): 51-63 DOI:10.1002/mrd.21404 |
Niehrs C, 2012. The complex world of WNT receptor signalling. Nature Reviews Molecular Cell Biology, 13(12): 767-779 DOI:10.1038/nrm3470 |
Nusse R, Varmus H E, 1982. Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome. Cell, 31(1): 99-109 DOI:10.1016/0092-8674(82)90409-3 |
Nusse R, Varmus H E, 1992. Wnt genes. Cell, 69(7): 1073-1087 DOI:10.1016/0092-8674(92)90630-U |
Prunskaite-Hyyrylainen R, Shan J D, Railo A et al, 2014. Wnt4, a pleiotropic signal for controlling cell polarity, basement membrane integrity, and antimullerian hormone expression during oocyte maturation in the female follicle. The FASEB Journal, 28(4): 1568-1581 DOI:10.1096/fj.13-233247 |
Smolich B D, McMahon J A, McMahon A P et al, 1993. Wnt family proteins are secreted and associated with the cell surface. Molecular Biology of the Cell, 4(12): 1267-1275 DOI:10.1091/mbc.4.12.1267 |
Stark K, Vainio S, Vassileva G et al, 1994. Epithelial transformation of metanephric mesenchyme in the developing kidney regulated by Wnt-4. Nature, 372(6507): 679-683 DOI:10.1038/372679a0 |
van Ooyen A, Nusse R, 1984. Structure and nucleotide sequence of the putative mammary oncogene int-1:proviral insertions leave the protein-encoding domain intact. Cell, 39(1): 233-240 DOI:10.1016/0092-8674(84)90209-5 |
Wu G C, Chang C F, 2009. Wnt4 is associated with the development of ovarian tissue in the protandrous black porgy, Acanthopagrus schlegeli. Biology of Reproduction, 81(6): 1073-1082 DOI:10.1095/biolreprod.109.077362 |
Yao H H, Matzuk M M, Jorgez C J et al, 2004. Follistatin operates downstream of wnt4 in mammalian ovary organogenesis. Developmental Dynamics, 230(2): 210-215 DOI:10.1002/dvdy.20042 |
 2021, Vol. 52
2021, Vol. 52


