中国海洋湖沼学会主办。
文章信息
- 章骞, 陈宏, 阙华勇, 李钰金, 孙乐常, 翁凌, 张凌晶, 刘光明, 曹敏杰. 2021.
- ZHANG Qian, CHEN Hong, QUE Hua-Yong, LI Yu-Jin, SUN Le-Chang, WENG Ling, ZHANG Ling-Jing, LIU Guang-Ming, CAO Min-Jie. 2021.
- 长牡蛎(Crassostrea gigas)不同组织中蛋白酶的分布及冷藏过程中酶活力与鲜度变化
- DISTRIBUTION OF PROTEASES IN DIFFERENT TISSUES OF CRASSOSTREA GIGAS AND CHANGES OF ENZYME ACTIVITY AND FRESHNESS DURING COLD STORAGE
- 海洋与湖沼, 52(4): 1039-1046
- Oceanologia et Limnologia Sinica, 52(4): 1039-1046.
- http://dx.doi.org/10.11693/hyhz20210100016
文章历史
-
收稿日期:2021-01-17
收修改稿日期:2021-04-13
2. 水产品深加工技术国家地方联合工程研究中心 厦门 361021;
3. 集美大学水产学院 厦门 361021;
4. 中国海洋大学食品科学与工程学院 青岛 266003
2. National & Local Joint Engineering Research Center of Processing Technology for Aquatic Products, Xiamen 361021, China;
3. Fisheries College of Jimei University, Xiamen 361021, China;
4. College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China
牡蛎又名蚝, 其肉质鲜嫩, 营养丰富, 在我国沿海地区均有养殖。2019年我国牡蛎产量达523万t, 已成为海水养殖产量最大的主养品类, 也是为数不多的保持量效齐增的主养水产品种(张国范等, 2020)。牡蛎加工产品主要有生鲜品、冻品、干制品、罐制品、调味品、休闲即食产品以及活性肽(何定芬等, 2020)、活性多糖(Cheong et al, 2017)等功能食品。
生鲜牡蛎肉保留了牡蛎原有的口感和营养, 颇受消费者喜爱。牡蛎采收后, 在开壳取肉、贮运、销售等环节, 应在低温(0—4 ℃)下进行, 而且冷藏保鲜时间不宜超过7 d才能保持其良好的品质。得益于我国低温贮藏和冷链技术的发展, 牡蛎肉的保鲜期得到延长, 消费地域也不断扩大。在低温冷藏过程中, 影响牡蛎肉品质的主要因素有内源酶和微生物作用引起的糖原酵解、ATP降解、蛋白质降解以及脂肪氧化导致的风味下降等。内源性蛋白酶以及微生物繁殖产生的胞外酶的作用会分解牡蛎肌肉蛋白质, 导致肌肉组织破坏, 而蛋白质分解产物——肽、氨基酸和低分子含氮化合物浓度的上升, 为微生物的进一步生长繁殖提供了有利条件(章超桦等, 2014)。关于牡蛎的冷藏保鲜, 已有较多研究报道。基于微生物分析, 研究了壳聚糖在牡蛎冷藏期间的抗菌作用(Cao et al, 2009), 冰藏过程中牡蛎不同组织中ATP相关产物的变化情况也有报道(Yokoyama et al, 1992), 采用顶空固相微萃取和主成分分析法鉴定出贮藏过程中新鲜和劣化牡蛎的挥发性成分及其分布特征(Zhang et al, 2009), 不同冷冻方式和保鲜剂处理对牡蛎品质的影响也被作了比较研究(Songsaeng et al, 2010)。
水产动物肌肉中含有多种蛋白酶类, 如鱼类死亡后由僵直进入软化自溶过程中, 对肌肉蛋白降解和游离氨基酸积累起重要作用的酶类主要有组织蛋白酶、丝氨酸蛋白酶、氨肽酶等(章超桦等, 2018)。我国牡蛎产量逐年增加, 消费区域不断扩大, 但是, 牡蛎在冷藏过程中蛋白质的变化及与其密切相关的蛋白酶活力变化尚未有相关报道。
本研究以长牡蛎为实验材料, 比较牡蛎四种不同组织(外套膜、鳃、闭壳肌和性腺-内脏团)中主要蛋白酶类的分布情况, 探明牡蛎肉在4 ℃冷藏过程中酶活力和鲜度指标变化规律, 旨在从内源性蛋白酶的角度揭示牡蛎肉在短期(7 d)低温冷藏过程中鲜度变化的机理, 为牡蛎的保鲜贮藏提供理论参考。
1 材料与方法 1.1 材料与试剂2019年3月, 从福建省厦门市夏商国际水产交易中心采购鲜活长牡蛎(Crassostrea gigas) [长(10.55±0.82) cm, 宽(5.34±0.38) cm, 带壳重(98.73±8.42) g], 低温运送回实验室。
兔抗真鲷亮氨酸氨肽酶多克隆抗体(Wu et al, 2008)、兔抗鲍组织蛋白酶L多克隆抗体(Shen et al, 2015)由本实验室制备; 标准蛋白、二硫苏糖醇(DTT) (采购自美国Bio-Rad公司); 乙二胺四乙酸(EDTA) (采购自美国Sigma公司); 氨肽酶荧光底物(Leu-MCA, Ala-MCA, Arg-MCA)、胰蛋白酶型丝氨酸蛋白酶荧光底物(Boc-Phe-Ser-Arg-MCA)、组织蛋白酶荧光底物(Z-Phe-Arg-MCA, Z-Arg-Arg-MCA) (采购自日本Peptide Institute公司); 其他试剂购于国药集团化学试剂有限公司, 均为分析纯级别。
1.2 仪器与设备本研究用到主要仪器包括: PT-2100组织捣碎机(瑞士Kinematica公司); WB-14恒温水浴锅(德国Memmert公司); Bio Photometer紫外分光光度计(美国Perkin Elmer公司); Avanti JA-26.5高速冷冻离心机(美国Beckman公司); Agilent高效液相色谱仪(美国Agilent Technologies公司); pH计(德国Sartorius公司); FP-8200荧光分光光度计(日本Jasco公司); Mini-PIII电泳仪(美国Bio-Rad公司); G-BOX凝胶成像系统(英国Syngene公司)。
1.3 实验方法 1.3.1 原料预处理新鲜长牡蛎人工开壳取肉后用预冷海水清洗, 沥干, 随机分成21组, 每组5只, 并用密封袋包装, 置于(4.0±0.5) ℃冷库冷藏。
1.3.2 蛋白酶活力的测定取4 ℃冷藏0、1、2、3、5、7 d牡蛎的四种不同组织(外套膜、鳃、闭壳肌和性腺-内脏团), 分别加入4倍的冰冷蒸馏水, 组织捣碎, 离心(10 000×g, 15 min, 4 ℃)取上清液, 分别进行酶活力测定, 分析牡蛎不同组织中蛋白酶的分布。
氨肽酶(Aminopeptidase, AP)酶活力测定参照Zhang等(2013)的方法, 并作适当修改。取50 μL上清液与900 μL 25 mmol/L PBS (pH 7.0, 含1mmol/L DTT)混合, 置于37 ℃恒温水浴锅中, 加入50 μL 10 μmol/L的荧光底物(Leu-MCA, Ala-MCA, Arg-MCA)混匀。胰蛋白酶型丝氨酸蛋白酶(Serine Proteinase, SP)活力测定参照Cao等(1999)的方法。取50 μL上清液与900 μL 25 mmol/L Tris-HCl (pH 8.0)混合摇匀, 置于37 ℃恒温水浴锅中, 加入50 μL 10 μmol/L的荧光底物(Boc-Phe-Ser-Arg-MCA)混匀。组织蛋白酶(Cathepsin)活力测定参照Barrett等(1981)的方法。取50 μL上清液与900 μL 25 mmol/L PBS (pH 6.0, 含1 mmol/L DTT, 1 mmol/L EDTA)混合, 置于37 ℃恒温水浴锅中, 加入50 μL 10 μmol/L的荧光底物(组织蛋白酶B+L的荧光底物为Z-Phe-Arg-MCA, 组织蛋白酶B的荧光底物为Z-Arg-Arg-MCA)。以上各体系均在对应的温度和pH下反应30 min后, 立即加入1.5 mL终止液(甲醇︰异丙醇︰水=35︰30︰35, 体积分数)终止反应。用荧光分光光度计在激发波长380 nm和发射波长450 nm下测定反应释放的7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin, AMC)的荧光强度, 空白组用缓冲液代替荧光底物。
一个酶活力单位(U)定义为每分钟释放1 nmol AMC所需要的酶量。
1.3.3 SDS-PAGE分析分别取在4 ℃冷藏0、1、2、3、5、7 d牡蛎的四种不同组织样品, 加入4倍含有0.5 mol/L NaCl的PBS (pH 7.0), 组织捣碎, 离心(10 000×g, 15 min)取上清, 样品与上样缓冲液(200 mmol/L Tris-HCl, pH 8.0, 含400 mmol/L DTT, 8% SDS, 0.4%溴酚蓝, 40%甘油)按照1︰3 (体积分数)混合, 95 ℃加热10 min后–20 ℃冻藏待用。收集7 d的样品后一并进行SDS-PAGE分析。SDS-PAGE参考Laemmli(1970)的方法, 浓缩胶浓度为5%, 分离胶浓度为12%, 电泳结束后用考马斯亮蓝染色, 经脱色液脱色至蛋白条带清晰, 再用凝胶成像系统对结果进行分析。
1.3.4 免疫印迹法分析(Western blotting)参照Towbin等(1979)的文献报道, 将第0 d下4种不同组织上样于SDS-PAGE, 蛋白通过半干式电转印转移至硝酸纤维素膜上。将膜以5%脱脂奶封闭1.5 h, TBST清洗3次, 每次5 min, 接着用兔抗真鲷亮氨酸氨肽酶抗体或兔抗鲍组织蛋白酶L抗体孵育1.5 h, TBST清洗5次, 每次5 min。再以辣根过氧化物酶标记的羊抗兔IgG孵育1.5 h, TBST清洗7次, 每次7 min, 加入ECL底物孵育2 min, 经化学发光成像系统显色, 记录结果。
1.3.5 pH值的测定取冷藏第0、1、2、3、5、7、9、11、13 d的牡蛎肉样品, 分别进行组织捣碎, 得到肉糜样品备用。称取5.00 g肉糜, 加新煮沸后冷却的蒸馏水至50 mL, 摇匀, 浸渍30 min后过滤, 取25 mL滤液于50 mL烧杯中。按照GB 5009.237—2016《食品pH值的测定》的方法进行pH值的测定。
1.3.6 氨基酸态氮的测定称量上述第0、1、2、3、5、7 d的肉糜样品1.00 g用蒸馏水溶解后转至50 mL容量瓶中, 加水稀释至刻度, 混匀。按照GB 5009.235-2016《食品中氨基酸态氮的测定第二法》的方法进行氨基酸态氮含量的测定。
1.3.7 挥发性盐基氮的测定称取上述第0、1、2、3、5、7 d的肉糜样品10.00 g于蒸馏管内, 加入75 mL水, 振摇, 使试样在样液中分散均匀, 浸渍30 min。按照GB 5009.228-2016《食品中挥发性盐基氮的测定第二法》的方法进行挥发性盐基氮含量的测定。
1.3.8 数据统计分析采用Excel 2007对数据进行分析和制图。
2 结果与分析 2.1 牡蛎不同组织中蛋白酶的分布新鲜牡蛎不同组织中几种酶的相对活力如图 1所示。四种组织中, 不同种类的酶, 最高酶活力均出现在性腺-内脏团, 其次为鳃, 外套膜和闭壳肌的酶活力相当。丙氨酸氨肽酶和精氨酸氨肽酶在鳃中的酶活力约为性腺-内脏团的80%—90%, 外套膜和闭壳肌中的酶活力约为性腺-内脏团的40%—60%。亮氨酸氨肽酶在鳃中的活力为性腺-内脏团的50%, 外套膜和闭壳肌中的酶活力约为性腺-内脏团的35%。胰蛋白酶型丝氨酸蛋白酶在外套膜、鳃、闭壳肌中的酶活力相当, 仅约为性腺-内脏团的25%。为了进一步确认酶在不同组织中的蛋白水平差异, 利用兔抗真鲷亮氨酸氨肽酶多克隆抗体和兔抗鲍鱼组织蛋白酶L多克隆抗体进行Western blotting分析。如图 2所示, 牡蛎四种组织样品均能与兔抗真鲷亮氨酸氨肽酶抗血清产生免疫反应, 表明该酶在这四种组织中均有表达。亮氨酸氨肽酶在性腺-内脏团中的表达量最高, 其次为鳃, 在外套膜和闭壳肌中的表达量相当。而组织蛋白酶L只在性腺-内脏团中有表达, 与酶活力分析结果相同。
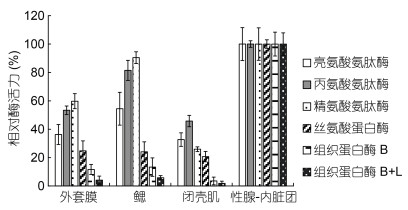 |
| 图 1 牡蛎4种不同组织中的相对酶活力(n=5) Fig. 1 The relative enzyme activity in 4 different tissues of oyster (n=5) |
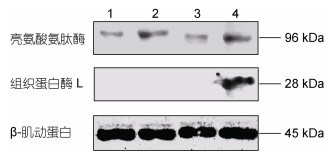 |
| 图 2 牡蛎4种不同组织中酶分布的Western blotting鉴定 Fig. 2 Identification of enzyme distribution in 4 different tissues of oyster by the Western blotting 注: 1. 外套膜, 2. 鳃, 3. 闭壳肌, 4. 性腺-内脏团 |
在冷藏过程中, 酶的作用直接影响牡蛎的品质。如图 3所示, 三种氨肽酶中亮氨酸氨肽酶的活力最高, 其次为精氨酸氨肽酶, 酶活力最低的是丙氨酸氨肽酶。三种氨肽酶在性腺-内脏团中的初始酶活力分别为(159.03±18.47)、(107.82±12.32)和(3.16±0.07) U/g。氨肽酶的酶活力随冷藏时间的延长逐渐降低, 经7 d冷藏后, 性腺-内脏团中亮氨酸氨肽酶的酶活力为初始值的25.15%, 丙氨酸氨肽酶的酶活力为初始值的31.65%, 精氨酸氨肽酶的酶活力为初始值的23.19%。胰蛋白酶型丝氨酸蛋白酶主要分布于性腺-内脏团中, 酶活力在冷藏过程中缓慢上升, 经7 d冷藏后, 性腺-内脏团中丝氨酸蛋白酶的酶活力上升44%, 这是酶原被激活的结果。组织蛋白酶B和组织蛋白酶B+L随着贮藏时间的延长, 酶活力均上升, 组织蛋白酶B+L的酶活力上升较组织蛋白酶B快, 说明在短期冷藏后期组织蛋白酶L对牡蛎品质的影响逐渐加强。组织蛋白酶B和组织蛋白酶B+L的酶活力至第7 d达到最高值, 分别为(30.61±2.75)和(40.44±8.72) U/g, 是初始酶活力的2.59和4.23倍, 同样, 这是酶原被激活的结果。
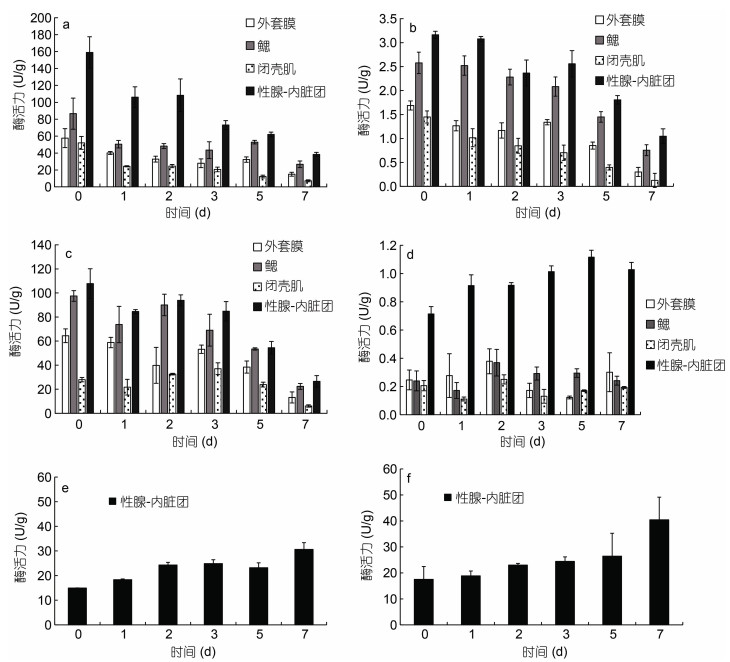 |
| 图 3 冷藏过程中牡蛎4种不同组织中酶活力的变化(n=5) Fig. 3 Changes of enzyme activity in 4 different tissues of oyster during cold storage (n=5) 注: a. 亮氨酸氨肽酶, b. 丙氨酸氨肽酶, c. 精氨酸氨肽酶, d. 丝氨酸蛋白酶, e. 组织蛋白酶B, f. 组织蛋白酶B+L |
牡蛎不同组织蛋白质降解情况如图 4所示, 在冷藏过程中, 四种组织中的蛋白质均受到不同程度的降解。外套膜(图 4a)中分子量为40 kDa的蛋白条带在冷藏的第7 d发生较为明显的降解。鳃(图 4b)中分子量为41、37和30 kDa的蛋白条带在冷藏第2 d就发生降解, 并出现低分子量(15 kDa)的蛋白降解条带。冷藏第3 d, 闭壳肌(图 4c)中分子量为25—30 kDa的蛋白降解条带产生。性腺-内脏团(图 4d)中分子量为40—50 kDa和25—30 kDa的蛋白条带在冷藏第2 d发生降解。总体上, 牡蛎组织中鳃和性腺-内脏团中的蛋白发生更为明显的降解现象, 这与这两个组织中内源性蛋白酶的高活力是密切相关的。
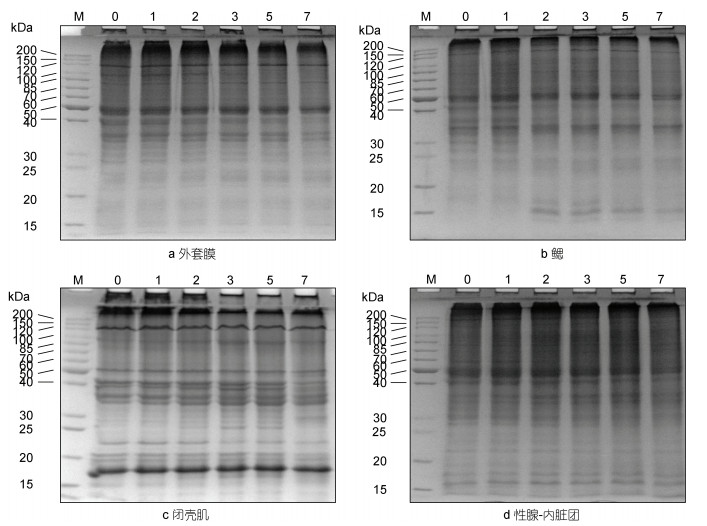 |
| 图 4 冷藏过程中牡蛎4种不同组织蛋白降解 Fig. 4 Protein degradation in 4 different tissues of oyster during cold storage 注: M. 标准蛋白; 0: 0 d; 1: 1 d; 2: 2 d; 3: 3 d; 5: 5 d; 7: 7 d |
由图 5可知, 牡蛎肉在4 ℃冷藏条件下, pH值随着贮藏时间的延长先降低后上升, pH值从初始的6.65±0.07到第9 d达最低值5.80±0.05, 随后由于蛋白质降解产生碱性的胺类物质而缓慢上升。但是, 与鱼类相比, 牡蛎肉因含有更多可生成乳酸的糖原, 使得牡蛎在冷藏过程中都处于较低的pH值。即便冷藏13 d, 已有浓重腐臭味, 牡蛎的pH值仍低于6.0。
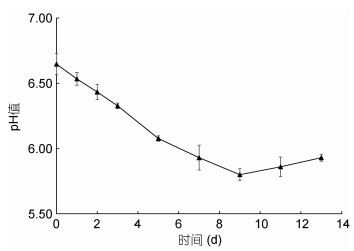 |
| 图 5 冷藏过程中牡蛎肉pH值的变化(n=5) Fig. 5 Changes in pH of oyster during cold storage (n=5) |
氨基酸态氮是指以游离氨基酸形式存在的氮元素含量。该指标在一定程度上可反映牡蛎肉中高分子量蛋白质被蛋白酶降解为低分子量肽后, 进一步被外切酶氨肽酶作用, 导致游离氨基酸量的增加。如图 6所示, 新鲜牡蛎肉的氨基酸态氮含量为(0.26±0.05) g/100g。4 ℃冷藏第2 d, 氨基酸态氮含量为(0.28±0.01) g/100g, 第7 d为(0.31±0.03) g/100g。挥发性盐基氮是机体在内源酶和微生物的作用下, 蛋白质降解而产生的挥发性碱性含氮物质, 其含量越高, 表明氨基酸被破坏的越多。牡蛎肉中挥发性盐基氮的含量在冷藏前2 d保持稳定, 随后快速增长。第0 d挥发性盐基氮的含量为(5.60±0.64) mg/100g, 冷藏至第7 d其含量达到(17.50±0.37) mg/100g, 增加了212.5%。
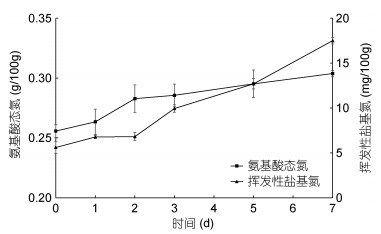 |
| 图 6 冷藏过程中牡蛎肉氨基酸态氮和挥发性盐基氮的变化(n=5) Fig. 6 Changes in amino nitrogen and volatile base nitrogen of oyster during cold storage (n=5) |
水产动物含有丰富的酶类, 酶类在不同组织中的分布差异与其生理功能密切相关。前期研究中我们发现, 赖氨酸氨肽酶在牙鲆肌肉、肝脏、鳃和肾脏等组织均有分布(陈曦等, 2012)。亮氨酸氨肽酶在真鲷不同组织中都有分布, 在脑和肾脏中含量较高(Wu et al, 2008)。对皱纹盘鲍组织蛋白酶L研究发现, 该酶存在于性腺和肝胰脏组织中, 而在肌肉、鳃和外套膜中均未检测到该酶的表达(Shen et al, 2015)。结合本文对牡蛎的研究结果表明, 氨肽酶广泛分布于水产动物的不同组织中, 而组织蛋白酶L主要存在于性腺和肝胰脏(内脏团)中。
牡蛎肉在4 ℃冷藏过程中, pH值呈现先下降后上升的“V”字形变化, 并且在第9 d时pH值最低, 与牛改改等(2020)对牡蛎冷藏保鲜的研究结果一致。动物死后, 随着糖原酵解生成乳酸, pH值下降, 下降的程度与机体中糖原的含量有关, 糖原含量越高, 乳酸的生成量越多, pH值越低。后续pH的上升主要是由于蛋白质降解产生的氨基酸受微生物的作用进一步分解生成呈碱性的生物胺类物质引起的。
牡蛎肉中氨基酸态氮含量在4 ℃冷藏的前7 d随冷藏时间延长而缓慢增加, 与刘寿春等(2013)报道的罗非鱼片在0 ℃冷藏过程中氨基酸态氮含量的变化结果类似。牡蛎肉在冷藏过程中氨基酸态氮含量缓慢增加, 与牡蛎肉中胰蛋白酶型丝氨酸蛋白酶、组织蛋白酶和氨肽酶的共同作用有关。牡蛎肉在冷藏前2 d是保鲜处理的关键时间点, 此时蛋白质降解程度弱, pH值、挥发性盐基氮、氨基酸态氮等指标基本稳定。冷藏2 d后, 挥发性盐基氮含量增长较快, 这与冷藏后期胰蛋白酶型丝氨酸蛋白酶、组织蛋白酶的高活力以及微生物的作用密不可分。至第7 d, 挥发性盐基氮含量达到(17.50±0.37) mg/100g, 与张观科等(2012)研究长牡蛎0—2 ℃冷藏过程中第7 d的挥发性盐基氮含量(16 mg/100g)接近, 但已超过卫生标准值规定的15 mg/100g, 牡蛎也已失去其特有的气味并有不愉快的腐败气味产生。郭晓伟(2010)的研究发现, 长牡蛎在4 ℃冷藏6 d时挥发性盐基氮值达到19.6 mg/100g。不同研究者对牡蛎冷藏过程中挥发性盐基氮指标研究的结果不同, 很大可能是由于牡蛎不同产区水域环境及季节的影响, 从而导致其在冷藏过程中产生鲜度指标上的差异。
牡蛎的不同组织中, 蛋白酶活力最高的性腺-内脏团和鳃最先开始蛋白降解, 而后外套膜和闭壳肌中的蛋白逐渐降解。胰蛋白酶型丝氨酸蛋白酶的最适pH为8.0左右, 在中性附近也有较高活性, 在冷藏初期, 该酶对蛋白的降解起主要作用。随着冷藏时间的延长, 牡蛎的pH值不断下降(图 5所示), 此时最适pH为5.5的组织蛋白酶L和B的作用更为突出。因此, 本文认为胰蛋白酶型丝氨酸蛋白酶和组织蛋白酶等蛋白酶的协同作用是牡蛎肉冷藏前期蛋白质降解的主要因素, 而氨肽酶是外切酶, 其作用主要是增加游离氨基酸含量。接下来, 有必要对相关蛋白酶的性质作更深入研究。
冷藏保鲜是世界上历史最悠久的保鲜方法, 因其操作简单、成本低, 至今仍是国内最广泛使用的牡蛎保鲜方法。冷藏保鲜的温度一般维持在0—4 ℃, 本文结果显示牡蛎肉通过4 ℃冷藏保鲜, 货架期为6 d, 尚不能满足运往内地市场更长时间货架期的要求。而通过低温并结合降低微生物生长繁殖速度的手段, 可以有效延长牡蛎肉的冷藏货架期。牡蛎肉使用浓度为3.36 mg/L的臭氧水浸泡处理15 min, 4 ℃冷藏的保鲜期为8 d (袁勇军等, 2009)。气调包装(60% CO2 / 30% N2 / 10% O2)的长牡蛎肉样品在[(4±1) ℃]冷藏条件下, 货架期可达到11—12 d (曹荣等, 2009)。长牡蛎肉经350 MPa超高压处理10 min后, 4 ℃冷藏货架期延长至14 d (刘远平等, 2016)。牡蛎肉轻度热处理(80 ℃隔袋加热20 min)后, 4 ℃冷藏的货架期可达15 d (岳敏等, 2019)。今后, 有必要借鉴这些方法并对产生的效果作深入分析。
对长牡蛎中内源性蛋白酶的分布及冷藏过程中蛋白质降解、酶活力和鲜度指标变化规律的研究, 对于采取更加切实有效的措施做好牡蛎冷链物流过程中的牡蛎品质保持具有参考意义。
4 结论内源性蛋白酶对短期冷藏过程中牡蛎的品质有重要影响。氨肽酶、胰蛋白酶型丝氨酸蛋白酶和组织蛋白酶等三大类酶在牡蛎的性腺-内脏团中活力最高。氨肽酶在外套膜、鳃、闭壳肌和性腺-内脏团等四种组织中均有表达分布, 胰蛋白酶型丝氨酸蛋白酶主要存在于性腺-内脏团, 而组织蛋白酶绝大部分在性腺-内脏团中表达。在7 d的4 ℃冷藏过程中, 四种组织中的酶活力均发生了明显变化, 氨肽酶的活力逐渐降低, 而组织蛋白酶和胰蛋白酶型丝氨酸蛋白酶的酶原被激活, 酶活力随着时间的延长而升高。四种组织中的蛋白质随冷藏时间的延长而发生不同程度的降解, 氨基酸态氮和挥发性盐基氮含量与冷藏时间呈正相关性。
牛改改, 游刚, 张晨晓, 等. 2020. 真空包装牡蛎肉在冷藏和冻藏过程中的品质变化. 食品研究与开发, 41(18): 7-14 |
刘寿春, 钟赛意, 李平兰, 等. 2013. 蛋白质降解指示冷藏罗非鱼片品质劣变研究. 食品科学, 34(2): 241-245 |
刘远平, 史田, 王富龙, 等. 2016. 超高压处理对冷藏牡蛎保鲜效果及品质变化的影响. 食品工业科技, 37(15): 325-328 |
何定芬, 谢超, 梁佳, 等. 2020. 基于UF、GFC及RP-HPLC的长牡蛎(Crassostrea gigas)蛋白抗衰老小分子活性肽(Zel'ner)的纯化及结构解析. 海洋与湖沼, 51(1): 141-147 |
张观科, 刘红英, 齐凤生. 2012. 生物保鲜对牡蛎冷藏保鲜效果的研究. 水产科学, 31(10): 611-615 DOI:10.3969/j.issn.1003-1111.2012.10.009 |
张国范, 李莉, 阙华勇. 2020. 中国牡蛎产业的嬗变—新认知、新品种和新产品. 海洋与湖沼, 51(4): 740-749 |
陈曦, 蔡秋凤, 刘光明, 等. 2012. 牙鲆肌肉赖氨酸氨肽酶的分离纯化与性质研究. 中国食品学报, 12(6): 22-29 DOI:10.3969/j.issn.1009-7848.2012.06.004 |
岳敏, 苏明月, 姜岁岁, 等. 2019. 轻度热处理牡蛎肉在冷藏过程中品质变化. 食品科技, 44(7): 179-184 |
袁勇军, 陆宇波, 陈伟, 等. 2009. 臭氧处理和低温保藏对牡蛎保鲜效果研究. 食品科技, 34(10): 137-140 |
郭晓伟, 董士远, 刘尊英, 等. 2010. 冰温牡蛎的货架期. 食品科技, 35(11): 86-90 |
曹荣, 薛勇, 薛长湖, 等. 2009. 气调包装对太平洋牡蛎冷藏保鲜效果的研究. 食品工业科技, 30(5): 307-309, 319 |
章超桦, 秦小明. 2014. 贝类加工与利用. 北京: 中国轻工业出版社, 53
|
章超桦, 薛长湖. 2018. 水产食品学. 第3版. 北京: 中国农业出版社, 33
|
Barrett A J, Kirschke H, 1981. [41] Cathepsin B, Cathepsin H, and cathepsin L. Methods in Enzymology, 80: 535-561
|
Cao M J, Osatomi K, Pangkey H et al, 1999. Cleavage specificity of a myofibril-bound serine proteinase from carp (Cyprinus carpio) muscle. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 123(4): 399-405 DOI:10.1016/S0305-0491(99)00086-3 |
Cao R, Xue C H, Liu Q, 2009. Changes in microbial flora of Pacific oysters (Crassostrea gigas) during refrigerated storage and its shelf-life extension by chitosan. International Journal of Food Microbiology, 131(2/3): 272-276 |
Cheong K L, Xia L X, Liu Y, 2017. Isolation and characterization of polysaccharides from oysters (Crassostrea gigas) with anti-tumor activities using an aqueous two-phase system. Marine Drugs, 15(11): 338 DOI:10.3390/md15110338 |
Laemmli U K, 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 227(5259): 680-685 DOI:10.1038/227680a0 |
Shen J D, Cai Q F, Yan L J et al, 2015. Cathepsin L is an immune-related protein in Pacific abalone (Haliotis discus hannai)-purification and characterization. Fish & Shellfish Immunology, 47(2): 986-995 |
Songsaeng S, Sophanodora P, Kaewsrithong J et al, 2010. Quality changes in oyster (Crassostrea belcheri) during frozen storage as affected by freezing and antioxidant. Food Chemistry, 123(2): 286-290 DOI:10.1016/j.foodchem.2010.04.033 |
Towbin H, Staehelin T, Gordon J, 1979. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proceedings of the National Academy of the Sciences of the United States of America, 76(9): 4350-4354 |
Wu G P, Cao M J, Chen Y et al, 2008. Leucine aminopeptidase from red sea bream (Pagrus major) skeletal muscle: purification, characterization, cellular location, and tissue distribution. Journal of Agricultural & Food Chemistry, 56(20): 9653-9660 |
Yokoyama Y, Sakaguchi M, Kawai F et al, 1992. Changes in concentration of ATP-related compounds in various tissues of oyster during ice storage. Nihon-Suisan-Gakkai-Sh, 58(11): 2125-2136 DOI:10.2331/suisan.58.2125 |
Zhang L, Cai Q F, Wu G P et al, 2013. Arginine aminopeptidase from white shrimp (Litopenaeus vannamei) muscle: purification and characterization. European Food Research and Technology, 236(5): 759-769 DOI:10.1007/s00217-013-1941-x |
Zhang Z M, Li T L, Wang D et al, 2009. Study on the volatile profile characteristics of oyster Crassostrea gigas during storage by a combination sampling method coupled with GC/MS. Food Chemistry, 115(3): 1150-1157 DOI:10.1016/j.foodchem.2008.12.099 |
 2021, Vol. 52
2021, Vol. 52


