中国海洋湖沼学会主办。
文章信息
- 林立东, 马增岭, 陈斌斌, 吴明江. 2021.
- LIN Li-Dong, MA Zeng-Ling, CHEN Bin-Bin, WU Ming-Jiang. 2021.
- 栽培羊栖菜(Sargassum fusiforme)成熟藻体不同器官的组织结构显微观察及其生理生态学功能剖析
- ANALYSIS OF PHYSIOLOGICAL AND ECOLOGICAL FUNCTIONS TO MATURE SPOROPHYTE OF CULTIVATION SARGASSUM FUSIFORME BASED ON ITS ORGAN MORPHOLOGICAL STRUCTURE
- 海洋与湖沼, 52(4): 1047-1057
- Oceanologia et Limnologia Sinica, 52(4): 1047-1057.
- http://dx.doi.org/10.11693/hyhz20210100008
文章历史
-
收稿日期:2021-01-10
收修改稿日期:2021-03-30
2. 温州大学浙江省水生环境与海洋生物资源保护重点实验室 温州 325035;
3. 温州大学生命与环境科学学院 温州 325035
2. Zhejiang Provincial Key Laboratory for Water Environment and Marine Biological Resources Protection, Wenzhou University, Wenzhou 325035, China;
3. College of Life and Environmental Science, Wenzhou University, Wenzhou 325035, China
羊栖菜(Sargassum fusiforme)属褐藻门(Phaeophyta)、马尾藻科(Sargassaceae)植物, 雌雄异株, 具有性生殖和无性生殖两种生殖方式, 为太平洋西北部近岸海域特有的多年生大型海藻(曾呈奎, 2000; 林立东等, 2020)。近年来, 有关羊栖菜的研究报道主要集中于羊栖菜褐藻硫酸多糖提取、分离与药理活性分析(Wu et al, 2013; Sun et al, 2018); 羊栖菜藻体膳食纤维、微量元素、氨基酸、蛋白质等营养成分分析(赵艳芳等, 2013; Li et al, 2018); 羊栖菜藻体响应光照、温度、CO2供给、干出和低渗等环境因子变化的生理学研究(Zou et al, 2004; Qian et al, 2016; Xie et al, 2016; Jiang et al, 2019; Li et al, 2019; Liu et al, 2020); 羊栖菜藻体响应重金属镍、汞、铜、锌和镉等胁迫的生态毒理学研究(Lee et al, 2012; Shin et al, 2014; Huang et al, 2015); 羊栖菜幼胚响应米氏凯伦藻(Karenia mikimotoi)赤潮感染的光合生理研究(Ma et al, 2017; Shang et al, 2020); 重金属砷含量研究(Ma et al, 2018)等六个方面, 此外, 也有少量关于温州洞头栽培羊栖菜样品RAPD和ISSR分子标记研究(徐佳丽等, 2014; 南春容等, 2015; Yao et al, 2019)等报道。褐藻是藻类植物中进化较为高级的一个类群, 具表皮、皮层和髓组织分化特征(朱仲嘉等, 1992; 黄冰心等, 2015)。目前, 文献《羊栖菜生物的初步研究》和《中国经济海藻超微结构研究》分别描述了野生羊栖菜成熟藻体各器官显微和超显微结构特征, 而文献《羊栖菜的生药学研究》仅对栽培羊栖菜藻体茎和叶器官的组织显微结构进行了观察与分析(王素娟, 1991; 张华芳, 2005), 上述文献在羊栖菜器官组织形态结构、细胞形态结构和学术名词等方面进行了初步描述和定义, 为我们深度认知羊栖菜各器官间的组织形态特征提供了借鉴基础, 但相距系统认知栽培羊栖菜成熟藻体各器官间组织形态差异、显微结构差异和定量描述组织形态结构等方面尚有差距, 还需进一步补充和完善。
植物解剖学与生理学、生物化学、基因组学和代谢组学等相结合, 提供了大量的数据集, 为系统地揭示植物在胁迫环境下的生长、发育、防御和生产力铺平了道路(Yadav et al, 2021)。结构与功能是生命科学研究的主题, 结构是物质系统内部的组织形式, 功能则是物质系统在与内外环境的相互作用中, 所表现出来的特性、行为、效能(Zhao et al, 2008; Dias et al, 2016; 程铭恩等, 2019)。羊栖菜不同器官的组织结构不同, 生物活性物质的含量也不尽相同(赵艳芳等, 2013)。羊栖菜器官组织形态是光合作用、无机离子选择吸收和逆境生理生态学等基础研究的认知基础, 准确掌握栽培羊栖菜器官组织显微形态特征, 利于研究者精准选定目标器官, “集成”研究栽培羊栖菜响应环境变化的组织形态变化、生化成分与动态分布、生理代谢活动等重要生命活动过程及其分子机制。
本文在观察和记录栽培羊栖菜成熟孢子体假根、茎、叶(气囊)和生殖托(雌托和雄托)四类器官组织形态特征基础上, 结合现有羊栖菜生理生态学文献报道, 系统阐述了羊栖菜叶绿体分布, 膳食纤维、微量元素和褐藻多糖(褐藻胶、褐藻淀粉和褐藻糖胶)等含量与分布特征, 以期为建立羊栖菜器官模拟生物细胞结构力学模型, 解析栽培羊栖菜生长发育, 揭示微量元素的吸收、转运和储藏, 藻体响应环境信号的分子机理等生命活动提供基础数据和理论参考。
1 材料与方法 1.1 材料选择与处理于温州市洞头区选取栽培羊栖菜(Sargassum fusiforme)成熟孢子体雌雄植株, 去除杂质, 分别选取假根、叶片、气囊、茎和生殖托器官, 新鲜过滤海水清洗后, 分别置事先注入固定液的棕色广口试剂瓶中, 4 ℃冷藏待用。
1.2 固定与石蜡切片制作固定 将羊栖菜各部器官分别置FAA固定液(5 mL福尔马林, 6 mL乙酸和89 mL 50%乙醇)中固定24 h;
脱水 取已固定器官材料置50%、60%、70%、80%、90%和100%乙醇中梯度脱水, 每梯度乙醇脱水1 h, 期间每梯度乙醇更换3次;
透明 将脱水后羊栖菜器官置1 : 1 (体积分数)的无水乙醇和二甲苯混合液中浸泡透明2 h, 再置100%二甲苯溶液中透明3 h, 期间每1 h更换二甲苯1次;
透蜡 在56 ℃恒温箱中置放50 mL烧杯6只且编号, 1号烧杯置放1 : 1二甲苯和石蜡混合液30 mL, 2号烧杯置放1 : 2二甲苯和石蜡混合液30 mL, 3号和4号烧杯分别置放软蜡30 mL, 5号和6号烧杯各置放硬蜡30 mL, 羊栖菜器官材料依次浸蜡1 h;
包埋 将事先准备好的纸盒置温度略高于石蜡熔点的温台上, 将浸蜡后的羊栖菜器官材料连同石蜡倒入纸盒内, 加热后用解剖针摆正器官材料, 将纸盒平缓快速浸置冷水中50—60 min, 取出带有纸盒的蜡块, 去除纸盒, 用解剖刀规则修整蜡块, 编号置4 ℃冰箱冷藏待用。
切片 将包埋器官的蜡块固定至kd-1508型旋转切片机上, 切取厚度为8—10 μm的器官横切片或纵切片;
贴片、展片与烫片 将事先准备好的胶黏剂(体积分数为1︰1的蛋白和甘油, 加入少量麝香草酚或石碳酸)均匀涂抹干净载玻片中央; 后滴上适量蒸馏水, 将事先选好的器官石蜡切片浮于蒸馏水上, 亮而光的反面朝下; 将载玻片置酒精灯火焰上方平稳移动, 均匀展平切片, 静置3—5 min, 清去水液, 吸干余水, 将载片置放置37 ℃温箱中, 至蜡片干透;
脱蜡 将染色后的蜡片置25 ℃二甲苯溶剂中脱蜡, 连续置换3次二甲苯溶液, 每次二甲苯溶液脱蜡5 min, 彻底清除石蜡;
复水 将脱蜡后的蜡片分别置100%、90%、80%和70%梯度乙醇液中快速复水, 每梯度乙醇液复水2 min;
染色 将蜡片分别置事先配制好的番红(Safranin)染色剂和固绿(Fast green)染色剂中染色, 使细胞核着红色, 纤维素细胞组织着为灰色(70%乙醇配制液染色, 4 ℃冷藏);
脱水 将染色后的蜡片分别置70%、80%、90%和100%乙醇中脱水, 每梯度液脱水3 min, 100%乙醇重复脱水3次;
透明 将脱水后的蜡片置1 : 1 (体积分数)无水乙醇和二甲苯混合液中, 后置二甲苯溶液中透明3次, 每次透明5 min;
封片 去除蜡片多余二甲苯溶液, 滴一滴树胶, 倾斜置放载玻片, 排出空气, 置35 ℃烘干箱中干燥至牢固。
1.3 组织形态记录与测定方法使用倒置生物显微镜(NIKON 90i, 日本)观察与记录器官组织形态照片。根据各器官蜡片实际, 选择4(物镜)×10(目镜)倍、10(物镜)×10(目镜)倍或40(物镜)×10(目镜)倍(下同)观察和记录器官组织形态。根据标尺长度/标尺距离=测量长度/测量距离公式, 计算测量距离, 相同部位重复测量5次, 计算均值和标准差(S.D)值。
2 结果与分析 2.1 羊栖菜假根横切组织形态特征羊栖菜假根呈柱状, 横切组织由外向内分别为表皮层、近表皮层、皮层和髓部组织区(图 1)。羊栖菜假根的组织形态主要特征为, 表皮层由单层细胞组成, 位于假根最外层, 宽度为(26.04 ± 5.21) μm, 具表皮外皮层和表皮内皮层结构。表皮细胞致密, 栅栏状排列, 着色最深, 腔内均富含淀粉粒。表皮细胞侧壁的宽度是外皮层或内皮层宽度的6—7倍, 部分表皮细胞侧壁延伸至近表皮细胞层, 表皮细胞腔内色素体含量较多; 近表细胞层位于表皮内皮层内侧, 由1—2层薄壁细胞构成, 宽度为(31.25±10.42) μm; 细胞壁着色较深, 与表皮外皮层、表皮内皮层颜色差异不显著, 但显著深于皮层细胞壁; 近表皮细胞间的胞间隙结构明显。近表皮细胞与表皮细胞共壁1—2面, 细胞腔大小不均一, 腔内均富含淀粉粒; 皮层细胞位于近表皮细胞层内侧, 由8—9层薄壁细胞构成, 宽度为(475.18±33.45) μm, 皮层组织区细胞形态呈四边形、五边形或六边型等典型植物细胞形态特征, 细胞腔较大, 细胞壁较薄, 腔内含淀粉粒, 由表皮向髓部方向, 颜色逐渐变浅。髓部组织区位于形态学中心部位, 直径为(727.2±37.56) μm。髓部细胞致密, 多数细胞腔小于皮层细胞腔, 少数细胞与皮层细胞腔相近, 细胞淀粉粒的含量多于皮层细胞, 少于表皮和近表皮细胞。
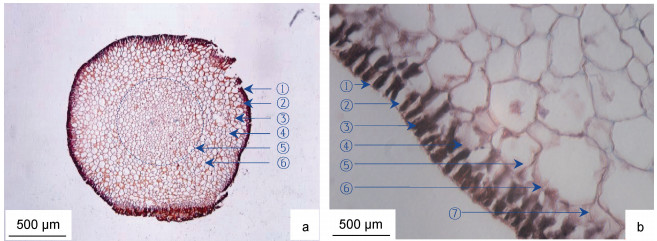 |
| 图 1 羊栖菜假根的横切组织形态 Fig. 1 Morphology of transverse tissue of S. fusiforme rhizoid 注: a. 4×10倍, ①表皮, ②近表皮细胞, ③皮层细胞壁, ④皮层细胞腔, ⑤髓部组织区, ⑥淀粉粒; b. 40×10倍, ①表皮外皮层, ②表皮细胞腔, ③色素体, ④表皮内皮层, ⑤皮层细胞, ⑥皮层细胞壁, ⑦胞间隙 |
羊栖菜茎横切面呈椭圆形, 横切组织由外向内分别为表皮、近表皮层、皮层和髓部组织区(图 2a, 2b, 2c)。羊栖菜茎组织形态主要特征为, 表皮层位于茎组织最外层, 由单层细胞组成, 宽度为(43.96±10.99) μm, 细胞壁着色最深; 表皮细胞致密, 栅栏状排列, 腔内富含淀粉粒; 表皮细胞层具外皮层和内皮层结构, 界限清晰, 腔内含色素体。表皮细胞侧壁增厚, 多数细胞侧壁延伸至近表皮细胞层。近表皮细胞位于表皮内皮层内侧, 由1—2层薄壁细胞构成, 宽度为(47.62±16.79) μm; 近表皮细胞与表皮细胞共壁1—2面, 细胞腔大小不均一, 细胞壁着色浅于表皮细胞壁, 腔内富含淀粉粒。皮层细胞位于近表皮细胞内侧, 宽度为(787.55±74.80) μm—(1 146.52±177.99) μm; 皮层细胞腔最大, 具典型多边形植物细胞形态特征, 腔内富含淀粉粒。髓部组织区位于形态学中心部位, 呈椭圆形, 长宽分别为(457.87±16.79) μm、(357.14±5.49) μm; 髓部多数细胞腔较小, 少数细胞腔较大, 细胞致密, 腔内富含淀粉粒。
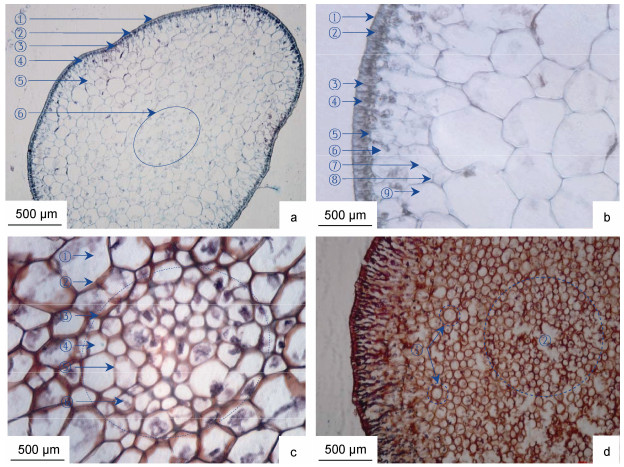 |
| 图 2 羊栖菜茎的横切组织形态 Fig. 2 Morphology of transverse tissue of S. fusiforme stem 注: a. 10×10倍, ①表皮外皮层, ②表皮细胞, ③表皮内皮层, ④近表皮细胞, ⑤皮层细胞, ⑥髓部组织; b. 40×10倍, ①表皮外皮层, ②表皮细胞, ③表皮细胞壁, ④色素体, ⑤表皮内皮层, ⑥近表皮细胞, ⑦皮层细胞壁, ⑧胞间隙, ⑨皮层细胞腔; c. 40×10倍, ①皮层细胞, ②皮层细胞壁, ③髓部组织区, ④髓部细胞, ⑤髓部细胞壁, ⑥淀粉粒; d. 10×10倍, ①幼孢子体茎皮层组织圆形细胞, ②幼孢子体茎髓部组织区 |
羊栖菜幼孢子体茎(图 2d)与成熟孢子体茎的形态和横切组织结构特征相似, 但皮层和髓部组织细胞形态均呈卵圆形或圆形特征。皮层组织细胞中, 多数胞腔相对较大, 细胞直径长度为(223.86±8.70) μm; 少数胞腔较小, 且与髓部组织细胞中少数细胞腔较大的直径相近, 细胞直径长度为(170.45±5.87) μm。
2.3 羊栖菜叶横切组织形态特征羊栖菜叶横切面呈梭形, 长度为(2 526.04±5.21) μm, 宽度为(973.96±5.20) μm, 横切组织由外向内分别为表皮、近表皮、皮层和髓部组织区(图 3)。羊栖菜叶组织形态主要特征为, 表皮位于叶组织最外层, 宽度为(26.04±5.19) μm, 具表皮外皮层和表皮内皮层结构。表皮细胞壁着色最深, 细胞致密, 栅栏状排列, 细胞侧壁增厚, 并延伸至近表皮细胞组织区。近表皮细胞位于表皮内侧, 宽度为(48.61±15.9) μm; 近表皮细胞与表皮细胞共壁1—3面(如: 图 3c, ⑦), 细胞腔较小, 腔内富含黑色、较大颗粒淀粉粒。皮层细胞位于近表皮细胞内侧, 细胞壁清晰, 具典型植物细胞形态特征, 细胞腔较大, 淀粉粒含量明显多于假根和茎皮层细胞淀粉粒, 皮层组织区长度半径为(1 052.08±45.41) μm, 宽度半径为(402.78±21.68) μm左右。髓部组织区位于形态学中心部位, 呈椭圆形, 长度为(388.89±43.37) μm, 宽度为(175.35±10.84) μm。髓部细胞壁着色深蓝, 细胞致密, 多数细胞腔较小, 少数细胞腔较大, 具典型植物多边形细胞形态特征, 腔内富含淀粉粒。
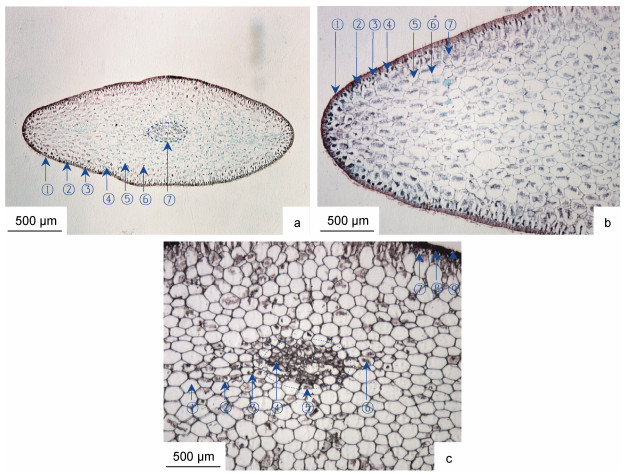 |
| 图 3 羊栖菜叶的横切组织形态 Fig. 3 Morphology of transverse tissue of S. fusiforme leaf 注: a. 4×10倍, ①表皮外皮层, ②表皮内皮层, ③色素体, ④近表皮细胞, ⑤皮层细胞壁, ⑥淀粉粒, ⑦髓部组织区; b. 10×10倍, ①表皮外皮层, ②表皮内皮层, ③近表皮细胞, ④淀粉粒, ⑤皮层细胞, ⑥皮层细胞壁, ⑦淀粉粒; c. 10×10倍, ①皮层细胞, ②皮层细胞壁, ③胞间隙, ④髓部细胞, ⑤髓部组织区, ⑥淀粉粒, ⑦近表皮细胞, ⑧表皮内皮层, ⑨表皮外皮层 |
羊栖菜气囊横切面呈圆环状, 囊壁宽度为(359.83±10.42) μm, 横切组织由外向内分为表皮、近表皮、皮层和内皮层组织区(图 4)。羊栖菜气囊组织形态主要特征为: 表皮位于气囊组织最外层, 由单层细胞构成, 宽度为(26.04±5.21) μm, 具表皮外皮层和表皮内皮层结构; 表皮细胞壁着色最深, 呈暗红色, 细胞致密, 栅栏状排列, 细胞侧壁增厚, 并延伸至近表皮细胞组织区, 腔内色素体清晰可见; 近表皮细胞位于表皮内皮层内侧, 由1—2层细胞构成, 宽度为(29.51 ± 10.84) μm。近表皮细胞壁着色较深, 但略浅于细胞壁, 细胞腔大小不均, 多数细胞腔较小, 呈大小不规则间隔排列, 腔内富含淀粉粒; 皮层细胞位于近表皮细胞内侧, 宽度为(298.61 ± 57.37) μm, 具典型植物多边形细胞形态特征, 细胞腔普遍大于近表皮细胞腔, 腔内富含淀粉粒。内皮层细胞与皮层细胞大小和形态差异不显著, 较大腔细胞与较小腔细胞间嵌合排列, 细胞壁相互连接构成气囊空腔。
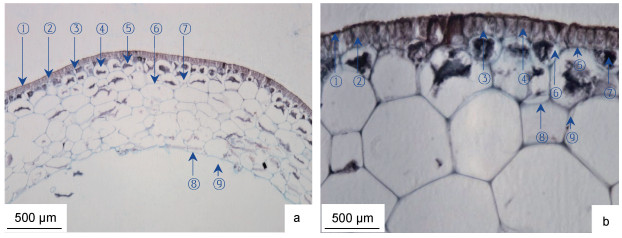 |
| 图 4 羊栖菜气囊的横切组织形态 Fig. 4 Morphology of transverse tissue of S. fusiforme air-bladder 注: a. 10×10倍, ①表皮外皮层, ②表皮细胞, ③皮层内皮层, ④近表皮细胞, ⑤淀粉粒, ⑥皮层细胞壁, ⑦皮层细胞腔, ⑧内皮层, ⑨气囊囊腔; b. 40×10倍, ①表皮外皮层, ②表皮细胞, ③表皮细胞壁, ④色素体, ⑤表皮内皮层, ⑥近皮层细胞, ⑦淀粉粒, ⑧皮层细胞壁, ⑨胞间隙 |
羊栖菜雌生殖托横切面整体呈柱状, 横切组织由外向内分为表皮、生殖窝孔、生殖窝、卵和皮层组织区(图 5)。羊栖菜雌生殖托组织形态主要特征为: 表皮位于生殖托最外层, 宽度为(64.14±11.23) μm, 具表皮外皮层和表皮内皮层结构; 表皮细胞壁着色最深, 栅栏状排列。生殖窝孔嵌合于表皮组织当中, 直径为(125.01±9.30) μm; 生殖窝位于表皮内侧, 呈球状分布与表皮内的皮层组织中, 直径为(635.41±120.77) μm, 窝与窝间隔排列, 中间着生皮层组织; 窝内着生椭圆形卵, 卵的长度为(184.21±26.32) μm、宽度为(100.88±7.59) μm, 卵通过隔丝生长于生殖窝内壁, 且卵与卵之间由隔丝间隔。近皮层细胞位于表皮内皮层内侧, 细胞壁着色浅于细胞壁, 细胞腔大小不均一, 多数细胞腔较小, 大小腔细胞间呈不规则排列, 腔内富含淀粉粒。皮层细胞具典型植物多边形细胞形态特征, 腔内富含淀粉粒。髓部组织区形态特征不明显。
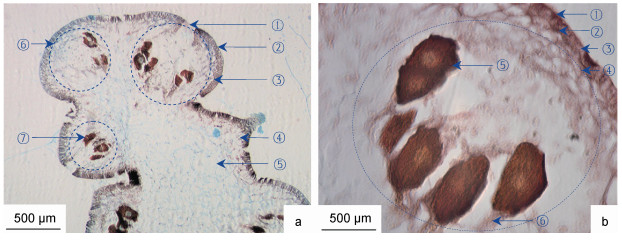 |
| 图 5 羊栖菜雌生殖托的横切组织形态 Fig. 5 Morphology of transverse tissue of S. fusiforme female receptacles 注: a. 10×10倍, ①雌生殖窝孔, ②表皮外皮层, ③表皮内皮层, ④近表皮细胞, ⑤皮层细胞, ⑥生殖窝, ⑦卵; b. 40×10倍, ①表皮外皮层; ②表皮内皮层; ③表皮细胞; ④生殖窝; ⑤卵; ⑥隔丝 |
羊栖菜雄生殖托横切面整体呈柱状, 横切组织由外向内分为表皮、生殖窝孔、生殖窝、精子、皮层组织和髓部组织区(图 6)。羊栖菜雄生殖托组织形态主要特征为: 表皮组织位于雄生殖托最外层, 由单层细胞构成, 宽度为(192.71±19.95) μm, 具表皮外皮层和表皮内皮层; 表皮细胞壁着色最深, 呈栅栏状排列。生殖窝孔嵌合于表皮当中; 生殖窝呈球状分布于表皮内的皮层当中, 大小为(868.06±156.71) μm, 窝与窝间隔排列, 中间着生皮层组织; 精子个体较小, 蝌蚪状, 数量较多, 全长约(200.09±33.23) μm, 尾部着生于生殖窝侧壁。皮层细胞具典型植物多边形细胞形态特征, 腔内富含淀粉粒。髓部细胞位于形态学中心部位, 直径为(538.46±40.70) μm, 细胞致密, 细胞腔小于皮层细胞腔, 腔内富含淀粉粒。
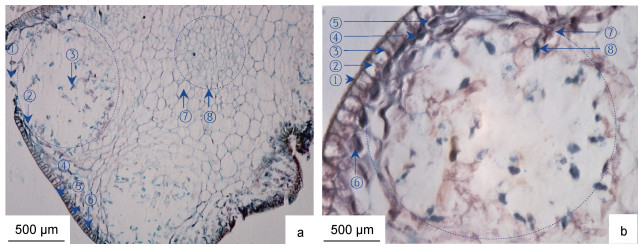 |
| 图 6 羊栖菜雄生殖托的组织形态 Fig. 6 Morphology of transverse tissue of S. fusiforme male receptacles 注: a. 10×10倍, ①雄生殖窝孔, ②生殖窝, ③精子, ④表皮外皮层, ⑤表皮细胞, ⑥表皮内皮层, ⑦皮层细胞, ⑧髓部组织区; b. 40×10, ①表皮外皮层, ②表皮细胞, ③表皮细胞壁, ④表皮内皮层, ⑤近表皮细胞, ⑥淀粉粒, ⑦生殖窝, ⑧精子 |
羊栖菜各器官横切形态、组织结构和组织宽度均有差异。羊栖菜各器官相同组织的形态相同或相近, 特征表现为: 表皮组织结构相同或相近, 均由单层致密的栅栏状细胞构成, 细胞壁着色最深, 侧壁增厚延伸至近表皮组织, 表皮厚度顺序为: 雄生殖托(200—214.3 μm) > 茎(110—180 μm) > 雌生殖托(42.85—114.3 μm) > 气囊(42.9—57.1 μm) > 叶(37.5—50.0 μm) > 假根(30.3—45.5 μm)。羊栖菜器官表皮呈单层、致密的细胞结构特征, 与王素娟(1991)、沈颂东等(2001)等观察的结果相同。羊栖菜表皮结构特征与羊栖菜适应潮间带生活、栽培浮水生活相符。自然环境下, 通过表皮脂双层作用, 有效调控蒸腾速率或复水速率, 保护皮层细胞过度蒸腾或吸胀吸水伤害。羊栖菜茎和叶极具水生植物组织结构特征, 其胞间隙极发达, 可贮存大量空气, 并在体内相互沟通, 供给藻体生活所需CO2和O2等。
羊栖菜器官近表皮细胞淀粉粒含量最多, 皮层淀粉粒含量最少, 该特征与张华芳(2005)对羊栖菜茎组织观察结果相同。皮层组织细胞腔最大, 具有四边形、五边形或六边形等典型植物细胞形态特征, 但幼孢子体茎皮层和髓部细胞形态呈卵圆形或圆形, 不具有成熟孢子体茎皮层细胞的多边形形态特征。髓部多数细胞腔较小、少数细胞腔较大, 嵌合于致密的髓部细胞组织当中。羊栖菜各器官之间的组织形态差异特征表现为: 假根、茎、叶、气囊、雌生殖托和雄生殖托器官横切组织形状分别为圆形、近圆形、锥形、圆环形、近椭圆形和近圆形; 假根、茎、叶、雌生殖托和雄生殖托器官横切组织由外向内分别为表皮、近表皮、皮层和髓部组织区, 其中, 雌、雄生殖托还包括生殖窝、卵及精子结构; 气囊的组织形态结构与其它器官不同, 由外向内分别为表皮、近表皮、皮层和内表皮组织区结构, 无髓部组织, 但具有内皮层结构。
3.2 基于羊栖菜假根组织形态特征的生理生态学功能羊栖菜假根在起到固着作用的同时, 还具有分化再生幼孢子体的生殖功能(林立东等, 2020)。有关羊栖菜组织培养研究表明, 羊栖菜的叶、假根和茎器官部分组织诱导后能够形成块状愈伤组织, 可继代培养, 含色素的愈伤组织可再生幼孢子体, 而分化再生幼孢子体的细胞来源于表皮细胞、近表皮细胞和皮层色素含量较高的细胞(沈颂东等, 2001; 殷明焱, 2005)。羊栖菜假根表皮组织结构与茎、叶和生殖托相同, 具表皮外皮层和表皮内皮层结构, 表皮细胞呈栅栏状排列结构, 这种结构可能与羊栖菜干出状态减缓水分过度流失及干出后复水缓慢吸水, 避免近表皮细胞、皮层细胞和髓部细胞损伤有关。髓部细胞腔普遍较小, 但细胞腔淀粉含量较多, 这种组织结构特征可能与假根的居尖生长特征相符, 即: 通过髓细胞的伸长生长、分裂和增殖, 实现假根的增粗和伸长。羊栖菜假根无性生殖幼孢子体有两种方式, 一种方式为根尖分生组织周缘区部位的表皮细胞向外增生为叶原基, 再发育成叶, 使得假根直接分化为幼孢子体, 另一种方式为根尖分生组织周缘区部位的表皮细胞、近表皮细胞或近表皮皮层细胞向外增生, 发育为幼孢子体。假根的无性生殖特征, 充分体现了假根细胞较强的植物细胞全能性(朱仲嘉等, 1992; 殷明焱, 2005)。
3.3 基于羊栖菜茎组织形态特征的生理生态学功能羊栖菜茎亚细胞结构的淀粉、微量元素与重金属元素、植物激素及响应低盐胁迫代谢物质变化的部位不同。羊栖菜仅有单一主茎, 其次为一级、二级、三级和四级测生茎, 均呈现居尖生长特征(林立东等, 2020)。羊栖菜茎表皮、近表皮和皮层色素含量较多细胞的全能性较强。沈颂东等(2001)关于羊栖菜茎部愈伤组织再生苗的解剖学研究结果表明, 羊栖菜茎近表皮细胞层首先可以生成愈伤组织, 后逐渐形成愈伤组织皮层和髓部组织, 再分化生成幼孢子体。
张华芳(2005)对羊栖菜茎横切观察表明, 茎表皮细胞和近表皮细胞富含大小不一、形态各异, 有的多个聚集成团, 外包裹浅黄色物质的“载色体”。目前, 尚无有关“载色体”成分的研究报道, 本文根据“载色体”的形态和细胞内分布特征初判为带有显色物质的淀粉粒。赵艳芳等(2013)关于羊栖菜中微量元素的亚细胞分区分布研究表明, Cu、Fe、Mn、Zn、Mg、Ca、Al、Cd、Pb等微量元素和重金属元素主要分布在茎和叶的细胞壁中, 其中Mg、Ca、Mn、Cu、Pb的分布特征相同, 为细胞壁 > 液泡 > 细胞器, Fe和Al的分布特征相同, 为细胞壁 > 细胞器 > 液泡, Cd和Zn在细胞器和液泡中均有分布(赵艳芳等, 2013)。李艳等(2014)关于羊栖菜主分枝、侧分枝、初生叶、次生叶和茎等5部位10种植物激素的研究表明, 吲哚乙酸(IAA)在羊栖菜茎中含量最高, 为4 041.431 ng/g, 脱落酸(ABA)主要分布于主分枝中, 含量达1 469.515 ng/g, 独角金内脂(SL)在主分枝中含量最高, 为534.833 ng/g (李艳等, 2014)。
3.4 基于羊栖菜叶组织形态特征的生理生态学功能羊栖菜叶器官主要呈现于幼孢子体生长发育期, 具平缘叶、齿缘叶和棒形叶三种形态(林立东等, 2020)。羊栖菜叶中微量元素的亚细胞分区分布特征与茎相同(赵艳芳等, 2013)。羊栖菜次生叶中茉莉酸和水杨酸的含量较高, 分别为259.983 ng/g和314.855 ng/g, 赤霉素在次生叶和茎中的含量较高, 分别为24.023 ng/g和18.242 ng/g (程铭恩等, 2019)。
羊栖菜的捕光色素复合体主要分布于器官表皮细胞, 通过捕光色素复合体捕捉光能, 进行光合作用, 为体细胞生长、发育和繁殖提供物质基础。羊栖菜对不同光强和光源的生理响应不同。Zou等(2015)关于重金属铜胁迫羊栖菜蛋白质组的变化研究表明, 色素体大部分存在于叶表皮, 并随表皮至皮层厚度加深, 叶绿素(chlorophyll)含量逐渐降低。Sugawara等(2006)有关褐藻岩藻黄素的研究报道表明, 褐藻岩藻黄素和叶绿素共同组成高效捕光复合物, 利于褐藻适应水环境中弱光条件的光合作用。Xie等(2016)对低盐和高盐海水短期浸泡对羊栖菜光合作用和叶黄素循环的影响研究表明, 110 µE/(m2 s)光照(低光)条件下, 90盐度海水处理对羊栖菜PSII有效量子产率影响显著, 淡水中处理1 h后, PSII有效量子产率也不降低。在800 µE/(m2 s)光照(高光)条件下, 光保护机制在淡水浸泡的叶片中有效发挥作用, PSII的量子产量在修复期得到恢复。相反, 90盐度海水处理的叶片不能承受高光照, 并积累很少的花青素和玉米黄质, 正常盐度海水修复期, 叶片的PSII量子产量受到严重抑制(Xie et al, 2016)。李科(2017)运用单色LED光源(白光、红光、绿光、蓝光和传统荧光)对羊栖菜比生长速率、叶绿素a (chl a)、类胡萝卜素(Car)和可溶性蛋白的研究表明, 羊栖菜置于白光培养条件的比生长速率最高, 置于蓝光培养条件下的chl a含量最高, 置于白光、红光、绿光和蓝光培养条件下的Car差异不显著, 但显著高于传统荧光, 置于蓝光培养条件下的可溶性蛋白含量最高, 且与传统荧光可溶性蛋白含量存在显著差异。
水温是羊栖菜光合作用、繁殖发育和生理代谢的主要影响因子。适宜羊栖菜生长的水温为4—25 ℃ (曾呈奎, 2000)。15—25 ℃范围内, 羊栖菜藻体chl a的含量随温度升高而升高, 20 ℃达到峰值, 超过25 ℃时chl a的含量会迅速下降, 至30 ℃时, chl a将逐渐分解(孟庆俊等, 2010)。Zou等(2005)对羊栖菜叶和生殖托的光合作用特征研究表明, 10—30 ℃温度范围内, 低光辐射条件下, 羊栖菜叶和生殖托能够保持相对稳定的光合效率, 而40 ℃温度条件下, 羊栖菜叶和生殖托对高光强的利用越来越有效(Zou et al, 2005)。Liu等(2020)关于高温胁迫对羊栖菜叶代谢组影响的研究表明, 27 ℃和32 ℃高温胁迫处理7 d, 抑制了叶片的叶绿素含量, 增加了电解质渗漏(Liu et al, 2020)。
羊栖菜叶形不同, 干出与沉水的光合作用耐受力不同。邹定辉等(2004)关于干出状态下羊栖菜的光合作用特性研究表明, 羊栖菜的光合活性与叶的形态学有关, 具有柱状分枝的海藻, 干出状态下比在海水状态下表现出较低的光合活性, 而叶状形态的海藻, 则在干出状态下有更高的光合活性。呼吸活性在海水和干出两种状态下相近, 表明呼吸作用有关过程(如呼吸作用相关的酶活性)对环境状态的敏感性较小。干出状态下海藻叶状体表面的高pH值成为大气CO2溶入水膜的动力。CO2在胞外碳酸酐酶的作用下, 转化为HCO3-, HCO3-扩散至藻细胞表面, 又在碳酸酐酶的作用下转化为CO2, 然后CO2以扩散作用的方式通过细胞壁、质膜、胞质溶胶以及叶绿体被膜, 最后进入叶绿体基质而被Rubisco所固定(邹定辉等, 2004)。王龙乐等(2017)关于羊栖菜叶状体与生殖托干出脱水及沉水条件下的荧光特性研究表明, 羊栖菜叶状体具有很高的干出脱水耐受力, 这种耐受力高于生殖托。
3.5 基于羊栖菜气囊组织形态特征的生理生态学功能羊栖菜的气囊由叶片特化生成, 由皮层细胞加厚, 中央髓部细胞逐渐分离形成囊腔, 囊腔内贮存空气或CO2、O2等(冯德培等, 1982)。目前, 有关气囊的生理生态学方面的研究暂无相关文献报道。本文根据气囊的组织形态结构特征推测, 气囊在参与光合作用和呼吸作用的同时, 也参与增加藻体浮力, 使得藻体适应浮水生活。羊栖菜气囊腔内含空气或CO2、O2的特征, 使得羊栖菜即使处于避光、低温及密闭隔离空气条件, 也可以通过内皮层细胞选择吸收腔内的CO2和O2, 短期内保持藻体生命力。
3.6 基于羊栖菜生殖托组织形态特征的生理生态学功能羊栖菜雌雄异株, 生殖器官为生殖托, 包括雌生殖托和雄生殖托, 雌生殖托产生卵细胞, 雄生殖托产生精子(林立东等, 2020)。关于羊栖菜生殖托离体培养的初步研究表明, 22 ℃、2 300 lx光强、8 h︰16 h光周期条件下, 离体培养的雌生殖托可完成性成熟, 完成全部排卵的生殖托在培养至第20 d时开始腐烂。邹定辉等(2010)关于羊栖菜离体生殖托低温超低温的保存研究表明, 离体生殖托超低温和冰冻条件下保存不理想, 而干出状态(避免失水)的生殖托在5 ℃条件下可以保存30 d, 其代谢活性、细胞相对活力及配子释放能力均较好。王龙乐等(2017)关于羊栖菜叶状体与生殖托干出脱水及沉水条件下的荧光特性研究表明, 雌生殖托的干出脱水的耐受力高于雄生殖托, 半脱水状态下不影响生殖托的PSII活性, 而大幅度脱水将严重降低生殖托的PSII活性, 且损伤不可逆。上述研究表明, 离体生殖托可通过表皮、近表皮和皮层细胞进行光合作用及营养物质选择吸收, 维持自身生长发育所需的养分和养料。上述研究表明, 羊栖菜生殖托可离体培养, 过度失水将导致表皮、近表皮和皮层组织细胞损伤, 致使主要光合作用场所——表皮中的PSII活性不可逆损伤。
4 结论羊栖菜假根、茎、叶和生殖托(雌托和雄托)器官组织结构相同, 均包括表皮、近表皮、皮层和髓部组织区。气囊的组织形态结构与其它器官不同, 由外向内分别为表皮、近表皮、皮层和内表皮组织区结构, 无髓部组织, 但具有内皮层结构。羊栖菜各器官表皮细胞呈栅栏状排列结构, 淀粉粒含量丰富, 近表皮、皮层和髓部细胞淀粉粒含量相对较少。羊栖菜幼孢子体茎皮层和髓部组织细胞呈卵圆形或圆形形态特征, 不具有成熟孢子体茎皮层和髓部细胞的多形植物细胞形态结构特征。
羊栖菜假根、茎和叶的表皮、近表皮和皮层色素含量较多细胞的植物细胞全能性较强, 可分生愈伤组织, 诱导生成幼孢子体。羊栖菜各器官表皮为光合作用主要场所, 富含光合色素复合体、chl a和岩藻黄素, 其次为近表皮和皮层组织, chl a的含量受温度、光照及干出与复水等环境因子的变化而变化。叶的光合活性与形态有关, 其生长、光合色素含量及可溶性蛋白的含量对白光、红光、绿光、蓝光等单色光源的响应与传统荧光不同。羊栖菜不同器官的植物激素含量不同, 次生叶中茉莉酸和水杨酸的含量较高, 茎和次生叶中赤霉素的含量较高。Cu、Fe、Mn、Zn、Mg、Ca、Al、Cd、Pb等微量元素和重金属元素主要分布于羊栖菜茎和叶细胞壁中, 其次为液泡和细胞器。
王龙乐, 张鑫, 邹定辉, 等. 2017. 干出脱水对羊栖菜叶状体与生殖托荧光特性的影响及其在沉水状态下的恢复. 生态学报, 37(22): 7710-7717 |
王素娟. 1991. 中国经济海藻超微结构研究. 杭州: 浙江科学技术出版社
|
冯德培, 谈家桢, 王鸣岐. 1982. 简明生物学词典. 上海: 上海辞书出版社, 175-176
|
朱仲嘉, 谭立佐, 翟世宽. 1992. 羊栖菜马尾藻组织培养芽生苗. 水产学报, 16(3): 275-277 |
李科, 2017. 单色LED光源对大型海藻生理生化特性的影响研究. 杭州: 浙江大学硕士学位论文
|
李艳, 徐继林, 郑立洋, 等. 2014. 高效液相色谱—三重四极杆质谱法同时测定羊栖菜5个部位中10种植物激素含量. 色谱, 32(8): 861-866 |
邹定辉, 阮祚禧, 陈伟洲. 2004. 干出状态下羊栖菜的光合作用特性. 海洋通报, 23(5): 33-39 DOI:10.3969/j.issn.1001-6392.2004.05.005 |
邹定辉, 高坤山. 2010. 羊栖菜离体生殖托低温超低温的保存. 水产学报, 34(6): 761-775 |
沈颂东, 崔竞进, 刘涛, 等. 2001. 羊栖菜茎部愈伤组织再生苗的解剖学研究. 青岛海洋大学学报, 31(1): 85-88 DOI:10.3969/j.issn.1672-5174.2001.01.007 |
张华芳. 2005. 羊栖菜的生药学研究. 时珍国医国药, 16(2): 128 DOI:10.3969/j.issn.1008-0805.2005.02.027 |
林立东, 尚天歌, 张甜甜, 等. 2020. 褐藻羊栖菜繁殖生物学特征和生活史流程的补充研究. 水产学报, 44(4): 581-595 |
孟庆俊, 王华芝, 陈暖, 等. 2010. 环境因子对羊栖菜氮磷吸收速率、生长速率和叶绿素a含量的影响. 海洋环境科学, 29(5): 723-727 DOI:10.3969/j.issn.1007-6336.2010.05.024 |
赵艳芳, 尚德荣, 宁劲松, 等. 2013. 羊栖菜中微量金属元素的亚细胞分区分布. 渔业科学进展, 34(6): 118-123 DOI:10.3969/j.issn.1000-7075.2013.06.018 |
南春容, 张鹏, 林少珍, 等. 2015. 温州羊栖菜(Hizikia fusiformis)野生与选育种群ISSR遗传研究. 浙江农业学报, 27(2): 234-239 DOI:10.3969/j.issn.1004-1524.2015.02.18 |
徐佳丽, 骆其君, 严小军. 2014. 浙江洞头不同品系羊栖菜的栽培性状及ISSR分析. 海洋学研究, 32(2): 74-79 |
殷明焱, 2005. 组织培养保存大型海藻种质的研究. 青岛: 中国科学院研究生院(海洋研究所)博士学位论文
|
黄冰心, 丁兰平, 栾日孝, 等. 2015. 中国海洋褐藻门新分类系统. 广西科学, 22(2): 189-200 DOI:10.3969/j.issn.1005-9164.2015.02.012 |
程铭恩, 彭华胜. 2019. 建立"形态-结构-功能"联系观提升药用植物显微形态教学. 药学教育, 35(4): 52-55 |
曾呈奎. 2000. 中国海藻志-第三卷-第二册-褐藻门, 墨角藻目. 北京: 科学出版社
|
Dias M I, Sousa M J, Alves R C et al, 2016. Exploring plant tissue culture to improve the production of phenolic compounds: A review. Industrial Crops and Products, 82: 9-22 DOI:10.1016/j.indcrop.2015.12.016 |
Huang S M, Lin G, 2015. Biosorption of Hg(Ⅱ) and Cu(Ⅱ) by biomass of dried Sargassum fusiforme in aquatic solution. Journal of Environmental Health Science & Engineering, 13: 21 |
Jiang H, Zou D H, Lou W Y et al, 2019. Effects of CO2 supply on growth and photosynthetic ability of young sporophytes of the economic seaweed Sargassum fusiforme (Sargassaceae, Phaeophyta). Journal of Applied Phycology, 31: 615-624 DOI:10.1007/s10811-018-1569-0 |
Lee S H, Park C H, 2012. Biosorption of heavy metal ions by brown seaweeds from southern coast of Korea. Biotechnology and Bioprocess Engineering, 17: 853-861 DOI:10.1007/s12257-011-0578-5 |
Li J Y, Liu Y C, Liu Y et al, 2019. Effects of temperature and salinity on the growth and biochemical composition of the brown alga Sargassum fusiforme (Fucales, Phaeophyceae). Journal of Applied Phycology, 31: 3061-3068 DOI:10.1007/s10811-019-01795-9 |
Li Y J, Fu X T, Duan D L et al, 2018. Comparison study of bioactive substances and nutritional components of brown algae Sargassum fusiforme strains with different vesicle shapes. Journal of Applied Phycology, 30: 3271-3283 DOI:10.1007/s10811-018-1543-x |
Liu L J, Lin L D, 2020. Effect of heat stress on Sargassum fusiforme leaf metabolome. Journal of Plant Biology, 63: 229-241 DOI:10.1007/s12374-020-09247-5 |
Ma Z L, Lin L D, Wu M J et al, 2018. Total and inorganic arsenic contents in seaweeds: Absorption, accumulation, transformation and toxicity. Aquaculture, 497: 49-55 DOI:10.1016/j.aquaculture.2018.07.040 |
Ma Z L, Wu M J, Lin L D et al, 2017. Allelopathic interactions between the macroalga Hizikia fusiformis (Harvey) and the harmful blooms-forming dinoflagellate Karenia mikimotoi. Harmful Algae, 65: 19-26 DOI:10.1016/j.hal.2017.04.003 |
Qian W G, Li N, Lin L D et al, 2016. Parallel analysis of proteins in brown seaweed Sargassum fusiforme responding to hyposalinity stress. Aquaculture, 465: 189-197 DOI:10.1016/j.aquaculture.2016.08.032 |
Shang T G, Lin L D, Chen B B et al, 2020. Cell density-dependent suppression on the development and photosynthetic activities of Sargassum fusiformis embryos by dinoflagellate Karenia mikimotoi. Harmful Algae, 96: 101842 DOI:10.1016/j.hal.2020.101842 |
Shin W S, Kim Y K, 2014. Biosorption characteristics of heavy metals (Ni2+, Zn2+, Cd2+, Pb2+) from aqueous solution by Hizikia fusiformis. Environmental Earth Sciences, 71: 4107-4114 DOI:10.1007/s12665-013-2799-8 |
Sugawara T, Matsubara K, Akagi E et al, 2006. Antiangiogenic activity of brown algae fucoxanthin and its deacetylated product, fucoxanthinol. Journal of Agricultural and Food Chemistry, 54(26): 9805-9810 DOI:10.1021/jf062204q |
Sun Y H, Chen X L, Liu S et al, 2018. Preparation of low molecular weight Sargassum fusiforme polysaccharide and its anticoagulant activity. Journal of Oceanology and Limnology, 36(3): 882-891 DOI:10.1007/s00343-018-7089-6 |
Wu M J, Wu Y, Qu M et al, 2013. Evaluation of antioxidant activities of water-soluble polysaccharides from brown alga Hizikia fusiformis. International Journal of Biological Macromolecules, 56: 28-33 DOI:10.1016/j.ijbiomac.2013.01.017 |
Wu X D, Jiang W, Lu J J et al, 2014. Analysis of the monosaccharide composition of water-soluble polysaccharides from Sargassum fusiforme by high performance liquid chromatography/electrospray ionisation mass spectrometry. Food Chemistry, 145: 976-983 DOI:10.1016/j.foodchem.2013.09.019 |
Xie X J, Wang X L, Lin L D et al, 2016. Effects of hypo- and hypersalinity on photosynthetic performance of Sargassum fusiforme (Fucales, Heterokontophyta). Photosynthetica, 54(2): 210-218 DOI:10.1007/s11099-015-0169-3 |
Yadav V, Arif N, Kováč J et al, 2021. Structural modifications of plant organs and tissues by metals and metalloids in the environment: A review. Plant Physiology and Biochemistry, 159: 100-112 DOI:10.1016/j.plaphy.2020.11.047 |
Yao J T, Shuai L, Li S Y et al, 2019. Genetic analysis of selected Sargassum fusiforme (Harvey) Setchell (Sargassaceae, Phaeophyta) strains with RAPD and ISSR markers. Journal of Oceanology and Limnology, 37(3): 783-789 DOI:10.1007/s00343-019-8140-y |
Zhao C X, Shao H B, Chu L Y, 2008. Aquaporin structure-function relationships: Water flow through plant living cells. Colloids and Surfaces B: Biointerfaces, 62(2): 163-172 DOI:10.1016/j.colsurfb.2007.10.015 |
Zou D H, Gao K S, 2004. Comparative mechanisms of photosynthetic carbon acquisitionin Hizikia fusiforme under submersed and emersed conditions. Acta Botanica Sinica, 46(10): 1178-1185 |
Zou D H, Gao K S, 2005. Photosynthetic characteristics of the economic brown seaweed Hizikia fusiforme (Sargassaceae, Phaeophyta), with special reference to its "leaf" and receptacle. Journal of Applied Phycology, 17: 255-259 DOI:10.1007/s10811-005-5768-0 |
Zou H X, Pang Q Y, Zhang A Q et al, 2015. Excess copper induced proteomic changes in the marine brown algae Sargassum fusiforme. Ecotoxicology and Environmental Safety, 111: 271-280 DOI:10.1016/j.ecoenv.2014.10.028 |
 2021, Vol. 52
2021, Vol. 52


