
中国海洋湖沼学会主办。
文章信息
- 吴含, 肖逸林, 柴光俊, 宋倩倩, 李志勇. 2021.
- WU Han, XIAO Yi-Lin, CHAI Guang-Jun, SONG Qian-Qian, LI Zhi-Yong. 2021.
- 变异轴孔珊瑚(Acropora valida)对酸化高温胁迫的转录组水平反应及恢复潜力分析
- TRANSCRIPTOMIC RESPONSE AND THE RECOVERY POTENTIAL OF ACROPORA VALIDA TO ACIDIC-THERMAL STRESS
- 海洋与湖沼, 52(4): 1058-1066
- Oceanologia et Limnologia Sinica, 52(4): 1058-1066.
- http://dx.doi.org/10.11693/hyhz20210100019
文章历史
-
收稿日期:2021-01-21
收修改稿日期:2021-03-25
大气二氧化碳浓度升高将会导致海洋酸化和高温, 从而加剧珊瑚礁的衰退(Hoegh-Guldberg et al, 2007, 2010; Pandolfi et al, 2011)。通过对珊瑚在海洋酸化和高温影响下基因表达模式的研究, 国内外研究人员发现了一些胁迫响应特征(DeSalvo et al, 2008; Rodriguez-Lanetty et al, 2009; Moya et al, 2012; Barshis et al, 2013; Maor-Landaw et al, 2014); 截至目前, 对珊瑚在高温和酸化胁迫下的响应机制(尤其是分子机制)的研究大多聚焦单一胁迫, 很少关注双胁迫同时存在的情况(Li et al, 2009; Swan et al, 2017)。其中Barshis等(2013)对珊瑚热胁迫的响应做了分析, Moya等(2015)对珊瑚在二氧化碳引起的酸化引起的转录本变化进行了探索, Kaniewska等(2015)则对珊瑚在同时酸化高温下的响应做了研究。海洋酸化和高温胁迫造成的损伤是否可逆能为胁迫后珊瑚礁的恢复的研究提供了基础, 对珊瑚礁的保护有及其重要的意义。但是, 基于转录组的珊瑚在胁迫处理后的恢复潜力研究仍十分匮乏。
作为造礁石珊瑚的重要分支, 鹿角珊瑚科中的变异轴孔珊瑚主要分布在印度洋-太平洋海域的大陆架中部及近海礁。根据Sakai等(2019)的报道, 变异轴孔珊瑚更容易因温度的影响而白化甚至死亡。在此之前, 关于酸化高温对珊瑚影响的研究往往只局限在胁迫下珊瑚的代谢、生物钟控制及氧化应激等方面的变化(Kaniewska et al, 2015), 却没有关于珊瑚在胁迫去除后转录水平能否恢复的研究。本研究从转录水平对变异轴孔珊瑚在酸化高温胁迫下和胁迫去除后珊瑚基因表达变化进行了分析, 探究该珊瑚能否在胁迫去除后恢复其生理功能。研究结果既有助于揭示全球气候变化下珊瑚的响应机制, 也可为因酸化高温胁迫损害的珊瑚的恢复提供理论依据。
1 材料与方法 1.1 样本采集变异轴孔珊瑚于2013年采自南海徐闻珊瑚礁国家自然保护区(20°15′29″N, 109°54′28″E)。所有珊瑚采自同一珊瑚礁盘, 采集后立即转入养殖设备(海水温度: 26 ℃, 盐度: 33; pH=8.1, 海水流速: 约30 L/h)进行适应性养殖7 d。之后, 健康珊瑚块被用作酸化与高温胁迫实验。
1.2 模拟实验及取样10块珊瑚被随机分到两个不同培养条件(对照处理, 酸化高温处理)的培养箱(100 L)。胁迫处理组的温度和pH在3 d内逐渐变化直到最终条件。pH≈7.7对应的二氧化碳浓度符合政府间气候变化专门委员会(IPCC)预测的2060—2099年达到的峰值。高温处理的最终温度为32 ℃是珊瑚白化阈值。对照维持在约26 ℃、pH≈8.1。酸度调节通过加入二氧化碳并通过pH控制器调节, 温度通过加热器控制。光照循环为12 h︰12 h。酸化高温胁迫处理6 d后取样作为处理组样品, 同时对照组取样作为对照组1; 处理组样品在酸化与高温胁迫去除后再培养9 d取样作为恢复组样品, 同时对照组取样作为对照组2。以上四次取样均至少三个生物样品重复。取样时将珊瑚块从池中取出, 在4 ℃下切成小块, 在10倍体积的RNA later (中国东胜)中孵育过夜, 之后在–80 ℃的条件下保存。
1.3 RNA提取及测序珊瑚样本在液氮中研磨, 采用RNeasy Plant Mini Kit (QIAGEN)提取珊瑚总RNA。纯化后的RNA通过SuperScript First-Strand Synthesis Kit转化为cDNA [共计12个, 处理组(TAH) 3个, 恢复组(PAH) 3个, 对照组1 (C1) 3个, 恢复组(C2) 3个]。cDNA样本使用量子位2.0荧光计进行定量并用0.8%的琼脂糖凝胶检测cDNA的质量。总共获得了12个cDNA文库, 测序在Illumina HiSeq 2500平台上进行, 使用2×125 bp双端配置。
1.4 测序数据处理将12个文库的原始数据使用FastQC软件评估测序质量, 并用Trimmomatic v0.36软件去除质量低的片段及RNA接头。通过bowtie2-2.2.8软件与构建的rRNA数据库检测并去除rRNA序列。其中, rRNA数据库包含了SILVA和RDP的核糖体RNA的序列, 并通过CD-hit软件以“最小相似度=99%”为标准消除rRNA数据库的序列冗余; 匹配长度大于30 bp的序列被认为是核糖体RNA并去除。清洁后的数据使用SOAPdenovo-Trans和KREATION软件进行从头拼接并产生一个单独contig长度大于300 bp的参考转录组。利用bowtie 2-2.2.8软件将所得文库与参考转录组进行比对, 然后导入SAMtools-1.5.1软件以生成已排序的文件。之后, 通过软件eXpress-1.3.0对转录本表达丰度进行定量, 获取转录本表达计数和FPKM值。
1.5 珊瑚转录本的鉴定和注释利用已报道的刺胞动物基因组数据(Acropora millepora, Acropora digitifera, Exaiptasia pallid, Nematostella vectensis和Orbicella faveolata)建立刺胞动物数据库, 并将参考转录本用blastn与刺胞动物基因组数据库比对, 取eValue < 1e-10的转录本为珊瑚转录本。对于鉴定到的珊瑚转录本, 使用blastx对其进行基因本体(GO)和Swiss-Prot蛋白数据库注释(E-value < 1e-5)。
1.6 差异表达分析及主成分分析差异表达分析通过Deseq2软件完成, 12个文库的所有比对到珊瑚的转录本通过DEseq2进行归一化, 对处理组和对照组1之间、恢复组与对照组2之间、恢复组与处理组之间和两个对照组之间进行了差异表达分析, 以adjusted P < 0.01和log2(差异表达倍数) > ±1作为阈值筛选差异转录本, 差异表达基因热图使用FPKM值进行Z-score换算后作出。对Deseq2归一化的数据进行主成分分析。
1.7 GO富集分析使用topGO对变异轴孔珊瑚的差异表达转录本进行差异表达分析, 以P < 0.001作为显著富集的阈值。
1.8 序列登录号珊瑚宏转录组原始序列信息已提交NCBI SRA数据库, Bio Project编号为PRJNA402085。
2 结果 2.1 珊瑚转录组构建本研究构建了处理组(TAH)、恢复组(PAH)与两个对照组(C1, C2)的12个cDNA文库, 总共产生了451 789 689个双端片段。在去除质量低的片段、接头和rRNA后, 总共获得了231 447 741个清洁的片段。通过从头拼接, 总共获得了1 056 727个转录本。通过与刺胞动物基因组数据库比对, 总共有913 766个(86.5%)转录本能与刺胞动物基因组数据库比对上。利用Swiss-Prot和基因本体(GO)数据库对珊瑚来源的转录本进行注释, 得到了96 060个(10.5%)被Swiss-prot注释到的转录本和130 979个(14.3%)被GO数据库注释到的转录本。
2.2 胁迫与恢复组的珊瑚转录本表达模式比较对变异轴孔珊瑚(Acropora valida)的转录本进行了主成分分析(PCA, 图 1a)。结果显示, 珊瑚转录本的表达在四个组间有明显的差异。其中, 对照组1 (C1)与对照组2 (C2)之间距离最近, 处理组(TAH)距离对照组1 (C1)最远; 而恢复组(PAH)珊瑚转录本表达有向两个对照组靠近的趋势。为了揭示珊瑚在酸化高温处理下发生显著变化的转录本, 我们对不同组别之间(C1 vs C2, TAH vs C1, PAH vs C2, PAH vs TAH)的珊瑚转录组进行了差异表达分析, 发现对照组1与对照组2之间总共470个转录本发生了差异表达, 这表明在没有任何胁迫的情况下, 培养时间长短也会对珊瑚的转录本表达产生影响。为了去除由培养时间带来的转录本表达变化, 我们在分析其它组别(TAH vs C1, PAH vs C2, PAH vs TAH)之间的转录本差异表达时将这470个转录本排除在外(图 1b)。珊瑚的处理组与对照组1相比(TAH vs C1)有6 328个转录本的表达发生了显著性变化, 恢复组与对照组2 (PAH vs C2)之间有794个转录本的表达发生显著性变化, 而在恢复组与处理组之间有5 182个显著变化的转录本。同时, 有123个转录本同时在处理组与对照组1之间和恢复组与对照组之间2都表现出显著性差异; 而处理组差异表达的转录本中有2 831个转录本在恢复组与处理组之间存在表达量的显著差异。
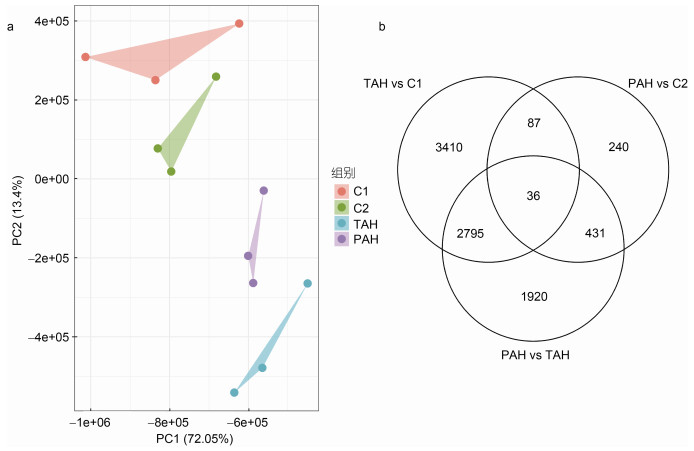 |
| 图 1 珊瑚转录本表达概况分析 Fig. 1 Gene expression profile 注: a. 转录本表达主成分分析; b. 三个组别之间的差异表达转录本韦恩图。差异转录本统计时去除了处理对照与胁迫对照组之间的差异表达转录本, C1. 对照组1, TAH. 处理组, C2. 对照组2, PAH. 恢复组。vs代表比较, 如TAH vs C1表示处理组与对照组1的比较 |
对处理组和对照组差异表达的转录本进行聚类分析(图 2a), 结果显示, 处理组(TAH)的转录本表达聚为一枝, 而对照组1 (C1)、对照组2 (C2)、恢复组(PAH)这三个组的9个样本聚为另一枝。在处理组中, 有6 328个转录本相对对照组差异表达, 这些转录本在恢复组中只有123个还存在显著的差异表达; 而其他的6 205个(98.1%)转录本的表达水平相对于对照组都已经不再表现出显著差异。
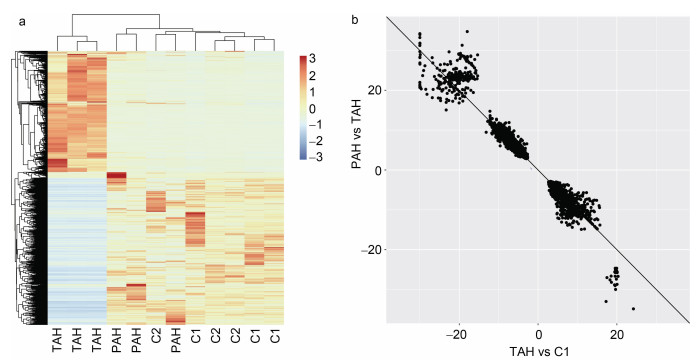 |
| 图 2 差异表达转录本分析 Fig. 2 Analysis of differently expressed genes 注: a. 珊瑚胁迫处理6 d差异表达转录本的表达热图; b. 2 831个在处理组与对照组1比较, 恢复组与处理组比较都差异表达的转录本的log2差异表达倍数散点图。X轴: 处理组与对照组1比较, Y轴: 处理组与恢复组比较。差异转录本统计时去除了处理对照与胁迫对照组之间的差异表达转录本, C1. 对照组1, TAH. 处理组, C2. 对照组2, PAH. 恢复组。vs代表比较, 如TAH vs C1表示处理组与对照组1的比较。色块数值为DEseq2归一化后的表达数所对应的Z-score |
在恢复组相对处理组(PAH vs TAH)差异表达的转录本中, 有2 831个转录本同时也在处理组中表现出相对于对照组2 (TAH vs C2)的显著性变化。对这2 831个转录本在这两次比较中的差异表达倍数进行散点图分析(图 2b)发现所有点均分布在二、四象限, 这表明在处理组中上调的转录本在恢复处理后表达下调, 而处理组中下调的转录本在恢复处理后表达上调。
在6 205个表达能恢复的转录本中, 大量编码热休克蛋白的转录本在处理组中表达上调(图 3): 包括编码Endoplasmin (P08110=2)、内质网伴侣BIP (Q90593=2)、Hsp68 (Q97125=3)、Hsp70 (P08106=2, P11503, Q9I8F9, P0DMV8, P12078, P41826)、热休克同源70、71 kDa蛋白(P08108, Q90473=2)、Hsp-16.1 (P34696)、Hsp-16.2 (P06582=4)及分子伴侣蛋白Djb11 (Q6TUG0)、Djc3 (Q13217=2, Q9R0T3)、Djc19 (Q3ZBN8=2)等蛋白的转录本; 在恢复培养9 d之后, 这些热休克蛋白的表达与对照组相比不再表现出显著差异。
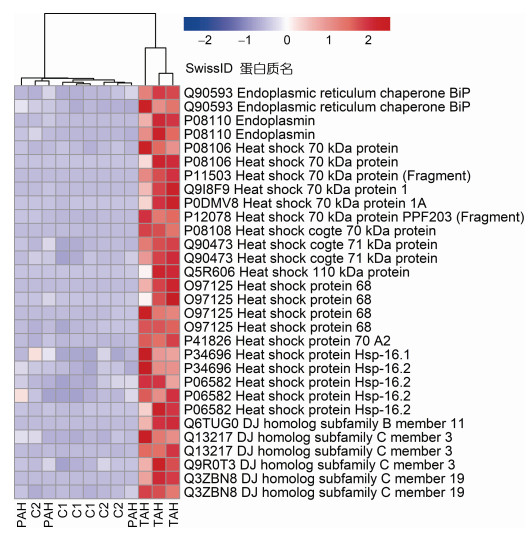 |
| 图 3 热休克蛋白表达热图 Fig. 3 Heatmap of genes encoding heat shock proteins 注: SwissID代表Swiss-Prot数据库编号, 蛋白质名是Swiss-Prot数据库注释到的蛋白名称。色块红色表示高表达, 蓝色表示低表达 |
细胞凋亡相关转录本在处理组也大量差异表达(表 1), 4个编码半胱天冬氨酸蛋白酶3 (caspase 3)的转录本显示出表达上调; 恢复组与处理组相比, 之前上调的四个CASP中有三个表达发现显著下调, 且最终CASP转录本的表达水平相对于对照组都没有差异表达。
| 转录本编号 | 平均表达量 | TAH vs C1 | PAH vs TAH | PAH vs C1 | PAH vs C2 | 蛋白 |
| 12093626 | 963.180 7 | 7.149 110 | –7.440 59 | ns | ns | caspase 3 |
| 20894237 | 234.460 4 | 3.850 034 | ns | ns | ns | caspase 3 |
| 6842791 | 335.478 4 | 3.637 498 | –4.282 49 | ns | ns | caspase 3 |
| 9164836 | 468.054 3 | 5.974 286 | –13.084 20 | ns | ns | caspase 3 |
| 注: 差异转录本统计时去除了处理对照与胁迫对照组之间的差异表达转录本, C1. 对照组1, TAH. 处理组, C2. 对照组2, PAH. 恢复组。vs代表比较, 如TAH vs C1表示处理组与对照组1的比较。ns代表没有显著变化 | ||||||
处理组表达显著下调的转录本中, 有大量编码物质转运蛋白的转录本(图 4)。其中脂质转运相关的蛋白(NPC1, SLC27)、氨基酸转运相关的溶质转运家族蛋白(SLC1, SLC6和SLC7)、碳酸氢根转运蛋白(SLC4, SLC26)、单羧酸转运蛋白(SLC16)、有机阳离子转运蛋白(SLC22, orct)、氨转运蛋白、糖转运相关蛋白(SLC2, SLC5和Tret), 锌离子转运蛋白(SLC39)都发生了明显的下调。
 |
| 图 4 编码物质转运相关蛋白的转录本表达热图 Fig. 4 Heatmap of genes encoding substrates transporting proteins 注: SwissID代表Swiss-Prot数据库编号, 蛋白质名是Swiss-Prot数据库注释到的蛋白名称。色块红色表示高表达, 蓝色表示低表达 |
与此同时, 编码钙离子ATP酶(PMCA3=3)的转录本表达下调, 且其他的钙离子转运相关蛋白, 包括电容性钙离子通道钙离子内流蛋白通道(CCE2)、钠/钙交换蛋白(NCL, NCL1)和钠钾钙交换蛋白5 (SLC24A5)也表现出表达下调(图 5)。碳酸氢根交换相关的转录本, 包括2个编码阴离子转运蛋白SLC4A2和3个编码SLC26A6蛋白的转录本, 也表现出表达下调。此外, 还有4个编码碳酸酐酶(carbonic anhydrase)的转录本在胁迫环境下表达下调。这些下调的转录本在胁迫去除后表达水平大都恢复到原来的水平, 恢复组表达聚类也和两个对照组聚在一起。
 |
| 图 5 珊瑚钙化相关转录本表达热图 Fig. 5 Heatmap of genes that related to coral biomineralization 注: SwissID代表Swiss-Prot数据库编号, 蛋白质名是Swiss-Prot数据库注释到的蛋白名称。色块红色表示高表达, 蓝色表示低表达 |
在恢复组中, 794个转录本相对对照组2显示差异表达, 其中有123个转录本在处理组中表现出相对胁迫对照组差异表达。因此, 这123个转录本被认为是胁迫去除后不能恢复的。通过GO富集, 这123个转录本分别富集到了5个生物学过程和5个分子功能条目。其中, 生物学过程均与离子跨膜运动相关; 而富集到的分子功能大多与代谢相关, 如有机磷酸代谢过程(GO: 0019637)、ATP代谢过程(GO: 0046034)、嘌呤核糖核苷三磷酸代谢过程(GO: 0009205)和三磷酸核糖核苷的代谢过程(GO: 0009199)。
3 讨论本研究采用RNAseq技术对变异轴孔珊瑚在酸化高温胁迫及恢复培养后的转录本表达变化进行了研究, 以探究珊瑚在胁迫去除后转录本表达能否恢复到原来水平。PCA分析显示, 在处理组和对照组1之间的距离最远; 而相比于处理组, 恢复组距离对照组1更近。同时, 我们发现变异轴孔珊瑚大部分(98.1%)在酸化高温胁迫处理下发生差异表达的转录本在胁迫去除后能恢复到原来的水平, 且部分转录本的表达模式在恢复组中与处理组中表现出相反的变化趋势。根据胁迫处理条件下差异表达转录本的丰度进行聚类分析, 恢复组和两个对照组聚为一枝且与处理组分属不同枝。这些结果表明, 总体而言, 在酸化与高温胁迫去除后, 变异轴孔珊瑚的差异表达的转录本表达能恢复到原来的水平的。
3.1 变异轴孔珊瑚热休克蛋白表达在胁迫去除后得到恢复热休克蛋白及其伴侣蛋白在蛋白质折叠、展开和降解过程中起着至关重要的作用(Sørensen et al, 2003), 是珊瑚热应激、高二氧化碳应激时的主要生物标志物(Black et al, 1984; DeSalvo et al, 2008; Moya et al, 2015), 其表达往往随着胁迫的产生而增高。在酸化高温处理下, 大量热休克蛋白表达上调(图 3), 表明该珊瑚正在经历胁迫, 并存在胁迫响应。在胁迫处理去除后, 这些在酸化高温胁迫下表达上调的热休克蛋白转录本不再表现出表达水平的显著差异, 表明在胁迫去除之后该珊瑚热休克蛋白的表达能恢复到原来的水平, 预示着胁迫去除后该珊瑚的整体胁迫响应有所缓解。
3.2 变异轴孔珊瑚细胞凋亡相关转录本表达在胁迫去除后得到恢复珊瑚细胞凋亡引起其共生虫黄藻释放被认为是珊瑚白化的一个重要原因(Weis, 2008)。凋亡相关的半胱天冬氨酸蛋白酶(caspase)在珊瑚白化的相关研究中多有报道(Kvitt et al, 2011; Tchernov et al, 2011); 在海洋酸化和高温的作用下, 珊瑚细胞死亡数也被发现有明显增高(Prada et al, 2017)。半胱天冬氨酸蛋白酶是一种天门冬氨酸特异性半胱氨酸蛋白酶, 在细胞凋亡中起重要作用, 而caspase 3是细胞凋亡的关键因子(Degterev et al, 2008)。编码caspase 3的转录本在在酸化高温胁迫处理下表达上调, 表明珊瑚在胁迫下细胞正在承受凋亡压力。在胁迫去除后, 凋亡相关转录本的表达水平与对照组没有显著差异。编码caspase 3的转录本表达水平的恢复表明, 变异轴孔珊瑚在经历酸化高温胁迫后细胞不再凋亡, 可能预示着珊瑚在胁迫下的凋亡现象在去除胁迫之后有所缓解。
3.3 变异轴孔珊瑚物质转运相关转录本表达在胁迫去除后得到恢复珊瑚的能量有部分来源于与其共生的虫黄藻。研究表明虫黄藻能为其共生刺胞动物提供葡萄糖、脂类、丙酮酸和氨基酸等营养物质(Von Holt et al, 1968; Kellogg et al, 1983; Burriesci et al, 2012)。处理组中变异轴孔珊瑚物质转运相关转录本的表达下调, 表明该珊瑚在酸化高温条件下其物质转运相关的功能受到严重抑制。而在恢复组中, 这些转录本的表达水平与对照组相比大多不再表现出显著性差异。同时, 转录本表达的聚类分析显示, 这些转录本在恢复组中的表达情况与在对照组1、对照组2中的表达情况聚为一枝, 而与处理组中的表达情况有明显区分: 这些结果暗示, 该珊瑚的包括糖转运、脂质转运、氨基酸转运、单羧酸转运和有机阳离子转运在内的物质转运功能在去除胁迫后得到一定程度的恢复。
3.4 变异轴孔珊瑚钙化相关转录本表达在胁迫去除后得到恢复钙化是造礁石珊瑚形成骨骼的重要过程。在钙化过程中, 离子转运蛋白是骨骼发生部位获取和浓缩钙离子的必需物质(Allemand et al, 2004)。Zoccola等人对珊瑚Stylophora pistillata的研究表明, 在珊瑚成骨细胞中存在的L型钙离子通道和高离子亲和力的钙离子ATP酶负责珊瑚的骨骼形成(Zoccola et al, 2004; Tambutté et al, 2011)。在本研究的处理组中, 该珊瑚编码钙离子转运蛋白的转录本PMCA3、NCL、NCL1、SLC24A5的表达表现出显著下调: 这些转运蛋白的减少可能会导致珊瑚钙离子无法运输到钙化相关位置, 从而抑制珊瑚的钙化功能。
SLC4家族蛋白具有运输碳酸氢/碳酸根根离子的功能(Wang et al, 2000); 而SLC26A6蛋白则属于阴离子转运蛋白家族, 具有转运碳酸氢根离子的功能。SLC4和SLC26被认为刺胞动物碳酸氢根离子转运重要转录本, 其中SLC4家族负责将碳酸氢根离子运输到钙化位点(Zoccola et al, 2015)。SLC24和SLC26在该珊瑚的处理组中表达下调, 预示着在酸化高温的共同作用下该珊瑚钙化过程中碳酸氢根的供给可能正受到抑制。
碳酸酐酶是大部分生物体内都存在的用于碳酸氢根离子与二氧化碳相互转化的蛋白酶(Bertucci et al, 2013), 是珊瑚钙化过程中碳酸氢根离子的重要来源, 过去很多研究表明它们直接参与了许多种造礁珊瑚的钙化过程(Tambutté et al, 2007; Moya et al, 2008; Chen et al, 2018)。在本研究的处理组中, 碳酸酐酶转录本表现出显著的表达下调: 这表明在酸化高温胁迫下, 该珊瑚的碳酸氢根转换功能可能受到了抑制。
在酸化高温胁迫处理下, 该珊瑚转录组数据显示其钙离子转运、碳酸氢根离子转运和转化都受到抑制, 由此可认为该珊瑚在酸化高温胁迫下的钙化功能受到了严重抑制。在酸化高温胁迫去除后, 上述转录本的表达恢复到了原来的水平, 暗示该珊瑚的钙化能力在胁迫去除之后也能得到恢复。
4 结论通过对变异轴孔珊瑚酸化高温胁迫前后总体转录本表达模式和差异转录本表达情况的分析, 发现在胁迫去除后, 珊瑚98.1%的转录本的表达水平都不再表现出显著性变化。对该珊瑚热休克蛋白、物质转运、细胞凋亡和钙化等方面的相关转录本的表达分析表明, 这些响应胁迫或在胁迫中受损的转录本的表达在胁迫去除后能回复到正常水平。基于此, 本研究认为, 在酸化高温胁迫处理后胁迫去除后继续培养, 变异轴孔珊瑚的生理功能在转录本表达水平与遭受胁迫前差异不显著。
致谢 感谢南海徐闻珊瑚礁国家自然保护区的帮助, 谨致谢忱。
Allemand D, Ferrier-Pagès C, Furla P et al, 2004. Biomineralisation in reef-building corals: from molecular mechanisms to environmental control. Comptes Rendus Palevol, 3(6/7): 453-467 |
Barshis D J, Ladner J T, Oliver T A et al, 2013. Genomic basis for coral resilience to climate change. Proceedings of the National Academy of Sciences of the United States of America, 110(4): 1387-1392 DOI:10.1073/pnas.1210224110 |
Bertucci A, Moya A, Tambutté S et al, 2013. Carbonic anhydrases in anthozoan corals-A review. Bioorganic & Medicinal Chemistry, 21(6): 1437-1450 |
Black R E, Bloom L, 1984. Heat shock proteins in Aurelia (cnidaria, scyphozoa). Journal of Experimental Zoology, 230(2): 303-307 DOI:10.1002/jez.1402300215 |
Burriesci M S, Raab T K, Pringle J R, 2012. Evidence that glucose is the major transferred metabolite in dinoflagellate-cnidarian symbiosis. Journal Experimental Biology, 215(19): 3467-3477 DOI:10.1242/jeb.070946 |
Chen S, Gagnon A C, Adkins J F, 2018. Carbonic anhydrase, coral calcification and a new model of stable isotope vital effects. Geochimica et Cosmochimica Acta, 236: 179-197 DOI:10.1016/j.gca.2018.02.032 |
Degterev A, Yuan J Y, 2008. Expansion and evolution of cell death programmes. Nature Reviews Molecular Cell Biology, 9(5): 378-390 DOI:10.1038/nrm2393 |
DeSalvo M K, Voolstra C R, Sunagawa S et al, 2008. Differential gene expression during thermal stress and bleaching in the Caribbean coral Montastraea faveolata. Molecular Ecology, 17(17): 3952-3971 DOI:10.1111/j.1365-294X.2008.03879.x |
Hoegh-Guldberg O, Bruno J F, 2010. The impact of climate change on the world's marine ecosystems. Science, 328(5985): 1523-1528 DOI:10.1126/science.1189930 |
Hoegh-Guldberg O, Mumby P J, Hooten A J et al, 2007. Coral reefs under rapid climate change and ocean acidification. Science, 318(5857): 1737-1742 DOI:10.1126/science.1152509 |
Kaniewska P, Chan C K K, Kline D et al, 2015. Transcriptomic changes in coral holobionts provide insights into physiological challenges of future climate and ocean change. PLoS One, 10(10): e0139223 DOI:10.1371/journal.pone.0139223 |
Kellogg R B, Patton J S, 1983. Lipid droplets, medium of energy exchange in the symbiotic anemone Condylactis gigantea: a model coral polyp. Marine Biology, 75(2/3): 137-149 |
Kvitt H, Rosenfeld H, Zandbank K et al, 2011. Regulation of apoptotic pathways by Stylophora pistillata (Anthozoa, Pocilloporidae) to survive thermal stress and bleaching. PLoS One, 6(12): e28665 DOI:10.1371/journal.pone.0028665 |
Li S, Yu K F, Shi Q et al, 2009. Low water temperature tolerance and responding mode of scleractinian corals in Sanya Bay. Chinese Journal of Applied Ecology, 20(9): 2289-2295 |
Maor-Landaw K, Karako-Lampert S, Ben-Asher H W et al, 2014. Gene expression profiles during short-term heat stress in the red sea coral Stylophora pistillata. Global Change Biology, 20(10): 3026-3035 DOI:10.1111/gcb.12592 |
Moya A, Huisman L, Ball E E et al, 2012. Whole transcriptome analysis of the coral Acropora millepora reveals complex responses to CO2-driven acidification during the initiation of calcification. Molecular Ecology, 21(10): 2440-2454 DOI:10.1111/j.1365-294X.2012.05554.x |
Moya A, Huisman L, Foret S et al, 2015. Rapid acclimation of juvenile corals to CO2-mediated acidification by upregulation of heat shock protein and Bcl-2 genes. Molecular Ecology, 24(2): 438-452 DOI:10.1111/mec.13021 |
Moya A, Tambutté S, Bertucci A et al, 2008. Carbonic anhydrase in the scleractinian coral Stylophora pistillata: characterization, localization, and role in biomineralization. Journal of Biological Chemistry, 283(37): 25475-25484 DOI:10.1074/jbc.M804726200 |
Pandolfi J M, Connolly S R, Marshall D J et al, 2011. Projecting coral reef futures under global warming and ocean acidification. Science, 333(6041): 418-422 DOI:10.1126/science.1204794 |
Prada F, Caroselli E, Mengoli S et al, 2017. Ocean warming and acidification synergistically increase coral mortality. Scientific Reports, 7: 40842 DOI:10.1038/srep40842 |
Rodriguez-Lanetty M, Harii S, Hoegh-Guldberg O, 2009. Early molecular responses of coral larvae to hyperthermal stress. Molecular Ecology, 18(24): 5101-5114 DOI:10.1111/j.1365-294X.2009.04419.x |
Sakai K, Singh T, Iguchi A, 2019. Bleaching and post-bleaching mortality of Acropora corals on a heat-susceptible reef in 2016. Peer J, 7: e8138 DOI:10.7717/peerj.8138 |
Sørensen J G, Kristensen T N, Loeschcke V, 2003. The evolutionary and ecological role of heat shock proteins. Ecology Letters, 6(11): 1025-1037 DOI:10.1046/j.1461-0248.2003.00528.x |
Swan H B, Deschaseaux E S M, Jones G B et al, 2017. The relative abundance of dimethylsulfoniopropionate (DMSP) among other zwitterions in branching coral at Heron Island, southern Great Barrier Reef. Analytical and Bioanalytical Chemistry, 409(18): 4409-4423 DOI:10.1007/s00216-017-0385-8 |
Tambutté S, Holcomb M, Ferrier-Pagès C et al, 2011. Coral biomineralization: From the gene to the environment. Journal of Experimental Marine Biology and Ecology, 408(1/2): 58-78 |
Tambutté S, Tambutté E, Zoccola D et al, 2007. Characterization and role of carbonic anhydrase in the calcification process of the azooxanthellate coral Tubastrea aurea. Marine Biology, 151(1): 71-83 DOI:10.1007/s00227-006-0452-8 |
Tchernov D, Kvitt H, Haramaty L et al, 2011. Apoptosis and the selective survival of host animals following thermal bleaching in zooxanthellate corals. Proceedings of the National Academy Sciences of the United States of America, 108(24): 9905-9909 DOI:10.1073/pnas.1106924108 |
Von Holt C, Von Holt M, 1968. The secretion of organic compounds by zooxanthellae isolated from various types of Zoanthus. Comparative Biochemistry and Physiology, 24(1): 83-92 DOI:10.1016/0010-406X(68)90960-2 |
Wang C Z, Yano H, Nagashima K et al, 2000. The Na+-driven Cl-/HCO3- exchanger Cloning, tissue distribution, and functional characterization. Journal of Biological Chemistry, 275(45): 35486-35490 DOI:10.1074/jbc.C000456200 |
Weis V M, 2008. Cellular mechanisms of cnidarian bleaching: stress causes the collapse of symbiosis. Journal of Experimental Biology, 211(19): 3059-3066 DOI:10.1242/jeb.009597 |
Zoccola D, Ganot P, Bertucci A et al, 2015. Bicarbonate transporters in corals point towards a key step in the evolution of cnidarian calcification. Scientific Reports, 5: 9983 DOI:10.1038/srep09983 |
Zoccola D, Tambutté E, Kulhanek E et al, 2004. Molecular cloning and localization of a PMCA P-type calcium ATPase from the coral Stylophora pistillata. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1663(1/2): 117-126 |
 2021, Vol. 52
2021, Vol. 52


