中国海洋湖沼学会主办。
文章信息
- 刘姗姗, 俞志明, 宋秀贤, 曹西华, 袁涌铨. 2021.
- LIU Shan-Shan, YU Zhi-Ming, SONG Xiu-Xian, CAO Xi-Hua, YUAN Yong-Quan. 2021.
- 微生物复合改性粘土去除东海原甲藻(Prorocentrum donghaiense)初探
- RESEARCH ON MITIGATION OF PROROCENTRUM DONGHAIENSE BY MICRO-MODIFIED CLAY
- 海洋与湖沼, 52(5): 1170-1179
- Oceanologia et Limnologia Sinica, 52(5): 1170-1179.
- http://dx.doi.org/10.11693/hyhz20210300063
文章历史
-
收稿日期:2021-03-08
收修改稿日期:2021-06-02
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory of Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
随着人类活动对近海环境影响的增加, 有害藻华呈全球扩展态势, 表现出暴发频率上升、持续时间增长、暴发规模扩大、致灾效应加重的趋势(俞志明等, 2019), 严重危害近海生态环境和水产养殖产业, 亟需有效的治理方法。根据控制原理的不同, 有害藻华的主要治理方法可分为物理法、化学法、天然矿物絮凝法和生物调控法等(Yu et al, 2017)。物理法是指通过打捞、引水换水、底泥疏浚、超声波等手段直接将藻华生物从水体中去除的方法, 存在着成本高、难以大范围应用的问题(Kim, 2006); 化学法是指利用化学试剂直接杀灭有害藻华生物, 该方法操作简单, 见效快, 但容易引发水体的二次污染(Ma et al, 2002; Sun et al, 2004); 天然矿物絮凝法则是利用天然矿物无毒、无害、能够絮凝藻华生物的特点, 应用于有害藻华的治理, 但是存在治理效率低、用量大的缺点。如何快速消除藻华生物而又不带来环境污染问题一直是困扰有害藻华治理领域的技术难题。
针对天然矿物絮凝法治理效率低、用量大的技术难题, 我国科学家提出了改性粘土治理赤潮的技术: 在粘土表面和层间引入带正电荷和适当链长的改性剂, 使粘土表面电性翻转、作用半径加大, 增加了粘土颗粒与藻细胞之间的桥联作用, 提升了絮凝效率, 大大降低了粘土用量(俞志明等, 1994)。改性粘土方法除藻效率高、对非藻华生物安全可靠, 已成为我国近海有害藻华应急处置的标准方法, 也是唯一在我国近海得到大规模应用、并走出国门的技术与方法。
除了这些方法之外, 利用生物间的营养盐竞争、捕食关系、藻菌相互作用(郑天凌等, 2002)等生态学原理抑制藻华, 也是很多科学家不断探索的藻华治理方法(Mayali et al, 2004; Sun et al, 2018), 称之为生物法。这类方法不但可以特异性去除藻华生物(Mankiewicz-Boczek et al, 2016), 且具备生态调控的优势, 可以有效降低水体中的铵盐、亚硝酸盐水平, 调节微生物群落结构, 提高养殖生物的品质(Chang et al, 2019; Xu et al, 2019)。但生物法存在着作用时间长、特异性弱、应急处置效果差等问题, 相关研究大都停留在实验室阶段, 鲜见实际应用的报道(Pal et al, 2020)。
由此可见, 在上述有害藻华治理方法中, 改性粘土方法展现出见效快、用量少、安全可靠的特点; 生物方法应急性差, 但是在后期会展现出其生态调控的优势。两种方法各具特色, 如果能够将二者结合在一起, 是否可以形成一种既能应急处置有害藻华、又可修复水体和生态系统的新型藻华治理方法呢?为此, 本文选取了几种目前水产养殖与水体修复常用的微生物, 将改性粘土与之结合, 研究了微生物复合改性粘土对典型有害藻华生物——东海原甲藻的去除效率, 考察了不同配比、熟化时间与温度等因素对去除效率的影响, 并对其作用机制进行探究, 为改性粘土治理有害藻华进行了新的探索。
1 材料与方法 1.1 实验材料本研究所用高岭土理化性质参照文献报道(Liu et al, 2016), 对其进行改性处理, 制备I型改性粘土, 简写为MC I (modified clay I)。
实验采用的东海原甲藻来自中科院海洋所海洋生态与环境科学重点实验室。所用培养基为L1, 培养温度为(20±1) ℃, 光照强度为65 μmol photons/(m2·s), 光暗比L: D=12 h: 12 h。所用海水取自青岛汇泉湾近海, 采用0.45 µm混合纤维膜过滤, 高温蒸汽灭菌后使用。
本研究所用的EM菌(effective microorganisms, 有效性微生物)与粪链球菌(Streptococcus faecalis)、乳酸菌(Lactobacillus sp.)均产自武汉天辰集团, 经流式细胞仪(BD FACS Calibur, 美国)进行细菌密度测定, EM菌与乳酸菌均为液态, 其中活菌含量均为1010 cells/mL; 经16S rDNA高通量测序, EM菌主要成分为芽孢杆菌(Bacillus sp., 61%)、乳酸菌(11%)、弧菌(Vibrio sp., 10%)和醋酸菌(Acetobacter sp., 6%)。粪链球菌为固态, 其中活菌含量为5×108 cells/g。光合细菌(固态)产自天创水产药品公司, 由四种光合细菌(沼泽红假单胞菌、胶质红假单胞菌、球形红假单胞菌、绿色红假单胞菌)混合而成, 其中活菌含量为2×109 cells/g; 芽孢杆菌(固态)产自落星生物公司, 其中活菌含量为3×108 cells/g。
1.2 实验方法 1.2.1 微生物复合改性粘土的制备与熟化称取一定质量的MC I于50 mL锥形瓶中, 121 ℃高温蒸汽灭菌30 min后于80 ℃烘箱中烘干1 h, 置于紫外灯下灭菌20 min, 冷却至室温。向灭菌处理后的MC I中按比例加入微生物(固态微生物的菌悬液或液态微生物)与灭菌海水, 摇匀置于恒温震荡培养箱(30 ℃、150 r/min)中震荡2 h, 使改性粘土与微生物充分接触、吸附, 形成微生物复合改性粘土(modified clay V, MC V)。
取5mL EM菌液与MC I按上述方法配置为微生物复合改性粘土, 将其置于不同温度(4、20、60 ℃)下, 熟化不同的时间(24、48、72、96 h), 制备不同熟化条件下的微生物复合改性粘土体系。
1.2.2 微生物复合改性对去除率影响的研究(1) 去除实验及去除率计算方法
取50 mL处于指数生长期中后期的东海原甲藻藻液(密度为1×108 cells/L)置于比色管中, 加入微生物复合改性粘土悬浮液, 上下颠倒混匀后, 于培养条件下静置24 h, 取上部(距离液面5 cm处)藻液, 用鲁哥试剂固定后, 在显微镜(Olympus IX71, 日本)下计数。每组设置三个平行。去除率计算公式为:
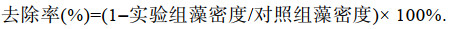 (1)
(1)(2) EM菌及其滤液与改性粘土复合前后去除率的变化
将EM菌培养液经0.22 μm滤膜过滤得到无菌滤液, 将其按照1.2.1所述的方法分别与改性粘土复合。取50 mL处于指数生长期中后期的东海原甲藻藻液置于比色管中, 分别加入液体EM菌、EM菌滤液, 设置体积分数梯度为0.1、0.2、0.5、1、1.5、2×1010 cells/L, 每组设三个平行。计算其对东海原甲藻的去除率。
1.3 实验参数测定 1.3.1 微生物复合改性粘土表面的电镜观察将微生物复合改性粘土离心(8 028 ×g, 3 min), 弃上清液并将样品完全浸没于5%戊二醛内固定1 h。使用0.1 mol/L磷酸缓冲液室温冲洗浸泡样品3次(每次10 min)后, 进行乙醇梯度脱水, 将其置换到醋酸异戊酯中。置于临界点干燥仪中干燥处理3 h后, 利用导电胶固定样品并喷金。使用扫描电镜(S-3400N, 日立, 日本)观察复合改性粘土表面微生物的吸附情况。
1.3.2 16SrDNA序列测序从样本中提取基因组DNA后, 用带有barcode的特异引物扩增rDNA的保守区(V3-V4 341F CCTACGGGNGGCWGCAG ~466 806R GGACTACHVGGGTATCTAAT)。将PCR扩增产物切胶回收, 用QuantiFluor TM荧光计进行定量。将纯化的扩增产物进行等量混合, 连接测序接头, 构建测序文库, Illumina PE250上机测序。
1.3.3 微生物密度测定采用流式细胞仪(BD FACS Calibur, USA)对微生物进行密度测定。将样品经SYBR Green I染色剂(体积比1︰10 000)避光染色15 min后, 上机检测。微生物与其他生物的判别主要根据与细胞大小有关的前向散射信号(forward scatter, FSC)、与细胞内部复杂程度有关的侧向散射信号(side scatter, SSC)、DNA与SYBR Green I结合后经激发所产生的绿色荧光信号(FL1, 波长515—545 nm)等参数完成。每一样品在“slow”状态下测量30 s, 利用内含数量已知Beads的绝对计数管(BD Trucount tubes, 美国)确定微生物的密度。
1.3.4 吸附在粘土上的微生物密度测定取1.2.1所述的不同熟化条件下的微生物复合改性粘土悬浊液5 mL, 静置3 h使其完全沉淀, 取上层菌悬液测定微生物密度D1; 向下层沉淀中加入10 mL PBS缓冲液洗脱吸附在改性粘土表面的微生物后离心(2 057 ×g, 10 min), 重复洗脱3次。利用流式细胞仪测定上清液中的微生物密度D2, 将沉淀烘干至恒重后称重得到改性粘土的干重M1。吸附在粘土上的菌密度计算公式为:
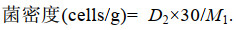 (2)
(2)吸附在粘土上的菌所占比例的计算公式为:
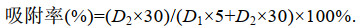 (3)
(3)利用FlowJo软件(TreeStar, 美国)进行细菌数量的读取和分析。运用Excel 2013和Origin 2019对数据进行处理及绘图, 数据使用SPSS软件ANOVA、LSD功能进行方差分析, 对各实验与对照组均值之间的差异性进行显著性检验。结果表示为平均值±标准偏差。
2 实验结果 2.1 不同种类的微生物及微生物复合改性粘土对东海原甲藻的去除效果 2.1.1 不同种类的微生物对东海原甲藻的去除效果为筛选适用于治理东海原甲藻的微生物, 本实验选用几种常用于水产养殖与水体修复的微生物(芽孢杆菌、粪链球菌、光合细菌、乳酸菌)及复合菌(EM菌), 分别进行了对东海原甲藻的去除实验。实验结果表明, 不同微生物去除东海原甲藻的有效密度不同, 光合细菌、粪链球菌、芽孢杆菌的有效密度分别为1.5、2、2×109 cells/L, EM菌、乳酸菌的有效密度分别为1.5、2×1010 cells/L; 且去除率随微生物密度的升高而升高(图 1a)。
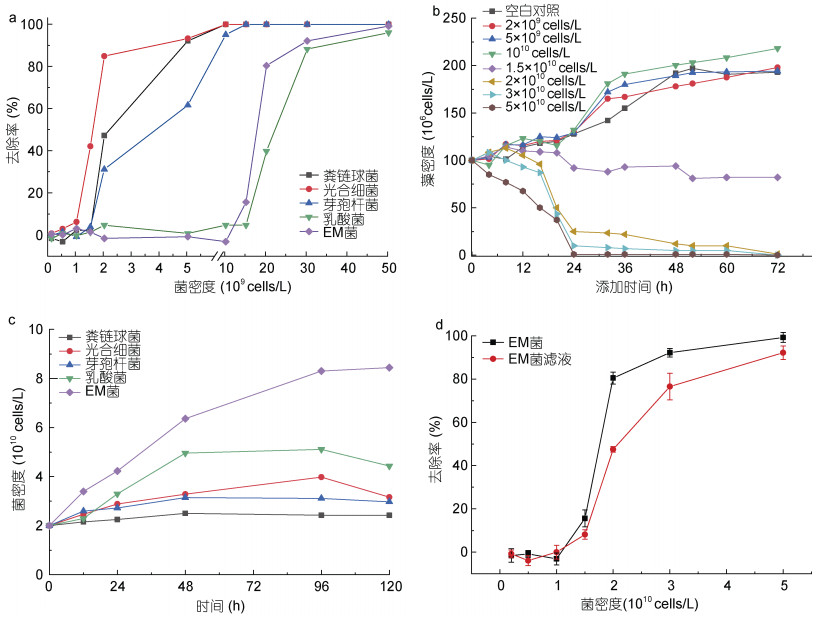 |
| 图 1 微生物对东海原甲藻的去除效果 Fig. 1 Effect of removal of microorganisms on Prorocentrum donghaiense 注a. 不同微生物对东海原甲藻的去除率(24 h); b. 不同微生物在东海原甲藻藻液中的生长情况; c. EM菌加入东海原甲藻后藻密度随时间的变化情况; d. EM菌及其滤液对东海原甲藻生长的影响(24 h) |
以往研究中, 大部分抑藻微生物无法被大规模应用于藻华治理的主要原因在于其无法适应目标水体环境, 因此微生物在目标水体中的存活状态是其抑藻效率的重要因素。为此, 本研究进一步探索了各种微生物在东海原甲藻藻液中的存活状况, 结果如图 1b所示。由图可以看出, 以2×1010 cells/L作为微生物的初始密度, 与东海原甲藻进行共培养, 发现随着时间增长, 粪链球菌、芽孢杆菌、光合细菌的密度变化较小, 说明其适应性较差、难以生长; 相比而言, 复合菌剂EM菌呈现明显的增长趋势, 反映出其适应性强、容易在此环境中生存的特点, 具有应用于藻华治理的潜力。
以EM菌为实验材料, 进一步考察了EM菌对东海原甲藻的去除作用适宜时间与方式。结果表明, 随作用时间增长, 低密度(≤1010 cells/L) EM菌添加组内的东海原甲藻密度不断上升; EM菌添加量为1.5×1010 cells/L的处理组藻密度先缓慢上升而后下降, 24 h后趋于稳定; EM菌密度高于2×1010 cells/L时, 藻密度在8 h后快速下降, 并于24 h后趋于消亡(图 1c)。将液态EM菌经过0.22 μm滤膜过滤, 加入东海原甲藻藻液中, 考察了EM菌滤液对去除东海原甲藻的影响, 发现EM菌密度≥1.5×1010 cells/L时, 其滤液具有去除效果; 随菌密度上升, 其滤液去除率升高, 且滤液去除率始终低于未过滤的菌液(图 1d)。
2.1.2 不同微生物复合改性粘土对东海原甲藻的去除效果由于不同微生物制剂因其制备方式及物态不同, 相同体积或重量下菌密度存在较大差异; 如果设定统一的菌密度, 微生物制剂的添加量将存在很大的差异。综合考虑室内实验和实际应用的可行性, 设定各种微生物制剂添加量为0.5 g/L(固态)或0.5 mL/L(液态), 与浓度为0.1 g/L的I型改性粘土(MC I)复合, 制备成不同的微生物复合改性粘土(MC V), 探讨微生物复合改性粘土对东海原甲藻去除效果(表 1)。
| 微生物种类 | 微生物制剂中初始菌密度 | 添加量为0.5 g(mL)/L时的菌密度(cells/L) | 仅添加微生物时的去除率(%) | 与MC I复合后去除率(%) |
| 粪链球菌 | 5×108 cells/g | 2.5×108 | 3.13±2.33 | 45.22±3.13 |
| 光合细菌 | 3×108 cells/g | 1.5×108 | 1.56±1.29 | 31.24±0.45 |
| 芽孢杆菌 | 2×109 cells/g | 1.5×108 | –0.78±3.03 | 38.28±1.93 |
| 乳酸菌 | 1010 cells/mL | 5×109 | 0.38±2.98 | 42.22±2.88 |
| EM菌 | 1010 cells/mL | 5×109 | –0.25±2.16 | 71.83±4.09 |
| 注: 浓度为0.1 g/L的MC I去除率为39.22%±1.51% | ||||
结果表明, 仅添加0.1 g/L的I型改性粘土(MC I)的处理组对东海原甲藻的去除率为39%; 芽孢杆菌、乳酸菌与MC I复合后, 去除率未发生显著性变化; 光合细菌与MC I复合后去除率显著降低(P < 0.05); 粪链球菌与MC I复合后, 去除率略有上升; EM菌与改性粘土复合后, 去除率可提升至70%左右, 显著高于其他微生物种类(P < 0.01)。值得注意的是, 仅添加0.5 mL/L的EM菌时对东海原甲藻无去除效果; 将其与MC I复合后, 除藻效率可进一步提高31%, 表现出1+1 > 2的现象, 即复合后改性粘土去除效率大于二者单独添加时的去除率之和。
2.2 EM菌复合改性粘土体系对除藻效率的影响根据2.1的研究结果, 相比其他微生物制剂, EM菌更适宜藻华治理, 是一类较好的与改性粘土进行复合、提升其除藻效率的生物材料。为此, 后续均以EM菌为主要微生物, 开展了不同复合制备条件对除藻效率的影响研究。
2.2.1 EM菌密度对复合改性粘土除藻效率的影响为了进一步探讨EM菌复合改性粘土对东海原甲藻的去除作用, 固定改性粘土浓度不变, 将液态EM菌和经过0.22 μm滤膜过滤后的滤液(不含菌体)与改性粘土进行复合, 考察其对东海原甲藻的去除效果, 结果如图 2所示。与改性粘土组相比, 随着EM菌添加量的增加, EM菌复合改性粘土的去除率不断上升; EM菌密度≤0.5×1010 cells/L时其滤液对东海原甲藻的去除率无显著提升, EM菌密度 > 0.5×1010 cells/L时, 随菌密度上升, 其滤液去除率上升; EM菌密度为2×1010 cells/L时, 二者去除率均达100%。
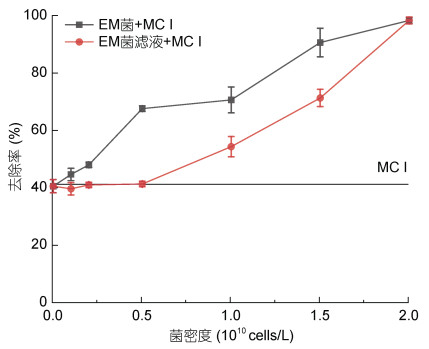 |
| 图 2 微生物复合改性粘土体系中EM菌及其滤液添加量对除藻效率的影响 Fig. 2 Effects of proportion of Effective Microorganisms on algal removal efficiency 注: 作用时间为24 h, MC I添加量均为0.1 g/L |
由于微生物的菌密度、活性及其在改性粘土上的吸附能力会受到培养时间、温度等条件的影响, 为优化微生物复合改性粘土的制备方法, 本文对EM菌进行不同熟化时间与温度的处理, 研究不同培养条件对EM菌复合改性粘土去除率的影响, 结果如图 3所示。
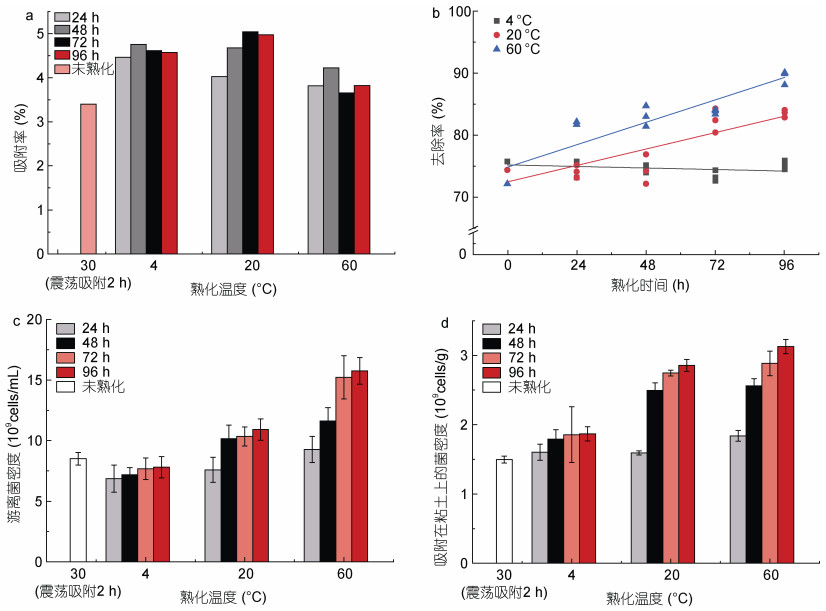 |
| 图 3 不同熟化时间与温度对去除率的影响(24 h) Fig. 3 Effects of different incubation time and temperature on removal rate (24 h) 注: a. 不同熟化时间与温度对去除率的影响(粘土浓度为0.1 g/L, EM菌密度为0.5×1010 cells/L); b. 熟化时间、温度与去除率的拟合曲线; c. 上层菌悬液中EM菌密度变化; d. 吸附在粘土上的EM菌密度变化 |
结果显示, 熟化温度与时间均会对EM菌复合改性粘土的去除率产生影响(图 3a)。适宜范围内, 去除率随着熟化温度的上升而上升, 4 ℃熟化处理组的去除率低于未熟化的EM菌复合改性粘土, 说明低温不利于EM菌复合改性粘土去除效果的发挥。在低温条件下, 时间对去除率的影响较小; 在高温条件下, 随熟化时间增长, 去除率升高。
为进一步探索熟化时间、温度与去除率的关系, 绘制熟化时间与去除率的散点图并进行拟合(图 3b)。4、20、60 ℃所对应曲线的R2(拟合优度)分别为0.112、0.723、0.828。熟化温度为4 ℃时, 随熟化时间增长, 去除率呈下降趋势; 熟化温度为20、60 ℃时, 微生物复合改性粘土的去除率与熟化时间显著正相关, 且随着熟化温度的提升, 去除率随熟化时间增长而上升的趋势越明显。
对于EM菌与改性粘土复合体系, 熟化温度会对菌类生长产生重要影响。换言之, 温度对微生物在水体和粘土上的密度产生重要影响。为此, 实验进一步探索了不同熟化温度下微生物在水体和粘土上的密度变化: 将EM菌复合改性粘土悬浊液中的上层菌悬液与底层粘土分离, 分别测定其中的微生物密度, 研究不同熟化条件下吸附在改性粘土上的微生物数目与上层悬液中的游离微生物密度的变化情况。
结果表明, 4 ℃熟化处理组的游离菌密度低于未熟化处理组; 随着熟化时间增长, 4 ℃处理组游离菌密度无显著变化, 20、60 ℃处理组游离菌密度上升(图 3c)。这说明4 ℃不利于微生物繁殖, 适宜温度下, 增加熟化时间有利于微生物繁殖。
如图 3d所示, 熟化时间越长, 吸附在粘土上的菌密度均呈上升趋势, 4 ℃处理组上升幅度低于20、60 ℃处理组, 说明低温条件微生物吸附能力较弱, 一定范围内温度升高有利于微生物在粘土上的吸附。
3 讨论受自然水体中土著微生物的竞争和不同环境条件的影响, 微生物往往难以在实际应用的环境中稳定生存(郑天凌等, 2011), 这是利用微生物方法控制有害藻华亟待解决的问题之一。本研究结果表明, 相比单一菌种而言, 复合微生物EM菌在藻液中更易生长、性能更为稳定、除藻作用更强(图 1), 这与Boruszko (2017)发现的复合菌群在新的环境中能够快速占据生态位, 更易于在自然水体中生存、形成优势微生物群落的结论一致。除此之外, 本研究发现利用EM菌复合后的改性粘土去除藻华生物的效率高于单独利用EM菌和改性粘土的去除效果之和, 即EM菌复合改性粘土对东海原甲藻的去除效果具有1+1 > 2的特点, 成为本研究中非常令人感兴趣的一个实验结果。
3.1 EM菌抑藻作用机制及其改性粘土复合后的影响理论上讲, 微生物的除藻作用可分为直接和间接作用。直接作用指微生物直接攻击藻细胞, 通过侵入、摄食藻细胞, 或接触藻细胞后分泌特定的酶类物质杀死藻细胞; 间接作用则指微生物通过分泌胞外活性物质、与藻类竞争营养物质等方式杀灭藻细胞。一定菌密度下, EM菌及其滤液对东海原甲藻均具有去除效果(图 1c), 这说明EM菌对东海原甲藻的去除作用既包括菌体所发挥的直接作用, 又包括滤液中其分泌的抑藻物质的间接作用。
为进一步比较改性粘土对EM菌的直接与间接抑藻作用的影响, 将图 1d与图 2中EM菌及其滤液与改性粘土复合前后的除藻率结合分析, 如图 4所示。图中红线既包括与改性粘土复合前后EM菌菌体的直接作用, 又包括其分泌的活性物质的间接除藻作用; 黑线则表示与改性粘土复合前后EM菌的间接作用, 阴影部分代表二者之差, 即为EM菌菌体的直接作用。
 |
| 图 4 EM菌及其滤液与改性粘土复合前后对东海原甲藻生长的影响(24 h) Fig. 4 Influence of Effective Microorganisms and filtrate on Prorocentrum donghaiense before and after adding modified clay (24 h) 注: 粘土浓度为0.1 g/L |
由图 1a可知, EM菌必须到达一定密度, 其菌液及滤液才具有去除率。但与改性粘土复合后, EM菌发挥直接与间接除藻作用的最低密度由1.5×1010 cells/L分别降低为0.2×1010、0.5×1010 cells/L (图 4)。这说明改性粘土可能具有富集EM菌及其滤液中的活性物质的能力, 使菌-藻混合体系中EM菌或活性物质的局部浓度上升。
实验发现, 改性粘土对EM菌具有一定的富集能力(图 3d), 进一步对EM菌复合改性粘土进行电镜观察发现, EM菌可以附着在改性粘土表面(图 5a), 证实了上述推测。为进一步比较改性粘土对EM菌及其分泌的抑藻物质富集能力的差异, 将图 4中EM菌与改性粘土复合前后的直接、间接除藻作用变化进行比较(表 2)。与改性粘土复合后, 随着EM菌添加量的上升, 直接作用提升比间接作用提升更快, 这可能说明改性粘土对EM菌的富集能力大于对胞外抑藻物质的富集能力。总而言之, 改性粘土可以富集EM菌及其滤液中的活性物质, 增加了菌-藻混合体系中EM菌的局部浓度, 提升了其直接与间接抑藻作用, 因此出现1+1 > 2的现象。
 |
| 图 5 EM菌复合改性粘土对藻细胞的破坏及粘土颗粒表面的细菌固定情况 Fig. 5 Damage of micro-modified clay to algal cells and bacterial fixation on the surface of clay |
| EM菌密度(×1010 cells/L) | ΔEM菌(直接作用+间接作用)(%) | ΔEM菌滤液(间接作用)(%) | Δ直接作用(%) |
| 0.2 | 7.43 | 0.43 | 7.78 |
| 0.5 | 27.04 | 0.76 | 23.15 |
| 1 | 30.06 | 13.14 | 19.43 |
| 1.5 | 50.06 | 30.46 | 11.81 |
| 2 | 57.76 | 57.76 | -32.97 |
| 注: ΔEM菌=去除率(EM菌+MC I)-去除率(EM菌); ΔEM菌滤液=去除率(EM菌滤液+MC I)-去除率(EM菌滤液); Δ直接作用=[去除率(EM菌+MC I)-去除率(EM菌滤液+MC I)]-[去除率(EM菌)-去除率(EM菌滤液)] | |||
如前所述, 本实验使用的EM菌是一种复合微生物菌剂, 其除藻效果可能是由某一种或几种微生物所导致的。为进一步探究EM菌中的有效微生物种类, 对EM菌的生物组成进行了16S分析, 结果如表 3所示。结果表明, 本实验使用的EM菌剂主要由芽孢杆菌(Bacillus)、乳酸杆菌(Lactobacillus)、弧菌(Vibrio)、醋酸菌(Acetobacter)等组成, 其优势菌株为芽孢杆菌, 达到61%, 占据绝对优势; 占比第二的是乳酸杆菌, 仅为11%。所以, 可以认为该EM菌剂产生抑藻作用的主要是芽孢杆菌, 这与前人的相关结果一致: Shi等(2006)发现芽孢杆菌接触藻细胞后可以分泌水解酶从而发挥直接抑藻作用, 溶解水华束丝藻(Aphanizomenon flosaquae); Lin等(2020)的报道证明, 芽孢杆菌所分泌的胞外杀藻化合物可以抑制赤潮异弯藻(Heterosigma akashiwo)的酯酶活性和PSⅡ最大光化学量子产量(Fv/Fm)。本研究在显微镜(Olympus IX71, 日本)下观察EM菌复合改性粘土处理后的东海原甲藻细胞, 发现部分藻细胞的细胞壁被破坏, 细胞内容物流出(图 5b), 这可能是由芽孢杆菌所引发的直接抑藻效应, 与Shi等(2006)的结论一致; EM菌滤液所具备的抑藻功能与Lin等(2020)的报道一致。
| 物种组成 | 相对丰度(%) |
| Bacillus | 61.165 9 |
| Lactobacillus | 11.278 1 |
| Vibrio | 10.060 2 |
| Acetobacter | 5.849 9 |
| Stenotrophomonas | 1.769 5 |
| Acinetobacter | 0.495 9 |
| Marinobacter | 0.421 7 |
| Pseudomonas | 0.394 7 |
| Synechocystis PCC-6803 | 0.253 0 |
| Thiomicrorhabdus | 0.246 3 |
根据2.1的实验结果, 芽孢杆菌作为单菌株存在于水体中时不易存活, 仅仅使用芽孢杆菌控制藻华的瓶颈在于其无法在自然开阔水体中稳定生存。本研究结果表明, 将芽孢杆菌与其他微生物制成复合菌剂会增加其在水体中的稳定生存, 从而更好地发挥抑藻作用。
3.3 微生物复合改性粘土制备条件的影响由上述讨论可知, 微生物或活性物质在粘土上的富集作用导致其产生了1+1 > 2的作用, 所以微生物在粘土上的分布会直接影响去除效率, 而分布状态受到时间、温度影响。Nathan等(2000)报道, 枯草芽孢杆菌(B. subtilis)在石英(SiO2)和刚玉(α-AlO3)表面的吸附反应在1 h内达到平衡。实验2.2.2发现未经熟化处理的EM菌复合改性粘土体系中, 有3.4%的EM菌可以附着在改性粘土表面(图 3d), 且随着培养时间与温度上升, 上层菌悬液中的微生物进行繁殖(图 3c), 使得EM菌在改性粘土的吸附状态不断变化。将图 3c、3d的结果经1.3.4所述方法计算后得出不同熟化条件下吸附在粘土上的菌所占比例变化, 如图 6所示。经熟化处理后, 吸附率均高于未熟化处理组; 20 ℃吸附率最高, 60 ℃吸附率最低。4 ℃条件下, 随着熟化时间增长, 吸附率未发生显著变化; 20 ℃条件下, 随着熟化时间增长, 吸附率先上升后保持稳定; 60 ℃条件下, 吸附率先上升后下降。
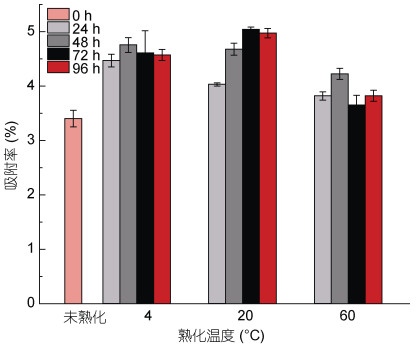 |
| 图 6 熟化温度与时间对吸附率的影响 Fig. 6 Effect of temperature and time on adsorption rate |
结合图 3d游离菌密度的变化情况, 可以发现4 ℃条件下, 微生物的繁殖被抑制, 导致其除藻率降低; 20 ℃条件下, 微生物的繁殖与吸附作用均被促进; 60 ℃条件下, 微生物的繁殖被促进, 而吸附作用比低温条件下降低。Mceldowney等(1988)进行了温度(5—45 ℃)对细菌在聚苯乙烯表面吸附的实验研究, 结果显示, 荧光假单胞菌(Pseudomonas ftuorescens)和紫色色杆菌(chromobacterium sp.)的最大吸附发生在20—25 ℃。本研究进一步印证了该结果。温度可能是通过改变细菌表面的蛋白含量或表面电荷来改变其表面疏水性, 进而影响细菌的吸附能力(Parker等, 1984)。此外, 相关的研究认为, 温度可以通过影响细菌和土壤颗粒表面活性官能团的水解和电离, 改变可变电荷的数量甚至符号, 从而影响二者之间的吸附作用(Venkateswerlu et al, 1992)。
综上, EM菌具有直接和间接除藻作用, 其中主要发挥除藻作用的微生物为芽孢杆菌; 改性粘土可以富集EM菌及其滤液中的抑藻物质, 从而提升EM菌的直接与间接除藻作用, 因此出现1+1>2的现象; 在适宜的熟化温度、时间等条件下, EM菌在改性粘土上的吸附和繁殖得到促进, 提升了EM菌复合改性粘土的除藻能力。
4 结论(1) EM菌剂在藻液中呈现明显的增长趋势, 并具有较高的抑藻效果, 是一类适宜于与粘土复合改性、提升其除藻效率的生物材料。
(2) EM菌与改性粘土复合后产生1+1 > 2的除藻效果, 主要由于改性粘土对EM菌及其分泌的抑藻物质具有一定的富集作用, 提升了EM菌的局部密度, 增强了其直接和间接除藻作用。
(3) 对EM菌复合改性粘土进行熟化后, 适宜的熟化温度与时间能够促进EM菌的繁殖及其在改性粘土上的吸附, 进一步提升对东海原甲藻的去除效率。
郑天凌, 田蕴, 苏建强, 等. 2002. 海洋赤潮生物与厦门海域几种细菌的生态关系研究. 生态学报, 22(12): 2063-2070 DOI:10.3321/j.issn:1000-0933.2002.12.007 |
郑天凌, 吕静琳, 周艳艳, 等. 2011. 海洋有害赤潮调控功能菌的发现与研究. 厦门大学学报(自然科学版), 50(2): 445-454 |
俞志明, 邹景忠, 马锡年. 1994. 一种提高粘土矿物去除赤潮生物能力的新方法. 海洋与湖沼, 25(2): 226-232 DOI:10.3321/j.issn:0029-814X.1994.02.020 |
俞志明, 陈楠生. 2019. 国内外赤潮的发展趋势与研究热点. 海洋与湖沼, 50(3): 474-486 |
Boruszko D, 2017. Research on the influence of anaerobic stabilization of various dairy sewage sludge on biodegradation of polycyclic aromatic hydrocarbons PAHs with the use of effective microorganisms. Environmental Research, 155: 344-352 DOI:10.1016/j.envres.2017.02.019 |
Chang B V, Chang Y T, Chao W L et al, 2019. Effects of sulfamethoxazole and sulfamethoxazole-degrading bacteria on water quality and microbial communities in milkfish ponds. Environmental Pollution, 252: 305-316 DOI:10.1016/j.envpol.2019.05.136 |
Kim H G, 2006. Mitigation and controls of HABs. In: Granéli E, Turner J T eds. Ecology of Harmful Algae. Berlin, Heidelberg: Springer
|
Lin Z H, Chen B B, Zhao L, 2020. Fluorescence-based bioassays with dose-response curve and relative potency in measuring algicidal virulence of Bacillus sp. B1 exudates against Heterosigma akashiwo. Science of the Total Environment, 724: 137691 DOI:10.1016/j.scitotenv.2020.137691 |
Liu Y, Cao X H, Yu Z M et al, 2016. Controlling harmful algae blooms using aluminum-modified clay. Marine Pollution Bulletin, 103(1/2): 211-219 |
Ma J, Wei L, 2002. Effectiveness and mechanism of potassium ferrate(VI) preoxidation for algae removal by coagulation. Water Research, 36(4): 871-878 DOI:10.1016/S0043-1354(01)00282-2 |
Mankiewicz-Boczek J, Bednarek A, Zaborowski A et al, 2016. Microbiologically activated barriers for removal of nitrogen compounds from farm sewage. New Biotechnology, 33(Suppl 1): S130 |
Mayali X, Azam F, 2004. Algicidal bacteria in the sea and their impact on algal blooms. Journal of Eukaryotic Microbiology, 51(2): 139-144 DOI:10.1111/j.1550-7408.2004.tb00538.x |
McEldowney S, Fletcher M, 1988. Effect of pH, temperature, and growth conditions on the adhesion of a gliding bacterium and three nongliding bacteria to polystyrene. Microbial Ecology, 16(2): 183-195 DOI:10.1007/BF02018913 |
Yee N, Fein J B, Daughney C J, 2000. Experimental study of the pH, ionic strength, and reversibility behavior of bacteria-mineral adsorption. Geochimica Et Cosmochimica Acta, 64(4): 609-617 DOI:10.1016/S0016-7037(99)00342-7 |
Pal M, Yesankar P J, Dwivedi A et al, 2020. Biotic control of harmful algal blooms (HABs): a brief review. Journal of Environmental Management, 268: 110687 DOI:10.1016/j.jenvman.2020.110687 |
Parker N D, Munn C B, 1984. Increased cell surface hydrophobicity associated with possession of an additional surface protein by Aeromonas salmonicida. FEMS Microbiology Letters, 21(2): 233-237 DOI:10.1111/j.1574-6968.1984.tb00216.x |
Shi S Y, Liu Y D, Shen Y W et al, 2006. Lysis of Aphanizomenon flos-aquae (Cyanobacterium) by a bacterium Bacillus cereus. Biological Control, 39(3): 345-351 DOI:10.1016/j.biocontrol.2006.06.011 |
Sun X X, Han K N, Choi J K et al, 2004. Screening of surfactants for harmful algal blooms mitigation. Marine Pollution Bulletin, 48(9-10): 937-945 DOI:10.1016/j.marpolbul.2003.11.021 |
Sun R, Sun P F, Zhang J H et al, 2018. Microorganisms-based methods for harmful algal blooms control: a review. Bioresource Technology, 248: 12-20 DOI:10.1016/j.biortech.2017.07.175 |
Venkateswerlu G, Stotzky G, 1992. Binding of the protoxin and toxin proteins of Bacillus thuringiensis subsp. kurstaki on clay minerals. Current Microbiology, 25(4): 225-233 DOI:10.1007/BF01570723 |
Xu W J, Yu X, Huang X S et al, 2019. Addition of algicidal bacterium CZBC1 and molasses to inhibit cyanobacteria and improve microbial communities, water quality and shrimp performance in culture systems. Aquaculture, 502: 303-311 DOI:10.1016/j.aquaculture.2018.12.063 |
Yu Z M, Song X X, Cao X H et al, 2017. Mitigation of harmful algal blooms using modified clays: theory, mechanisms, and applications. Harmful Algae, 69: 48-64 DOI:10.1016/j.hal.2017.09.004 |
 2021, Vol. 52
2021, Vol. 52


