中国海洋湖沼学会主办。
文章信息
- 杨佳丽, 冯泽中, 牛建峰, 顾文辉, 何帮翔, 刘雪华, 邵之卓, 郑阵兵, 王旭雷, 王广策. 2021.
- YANG Jia-Li, FENG Ze-Zhong, NIU Jian-Feng, GU Wen-Hui, HE Bang-Xiang, LIU Xue-Hua, SHAO Zhi-Zhuo, ZHENG Zhen-Bing, WANG Xu-Lei, WANG Guang-Ce. 2021.
- 低盐、高温诱导的条斑紫菜(Pyropia yezoensis)病烂机制研究
- PRELIMINARY STUDY ON THE MECHANISM OF ROTTEN DISEASES INDUCED BY LOW SALINITY AND HIGH TEMPERATURE IN PYROPIA YEZOENSIS
- 海洋与湖沼, 52(5): 1214-1223
- Oceanologia et Limnologia Sinica, 52(5): 1214-1223.
- http://dx.doi.org/10.11693/hyhz20210300057
文章历史
-
收稿日期:2021-03-03
收修改稿日期:2021-04-06
2. 青岛海洋科学与技术试点国家实验室海洋生物学与生物技术功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049;
4. 青岛农业大学海洋科学与工程学院 青岛 266109;
5. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Marine Science and Engineering College, Qingdao Agricultural University, Qingdao 266109, China;
5. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
紫菜生长于潮间带, 随着每日的潮涨潮落, 周期性地经历干出、强光、温度等胁迫, 在此过程中, 藻体细胞会产生一系列生理响应, 其中最重要的就是氧自由基(ROS)的产生与清除(Collén et al, 1999)。目前, 国际上已有大量关于潮间带海藻ROS动态平衡与抗氧化酶活性变化的相关报道。Burritt等(2002)通过比较低潮位和高潮位生长的Stictosiphonia arbuscula藻体中过氧化氢和脂质过氧化物的含量, 确定体内抗氧化酶活性较高的藻体具有更强的逆境耐受能力。类似的, 研究人员也发现坛紫菜耐高温性状与藻体本底的抗氧化能力密切相关(杨锐等, 2007; 张元等, 2011)。坛紫菜对高温胁迫的生理响应总体上可概括为: 高温胁迫导致ROS含量升高, 丙二醛(MDA)含量增加, 抗氧化机制和渗透调节系统在活性氧信号下被激活, ROS被清除, 最终体内ROS的产生和消除重新获得平衡(张元等, 2011)。而且, 还原型NADPH氧化酶(NOX)介导的超氧阴离子生成被认为是导致生物体细胞内ROS水平上调的第一反应(Lamb et al, 1997; 郝福顺等, 2005)。
在条斑紫菜(Pyropia yezoensis)抗氧化系统响应逆境胁迫方面, 亦有众多研究成果发表。Heber等(2010)报道称, 干出过程中条斑紫菜的光合活性持续降低且ROS逐渐累积。黄林斌等(2020)也发现22 ℃高温胁迫条件下培养的不同品系条斑紫菜, Fv/Fm均呈下降趋势, 而且其下降幅度与胁迫的温度、胁迫的时间呈正相关。侯和胜等(2008)研究了条斑紫菜丝状体在高温胁迫下的生理响应, 发现长时间的高温胁迫使得藻体叶绿素含量下降, 藻体颜色变红, 可溶性蛋白、丙二醛、可溶性糖含量呈现先上升后下降的趋势, 后期细胞内容物渗露。Yu等(2020)发现多种抗氧化酶和抗氧化分子在条斑紫菜应对高盐胁迫中发挥作用, 且本底抗氧化库库容大小对清除活性氧的瞬时暴发具有重要意义。
我国是世界上最大的紫菜生产国, 但近年来, 随着全球气候变暖, 栽培海区同期温度不断升高。同时, 由于紫菜栽培面积持续而无序的扩张, 导致海区栽培密度过大, 从而造成了潮流不畅, 水质贫瘠, 最终导致大面积烂菜现象时有发生。病烂发生时, 藻体梢部颜色变红, 部分藻体颜色变淡, 细胞死亡呈空胞化, 发白、腐烂甚至脱落(陈伟洲等, 2015)。2012年, 福鼎敏灶湾坛紫菜大面积病烂暴发期间, 林晓明(2014)检测了当地海水及紫菜表面微生物情况, 认为海水中细菌对坛紫菜烂苗基本无影响, 坛紫菜叶状体表面并未检测到微生物的异常繁殖。因而, 这种烂菜现象被认为是源于生理性的病变。在气温异常升高、海水交换不畅、二氧化碳和营养盐供给滞缓的情况下易导致坛紫菜病烂的发生(宋武林, 2009; 赖平玉, 2009; 林晓明, 2014)。另一方面, 我们在长期的观察中也发现, 缺乏干出的紫菜苗帘, 或者连续的阴雨天, 更容易导致病烂发生。而病烂发生时, 处于较高潮位的紫菜受影响程度较轻。目前, 对紫菜病烂现象发生的原因, 相关研究基本是从环境因素方面进行分析(宋武林, 2009; 林晓明, 2014), 至于环境改变对藻体细胞造成了怎样的影响, 以及导致紫菜病烂发生的内在生物学机制, 一直没有较为明确和系统的研究。
据报道, 坛紫菜耐高温性状与其本底的抗氧化能力密切相关(杨锐等, 2007; 张元等, 2011)。因此我们推测, 条斑紫菜中可能也存在类似的机制, 即活跃的抗氧化酶活性有助于藻体抵御不良环境的胁迫; 相反, 长期生长于最适环境条件下的藻体, 其ROS的产生和消除功能处于较不活跃的状态, 导致条斑紫菜细胞对逆境响应的减弱, 若此时经历高温胁迫, 很容易造成藻体的氧化损伤, 病菌借机侵入, 造成大规模的烂菜。众所周知, 条斑紫菜幼苗的生长适温为12—17 ℃, 随着藻体生长, 其适温有所降低, 适宜盐度约21—29 (朱建一等, 2016)。为此, 我们采用不同盐度、不同温度处理条斑紫菜, 通过测定其光合作用参数、抗氧化酶活性, 以及相关基因的表达, 研究了温度升高及盐度降低对条斑紫菜抗氧化系统的影响。
1 材料与方法 1.1 材料2020年12月初, 从启东市连涛水产养殖专业合作社青岛即墨紫菜栽培海区剪取附有健康条斑紫菜(Pyropia yezoensis)叶状体网帘, 带回实验室暂养, 培养条件为: 温度15 ℃; 光照强度50 μE/(m2·s); 光周期12L︰12D。海水中添加PES营养盐, 通气培养, 期间每天换水一次。
1.2 方法 1.2.1 不同盐度海水处理在灭菌海水中添加去离子水, 分别配制盐度为20、25的稀释海水。新鲜条斑紫菜分别置于相应盐度海水中适应24 h, 其他条件同对照(盐度30)。分别对不同盐度(20, 25, 30)条件下的条斑紫菜进行高温、强光处理。本实验以卤素灯提供1 000 μE/(m2·s)的强光照条件, 温度通过水浴的方法加以控制。各样本胁迫处理4 h后, 测定光合作用参数, 收集材料, 吸水纸吸干, 液氮速冻, –80 ℃保存待用。
1.2.2 光合参数测定藻体在不同盐度、温度条件处理后暗适应10 min, 使用调制叶绿素荧光仪Dual-PAM-100 (Heinz Walz, Effeltrich)测定其光合作用参数(Pfündel et al, 2008)。具体测定程序包括: 初始荧光(Fo), 以12 μE/(m2·s)的测量光测定获得; 最大荧光参数(Fm), 使用饱和脉冲[SP, 强度6 000 μE/(m2·s)], 持续时间300 ms测定; 可变荧光(Fv)由Fm和F0的差值获得。测定过程中光化光强度设定为57 μE/(m2·s), 通过运行饱和脉冲的方法, 获得光合作用各参数, 并在Microsoft Office Excel 2003中进行数据处理并作图, P < 0.05时认为差异显著。
1.2.3 过氧化氢(H2O2)含量测定取适量–80 ℃冻存的条斑紫菜样品, 放入2 mL离心管, 液氮预冻, 于研磨仪(JX-FSTPRP-24, 净信科技, 中国上海)粉碎成粉, 加适量提取液(南京建成)充分混匀, 12 000 g, 4 ℃离心10 min, 小心吸取上清, 得粗提液。使用多功能微孔板检测仪(M1000Pro, Tecan Ifinite, Switzerland), 按试剂盒操作步骤, 测定吸光值, 计算H2O2含量。
1.2.4 丙二醛(MDA)含量测定通过植物MDA试剂盒(南京建成)测定。材料粉碎研磨及粗提液的获得方法同前。按照说明书步骤, 以无水乙醇为空白对照, 以10 nmol/mL的MDA标准品作为标准管对样本中MDA含量的标定, 不同样本作为测定管, 使用多功能微孔板检测仪(M1000Pro, Tecan Ifinite, Switzerland)在340 nm波长下测定吸光度, 计算MDA含量。
1.2.5 抗氧化酶活性测定材料粉碎研磨及粗提液的获得方法同前。超氧化物歧化酶(SOD)试剂盒(南京建成)基于WST-8的显色反应, 通过比色对组织样品中的酶活进行测定; 抗坏血酸过氧化物酶(APX)活性通过APX试剂盒(南京建成)测定, 根据单位时间内A290吸光度的减少值计算。过氧化氢酶(CAT)活性通过CAT试剂盒(南京建成)测定, 根据单位时间内A405吸光度的变化量测定获得。过氧化物酶(POD)活性通过POD试剂盒(南京建成)测定, 根据单位时间内A420吸光度的变化量测定获得。
1.2.6 抗氧化酶系统关键分子实时荧光定量(qRT-PCR)检测(1) RNA提取 各取适量不同条件处理后的样品, 依据RNAprep pure试剂盒说明书进行总RNA提取。提取得到的RNA浓度通过Nanodrop Photometer分光光度计(IMPLEN, CA, 美国)测定。每个样品提取3次。
(2) 反转录 反转录操作依据TaKaRa反转录酶试剂盒说明书进行, 每个反应含总RNA 200 ng, 具体操作步骤包括: (1) 去除基因组DNA反应。5×gDNA Eraser Buffer 2 μL, gDNA Eraser 1 μL, Total RNA (200 ng), 添加RNase Free dH2O至10 μL; 42 ℃ 2 min; (2) 反转录反应。向步骤(1)的反应液中加入以下试剂: PrimeScript RT Enzyme Mix I 1 μL, RT Primer Mix 1 μL, 5×Primescript Buffer 4 μL, RNase Free dH2O 4 μL; 37 ℃ 15 min, 85 ℃ 5 s, 4 ℃保存。所获cDNA模板置于–20 C暂存。
(3) 引物设计 选择eEF-1a (Elongation factor1-α)为内参基因, 基因序列从本实验室转录组数据获得。利用Primer Premier 5.0设计引物, 基因名称及引物序列见表 1。
| 基因名称 | 基因描述 | 引物序列(5′→3′) | 产物长度(bp) |
| eEF-1a | Elongation factor1-α | AGACGGTCCAATGCCACAA TCATCTCCAGGAAAGTCGTATTG |
174 |
| SOD | Superoxide dismutase | TCTCTTCCCCCCCGCACA GGCAGGGTCACGACTTCC |
236 |
| CAT | Catalase | TTTGGTGCTCTCGGGGGT CGGGTTGCGTGGTTGAAG |
236 |
| APX | Ascorbate peroxidase | CACCTGCGCGACATCTTT CGGGCGTCTCCTTCATAA |
178 |
| POD | Peroxidase | GACCGCTTCTTCTACCGCAATATCC CCATCATGCCGTTGTCCACGAG |
118 |
| GR | Glutathione reductase | GTACATTGCGGTGGAGTTTG AGGGTAGTTGTGAAGGAGCC |
210 |
| NOX | NADPH oxidase | CGGTGTGGTGGTTTGGAG AGATGGACAGGGGGGTGC |
192 |
(4) qRT-PCR条件优化及基因表达量测定 通过调整PCR各参数, 分别对各引物扩增条件进行优化。将获得的纯化片段插入PMD19-T载体, 转化E. coil感受态细胞。菌落PCR及测序验证后, 利用EZNA TM plasmid mini kit提取试剂盒提取质粒, 并对质粒进行10倍梯度稀释, 进行引物扩增效率检测。如扩增效率达到90%—110%, 则进行qRT-PCR实验。
借助于StepOne Plus多色实时荧光定量PCR仪(ABI, Foster, CA, USA), 使用2 × SYBR Green Master Mix (Roche, 德国), 每组处理样品设3个重复, 进行基因转录水平的测定。qRT-PCR反应体系20 μL, 包括1 μL cDNA模板, 10 μL 2 × SYBR Green Master Mix, 上下游引物各0.5 μL (浓度为10 μmol/μL), 8 μL RNase-free水。qRT-PCR反应程序: 预变性: 95 ℃ 10 min; 变性: 95 ℃ 10 s、退火: 不同引物有不同退火温度15 s、延伸: 72 ℃ 25 s, 40个循环; 65 ℃ 30 s, 61个循环。反应结束后, 通过2–ΔΔCt的方法计算相对基因表达值(Livak et al, 2001)。
2 结果 2.1 不同胁迫处理条件下光合参数的变化胁迫处理4 h后, 各样本潜在最大量子产额(Fv/Fm)及非光化学淬灭(Y(NO))结果如下图所示(图 1)。在15 ℃下, 不同盐度处理组的Fv/Fm无显著性差异; 而在20 ℃处理后, Fv/Fm明显降低(图 1a), 各样本的潜在光合作用均受到了影响, 尤其是20低盐处理的样本, 其活性不仅显著低于15 ℃处理的样本, 而且也明显低于盐度25及盐度30在20 ℃高温条件下的Fv/Fm。
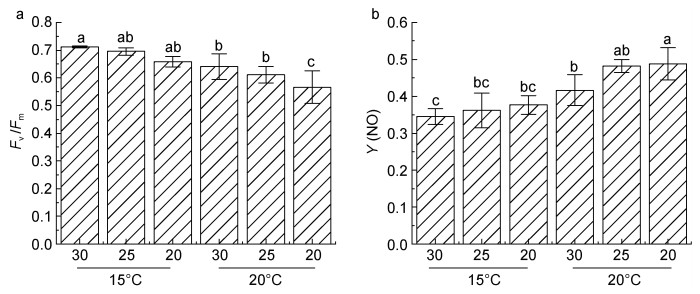 |
| 图 1 不同盐度、温度条件下条斑紫菜Fv/Fm及Y(NO)的变化 Fig. 1 Changes in Fv/Fm and Y(NO) of P. yezoensis under different salinity and temperature conditions 注: a. Fv/Fm; b. Y(NO)。柱上标有不同字母表示存在显著性差异(P < 0.05)。下同 |
非光化学淬灭Y(NO)值则显示, 在15 ℃条件下, 随着盐度降低, Y(NO)值存在上调趋势。而20 ℃高温胁迫下, 30盐度下藻体Y(NO)值相较于15 ℃显著上调, 且随盐度降低Y(NO)值持续上调(图 1b)。
2.2 过氧化氢及丙二醛含量变化测定结果显示, 在30盐度下, 20 ℃高温胁迫会导致H2O2含量显著增加, 而在较低的25及20盐度条件下, H2O2含量与15 ℃低温条件下相当, 未见明显变化(图 2)。
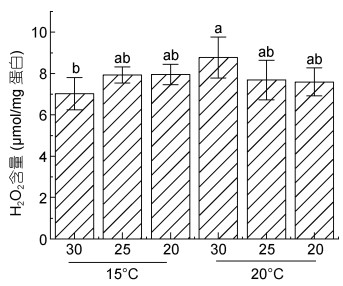 |
| 图 2 条斑紫菜叶状体不同处理条件下H2O2含量 Fig. 2 H2O2 content of P. yezoensis under different treatment conditions |
机体MDA含量可间接反应细胞受损伤的程度。本实验测定结果如图 3所示, 在15 ℃低盐(20)条件下, MDA含量相对低于盐度25及30样本中的含量, 但当温度上升到20 ℃时, MDA含量显著上升。在20 ℃条件下, 盐度25和20处理的样本中, MDA含量亦出现轻微上调, 且显著高于盐度30条件下的MDA含量。
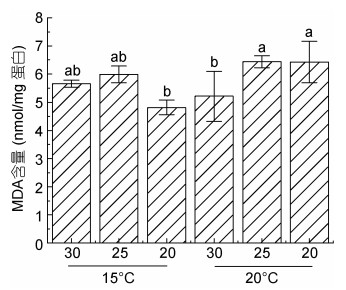 |
| 图 3 条斑紫菜叶状体不同处理条件下MDA含量 Fig. 3 MDA content of P. yezoensis under different treatment conditions |
前期研究表明, 抗氧化系统在条斑紫菜应对环境胁迫的过程中发挥了重要作用(Yu et al, 2020)。因此, 本文测定了超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)在不同条件下的活性变化(图 4)。
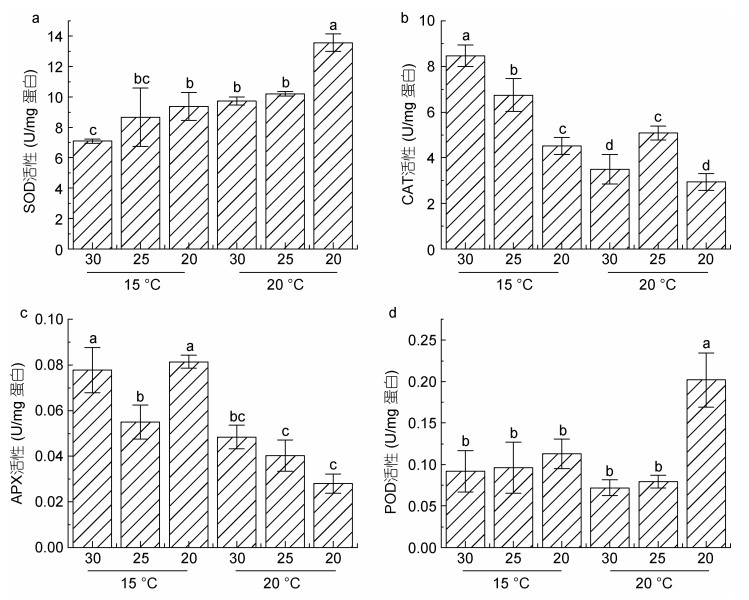 |
| 图 4 条斑紫菜叶状体不同处理条件下抗氧化酶活性变化 Fig. 4 Changes of antioxidant enzyme activities in P. yezoensis under different treatment conditions 注: a. SOD活性; b. CAT活性; c. APX活性; d. POD活性 |
SOD酶活检测结果显示(图 4a), 盐度降低, SOD酶活性增加, 尤其在盐度20条件下, 其活性较相同温度下30盐度处理组样本显著上调。升高的温度也会引起SOD酶活性的上调, 在盐度30和20处理组中, 20 ℃条件下样本SOD活性均显著高于15 ℃培养样本的SOD活性。
在15 ℃条件下, CAT活性随盐度的降低而呈现降低的趋势。当温度升高至20 ℃后, 无论在高盐还是低盐条件下, CAT活性均明显低于15 ℃ (图 4b), 同时发现, CAT活性在盐度20条件下下调最为明显。
抗坏血酸过氧化物酶(APX)活性(图 4c)在15 ℃条件下, 随着盐度的降低呈现先下降后上升的趋势; 盐度25条件下, APX活性显著降低; 在盐度20下, 又出现明显的上调。而盐度不变, 温度升至20 ℃时后APX酶活出现显著下调。尤其在盐度20的样本中, APX活性受到明显的影响, 降至15 ℃条件下的三分之一。
过氧化物酶(POD)活性测定结果显示(图 4d), 在15 ℃, 不同的盐度条件下处理4 h后其活性无明显变化, 当温度升高至20 ℃时, 盐度30和25培养下的POD活性略有下降, 但不显著, 而在盐度20处理的藻体中, POD活性出现显著上调。
2.4 抗氧化酶系统关键基因的实时荧光定量分析荧光定量检测结果显示SOD表达量(图 5a)在不同盐度条件下无明显差别, 除盐度20处理的样本外, 较高温度的胁迫使得SOD表达均明显上调。因此, 推测SOD的表达受盐度影响较小, 而温度对SOD的表达影响较大。但在高温低盐(20 ℃, 盐度20)条件下, SOD的转录表达受到了抑制。
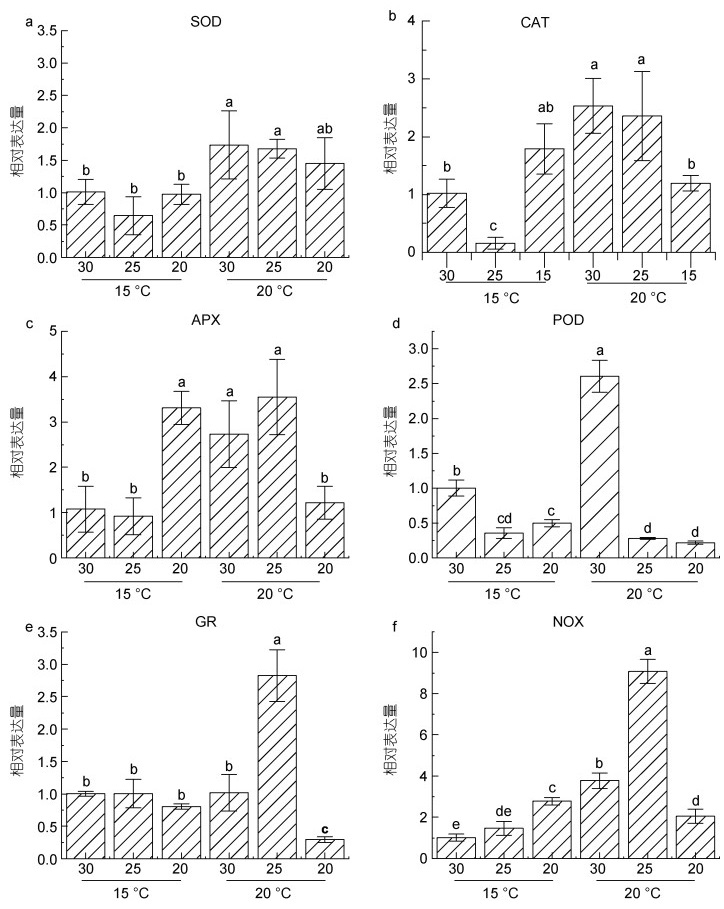 |
| 图 5 不同培养条件下抗氧化酶关键基因的表达变化 Fig. 5 Changes of the expression of key antioxidant enzyme genes under different conditions 注: a. SOD表达; b. CAT表达; c. APX表达; d. POD表达; e. GR表达; f. NOX表达 |
藻体中H2O2可被CAT直接还原为H2O和O2。荧光定量结果显示15 ℃下, 与30盐度条件下的对照相比, 25条件下CAT表达显著下调, 而20的低盐可诱导CAT上调表达。相反地, 在温度升高至20 ℃后, CAT的表达在盐度30和25下与对照相比显著上调, 但20的低盐条件则抑制了其转录活性(图 5b)。
与SOD的转录变化趋势类似, APX转录水平(图 5c)在温度15 ℃条件下亦呈现先降低后升高的趋势, 值得注意的是在20的低盐胁迫下, APX转录水平与其他盐度处理组相比, 出现显著的上调。高温胁迫使得APX在盐度25与30条件下, 表达量均明显上调, 而在盐度20条件下, APX表达则出现明显的下调。
POD的表达在盐度25及20条件下显著下调。在20 ℃高温条件下, 盐度30处理的样本POD转录水平显著上调, 低盐条件下的转录随盐度降低而呈下调趋势(图 5d)。
谷胱甘肽还原酶(GR)荧光定量的结果显示(图 5e), 15 ℃条件下不同盐度对其表达量影响甚微, 而20 ℃时出现高温胁迫, 使得GR在不同盐度下的表达出现明显变化。在盐度25时, 表达显著上调, 而在盐度20的条件下, 则显著下调。
NAD(P)H氧化酶(NOX)荧光定量结果显示(图 5f), NOX的表达在15 ℃条件下随盐度的降低呈现上调趋势, 在盐度20下显著高于对照。另一方面, 在20 ℃下, NOX的转录水平与对照相比均呈显著变化, 在盐度25和30条件下, 其表达活性比低温条件下(15 ℃)明显上调, 而在盐度20条件下, NOX转录活性与低温条件下(15 ℃)相比, 呈明显下调表达。
3 讨论 3.1 高温胁迫对条斑紫菜的影响光合作用是对温度变化非常敏感的一个生理生化过程, 高温等逆境胁迫条件下, 通常是光合作用先受到影响(Berry et al, 1980), 反映在光合作用参数上则为, 指示光能转换效率参数的Fv/Fm值首先下降, 光合电子传递速率降低, 以及非光化学淬灭的增加(Davison et al, 1996; 张守仁, 1999)。本研究中, 我们发现高温(20 ℃)导致条斑紫菜Fv/Fm出现下调, 尤其在高温和低盐(盐度20)复合胁迫下, 藻体光合作用受到明显抑制。同时, 指示藻体光合系统受损的非光化学淬灭Y(NO)值均上升, 且这种损伤在盐度降低时更加明显。因此, 高温逆境会影响条斑紫菜的光合作用系统, 而盐度的降低则加剧了对光合作用的抑制效果。
正常的植物生长发育过程中, 其机体内会维持一个相对稳定的氧自由基代谢平衡状态, 而这种相对稳定的状态在胁迫发生时会遭到破坏(Mittler et al, 2006)。高能态电子与氧分子结合形成活性氧(reactive oxygen species, ROS) (Mittler, 2002), 包括单线态氧(singlet oxygen, 1O2)、过氧化氢(hydrogen peroxide, H2O2)、超氧阴离子(superoxide anion free radical, O2–)和羟自由基(hydroxyl radical, HO·)。构成细胞的蛋白质、DNA、脂质等可能受到氧化损伤而导致正常的细胞功能受到影响(Apel et al, 2004)。若藻体内生物膜的多不饱和脂肪酸与氧自由基发生过氧化反应, 生成丙二醛(MDA), 会引起蛋白质、核酸等生命大分子的交联聚合, 加剧细胞膜的损伤, 因而MDA的含量可反映机体脂质过氧化的程度, 间接反映出细胞受损伤的程度。我们的测定结果显示不同处理条件下, H2O2含量的变化不大, 说明条斑紫菜中存在有效的氧自由基清除机制。而值得注意的是, 温度升高的条件下, 盐度25或20条件下的样本中, MDA含量出现显著增加。因此推测, 在高温(20 ℃)条件下, 藻体内抗氧化酶系统作用的发挥可能受到了抑制, 尤其在盐度降低的情况下, 会导致藻体MDA含量增加, 最终可能引起藻体膜系统受到损伤。
3.2 抗氧化酶活化是条斑紫菜抵御高温胁迫的重要机制之一植物在长期的进化过程中, 发展出了多种应对环境胁迫的保护机制。而抗氧化防御系统的活性变化被认为是植物细胞耐高温的主要机制之一, 依赖抗氧化系统的作用, 生物体内的氧化胁迫得到缓解(Sies, 1993; 臧晓南等, 2008)。本文测定发现, 条斑紫菜叶状体在高温处理4 h后, 无论SOD酶活(图 4a), 还是其转录水平(图 5a)均出现上调。然而, 在25及20的低盐度条件下, H2O2的含量却没有出现与SOD酶活相对应的上调趋势。尤其是20低盐条件下, 20 ℃处理4 h后, 其酶活显著上调, 而H2O2的含量却保持在较低水平, 说明H2O2的清除效率相对较高。同时, 高温条件下, 低盐(20)胁迫导致SOD转录水平略微下调, 暗示SOD的转录已经受到了影响。
CAT可以将H2O2转化为水和分子氧, 从而减少对细胞造成的氧化损伤。高温胁迫下, CAT活性的降低说明其对温度较敏感, 而且, 15 ℃下, CAT活性随海水盐度降低而下降, 说明其活性对盐度也较为敏感。在转录水平, 20 ℃的高温胁迫导致CAT表达在盐度25和30样本中均显著上调, 这与CAT被认为是植物热激下ROS主要清除剂的报道相一致(Gill et al, 2010)。然而, 无论在酶活水平还是在基因转录水平, CAT在高温低盐(20 ℃, 盐度20)条件下均被抑制。暗示此条件下产生的H2O2不能被CAT及时分解, 会对细胞造成一定的损伤。
POD以H2O2为电子受体, 催化H2O2直接氧化酚类或胺类化合物, 据报道, POD活性在条斑紫菜应对高温胁迫的过程中呈现先降低后升高的趋势(侯和胜等, 2008), 本实验中, 我们仅测定了高温胁迫4 h后的酶活变化, 发现在盐度25与30的条件下, 其活性变化同文献报道的结果类似(图 4d), 而盐度20条件下高温处理样本POD酶活则显著升高, 说明低盐高温胁迫可能已经造成了条斑紫菜体内抗氧化系统的失衡, POD活性的显著上调, 也解释了CAT (图 4b)在此条件下下调而H2O2含量却略微下调的原因。而在转录水平, 除盐度30外, 藻体在低盐高温度条件下的转录受到了显著抑制(图 5d), 因此, 随着胁迫时间的推移, POD酶在低盐高温条件下的表达将受到抑制, 酶活不可避免地出现下调, 最终导致氧自由基对细胞造成更为严重的损伤。
抗坏血酸过氧化物酶(APX)是叶绿体和过氧化物酶体中主要的H2O2清除酶, 以还原型抗氧坏血酸(AsA)作为电子供体将H2O2还原, 与过氧化氢酶(CAT)相比具有更高的H2O2亲和性, 很多情况下是一种更高效的H2O2清除剂(阎成士等, 1999)。其酶活与转录在在整个低盐、高温胁迫过程中显著变化, 暗示APX对于环境胁迫具有较强烈的响应, 且高温条件明显抑制了其活性, 而盐度的降低, 使得这种抑制作用更为明显(图 4c)。APX的转录在盐度20, 温度15 ℃时表达出现明显上调(图 5c), 则可能暗示在较低的温度下, 低盐已经造成了藻体的胁迫, 而在温度升高的条件下, APX的表达受到了抑制, 故而导致APX的表达显著下调。同时发现, 盐度25和30下培养的藻体, 其APX活性虽然在高温胁迫下降低, 但其表达量则呈现明显的上调(图 4c), 说明, 高温条件下APX迅速发挥功能而失活, 转录水平的上调则为其合成奠定基础, 随着胁迫时间的延长, APX酶活可能出现上调, 这与其他报道中抗氧化酶活性在胁迫条件下出现先降低后升高的趋势相同(王润豪等, 2020)。另据文献报道, 高等植物中, APX在热激条件下常被作为一种代表性的ROS清除酶被激活(Han et al, 2019)。但在盐度20的条件下培养的藻体, 其表达受到了抑制, 因而, 藻体对高温胁迫的响应受到了抑制。
谷胱甘肽还原酶(GR)以NADPH为电子供体将氧化型谷胱甘肽(GSSG)还原为还原型谷胱甘肽(GSH), 是维持谷胱甘肽还原性的重要酶, 而GSH是抗坏血酸-谷胱甘肽循环(AsA-GSH循环)的电子供体, 将脱氢型抗坏血酸(DHA)还原为AsA, 被认为是叶绿体中清除超氧阴离子和H2O2的主要途径。相对于CAT, 在15 ℃的低温条件下, 盐度变化对GR转录水平无明显影响, 而在20 ℃高温胁迫下, 不同盐度条件下GR的转录存在较大区别, 30的盐度条件下与对照相比无明显变化, 25盐度条件下, 其转录显著上调, 在20盐度条件下显著下调(图 5e)。说明细胞内抗氧化酶系统及AsA-GSH循环在低盐条件下可能受到了抑制, 导致藻体更易受到氧化损伤。
NAD(P)H氧化酶在植物应答生物或非生物胁迫中发挥重要作用(李林波等, 2010)。其功能为利用NAD(P)H为电子供体, 还原分子氧而产生O2-。是体内活性氧(ROS)的主要来源, 适量ROS具有免疫防御作用, 可作为第二信使, 使植物及时对逆境胁迫做出反应, 以适应外界环境的变化(Sagi et al, 2006)。荧光定量测定的结果显示, 不同盐度及温度对NOX基因的表达均具有显著影响。随着盐度的降低, 其表达量在15 ℃条件下呈现明显持续上调, 而在20 ℃高温胁迫下, 其表达量在盐度25至30明显上调, 但在低盐度(盐度20)条件下, 与低温条件下相比, 其表达显著下调。那么, 高温低盐条件下, 藻体内通过生成O2-进而再转化为毒性较小的过氧化氢的代谢通路可能受到了抑制。
3.3 海水盐度与高温诱发的条斑紫菜病烂发生密切相关综上所述, 条斑紫菜叶状体在盐度25与30的条件下, 短时经历高温、强光等环境因子胁迫时, 藻体内部分抗氧化酶活性及抗氧化系统关键基因的表达均呈现上调趋势, 抗氧化系统对藻体细胞起到了有效地保护作用。但当盐度降低到20时, 藻体利用NAD(P)H提供电子而生成超氧阴离子自由基的反应受到了抑制, 同时, 抗氧化系统相关酶的表达也不同程度地受到了影响, 因而不可避免地造成了MDA含量上升, 最终导致藻体细胞受到了严重的氧化损伤。
另据报道, 较高的抗氧化酶的表达, 对于坛紫菜应对水体升温导致的环境胁迫具有积极意义(杨锐, 2007; 张元等, 2011)。这是因为植物体内存在交叉适应现象, 即一种胁迫处理会诱导出植物体对另外一种或多种逆境的抗性, 因而可以通过多种胁迫预处理来增强植物对某种逆境的抵抗力(Valladares et al, 1997; Sabehat et al, 1998; Ladjal et al, 2000; 康建宏等, 2008; 张永福等, 2015)。事实上, 在紫菜人工栽培生产过程中, 人们也正是利用干出胁迫处理来提高紫菜的品质和预防病烂发生。分布于江苏南通长江入海口北部的启东、如东等沿海地区, 是我国高品质条斑紫菜主产区, 由于长江冲淡水的影响, 海区盐度一般在24—26之间(何小燕等, 2010)。栽培期间, 如遇高温降水, 很容易导致烂菜现象的发生。
4 结论在温度升高及盐度降低的双重胁迫下, 条斑紫菜藻体内抗氧化系统酶活及相关基因的表达受到抑制, 并由此导致藻体MDA含量增加, 膜系统受到损伤, 这可能是紫菜病烂发生的重要诱因之一。故在海水盐度较低的南通海区, 温度升高很容易导致紫菜病烂的发生, 而山东青岛、威海等北方海区海水盐度通常维持在30左右, 即使在遭遇高温、降雨天气时, 藻体抗氧化系统的表达受影响程度仍然较小。因此, 在同样的海水温度条件下, 山东栽培的条斑紫菜在抵御高温诱发的病烂方面, 比南通沿岸栽培的同品系条斑紫菜具有更大的优势。
王润豪, 于永昂, 胡海燕, 等. 2020. 小麦抗坏血酸过氧化物酶TaAPX基因克隆与表达分析. 华北农学报, 35(2): 48-56 |
朱建一, 严兴洪, 丁兰平, 等. 2016. 中国紫菜原色图集. 北京: 中国农业出版社, 205
|
李林波, 罗宇, 屈凌波, 等. 2010. NADH氧化酶研究进展. 河南工业大学学报(自然科学版), 31(4): 80-88 |
杨锐, 张晓龙, 徐丽宁等, 2007. 坛紫菜耐高温胁迫机理之初步研究. 见: 中国海洋湖沼学会藻类学分会第七届会员大会暨第十四次学术讨论会论文摘要集. 呼和浩特: 中国海洋湖沼学会, 1
|
何小燕, 胡挺, 汪亚平, 等. 2010. 江苏近岸海域水文气象要素的时空分布特征. 海洋科学, 34(9): 44-54 |
宋武林. 2009. 坛紫菜烂苗原因分析及预防对策. 福建水产, (2): 75-75 |
张元, 谢潮添, 陈昌生, 等. 2011. 高温胁迫下坛紫菜叶状体的生理响应. 水产学报, 35(3): 379-386 |
张永福, 黄鹤平, 银立新, 等. 2015. 温度与水分胁迫下玉米的交叉适应机制研究. 河南农业科学, 44(1): 19-24 |
张守仁. 1999. 叶绿素荧光动力学参数的意义及讨论. 植物学通报, 16(4): 444-448 DOI:10.3969/j.issn.1674-3466.1999.04.021 |
陈伟洲, 许俊宾, 吴文婷, 等. 2015. 三种紫菜叶状体对高温胁迫的生理响应. 热带海洋学报, 34(1): 49-55 DOI:10.3969/j.issn.1009-5470.2015.01.007 |
林晓明. 2014. 福鼎敏灶湾2012年坛紫菜烂菜原因初探. 福建水产, 36(3): 227-233 DOI:10.3969/j.issn.1006-5601.2014.03.010 |
郝福顺, 陈珈. 2005. 植物细胞膜NADPH氧化酶的研究进展. 植物学通报, 22(S1): 1-10 |
侯和胜, 何文君, 李洪艳, 等. 2008. 高温胁迫对条斑紫菜丝状体的生长和生理影响. 辽宁师范大学学报(自然科学版), 31(4): 487-490 |
黄林彬, 黄文, 严兴洪. 2020. 条斑紫菜两个耐高温品系的耐低盐特性. 水产学报, 44(2): 222-233 |
康建宏, 吴宏亮, 黄灵丹. 2008. 干旱预处理的玉米幼苗对逆境的交叉适应研究. 干旱地区农业研究, 26(6): 143-148 |
阎成士, 李德全, 张建华. 1999. 植物叶片衰老与氧化胁迫. 植物学通报, 16(4): 398-404 DOI:10.3969/j.issn.1674-3466.1999.04.012 |
赖平玉. 2009. 2008年秋季福鼎市坛紫菜病烂情况调查与对策. 现代渔业信息, 24(7): 6-9 DOI:10.3969/j.issn.1004-8340.2009.07.002 |
臧晓南, 张学成, 张璐, 等. 2008. 藻类高温胁迫分子响应的研究进展. 武汉大学学报(理学版), 54(6): 732-738 DOI:10.3321/j.issn:1671-8836.2008.06.024 |
Apel K, Hirt H, 2004. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annual Review of Plant Biology, 55: 373-399 DOI:10.1146/annurev.arplant.55.031903.141701 |
Berry J, Bjorkman O, 1980. Photosynthetic response and adaptation to temperature in higher plants. Annual Review of Plant Physiology, 31: 491-543 DOI:10.1146/annurev.pp.31.060180.002423 |
Burritt D J, Larkindale J, Hurd C L, 2002. Antioxidant metabolism in the intertidal red seaweed Stictosiphonia arbuscula following desiccation. Planta, 215(5): 829-838 DOI:10.1007/s00425-002-0805-6 |
Collén J, Davison I R, 1999. Stress tolerance and reactive oxygen metabolism in the intertidal red seaweeds Mastocarpus stellatus and Chondrus crispus. Plant Cell & Environment, 22(9): 1143-1151 |
Davison I R, Pearson G A, 1996. Stress tolerance in intertidal seaweeds. Journal of Phycology, 32(2): 197-211 DOI:10.1111/j.0022-3646.1996.00197.x |
Gill S, Tuteja N, 2010. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants. Plant Physiology and Biochemistry, 48: 909-930 DOI:10.1016/j.plaphy.2010.08.016 |
Han S, Park Y, Park C, 2019. Light primes the thermally induced detoxification of reactive oxygen species during development of thermotolerance in Arabidopsis. Plant and Cell Physiology, 60: 230-241 DOI:10.1093/pcp/pcy206 |
Heber U, Bilger W, Türk R et al, 2010. Photoprotection of reaction centres in photosynthetic organisms: mechanisms of thermal energy dissipation in desiccated thalli of the lichen Lobaria pulmonaria. New Phytologist, 185(2): 459-470 DOI:10.1111/j.1469-8137.2009.03064.x |
Ladjal M, Epron D, Ducrey M, 2000. Effects of drought preconditioning on thermotolerance of photosystem II and susceptibility of photosynthesis to heat stress in cedar seedlings. Tree Physiology, 20(18): 1235-1241 DOI:10.1093/treephys/20.18.1235 |
Lamb C, Dixon R A, 1997. The oxidative burst in plant disease resistance. Annual Review of Plant Physiology and Plant Molecular Biology, 48: 251-275 DOI:10.1146/annurev.arplant.48.1.251 |
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method. Methods, 25(4): 402-408 DOI:10.1006/meth.2001.1262 |
Mittler R, 2002. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, 7(9): 405-410 DOI:10.1016/S1360-1385(02)02312-9 |
Mittler R, Kim Y, Song L H et al, 2006. Gain- and loss-of-function mutations in Zat10 enhance the tolerance of plants to abiotic stress. FEBS Letters, 580(28/29): 6537-6542 |
Pfündel E, Klughammer C, Schreiber U, 2008. Monitoring the effects of reduced PS II antenna size on quantum yields of photosystems I and II using the Dual-PAM-100 measuring system. PAM Application Notes, 1: 21-24 |
Sabehat A, Weiss D, Lurie S, 1998. Heat-shock proteins and cross-tolerance in plants. Physiologia Plantarum, 103(3): 437-441 DOI:10.1034/j.1399-3054.1998.1030317.x |
Sagi M, Fluhr R, 2006. Production of reactive oxygen species by plant NADPH oxidases. Plant Physiology, 141(2): 336-340 DOI:10.1104/pp.106.078089 |
Sies H, 1993. Strategies of antioxidant defense. European Journal of Biochemistry, 215(2): 213-219 DOI:10.1111/j.1432-1033.1993.tb18025.x |
Valladares F, Pearcy R W, 1997. Interactions between water stress, sun-shade acclimation, heat tolerance and photoinhibition in the sclerophyll Heteromeles arbutifolia. Plant, Cell & Environment, 20(1): 25-36 |
Yu B, Yang J L, Niu J F et al, 2020. Antioxidant responses to hyperosmolarity stress in the intertidal Pyropia yezoensis (Bangiales, Rhodophyta). Algal Research, 48: 101930 DOI:10.1016/j.algal.2020.101930 |
 2021, Vol. 52
2021, Vol. 52


