中国海洋湖沼学会主办。
文章信息
- 林立东, 吴明江. 2021.
- LIN Li-Dong, WU Ming-Jiang. 2021.
- 基于聚类及简化基因组联合分析的浙江洞头栽培羊栖菜(Sargassum fusiforme)品系筛选研究
- THE DIVERSITY OF CULTIVATED SARGASSUM FUSIFORME STRAINS IN DONGTOU, ZHEJIANG PROVINCE BY THE COMBINATION OF AIR-BLADDER PHENOTYPE AND SIMPLIFIED GENOME
- 海洋与湖沼, 52(5): 1224-1235
- Oceanologia et Limnologia Sinica, 52(5): 1224-1235.
- http://dx.doi.org/10.11693/hyhz20210200033
文章历史
-
收稿日期:2021-02-02
收修改稿日期:2021-03-30
2. 温州大学生命与环境科学学院 温州 325035
2. College of Life and Environmental Science, Wenzhou University, Wenzhou 325035, China
羊栖菜[Sargassum fusiforme (Harvey)]为褐藻门(Phaeophyta)、圆子纲(Cyclospreae)、墨角藻目(Fucales)、马尾藻科(Sargassaceae)植物(曾呈奎, 2000)。美国学者Setchell(1931)将其归为马尾藻属(Sargassum)反曲叶亚属(Bactrophycus)中, 而日本藻类学家Okamura(1932)则将其单列为羊栖菜属(Hizikia) (吉田忠生, 2001)。目前, Algaebase数据库参考了相关文献信息(Cho et al, 2012; Dixon et al, 2014; Titlyanov et al, 2016; Huang et al, 2017), 仅采用Sargassum fusiforme拉丁名。
羊栖菜是太平洋西北沿岸特有的多年生大型褐藻, 主要分布于我国(北起辽东半岛南至广东雷州半岛)、日本(北海道南部经本州至九州)和朝鲜半岛(东岸、南岸及西南岸)近岸海域(曾呈奎, 2000)。目前, 羊栖菜野生种群主要分布于我国辽宁省大连市长海县獐子岛, 山东省烟台市长岛列岛、威海荣成市镆铘岛和苏山岛, 浙江省舟山市嵊泗列岛、枸杞岛、嵊山岛(种群数量最多)、温州市洞头列岛(中国最大人工栽培基地)和南麂列岛, 福建省漳浦县古雷半岛、福州市马祖岛和黄岐岛、漳州市东山岛, 广东省汕头市南澳岛、湛江市硇洲岛等地(李生尧等, 2010; 于深辉, 2012; 徐佳丽等, 2014; 南春容等, 2015)。日本羊栖菜野生种群主要分布于北海道南部近海海域, 九州岛长崎野母崎、长崎壹岐岛和对马岩原町岛近岸海域。韩国羊栖菜野生种群主要分布于全罗南道省南部和济州岛(韩国最大人工栽培基地)近岸海域。
羊栖菜为食药两用海藻, 被推崇为益寿食品, 我国的《神农本草经》和《本草纲目》中记载了羊栖菜的疗效(林立东等, 2019)。日本民众食用羊栖菜的历史悠久, 将羊栖菜美誉为“长寿菜”(何丹等, 2016), 并将每年的9月15日定为羊栖菜节, 16岁成人礼要食羊栖菜。近年来, 日本羊栖菜市场的进口需求总量约4 500 t/年。浙江洞头于1987年首例实现野生羊栖菜干品出口日本贸易, 于1989年开始以野生羊栖菜为苗种的试验栽培, 成为我国最大的羊栖菜栽培、收购、加工和出口基地(杨志林, 1993)。1989—2000年间栽培苗种主要依赖采集各地野生苗及假根再生苗, 尤以浙江、福建沿海地区野生苗长势最好、产量最高、品质最佳(何培民等, 2018)。2000年以后羊栖菜有性生殖培苗技术逐渐成熟, 成为生产用苗种的主要来源。早期来自不同地域野生苗的基因在世代有性生殖过程中彼此交流, 形成了浙江洞头栽培羊栖菜品系的多样性。本文运用“特征”大气囊表型和简化基因组联合分析方法, 系统归纳了浙江洞头栽培羊栖菜群体品系特征, 以期为开展栽培羊栖菜品系多样性与结构, 品系间亲缘关系、优良品系筛选、品系生殖与繁衍特征、遗传稳定性和品质差异等基础研究, 以及遗传育种、农业新品种选育、品系纯化与扩繁等应用研究, 提供方法和理论支撑。
1 材料与方法 1.1 栽培羊栖菜品系“特征”大气囊的选取、测量与样品差异聚类分析基于作者前期授权的国家发明专利“一种羊栖菜的品系鉴别和分类方法”(ZL201511004442.4) (林立东等, 2018), 以孢子体器官(假根、茎、气囊、生殖托等)方差贡献率最大的“特征”大气囊表型为标准, 2018年4月2日, 挑选浙江洞头栽培羊栖菜多态性植株21个, 置4 ℃保存; 再分别选取各样品二级侧生枝“特征”大气囊(≥10支) (图 1), 置于事先注入适量新鲜过滤海水的培养皿中, 拍照记录形态(图 2); 选取羊栖菜各样品10支“特征”大气囊, 参照测量单个气囊总长、囊尖长、囊体长、囊体宽、囊柄长及鲜重, 记录数据, 计算均值与标准差, 均值数据代入SPSS16.0统计软件, 距离阈值T=0.9, 聚类判定样品表型差异。
 |
| 图 1 栽培羊栖菜侧生茎和“特征”大气囊 Fig. 1 Lateral stem and characteristic big air-bladder of cultivated S. fusiforme 注: ①一级侧生茎; ②二级侧生茎; ③一级侧生茎“特征”大气囊; ④二级侧生茎“特征”大气囊 |
 |
| 图 2 栽培羊栖菜“特征”大气囊形态 Fig. 2 Characteristic big air-bladder morphologys of cultivated Sargassum fusiforme 注: 序号简标SF1—SF21表示样品编号S. fusiforme 1—S. fusiforme 21 |
于2017年11月和2018年4月份两个批次采集样品, 共计34个样品(表 1)。取各样品侧生枝20 g, 置封口袋封存, 置4 ℃保存待测。
| 采样批次 | 采样地点 | 样品种类 | 样品数量(个) |
| 2017年11月23日 | 浙江洞头鹿西乡 | 传统栽培羊栖菜幼孢子体 | 3 |
| 浙江舟山嵊泗县 | 野生羊栖菜孢子体 | 1 | |
| 辽宁大连长海县 | 野生羊栖菜幼孢子体 | 2 | |
| 浙江洞头 | 自育齿缘叶幼孢子体 | 1 | |
| 浙江洞头 | 细棒形叶幼孢子体 | 1 | |
| 浙江洞头 | 粗棒形幼孢子体 | 1 | |
| 2018年4月2日 | 浙江洞头 | 选育羊栖菜样品 | 11×2 (含3个单株重复样品) |
| 韩国丽水市 | 羊栖菜野生苗 | 6 |
精确称取叶片或气囊1.0 g, 置于液氮预冷的研钵中研磨成粉末; 转入2 mL离心管中, 加入750 µL CTAB溶液(用前预热至65 ℃, 并加入3%—5% β巯基乙醇), 涡旋混匀; 65 ℃恒温水浴30 min后, 加入700 µL的氯仿: 异戊醇(24 : 1), 摇至乳白色; 4 ℃、10 000 r/min离心10 min, 取上清液650 µL置2 mL离心管中, 加入预冷异丙醇700 µL, 再加3 mol/L NaAc 100 µL, 加盖, 轻轻混匀, 至白色絮状沉淀析出; 缓慢挑出白色絮状沉淀至1.5 mL离心管(预先加入1 mL 70%酒精), 轻摇洗去杂质; 4 ℃、12 000 r/min离心10 min, 倒掉酒精, 将沉淀DNA置阴凉通风处, 使酒精全部自然挥发; 加入含有0.5% RNA消化酶的T.E溶液, 于4 ℃溶解DNA 12 h, 将溶解好的DNA进行SDS电泳检测, 待用。
1.2.3 羊栖菜样品的简化基因组测序与DNA文库构建利用参考基因组序列模拟各种限制性内切酶的酶切位点的数量与分布, 选择合适的酶进行酶切建库; 本实验采用Reads1端EcoRI (G^AATTC)和Read2端NlaIII (Hin1II, CATG^)进行双酶切。质检合格的DNA样品, 采用ddRAD建库方式构建长度范围在300—500 bp的pair-end文库。具体实验内容包括: (1) 取DNA 500 ng, 加入0.6 U EcoRI (NEB)、T4 DNA连接酶(NEB)、ATP (NEB)和EcoRI接头(含区分样品的Index序列), 37 ℃反应3 h, 65 ℃退火1 h; 然后加限制性内切酶NlaIII (NEB)和NlaIII接头在37 ℃下反应3 h, 反应结束后在65 ℃ PCR仪中放置30 min失活内切酶。(2) 使用琼脂糖凝胶电泳对连接产物进行片段选择, 选择400—600 bp回收酶切产物。(3) 使用Qubit3.0 (Life Technology)对回收产物进行DNA定量, 等量混合34个样品。(4) 使用Illumina TruSeq试剂盒对混合产物进行DNA文库构建。
1.2.4 羊栖菜样品的简化基因组系统进化树分析(1) 信息分析: 对测序得到的原始reads (双端序列)进行数据评估, 得到各个样品的原始reads, 将reads进行比对聚类, 获得ddRAD片段后进行SNP检测。
(2) 系统进化分析: 基于SNP, 通过FastTree软件, 做样品间的系统进化分析, 计算得到群体进化树。
1.3 栽培羊栖菜品系学名命名根据林奈(Carl von Linné)的“双名法”, 采用羊栖菜拉丁文“Sargassum fusiforme”命名规则, 对浙江洞头栽培羊栖菜5个品系进行命名。“Sargassum”为属名拉丁文, “fusiforme”为种加词, 属形容词, 中文解释为梭形的、纺锭状的或两端渐细的。据此, 本文采用“属名+种加词(adj)+命名人+新品系标识”规则予以学名命名, 并对命名品系加以“模式指定”。
2 结果 2.1 浙江洞头栽培羊栖菜样品的“特征”大气囊表型指标浙江洞头栽培羊栖菜样品二级侧枝“特征”大气囊表型包括气囊总长、囊尖长、囊体长、囊体宽、囊柄长和气囊鲜重6个指标, 测量结果显示不同样品表型参数差异较大(表 2)。各样品气囊总长介于(22.57±2.85)—(56.65±3.09) mm, 有尖或无尖, 囊尖长度介于(2.57±1.34)—(13.47±2.11) mm, 囊体长介于(8.82±0.36)—(27.86±1.23) mm, 囊体宽介于(2.50±0.28)—(5.60±0.48) mm, 囊柄长介于(8.00±2.49)—(28.24±2.72) mm, 鲜重介于(43.70±10.00)—(200.80±20.00) mg。
| 样品编号 | 总长(mm) | 囊尖长(mm) | 囊体长(mm) | 囊体宽(mm) | 囊柄长(mm) | 鲜重(mg) | 样品群体占比(%) | “特征”大气囊形态特征 | 样品分类名称 |
| SF1 | 56.65±3.09 | 8.25±2.18 | 19.58±1.66 | 4.09±0.37 | 28.24±2.72 | 200.80±16.70 | 4.76 | 气囊黄褐色; 总长较长; 囊体梭镖形或棒形, 囊柄最长; 单枝气囊鲜重最重。 | 梭镖形囊羊栖菜 |
| SF2 | 26.87±5.22 | 2.57±1.34 | 10.59±0.75 | 5.60±0.48 | 12.69±4.31 | 113.50±21.88 | 28.57 | 气囊深褐色或黄褐色; 总长普遍较短, 个别植株 | 球形囊羊栖菜 |
| SF3 | 22.57±2.85 | 5.16±1.52 | 8.82±0.36 | 5.20±0.32 | 8.00±2.49 | 92.50±13.63 | 相对较长; 有囊尖或无囊尖; 囊体卵圆形或近卵 | ||
| SF4 | 24.99±0.93 | 4.51±0.58 | 11.60±0.77 | 4.90±0.21 | 8.44±1.01 | 72.90±5.53 | 圆形; 不同植株囊柄长短不同。 | ||
| SF5 | 23.22±2.47 | 0.00 | 13.82±0.83 | 5.46±0.15 | 8.24±1.76 | 139.20±39.14 | |||
| SF6 | 28.73±2.32 | 5.29±0.67 | 9.45±0.94 | 3.09±0.30 | 12.47±2.40 | 51.20±4.83 | |||
| SF7 | 26.38±2.14 | 6.01±1.14 | 11.23±1.58 | 2.50±0.28 | 8.97±1.16 | 43.70±12.28 | |||
| SF8 | 43.49±2.80 | 0.00 | 22.16±1.35 | 4.78±1.33 | 19.92±3.16 | 184.70±35.25 | 19.05 | 气囊褐色或黄褐色; 整体呈锥形; 尖囊一体, 囊 | 锥形囊羊栖菜 |
| SF9 | 42.51±4.37 | 0.00 | 27.86±1.23 | 3.30±0.23 | 13.77±4.49 | 126.30±33.13 | 柄长度短于囊体; 个别植株囊体呈双锥体连接形。 | ||
| SF10 | 37.08±3.49 | 0.00 | 24.81±1.06 | 3.38±0.38 | 12.68±1.91 | 98.20±14.58 | |||
| SF11 | 34.90±2.80 | 0.00 | 22.36±1.61 | 4.36±0.48 | 12.10±2.37 | 149.10±32.65 | |||
| SF12 | 34.07±4.10 | 6.13±1.20 | 12.50±0.69 | 4.18±0.18 | 15.13±1.87 | 106.40±10.09 | 19.05 | 气囊褐色或黄褐色; 总长相对较短; 囊体和囊 | 狭棒形囊羊 |
| SF13 | 36.10±4.03 | 3.80±1.22 | 13.46±0.68 | 3.96±0.41 | 17.53±3.89 | 82.50±8.82 | 柄界限明显; 囊体棒形, 囊体宽度狭窄, 长度普 | 栖菜(SF15与SF1 | |
| SF14 | 36.27±1.98 | 13.47±2.11 | 10.21±1.15 | 2.63±0.23 | 11.07±1.11 | 51.50±6.59 | 遍较短。 | 形态特征相近) | |
| SF15 | 33.31±2.23 | 9.41±1.61 | 10.40±0.67 | 4.45±0.23 | 12.30 ±0.95 | 110.60±12.78 | |||
| SF16 | 40.17±4.38 | 9.81±1.12 | 14.13±1.02 | 4.30±0.48 | 15.56±4.15 | 129.30±16.51 | 28.57 | 气囊褐色或黄褐色; 总长较长; 囊尖、囊体和囊 | 宽棒形囊羊栖菜 |
| SF17 | 43.29±7.51 | 9.58±2.38 | 12.99±0.93 | 3.07±0.26 | 20.02±6.39 | 97.00±17.75 | 柄界限明显; 囊体棒形, 囊体较长、较宽。 | ||
| SF18 | 45.57±3.26 | 12.36±2.46 | 16.94±2.47 | 2.87±0.28 | 14.96±1.69 | 91.60±10.18 | |||
| SF19 | 46.31±4.44 | 7.70±1.49 | 16.86±1.12 | 5.70±0.61 | 21.26±4.18 | 166.70±26.70 | |||
| SF20 | 45.14±3.24 | 9.43±1.73 | 19.19±1.30 | 4.40±0.26 | 15.86±1.17 | 166.50±23.77 | |||
| SF21 | 47.68±2.49 | 8.17±2.03 | 20.88±1.75 | 4.11±0.34 | 18.28±1.97 | 163.80±11.85 |
依据气囊颜色、总长、有无囊尖、囊体性状和囊柄长短5个方面的差异, 将洞头栽培羊栖菜样品“特征”大气囊初步划分为梭镖形、卵圆形、锥形、狭棒囊形和宽棒囊形5种“特征”大气囊表型。梭镖形表型样品占比总样品数最少, 为4.76%, 卵圆形和宽棒囊形表型样品占比最高, 分别为28.57%, 锥形囊和狭棒囊形表型样品占比居中, 分别为19.05%。
2.2 浙江洞头羊栖菜样品的“特征”大气囊表型指标参数聚类分析羊栖菜样品“特征”大气囊表型参数聚类分析结果如图 3所示。根据系统聚类最短距离法判定分析如下:
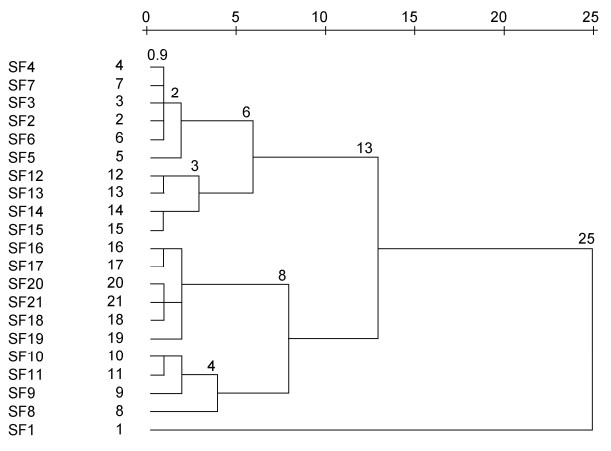 |
| 图 3 平均(不同群间)重新标度距离聚类树状图 Fig. 3 Dendrogram using average (between groups) rescaled distance cluster combining |
当T=0.9时, 21个样品各成一个表型品系; 当0.9≤T < 2.0时, 21个样品可分成11个表型品系, 即: 品系1 (SF2、SF3、SF4、SF6和SF7)、品系2 (SF5)、品系3 (SF12和SF13)、品系4 (SF14和SF15)、品系5 (SF16和SF17)、品系6 (SF18、SF20和SF21)、品系7 (SF19)、品系8 (SF10和SF11)、品系9 (SF9)、品系10 (SF8)及品系11 (SF1)。
当2.0≤T < 3.0时, 21个样品可分成7个表型品系, 即: 品系1 (SF2、SF3、SF4、SF5、SF6和SF7)、品系2 (SF12和SF13)、品系3 (SF14和SF15)、品系4 (SF16、SF17、SF18、SF19、SF20和SF21)、品系5 (SF9、SF10和SF11)、品系6 (SF8)和品系7 (SF1)。
当3.0≤T < 4.0时, 21个样品可分成6个表型品系, 即: 品系1 (SF2、SF3、SF4、SF5、SF6和SF7)、品系2 (SF12、SF13、SF14和SF15)、品系3 (SF16、SF17、SF18、SF19、SF20和SF21)、品系4 (SF9、SF10和SF11)、品系5 (SF8)和品系6 (SF1)。
当4.0≤T < 6.0时, 21个样品可分成5个表型品系, 即: 品系1 (SF2、SF3、SF4、SF5、SF6和SF7)、品系2 (SF12、SF13、SF14和SF15)、品系3 (SF16、SF17、SF18、SF19、SF20和SF21)、品系4 (SF8、SF9、SF10和SF11)和品系5 (SF1)。
当6.0≤T < 8.0时, 21个样品可分成4个表型品系, 即: 品系1 (SF2、SF3、SF4、SF5、SF6、SF7、SF12、SF13、SF14和SF15)、品系2 (SF16、SF17、SF18、SF19、SF20和SF21)、品系3 (SF8、SF9、SF10和SF11)和品系4 (SF1)。
当8.0≤T < 13.0时, 21个样品可分成3个表型品系, 即: 品系1 (SF2、SF3、SF4、SF5、SF6、SF7、SF12、SF13、SF14和SF15)、品系2 (SF16、SF17、SF18、SF19、SF20、SF21、SF8、SF9、SF10和SF11)和品系3 (SF1)。
当13.0≤T < 25时, 21个样品可分为2个表型品系, 即: 品系1 (SF2、SF3、SF4、SF5、SF6、SF7、SF12、SF13、SF14、SF15、SF16、SF17、SF18、SF19、SF20、SF21、SF8、SF9、SF10和SF11)、品系2 (SF1)。
当T≥25时, 21个样品仅为1个表型品系。
以阈值T=0.9为基数, T值距离2.0、3.0、4.0、6.0、8.0、13.0和25.0之间的相似度分别为45%、30%、22.5%、15%、11.25%、6.9%和3.6%, 差异贡献率(KMO, Kaiser-Meyer-Olkin)分别为55%、70%、77.5%、85%、88.75%、93.1%、96.4%。参照Kaiser的KMO检验统计变量是否适合因子分析的5级判定标准(本组设定KMO > 90%, 非常适合分类; 85%≤KMO≤90%, 适合分类; 80%≤KMO < 85%, 一般适合分类; 75%≤KMO < 80%, 不太适合分类, 比较勉强; KMO < 75%, 不适合分类), 作为栽培羊栖菜“特征”大气囊表型品系聚类分类判定标准, 即: 4.0≤T < 6.0时, 差异贡献率为85%, 符合“适合分类”标准。
依据以上聚类分析结果和Kaiser的判定标准, 本文将浙江洞头栽培羊栖菜“特征”大气囊表型品系分为5类, 即: 表型品系1-球囊形羊栖菜(SF2、SF3、SF4、SF5、SF6和SF7)、表型品系2-狭棒囊羊栖菜(SF12、SF13、SF14和SF15)、表型品系3-宽棒囊羊栖菜(SF16、SF17、SF18、SF19、SF20和SF21)、表型品系4-锥形囊羊栖菜(SF8、SF9、SF10和SF11)和表型品系5-梭镖形羊栖菜(SF1)。
2.3 羊栖菜样品的简化基因组测序和系统进化树分析 2.3.1 ddRAD标记多态性统计羊栖菜样品间的Tag标签进行比对聚类(blat软件), 聚类时将identity在95%以上的Tag标签聚类成Marker(标记), 且将小于2个Tag标签的标记定义为非多态性标记, 其余为多态性标记。羊栖菜34个样品ddRAD标记多态性结果(表 3)表明, 非多态性标记(nonPoly)数量为225 328, 总测序深度为11 712 620, 平均深度为52; 多态性标记(Poly)数量为167 777, 总测序深度为30 773 677, 平均深度为183。
| 标记类型 | 标记数量 | 总测序深度 | 平均深度 |
| 非多态性标记 | 225 328 | 11 712 620 | 52 |
| 多态性标记 | 167 777 | 30 773 677 | 183 |
羊栖菜34个样品Marker数量均不相同(图 4), 且差异显著, 其中较多Marker数量样品包括R16、R17、R18、R19和R24 (随机编组, 详见图 4), 数量分别为140 962、151 815、145 605、139 360和115 548; 较少Marker数量样品包括R01、R02、R03、R04和R06, 数量分别为17 852、17 945、23 654、20 724和28 170, 其他样品Marker数量介于二者之间。
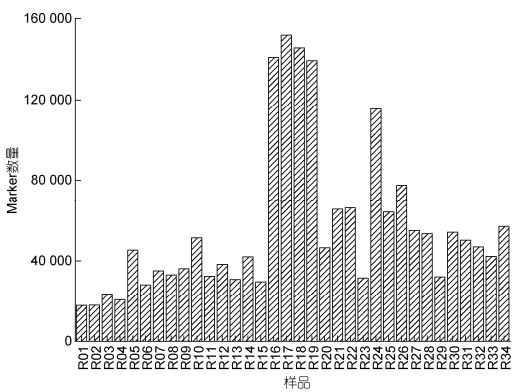 |
| 图 4 羊栖菜样品间的Marker深度分布 Fig. 4 Marker depth distribution between S. fusiforme samples |
浙江洞头栽培羊栖菜、野生羊栖菜(韩国丽水、辽宁大连和浙江舟山)及栽培羊栖菜幼孢子体简化基因组系统进化树特征表明(图 5), 浙江洞头栽培羊栖菜样品与不同地域野生羊栖菜之间具有不同的亲缘关系; 根据简化基因组进化树最远距离特征, 全部样品具备5个典型基因型品系聚类特征, 即: 基因型品系1 (韩国野生羊栖菜1和5, 鹿西培育幼孢子体1、2和3, SF1、SF4、SF6和SF7)、基因型品系2 (舟山野生幼孢子体, 自育齿缘叶、细棒叶和粗棒叶幼孢子体, SF2、SF17、SF20和SF21)、基因型品系3 (SF8、SF9、SF10、SF11和SF18)、基因型品系4 (韩国野生羊栖菜2、3和4, SF15)和基因型品系5 (大连野生羊栖菜1和2, SF14)。
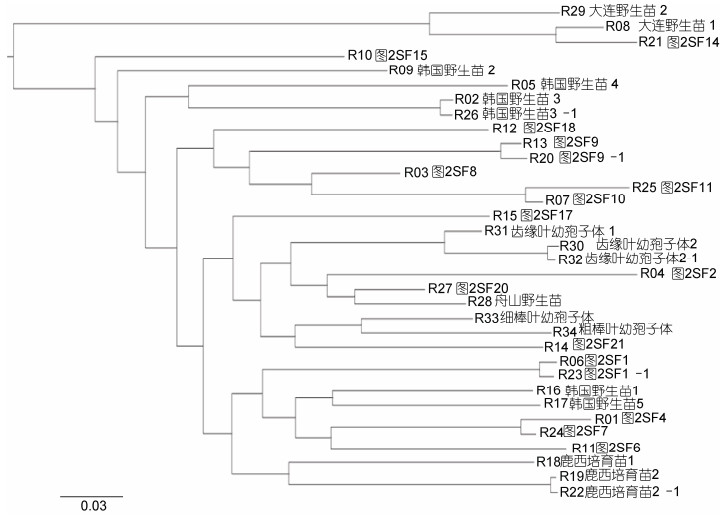 |
| 图 5 羊栖菜样品的简化基因组系统进化树 Fig. 5 A simplified genome phylogenetic tree of S. fusiforme samples 注: 韩国野生苗3-1为韩国野生苗3的重复检测, 齿缘叶幼孢子体2-1为齿缘叶幼孢子体2的重复检测, 鹿西培育苗2-1为鹿西培育苗2的重复检测, 图SF9-1为图SF9的重复检测, 图SF1-1为图SF1的重复检测 |
通过对韩国野生羊栖菜样品3、栽培羊栖菜样品1与样品9、洞头栽培羊栖菜齿缘叶幼孢子体和鹿西培育羊栖菜幼孢子体等5个同株样品简化基因组重复测序, 结果表明不同样品简化基因组遗传距离差异显著, 而同株不同部位的简化基因组无差异(图 5)。
2.4 浙江洞头栽培羊栖菜的基因型品系与表型品系比较分析栽培羊栖菜基因型品系1中R01 (SF4)、R11 (SF6)和R24 (SF7)样品的基因型与表型品系1相符, R06 (SF1)样品的基因型与表型品系1不符, 四者基因遗传距离不同, 但亲缘关系较近, 且四者均与韩国野生羊栖菜和鹿西培育羊栖菜具有较近的亲缘关系。
栽培羊栖菜基因型品系2中R15 (SF17)、R27 (SF20)和R14 (SF21)样品的基因型与表型品系3分类相符, R04 (SF2)样品的基因型与表型品系3不符, 四者基因遗传距离不同, 但亲缘关系较近, 且四者均与舟山野生羊栖菜及自育齿缘叶、细棒叶、粗棒叶羊栖菜幼孢子体亲缘关系较近。
栽培羊栖菜基因型品系3中R03 (SF8)、R13 (SF9)、R07 (SF10)和R25 (SF11)样品的基因型与表型品系4相符, R12 (SF18)样品的基因型与表型品系4不符, 5者基因遗传距离不同, 但亲缘关系较近, 且5者均与韩国、大连和舟山野生羊栖菜之间具有较远的亲缘关系。
栽培羊栖菜基因型品系4中R10 (SF15)样品的基因型与表型品系5相符, 它与韩国野生羊栖菜2、3和4样品的亲缘关系较近, 它们与韩国野生羊栖菜本1和5样品相比, 呈同源产地、不同样品间基因遗传距离不同的特征。
栽培羊栖菜基因型品系5中R21 (SF14)样品的基因型与表型品系2相符, 它的基因遗传距离最大, 基因型与大连野生羊栖菜基因型接近。
样品基因型与样品表型品系间重合度结果表明, 基因型品系1与样品表型品系1、基因型品系2与样品表型品系3、基因型品系3与样品表型品系4、基因型品系4与样品表型品系5及基因型品系5与样品表型品系2之间的重合率分别为75%、100%、75%、80%、100%, 样品平均总重合率为86%。
2.5 浙江洞头栽培羊栖菜的5个典型品系学名命名综合上述研究结果, 本文将浙江洞头栽培羊栖菜划分为球囊羊栖菜、锥囊羊栖菜、宽棒囊羊栖菜、窄棒囊羊栖菜和梭镖囊羊栖菜5个品系(表 4); 根据生物学分类及等级关系、林奈的动植物“双名法”及品系“模式指定”要求(Singh, 2004), 对5个新划分的栽培羊栖菜品系并加以学名命名和模式指定。
| 编号 | 品系名称 | 品系学名 | 模式指定 |
| 1 | 球囊羊栖菜 | Sargassum sphaer-bladder L. D. Lin et M. J. Wu, spp. nov. |  |
| 2 | 锥囊羊栖菜 | Sargassum turgidum-bladder L. D. Lin et M. J. Wu, spp. nov. |  |
| 3 | 宽棒囊羊栖菜 | Sargassum wide-cylindrical L. D. Lin et M. J. Wu, spp. nov. |  |
| 4 | 窄棒囊羊栖菜 | Sargassum strictures-cylindrical L. D. Lin et M. J. Wu, spp. nov. |  |
| 5 | 梭镖囊羊栖菜 | Sargassum dart-shaped bladder L. D. Lin et M. J. Wu, spp. nov. |  |
浙江洞头于1989年起以野生羊栖菜幼孢子体为苗种, 率先在国内探索性栽培羊栖菜(李生尧, 2001)。1989—1994年间, 在出口市场需求驱动下, 羊栖菜栽培面积逐年扩大, 羊栖菜苗种的需求量也越来越大, 羊栖菜苗种的采集地也从温州本土拓展到中国、日本和韩国等沿海地区, 形成了洞头栽培羊栖菜群体亲本的多样性来源, 使得现有栽培羊栖菜群体“特征”大气囊表型呈现出了多样性特征。
关于马尾藻属海藻的形态描述, 尚无统一标准。单体锋等(2009)采用羊栖菜藻体鲜重、藻体长度、侧枝密度、侧枝长度和侧枝鲜重等5个藻体性状指标, 描述不同品系差异(单体锋等, 2009)。李生尧等(2010)报道了“鹿丰1号”羊栖菜, 详细描述了枝叶粗壮繁茂、气囊产生早、颗粒大、产量高等性状特征, 且与舟山东福和嵊山野生种源羊栖菜比对了“特征”大气囊、主枝和侧枝的直径、长度和总量等基础数据, 但未采用科学方法进行主成分分析, 无法进行“特征”大气囊表型辨别和验证, 致使“鹿丰1号”羊栖菜品系信息至今停留在基础数据层面。Yao等(2019)运用RAPD和ISSR标记技术对洞头栽培羊栖菜品系进行了遗传分析, 但未对所用的两个鹿丰1号植株样品及另外两个羊栖菜样品的表型特征作出明确描述(Yao et al, 2019)。现有洞头栽培羊栖菜群体多样性研究报道表明, 洞头栽培羊栖菜群体“特征”大气囊表型多样性客观存在, 但仅有Li等(2018)在关于不同形态气囊褐藻羊栖菜生物活性物质及营养成分的比较研究中, 列举了两个样品的枝状体, 其他研究报道均未明确标识羊栖菜表型主成分“特征”大气囊的形态特征。
本文以“同种生物同一性状的不同表现形式称为相对性状”为理论依据(林立东等, 2018), 在多年跟踪监测栽培羊栖菜样品季节性单株鲜重、干重、长度、侧生枝数、茎宽、假根长度, 以及“特征”大气囊的总长度、宽度、囊尖长度、囊柄长度和鲜重等11项性状指标基础上, 通过羊栖菜成熟孢子体性状指标相关性数学模型、主成分数学模型、主成分聚类数学模型等综合分析, 确定羊栖菜性状指标中“特征”大气囊表型为性状主成分, 贡献率最高。上述判定符合栽培羊栖菜成熟藻体周身气囊, 气囊簇生, 每簇着生1—2支“特征”大气囊的特征描述(林立东等, 2020)。本研究以栽培羊栖菜“特征”大气囊表型和指标数据作为品系划分依据, 首创了定性+定量联合判定栽培羊栖菜品系表型方法, 使表型品系分类更加符合现代植物学、植物分类学和生物统计学的交叉学科特征, 补充了传统植物分类学仅依据直根或须根、单主茎或多主茎、叶对生或互生、花萼三基数或五基数和果实单心皮或两心皮等过于简单的定性定量分类的不足。
洞头栽培羊栖菜“特征”大气囊表型差异表明, 来源于同一地点的野生羊栖菜, 经驯化栽培, “特征”大气囊表型不尽相同。本研究通过栽培羊栖菜群体简化基因组分析表明, 洞头栽培羊栖菜球囊形、粗棒囊形和狭棒囊形品系分别与韩国丽水、浙江舟山和辽宁大连等地野生羊栖菜的亲缘关系较近; 联合分析结果表明, 羊栖菜基因型品系样品与表型品系样品之间的总重合率为86%, 说明当年采自上述三地的野生苗种在洞头虽历经三十年的杂交及有性生殖繁衍, 仍保持遗传的相对稳定性。然而, 控制气囊表型的基因定位, 以及不同“特征”大气囊表型羊栖菜间经有性生殖产生的子代基因型属“父系遗传”, 还是属“母系遗传”等问题尚未见文献报道, 还有待深入研究。
3.2 浙江洞头栽培羊栖菜群体的遗传多样性浙江洞头栽培羊栖菜品系遗传多样性问题一直深受国内研究者们的密切关注。单体锋等(2009)运用AFLP法研究了浙江洞头羊栖菜1个代表性栽培群体的遗传多态性, 多态位点比率为93.8%; 吕慧等(2009)运用RAPD技术研究了浙江洞头羊栖菜栽培中常见的3个品系的遗传多样性, 多态位点比率为84.4%; 徐佳丽等(2014)研究了5种不同品系羊栖菜(原始采集地分别是韩国、浙江洞头、浙江南麂列岛、浙江东极岛及广东汕头)的遗传多样性, 多态性比率为58.9%; 于深辉(2012)运用ISSR技术研究了我国北起辽宁南至广东沿海的9个野生羊栖菜种群遗传多样性, 多态性比率为99.61%; 南春容等(2015)运用ISSR技术对浙江洞头羊栖菜野生与选育种群的研究表明, 浙江南麂岛和浙江竹屿岛野生羊栖菜遗传相似度最大, 二者与洞头栽培羊栖菜三个品系间遗传距离较远。
上述研究结果表明, 地理隔离限制了群体间基因流动, 形成了自然种群独特的遗传特征, 因而野生羊栖菜群体的遗传变异性和遗传多样性普遍高于栽培羊栖菜, 种群间的遗传分化大于种群内。上述2009年的研究数据显示, 无论采用哪种分子标记技术和哪种样品采集方式, 浙江洞头栽培羊栖菜品系较之野生型羊栖菜的遗传多态性比例降低约15%, 2014年降低了40%, 说明早期采自各地的野生羊栖菜在有性生殖繁育过程中发生了基因流动, 且随着时间推移基因流动性会越来越大, 栽培群体的遗传多态性越来越低。
上述研究报道中, 样本的选择要么都是栽培样本, 要么都是野生样本; 即便是存在选用两类样本对比分析的情况, 样本采集量却不够全面。为了全视野地分析现阶段浙江洞头栽培羊栖菜群体遗传多态性, 深层次地挖掘栽培羊栖菜群体的亲本来源及遗传分化与变异规律, 本文全面选取浙江洞头栽培羊栖菜、野生羊栖菜(韩国丽水、辽宁大连和浙江舟山)及栽培羊栖菜幼孢子体等样品, 构建了大样本简化基因组系统进化树, 确立了5个基因型品系。韩国丽水、辽宁大连和浙江舟山野生羊栖菜遗传多样性差异较大, 体现了地理隔离对群体间基因流动的限制, 从而形成了自然种群独特的遗传特征; 韩国野生羊栖菜样品与本地选育的羊栖菜优良品系遗传关系较近, 说明早期来自韩国的羊栖菜苗种在人工有性生殖培育进程中得以基因延续, 该特征既体现了韩国羊栖菜遗传的相对稳定性, 又体现了在韩国羊栖菜深受国际市场青睐背景下, 科研单位和育种企业对韩国羊栖菜的长期性定向选育和示范推广。
3.3 浙江洞头栽培羊栖菜样品、系、种和新品种的关系与学名命名羊栖菜基因与环境之间存在着复杂的相互作用, 精细地调控着枝状体的性状, 即: 表型=基因型+环境因素。浙江洞头栽培羊栖菜“特征”大气囊表型多样性说明, 不同地源野生羊栖菜对洞头海洋环境均有适应性, 在长期繁衍过程中均表现出了多样性的气囊表型, 而不同“特征”大气囊表型植株间的基因组亲缘关系有近有远, 存在与野生羊栖菜较近的栽培样品。羊栖菜植株的生长发育呈非同步性, 簇生气囊的生长发育呈渐变性, 使得相同培育批次、相同生长环境、相同生长时间的羊栖菜植株之间“特征”大气囊表型不尽相同。因此, 洞头栽培羊栖菜群体的表型和遗传特征极具复杂性。有关基础研究若无科学的表型和基因型判定依据, 所采集的植株仅能定义为生物统计学中的样品或样本。生物学分类单位及层次关系包括: 界(Kingdom)、门(Phylum或Division)、纲(Class)、目(Order)、科(Family)、族(Tribe)、属(Genus)、组(Section)、系(Series)、种(Species)、变种(Variety)、变型(Form)、栽培品种(Cultivar) (陆宝树, 1990)。羊栖菜分类为马尾藻属, 为单支属海藻。本文通过表型和基因型双重判定法, 将洞头羊栖菜栽培群体划分为“系”或“品系”。被确认的“系”经多年选育、纯化、扩繁和示范推广, 获得了稳定表型、基因型、产量和营养品质等特征后, 可申请认定为生物学分类中的“种”; 若再具备稳定的纯化与繁育基地, 多态性(多地区)栽培、规模化栽培及获得显著的经济效益等条件, 经国家良种审定委员会审定, 可认定为新品种。
现有涉及栽培羊栖菜“品系”的相关文献报道, 所使用的栽培羊栖菜样品均来自于浙江洞头, 未出现其他地区栽培样品信息, 这一研究样品信息, 符合生物学分类中“系”的生境限定要求。本文在气囊表型和基因型双重判定基础上, 将浙江洞头栽培羊栖菜群体系统划分了5个品系(表 4), 在林奈的“双名法”规则基础上, 分别予以学名命名, 为栽培羊栖菜的生物学研究及育种实践应用提供了更加准确的品系分类信息。
4 结论羊栖菜性状差异的主成分为簇生气囊中的“特征”大气囊。浙江洞头栽培羊栖菜群体“特征”大气囊表型多样性源于多样性地源种的混杂栽培; 不同地源野生羊栖菜对洞头海洋环境均有适应性, 在长期繁衍过程中均表现出了多样性的“特征”大气囊表型; 不同“特征”大气囊表型植株简化基因组之间的亲缘关系有近有远, 群体中存在与野生羊栖菜较近的栽培样品。浙江洞头栽培羊栖菜表型品系和基因型品系的总重合率为86%, 适合品系多样性分类条件。浙江洞头栽培羊栖菜群体可分球囊(Sargassum sphaer-bladder L. D. Lin et M. J. Wu, spp. nov.)、锥囊(Sargassum turgidum-bladder L. D. Lin et M. J. Wu, spp. nov.)、宽棒囊(Sargassum wide-cylindrical L. D. Lin et M. J. Wu, spp. nov.)、狭棒囊(Sargassum strictures-cylindrical L. D. Lin et M. J. Wu, spp. nov.)和梭镖囊羊栖菜(Sargassum dart-shaped bladder L. D. Lin et M. J. Wu, spp. nov.) 5个品系。浙江洞头栽培羊栖菜5个品系均具有稳定的表型、生活史、产量和生化组成等特征, 若长期纯化、扩繁和示范推广, 均可培育为新品种。
于深辉, 2012. 羊栖菜分类地位及铜藻和羊栖菜种群遗传的研究. 青岛: 中国科学院研究生院(海洋研究所)博士学位论文
|
吕慧, 姚建亭, 刘福利, 等. 2009. 羊栖菜养殖品系DNA指纹图谱的研究. 海洋科学, 33(12): 30-33 |
李生尧. 2001. 羊栖菜生产性育苗技术研究. 浙江海洋学院学报(自然科学版), 20(3): 251-255, 265 DOI:10.3969/j.issn.1008-830X.2001.03.017 |
李生尧, 许曹鲁, 李建榜, 等. 2010. 羊栖菜"鹿丰1号"人工选育及养殖中试. 渔业科学进展, 31(2): 88-94 |
杨志林. 1993. 洞头县志. 杭州: 浙江人民出版社, 142, 266
|
何丹, 张旭, 肖保衡, 等. 2016. 羊栖菜多糖的提取和抗氧化活性研究. 海洋科学, 40(12): 24-29 |
何培民, 张泽宇, 张学成, 等. 2018. 海藻栽培学. 北京: 科学出版社, 119-153
|
陆宝树. 1990. 生物学文献检索与利用. 大连: 大连理工大学出版社, 69-71
|
林立东, 吴明江, 阎秀峰等, 2018-01-09. 一种羊栖菜的品系鉴别和分类方法: 中国, 201511004442.4
|
林立东, 尚天歌, 张甜甜, 等. 2020. 褐藻羊栖菜繁殖生物学特征和生活史流程的补充研究. 水产学报, 44(4): 581-595 |
林立东, 尚天歌, 陈斌斌, 等. 2019. 经济海藻羊栖菜(Sargassum fusiforme)受精卵生物活性物质及矿质元素成分分析. 海洋与湖沼, 50(2): 429-436 |
单体锋, 李生尧, 孙建璋, 等. 2009. 浙江洞头不同羊栖菜品系的形态特征及1个代表性养殖群体的AFLP分析. 中国水产科学, 16(1): 61-68 |
南春容, 张鹏, 林少珍, 等. 2015. 温州羊栖菜(Hizikia fusiformis)野生与选育种群ISSR遗传研究. 浙江农业学报, 27(2): 234-239 |
徐佳丽, 骆其君, 严小军. 2014. 浙江洞头不同品系羊栖菜的栽培性状及ISSR分析. 海洋学研究, 32(2): 74-79 |
曾呈奎. 2000. 中国海藻志, 第三卷, 第二册: 褐藻门, 墨角藻目. 北京: 科学出版社
|
Singh G编著, 2004, 刘全儒, 郭延平, 于明译, 2008. 植物系统分类学——综合理论及方法. 北京: 化学工业出版社
|
吉田忠生. 2001. ヒジキの学名について. 藻類, 49(1): 38-39 |
Cho S M, Lee S M, Ko Y D et al, 2012. Molecular systematic reassessment of Sargassum (Fucales, Phaeophyceae) in Korea using four gene regions. Botanica Marina, 55(5): 473-484 |
Dixon R R M, Mattio L, Huisman J M et al, 2014. North meets south-Taxonomic and biogeographic implications of a phylogenetic assessment of Sargassum subgenera Arthrophycus and Bactrophycus (Fucales, Phaeophyceae). Phycologia, 53(1): 15-22 |
Huang C H, Sun Z M, Gao D H et al, 2017. Molecular analysis of Sargassum from the northern China seas. Phytotaxa, 319(1): 71-83 |
Li Y J, Fu X T, Duan D L et al, 2018. Comparison study of bioactive substances and nutritional components of brown algae Sargassum fusiforme strains with different vesicle shapes. Journal of Applied Phycology, 30(6): 3271-3283 DOI:10.1007%2Fs10811-018-1543-x |
Okamura K, 1932. Icones of Japanese algae. Vol. VI pp. 63-101 (English), 61-96 (Japanese)
|
Setchell W A, 1931. Hong Kong seaweeds, II. Hong Kong Naturalist, 2: 237-253 |
Titlyanov E A, Titlyanova T V, Belous O S et al, 2016. Useful Marine Plants of the Asia-Pacific Region Countries. Vladivostok: Dalnauka, 1-348
|
Yao J T, Shuai L, Li S Y et al, 2019. Genetic analysis of selected Sargassum fusiforme (Harvey) Setchell (Sargassaceae, Phaeophyta) strains with RAPD and ISSR markers. Journal of Oceanology and Limnology, 37(3): 783-789 |
 2021, Vol. 52
2021, Vol. 52


