中国海洋湖沼学会主办。
文章信息
- 胡凌威, 孙长森, 董迎辉, 林志华. 2021.
- HU Ling-Wei, SUN Chang-Sen, DONG Ying-Hui, LIN Zhi-Hua. 2021.
- 缢蛏(Sinonovacula constricta)心率Arrhenius拐点温度(ABT)及其与生长性状相关和通径分析
- CORRELATION AND REGRESSION ANALYSIS BETWEEN THE ARRHENIUS BREAK TEMPERATURES (ABT) OF HEART RATE AND GROWTH TRAITS OF SINONOVACULA CONSTRICTA
- 海洋与湖沼, 52(5): 1265-1272
- Oceanologia et Limnologia Sinica, 52(5): 1265-1272.
- http://dx.doi.org/10.11693/hyhz20210200039
文章历史
-
收稿日期:2021-02-06
收修改稿日期:2021-03-19
2. 浙江万里学院 浙江省水产种质资源高效利用技术研究重点实验室 宁波 315100;
3. 浙江万里学院宁海海洋生物种业研究院 宁海 315604
2. Zhejiang Key Laboratory of Aquatic Germplasm Resources, Zhejiang Wanli University, Ningbo 315100, China;
3. Ninghai Institute of Mariculture Breeding and Seed Industry, Zhejiang Wanli University, Ninghai 315604, China
温度是影响贝类生长发育重要的环境因子(许友卿等, 2012)。近年来, 在贝类养殖过程中因夏季高温诱发的大规模死亡现象越来越普遍, 高温适应或耐受能力已成为贝类遗传改良的重要育种目标性状(王庆志等, 2014; 王金鹏, 2016; 邢强, 2016; 陈楠, 2016)。目前用来衡量贝类高温耐受能力的方法通常是在一定高温水平下存活或死亡情况来评定(Pernet et al, 2007; Kvingedal et al, 2010), 操作方法简单易行, 但因顾忌过高温度会对贝类产生不可恢复的影响, 因此这种方法在贝类耐高温新品种选育中总体实施效果一般。也有研究者通过酶活(Chapple et al, 1998; Hamdoun et al, 2003)、脂质动力学和生理反应(Park et al, 2007)以及热休克蛋白表达(Widdows, 1973; Nickerson et al, 1989)来研究贝类对高温的生理响应, 这些方法费时费力, 且需要杀死贝类个体本身, 在贝类普遍缺乏稳定近交系的情况下无法在贝类育种实践中应用。
众所周知, 贝类心脏跳动的频率与振幅和机体血液循环量有直接关系, 心脏跳动强, 频率快, 血液的循环量大, 新陈代谢旺盛(Depledge et al, 1990)。已有研究表明, 无脊椎动物的心率可以通过捕获红外信号的方法被准确测得, 该方法高效稳定, 且对贝类生物体无损伤。根据阿伦尼乌斯方程(Arrhenius方程), 在一定温度范围内随着温度的上升, 新陈代谢加快, 心率加快; 当温度超过其耐受范围, 则随着温度的上升, 心率减慢, 这个拐点温度称为阿伦尼乌斯拐点温度(Arrhenius break temperatures, ABT) (Bakhmet et al, 2009)。目前, 心率ABT已成为贝类耐温性状的重要评测指标, 在帽贝(Dong et al, 2015)、扇贝(Xing et al, 2016, 2019)、鲍(Chen et al, 2016)等贝类耐温能力评价和遗传改良中实现了初步应用。
缢蛏(Sinonovacula constricta)是我国四大传统养殖贝类之一(董迎辉等, 2012), 2019年养殖产量达86.9万t, 产值超过200亿元, 具有重要的经济价值(农业农村部渔业渔政管理局等, 2020)。近年来, 受全球气候变暖的影响, 夏季极端高温水平一再被突破, 且高温持续时间有延长的趋势, 以致滩涂和池塘养殖区缢蛏死亡情况不断加重, 给缢蛏养殖产业的发展造成了严重威胁。因此, 建立缢蛏稳定、无损伤的耐高温测评技术指标应用于耐高温性状的遗传改良和新品种培育变得尤为迫切。本研究拟建立基于生物心跳参数红外监测的缢蛏心率测评方法, 分析缢蛏不同个体间心率的变异情况, 以及随温度变化的规律, 计算获得缢蛏个体高温耐受力指标ABT, 进一步分析心率ABT与生长性状的关系, 为缢蛏耐高温新品种的选育提供科学依据。
1 材料与方法 1.1 实验材料实验所用材料为缢蛏(Sinonovacula constricta)“甬乐1号”新品种14月龄贝, 平均壳长(53.56±3.78) mm, 活体取自浙江万里学院贝类育种咸祥试验基地, 清洗干净并剔除破损个体后运回实验室, 在5个规格为60 cm×50 cm×40 cm循环水养殖箱内进行暂养, 控制的暂养条件为: 海水盐度20、温度20 ℃、pH 8.0左右, 连续通气。暂养过程中及时剔除死亡和活力不佳的缢蛏个体, 每天保障全换水1次, 定时投喂饵料2次, 经7 d暂养后选用壳体无损伤、活力良好的缢蛏个体用于后续心跳测定实验。
1.2 实验方法 1.2.1 缢蛏心跳监测设备及连接心跳监测设备主要部件包括红外传感器Infrared Sensors (CNY-70)和心跳信号放大器Heartbeat Monitor Amplifier (AMP-03U) (购自葡萄牙Newshift®公司)、PowerLab 8/35八通道研究型高速记录主机(含LabChart Pro专业版, 澳大利亚ADInstruments生产, 购自埃德仪器国际贸易(上海)有限公司)、蓝丁胶(Blu-tag) (购自澳大利亚BOSTIK公司)。红外传感器探头一端用蓝丁胶固定在缢蛏心脏对应的壳表面, 另一端以RJ11连接方式接入信号放大器, 信号放大器和PowerLab 8/35八通道研究型高速记录主机两端均以BNC连接方式相互连接, PowerLab 8/35八通道研究型高速记录主机以USB连接方式接入电脑, 利用内置软件(LabChart Version 8.0)获取心跳的有关参数。
1.2.2 升温控温装置和心跳参数测定升温设备为HWS-28电热恒温水浴锅(购自上海一恒科学仪器有限公司, 分辨率为0.1 ℃)。水浴锅内放置一个40 cm×25 cm×10 cm玻璃水族箱, 水族箱内注入盐度20的海水(液面高度6 cm左右), 水浴锅内注入纯水高度8 cm左右。
每次实验随机选取8只生长状况良好的缢蛏, 在每个个体心脏壳表位置用蓝丁胶固定到红外传感器探头上, 一起放入上述的玻璃水族箱后连续充气, 待每只缢蛏的水管和斧足充分舒展后开始升温, 升温区间为22—38 ℃, 每次升温1 ℃, 待温度稳定10 min后记录该水温条件下典型波形图和心率参数, 尔后再进行后续升温以及波形图、心率数据采集。前后共进行12次实验, 对96只缢蛏在不同温度下的心跳的波形图和心跳数据进行了采集, 每次实验前还对每只缢蛏的生长性状测定, 包括壳长(mm)、壳高(mm)、壳宽(mm)、活体重(g)等。
1.3 数据分析将每只缢蛏个体心率数据转化为以自然数为底的对数, 同时将温度转化为1000/K (绝对温度)的形式。然后在阿伦尼乌斯方程Arrhenius曲线上推测拐点的两侧, 将心率与温度数据进行线性拟合, 两个方程交点的横坐标对应的温度即为该缢蛏个体的ABT值(Bakhmet et al, 2009; 陈楠, 2016)。
利用Excel 2016软件对不同温度水平下96个缢蛏个体的心率数据进行最大值、最小值、平均数、标准差和变异系数等有关特征值进行计算, 分析心率随温度变化的动态规律以及个体间的变异; 利用SPSS22.0对缢蛏心率ABT数据进行正态性检验, 计算其与生长性状的相关系数, 并采用逐步回归和通径分析方法对缢蛏心率ABT受其壳长、壳高、壳宽和活体重等生长性状影响情况进行分析。
2 结果与分析 2.1 不同温度下缢蛏心跳监测的波形特征图 1为一只缢蛏个体在22、27、32、35、38 ℃等五个不同水温条件下心跳监测获得的波形谱。从图 1可以看出, 22 ℃时, 缢蛏心脏搏动规律, 周期明显, 图中缢蛏个体的心率为21.15 BMP; 当温度升至27、32 ℃时, 缢蛏心跳随着温度升高不断加快, 但心脏搏动仍表现正常, 周期稳定, 两个温度条件下缢蛏个体的心率为24.12 BMP; 当温度达到35、38 ℃时, 缢蛏心跳随着温度升高不断减慢, 且心脏搏动很难维持在稳定水平, 周期时不时发生了波动。从波形曲线可以看出, 缢蛏心跳可以分为两种波形, 一种是窄而高、单一峰的心室波形, 另一种为宽而低、连续的心耳波形, 缢蛏一个心跳周期由一次心室的收缩和连续两次心耳的收缩所构成。
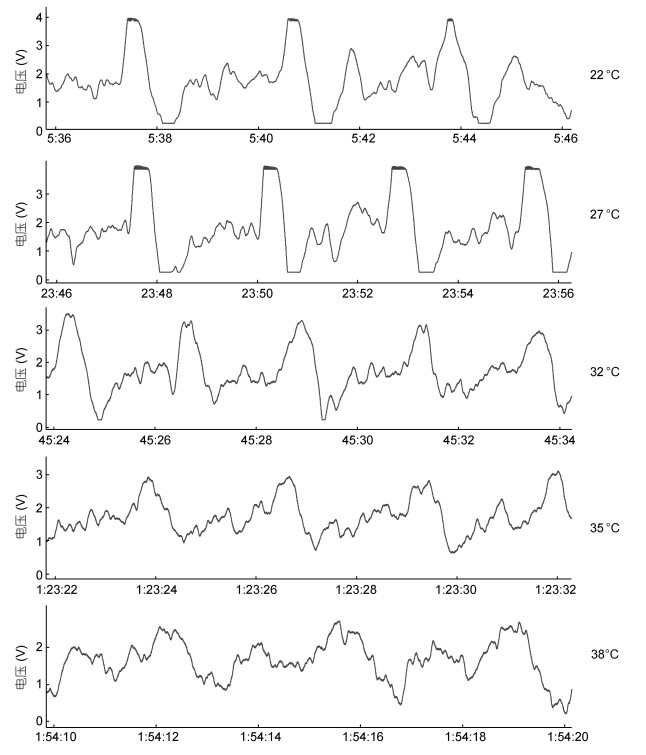 |
| 图 1 缢蛏心跳波形与温度关系图 Fig. 1 Relationship between heartbeat waveform and temperature in S. constricta |
升温过程中96只缢蛏个体心率变异的特征值见表 1。由表 1数据可知, 在升温前期缢蛏心跳随着温度的升高而逐渐变快, 到后期缢蛏心跳随着温度的升高而逐渐减弱, 96个个体22 ℃时心率平均值为19.66 BMP, 而后随温度上升心率值逐渐变大, 31 ℃时平均心率达峰值为33.66 BMP, 在32 ℃以后心率平均值开始下降, 34 ℃监测到稳定心率的平均值为29.19 BMP, 35 ℃以后心跳进一步变慢且难以稳定。同时我们也观察到缢蛏心率在个体之间的变异非常大, 如在22、34 ℃时, 心率的变幅分别为13.90—27.95 BMP、19.18—35.81 BMP, 变异系数分别达14.06%和13.18%, 只有在26—31 ℃温度范围内, 变异系数在10%以下, 但也均超过了8.5%。
| 温度(℃) | 最小值(BMP) | 最大值(BMP) | 平均值(BMP) | 标准差(BMP) | 变异系数(%) |
| 22 | 13.90 | 27.95 | 19.66 | 2.76 | 14.06 |
| 23 | 15.35 | 28.70 | 21.43 | 2.57 | 12.00 |
| 24 | 18.81 | 29.83 | 23.29 | 2.46 | 10.57 |
| 25 | 19.35 | 31.03 | 25.02 | 2.55 | 10.20 |
| 26 | 21.66 | 31.98 | 26.68 | 2.53 | 9.49 |
| 27 | 22.83 | 32.46 | 27.76 | 2.38 | 8.56 |
| 28 | 23.63 | 34.70 | 29.20 | 2.58 | 8.82 |
| 29 | 23.91 | 36.47 | 30.88 | 2.64 | 8.56 |
| 30 | 24.78 | 38.47 | 32.21 | 2.83 | 8.79 |
| 31 | 26.29 | 39.59 | 33.65 | 2.97 | 8.82 |
| 32 | 24.29 | 39.35 | 32.38 | 3.48 | 10.74 |
| 33 | 22.50 | 38.86 | 30.72 | 3.84 | 12.50 |
| 34 | 19.18 | 35.81 | 29.19 | 3.85 | 13.18 |
| 35—38 | 无法监测到稳定心率 | ||||
依据阿伦尼乌斯方程(Arrhenius方程), 对温度和心率进行数据转换后, 以心率出现拐点前后的数据分别拟合ln(BMP)依1000/K两个线性回归方程, 它们的交点所对应的温度即为缢蛏心率的ABT, 如图 2所示。通过计算分别获得96只缢蛏个体心率ABT, 最小值为29.74 ℃, 最大值为31.86 ℃, 平均值为31.02 ℃。
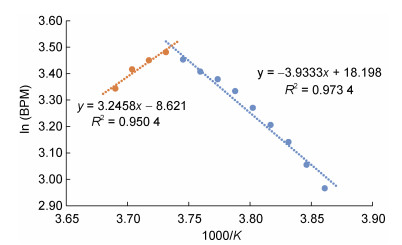 |
| 图 2 缢蛏12号个体ABT指标估算的示意图 Fig. 2 Diagram of ABT estimation for the individual No.12 of S. constricta |
观察变量分布的正态性是进行统计分析的前提, 以往的研究表明贝类壳长、壳高、壳宽和活体重等生长性状数据符合统计分析的这一要求。本研究对96个缢蛏个体的心率ABT数值进行频率分布、正态性趋势进行分析, 结果见图 3。从图 3结果可以看出, 缢蛏的心率ABT也比较符合正态分布, 进一步采用Kolmogorov-Smirnova方法进行统计测验, 其P值为0.200 (> 0.05), 表明该类数据也符合正态分布。
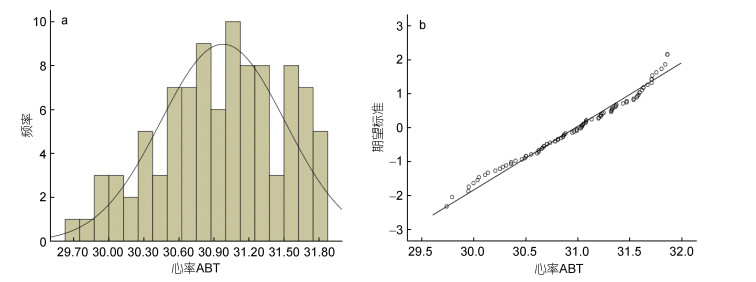 |
| 图 3 缢蛏心率ABT数据分布的正态性检测 Fig. 3 Normality detection of ABT data distribution of heart rate in S. constricta 注: a. 频率分布图; b. Q-Q图 |
缢蛏心率ABT与生长性状的相关系数见表 2, 从表中结果可以看出, 缢蛏心率ABT与壳长、壳高、活体重等3个生长性状具有不同程度的正相关关系, 其中与壳长的相关系数达到0.423 6, 显示为极显著的正相关, 而与壳宽性状呈负相关关系, 相关系数为–0.321 9, 同样达到了极显著性水平。
| 性状 | 壳长(X1) | 壳高(X2) | 壳宽(X3) | 活体重(X4) |
| 壳高(X2) | 0.569 8** | — | — | — |
| 壳宽(X3) | 0.281 5** | 0.657 9** | — | — |
| 活体重(X4) | 0.568 9** | 0.895 7** | 0.728 4** | — |
| ABT(Y) | 0.423 6** | 0.161 3 | –0.321 9** | 0.090 0 |
| 注: r0.05, 94 = 0.200 6, r0.01, 96 = 0.261 7 | ||||
采用逐步回归统计分析方法, 建立了缢蛏心率依据生长性状变化的最优回归方程:
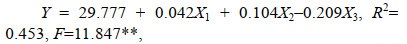 (1)
(1)该方程表明, 在4个生长性状中, 活体重对缢蛏心率ABT没有显著影响, 在回归分析中被剔除; 壳长、宽高、壳高等3个体尺性状对缢蛏心率ABT的变化具有不同程度的影响, 回归关系达到了极显著水平(F=11.847**), 其中壳长每增加1个单位, 心率ABT增加0.042个单位, 壳高每增加一个单位, 心率ABT增加0.104个单位, 而壳宽每增加一个单位, 缢蛏心率ABT减少0.209个单位。回归方程的决定系数R2=0.453, 说明缢蛏心率ABT除了受体尺性状的影响, 可能还受到遗传等其他因素的影响。
2.4 缢蛏心率ABT与体尺性状间的通径分析由SPSS 22.0计算得到缢蛏壳长、壳高、壳宽等3个体尺性状对心率ABT的直接通径系数分别为0.395 9、0.389 3和–0.689 5, 由于3个体尺性状彼此相关, 因此某一体尺性状还通过另外两个体尺性状间接影响缢蛏心率ABT, 它们对心率ABT作用的通径关系见图 4。
 |
| 图 4 缢蛏体尺性状与心率ABT通径关系图 Fig. 4 The path relationship between body size and heart rate ABT of S. constricta |
进一步计算并整理间接通径分析的结果列于表 3中, 从表 3数据可知缢蛏3个体尺性状中对心率ABT总的影响中, 壳长最大, 其次为壳宽(总的相关系数为0.423 6、–0.321 9), 而直接影响中, 壳宽的直接作用最大, 直接通径系数为–0.689 5, 然后是壳长、壳高, 直接通径系数分别为0.395 9和0.389 3。壳高性状通过壳宽性状来影响心率ABT的作用最大, 间接通径系数为–0.453 6, 其次是壳宽通过壳高性状对心率ABT变化影响, 间接通径系数为0.256 1, 而壳长和壳宽性状通过彼此作用, 进而影响心率ABT的变化最弱, 间接通径系数分别为–0.194 1和0.111 4。
| 性状 | 直接作用 | 间接作用 | 总相关系数 | |||
| 壳长X1 (mm) | 壳高X2 (mm) | 壳宽X3 (mm) | ||||
| 壳长X1 (mm) | 0.395 9 | — | 0.221 8 | –0.194 1 | 0.423 6 | |
| 壳高X2 (mm) | 0.389 3 | 0.225 6 | — | –0.453 6 | 0.161 3 | |
| 壳宽X3 (mm) | –0.689 5 | 0.111 4 | 0.256 1 | — | –0.321 9 | |
贝类养殖生产过程中, 因自然条件变化或人为因素影响常常受到许多不良生存环境的胁迫, 如高温、低氧、高氨氮等, 给贝类养殖业的稳定增产带来了严重威胁。因此, 近年来贝类育种从早期单纯关注生长性状的遗传改良逐步转变为更加注重抗逆性能提升的思路上来, 在这样的背景下促进了贝类有关抗逆性状评测方法的研究。然而, 目前贝类抗逆性状的评估指标仍然更多地集中于死亡率(Wright et al, 1993; Laing et al, 1996; Compton et al, 2007)、酶活力(An et al, 2010; Kvingedal et al, 2010)、基因表达(Chapple et al, 1998; Hamdoun et al, 2003; Park et al, 2007)等, 这些方法多需要牺牲贝类活体样本, 且费时费力, 较难在获取抗逆性评价的同时留取性能优良的贝类个体, 大大降低了贝类抗逆材料积累和新品种选育的效率。
3.2 心跳参数在贝类抗逆性状定量测评中应用与实践心跳参数的无损伤测定方法由Depledge等(1990)发明, 而后经Chelazzi等(1999)改进, 逐步应用到了贝类抗逆性能分析中。Curtis等(2000)研究了铜离子胁迫条件下紫贻贝心跳参数的变化规律, Bakhmet等(2005, 2009)分析了紫贻贝在盐度变化、油污污染等胁迫条件下心率变化的动态特征, Dong等(2011)研究了帽贝心跳参数对温度变化的响应, 这些研究工作均表明心跳参数可以在不损伤贝类的情况下较好地指示个体的活力水平, 对贝类抗逆性状是一种比较有效和可靠的评价指标。近年来, 国内学者将心跳参数应用到扇贝(Xing et al, 2016, 2019)、鲍(林思恒等, 2016; Chen et al, 2016)等重要养殖贝类抗逆性状评价和遗传改良工作中, 推动和引领了我国贝类育种技术的发展。
3.3 缢蛏心跳参数对温度的响应缢蛏心跳参数的动态特征和变异规律研究结果表明, 22—34 ℃范围内可采集获得缢蛏心脏搏动的稳定波形, 心率总体上随温度上升呈现规律性变化, 表现为在一定的温度阈值水平以下缢蛏心率随温度的上升而增大, 超过一定的温度阈值即随温度的上升而减少, 平均心率31 ℃达峰值为33.66 BMP。不同缢蛏个体之间的心率差异明显, 22 ℃时心率最小值为13.90 BMP, 最大值为27.95 BMP, 平均心率为19.66 BMP, 差异水平最高, 变异系数达14.06%, 26—31 ℃的中间温度个体间的心率差异相对较小, 但变异系数也均在8.5%以上; 用阿伦尼乌斯方程可以很好地实现线性拟合并求得每个缢蛏个体的心率ABT, 所有缢蛏个体中心率ABT最小值为29.74 ℃, 最大值为31.86 ℃, 平均值为31.02 ℃。
3.4 缢蛏耐高温品种选育的策略在我国, 缢蛏是浙江、福建等南方沿海省份重要的经济贝类, 养殖过程中大多要经历夏季高温的考验。据了解, 缢蛏的养殖成活率普遍不足50%, 其死亡和淘汰主要集中在夏季高温一两个月内。因此, 将心跳参数引入缢蛏温度适应性状定量评价, 并据之开展耐高温育种材料筛选和新品种培育非常迫切。在缢蛏耐高温性状的遗传改良过程中, 心率ABT可以作为该性状的评测指标, ABT值高的个体、家系或种群应加以优先保存和利用。本文还研究了缢蛏心率ABT与壳长、壳高、壳宽和活体重的相关关系, 建立了心率ABT受生长性状影响的最优回归方程, 并进行了通径分析, 结果显示缢蛏壳长对心率ABT的总体影响最大, 而壳宽直接的负作用最强, 在缢蛏耐高温新品种选育的过程可以同时关注壳形的选择, 相对扁长的缢蛏个体可能具有更好的耐高温潜力。
4 结论本文将生物心跳参数红外监测技术应用于缢蛏温度耐受性状定量测定研究, 结果显示在22—34 ℃范围内可以获得缢蛏心跳的稳定波形, 且符合在升温前期随温度升高心跳加快(心率值变大), 达到一定温度后随温度上升心跳减慢(心率值减少)的特征, 适合运用阿伦尼乌斯方程进行线性拟合求取心率ABT。进一步统计分析表明, 心率ABT在不同缢蛏个体间变异明显, 是其温度耐受性状一种理想的测评指标, 可在缢蛏耐高温新品培育过程中加以利用。同时, 缢蛏心率ABT也不同程度地受到其壳长、壳宽等体尺性状的影响, 在缢蛏耐高温性状的遗传改良中可兼顾壳形的选择以提高育种的效率。
王庆志, 李石磊, 付成东, 等. 2014. 虾夷扇贝耐高温育种家系的建立与早期筛查. 水产学报, 38(3): 371-377 |
王金鹏, 2016. 牡蛎生长与高温耐受性状的遗传解析. 青岛: 中国科学院研究生院(海洋研究所)博士学位论文
|
邢强, 2016. 扇贝耐热性与贝壳生长动态检测指标体系的建立及应用. 青岛: 中国海洋大学博士学位论文
|
许友卿, 吴卫君, 蒋伟明, 等. 2012. 温度对贝类免疫系统的影响及其机理研究进展. 水产科学, 31(3): 176-180 DOI:10.3969/j.issn.1003-1111.2012.03.012 |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2020. 2020中国渔业统计年鉴. 北京: 中国农业出版社
|
陈楠, 2016. 基于心率测评的鲍对高温耐受性的研究. 厦门: 厦门大学博士学位论文
|
林思恒, 吴富村, 张国范. 2016. 高温胁迫下皱纹盘鲍不同养殖群体心率变化比较. 海洋科学, 40(11): 84-90 DOI:10.11759/hykx20160328003 |
董迎辉, 姚韩韩, 张佩云, 等. 2012. 缢蛏受精和早期卵裂过程的细胞学变化观察. 水产学报, 36(9): 1400-1409 |
An M I, Choi C Y, 2010. Activity of antioxidant enzymes and physiological responses in ark shell, Scapharca broughtonii, exposed to thermal and osmotic stress: effects on hemolymph and biochemical parameters. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 155(1): 34-42 DOI:10.1016/j.cbpb.2009.09.008 |
Bakhmet I N, Berger V J, Khalaman V V, 2005. The effect of salinity change on the heart rate of Mytilus edulis specimens from different ecological zones. Journal of Experimental Marine Biology and Ecology, 318(2): 121-126 DOI:10.1016/j.jembe.2004.11.023 |
Bakhmet I N, Fokina N N, Nefedova Z A et al, 2009. Physiological-biochemical properties of blue mussel Mytilus edulis adaptation to oil contamination. Environmental Monitoring and Assessment, 155(1-4): 581-591 DOI:10.1007/s10661-008-0457-5 |
Chapple J P, Smerdon G R, Berry R J et al, 1998. Seasonal changes in stress-70 protein levels reflect thermal tolerance in the marine bivalve Mytilus edulis L. Journal of Experimental Marine Biology and Ecology, 229(1): 53-68 DOI:10.1016/S0022-0981(98)00040-9 |
Chelazzi G, Williams G A, Gray D R, 1999. Field and laboratory measurement of heart rate in a tropical limpet, Cellana grata. Journal of the Marine Biological Association of the United Kingdom, 79(4): 749-751 DOI:10.1017/S0025315498000915 |
Chen N, Luo X, Gu Y T et al, 2016. Assessment of the thermal tolerance of abalone based on cardiac performance in Haliotis discus hannai, H. gigantea and their interspecific hybrid. Aquaculture, 465: 258-264 DOI:10.1016/j.aquaculture.2016.09.004 |
Compton T J, Rijkenberg M J A, Drent J et al, 2007. Thermal tolerance ranges and climate variability: a comparison between bivalves from differing climates. Journal of Experimental Marine Biology and Ecology, 352(1): 200-211 DOI:10.1016/j.jembe.2007.07.010 |
Curtis T M, Williamson R, Depledge M H, 2000. Simultaneous, long-term monitoring of valve and cardiac activity in the blue mussel Mytilus edulis exposed to copper. Marine Biology, 136(5): 837-846 DOI:10.1007/s002270000297 |
Depledge M H, Andersen B B, 1990. A computer-aided physiological monitoring system for continuous, long-term recording of cardiac activity in selected invertebrates. Comparative Biochemistry and Physiology Part A: Physiology, 96(4): 473-477 DOI:10.1016/0300-9629(90)90664-E |
Dong Y W, Han G D, Ganmanee M et al, 2015. Latitudinal variability of physiological responses to heat stress of the intertidal limpet Cellana toreuma along the Asian coast. Marine Ecology Progress Series, 529: 107-119 DOI:10.3354/meps11303 |
Dong Y W, Williams G A, 2011. Variations in cardiac performance and heat shock protein expression to thermal stress in two differently zoned limpets on a tropical rocky shore. Marine Biology, 158: 1223-1231 DOI:10.1007/s00227-011-1642-6 |
Hamdoun A M, Cheney D P, Cherr G N, 2003. Phenotypic plasticity of HSP70 and HSP70 gene expression in the Pacific oyster (Crassostrea gigas): implications for thermal limits and induction of thermal tolerance. Biological Bulletin, 252(2): 160-169 |
Kvingedal R, Evans B S, Lind C E et al, 2010. Population and family growth response to different rearing location, heritability estimates and genotype×environment interaction in the silver-lip pearl oyster (Pinctada maxima). Aquaculture, 304(1/4): 1-6 |
Laing I, Child A R, 1996. Comparative tolerance of small juvenile palourdes (Tapes decussatus L. ) and Manila clams (Tapes philippinarum Adams & Reeve) to low temperature. Journal of Experimental Marine Biology and Ecology, 195(2): 267-285 DOI:10.1016/0022-0981(95)00097-6 |
Nickerson D M, Facey D E, Grossman G D, 1989. Estimating physiological thresholds with continuous two-phase regression. Physiological Zoology, 62(4): 866-887 DOI:10.1086/physzool.62.4.30157934 |
Park H, Ahn I Y, Lee H E, 2007. Expression of heat shock protein 70 in the thermally stressed Antarctic clam Laternula elliptica. Cell Stress & Chaperones, 12(3): 275-282 |
Pernet F, Tremblay R, Comeau L et al, 2007. Temperature adaptation in two bivalve species from different thermal habitats: energetics and remodelling of membrane lipids. Journal of Experimental Biology, 210(Pt 17): 2999-3014 |
Widdows J, 1973. Effect of temperature and food on the heart beat, ventilation rate and oxygen uptake of Mytilus edulis. Marine Biology, 20(4): 269-276 DOI:10.1007/BF00354270 |
Wright D A, Kennedy V S, Roosenburg W H et al, 1983. Temperature tolerance of embryos and larvae of five bivalve species under simulated power plant entrainment conditions: a synthesis. Marine Biology, 77(3): 271-278 DOI:10.1007/BF00395816 |
Xing Q, Li Y P, Guo H B et al, 2016. Cardiac performance: a thermal tolerance indicator in scallops. Marine Biology, 163(12): 244 DOI:10.1007/s00227-016-3021-9 |
Xing Q, Zhang L L, Li Y Q et al, 2019. Development of novel cardiac indices and assessment of factors affecting cardiac activity in a bivalve mollusc Chlamys farreri. Frontiers in Physiology, 10: 293 DOI:10.3389/fphys.2019.00293 |
 2021, Vol. 52
2021, Vol. 52


