中国海洋湖沼学会主办。
文章信息
- 陈子越, 武孝慈, 陆化杰, 刘凯, 任品, 宁欣, 陈新军. 2021.
- CHEN Zi-Yue, WU Xiao-Ci, LU Hua-Jie, LIU Kai, REN Pin, NING Xin, CHEN Xin-Jun. 2021.
- 南海西沙群岛海域鸢乌贼(Sthenoteuthis oualaniensis)角质颚微结构及生长特性研究
- BEAK MICROSTRUCTURE AND GROWTH CHARACTERISTICS OF STHENOTEUTHIS OUALANIENSIS IN THE XISHA ISLANDS WATERS OF THE SOUTH CHINA SEA
- 海洋与湖沼, 52(5): 1293-1302
- Oceanologia et Limnologia Sinica, 52(5): 1293-1302.
- http://dx.doi.org/10.11693/hyhz20210300061
文章历史
-
收稿日期:2021-03-05
收修改稿日期:2021-04-18
2. 国家远洋渔业工程技术研究中心 上海 201306;
3. 大洋渔业资源可持续开发省部共建教育部重点实验室 上海 201306;
4. 农业农村部大洋渔业开发重点实验室 上海 201306;
5. 农业农村部大洋渔业资源环境科学观测实验站 上海 201306
2. National Distant-water Fisheries Engineering Research Center, Shanghai 201306, China;
3. The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
5. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
鸢乌贼(Sthenoteuthis oualaniensis)生命周期短, 生长速度快, 是广布于印度洋和太平洋暖水域的大洋性头足类(董正之, 1991; 陈新军等, 2009; Jereb et al, 2010)。鸢乌贼在当地的海洋生态系统中占据着重要的位置, 起着承上启下的作用(张宇美等, 2013), 也是我国南海海域最为丰富的头足类资源之一, 开发潜力巨大(张鹏等, 2010)。近年来, 已有学者分别对不同海域鸢乌贼的种群结构(Nesis, 1993)、摄食生态(张宇美等, 2013; 陆化杰等, 2018)、繁殖生物学特性(陆化杰等, 2021)、微化学(陆化杰等, 2019)以及渔场分布(陈新军等, 2005)等进行了研究。角质颚具有不易腐蚀、结构稳定和信息量大等特点, 是头足类主要的摄食器官(Clarke, 1962), 在研究头足类的种群划分、年龄生长和生活史等方面发挥着关键的作用(陆化杰等, 2012; 胡贯宇等, 2017)。但目前针对鸢乌贼角质颚的研究主要集中于外部形态分析和色素沉积等方面(陈子越等, 2019a, 2019b; 陆化杰等, 2020b), 鸢乌贼日龄与生长的研究也主要建立在耳石微结构上(招春旭等, 2017; 江艳娥等, 2019; 陆化杰等, 2020a), 关于角质颚微结构及其生长特性的研究尚未见报道, 不利于深入了解鸢乌贼的整个生活史。为此, 本研究根据2017年5—8月中国灯光罩网渔船在南海西沙群岛海域生产调查期间所采集的鸢乌贼样本, 利用其角质颚微结构判读鸢乌贼的日龄, 建立了日龄与角质颚外形特征参数间的生长模型, 探究其生长拐点, 为后续利用角质颚深入研究鸢乌贼的关键生活史和重建洄游路线提供科学依据。
1 材料与方法 1.1 样本来源采样时间为2017年5—8月, 鸢乌贼样本由中国灯光罩网渔船“琼三亚渔72106”和“琼三亚渔72060”于南海西沙群岛12°18′—18°46′N, 110°10′—115°58′E采集(图 1)。调查采样期间, 从每个采样点的鸢乌贼渔获物中随机抽取20—30尾样本, 经低温急冻保存后运回实验室, 整个调查期间共采集鸢乌贼样本860尾。
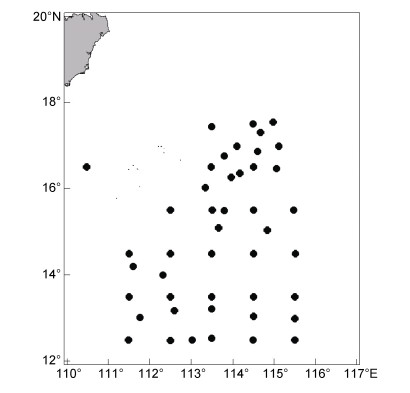 |
| 图 1 调查采样图 Fig. 1 Site of investigations and samples for S. oualaniensis |
样本解冻后依次进行编号, 同时对鸢乌贼的渔业生物学数据进行测量与判定, 对胴长(mantle length, ML)和体重(body weight, BW)等数据进行测定, ML测定精确至1 mm, BW测定精确至1 g (陈新军等, 2017)。
根据头足类性腺成熟度划分标准对鸢乌贼生殖器官的发育情况进行观察和等级判断(陈新军等, 2009)。将角质颚从口球的肌肉中剥离, 用超纯水冲洗并去除角质颚表面附着的有机物后, 放入装有75%乙醇溶液的离心管内保存。
1.2.2 角质颚外形特征参数测量使用游标卡尺对角质颚的上头盖长(Upper hood length, UHL)、上脊突长(Upper crest length, UCL)、上喙长(Upper rostrum length, URL)、上喙宽(Upper rostrum width, URW)、上侧壁长(Upper lateral wall length, ULWL)、上翼长(Upper wing length, UWL)、下头盖长(Lower hood length, LHL)、下脊突长(Lower crest length, LCL)、下喙长(Lower rostrum length, LRL)、下喙宽(Lower rostrum width, LRW)、下侧壁长(Lower lateral wall length, LLWL)和下翼长(Lower wing length, LWL)共12项外形特征参数依次进行测量, 测量结果精确至0.01 mm (陈子越等, 2019a)。
相关研究表明, 南海西沙海域鸢乌贼角质颚的UHL、UCL、ULWL、UWL、LHL、LCL、LLWL和LWL可代替12项外形特征参数来表征角质颚的外部形态生长特性(Clarke, 1962; 陈子越等, 2019a)。
1.2.3 角质颚研磨及日龄读取角质颚的日龄生长轮纹位于上颚喙部的矢状切面(rostrum sagittal section, RSS)上(胡贯宇等, 2017)。使用切割工具从角质颚喙部前端沿头盖顶部的中线切开直至后缘, 将喙端的半个矢状切面平整剪下, 平稳放入包埋槽后进而调整样本的摆放角度, 缓慢倒入用以硬化固定的树脂溶液后静置并硬化。硬化后的角质颚样本放置在不同目数的水磨砂纸上进行精细研磨, 研磨至切面可观察到较为清晰的日龄生长轮纹后滴入氧化铝抛光粉溶液加以抛光。最后将制备好的角质颚切片移至Olympus光学显微镜下进行观察, 同时采用charged coupled device (CCD)系统分别对不同部位连续拍摄照片, 使用PhotoShop 24.0对同一样本的多张照片进行后期拼接合成。
通过角质颚的日龄生长轮纹可以清晰地读取头足类的日龄(胡贯宇等, 2017), 每一个角质颚样本的日龄生长轮纹由两个实验员分别进行读取, 各自读取的日龄数据与均值的差值需低于5%方可认定为有效日龄, 共成功研磨并读取276枚角质颚的日龄数据。
1.2.4 数据分析(1) 利用线性、指数、幂、对数、Logistic、von Bertalanffy和Gompertz等7个生长模型拟合日龄与角质颚外形特征参数的生长关系(陆化杰等, 2012; 陈子越等, 2019a):
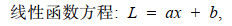 (1)
(1) (2)
(2)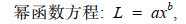 (3)
(3)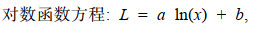 (4)
(4)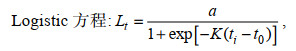 (5)
(5)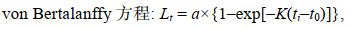 (6)
(6)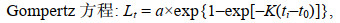 (7)
(7)式中, a、b和k为常数; Lt为ti龄时的外形特征参数值(mm); ti为日龄(d); t0为Lt=0时的理论日龄(d)。
(2) 采用最大似然法估计模型生长参数, 公式为:
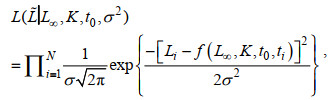 (8)
(8)式中, 其初始值设定为总体样本平均体长的15%, σ2为误差项反差, 最大似然法取自然对数后估算求得(Hiramatsu, 1993; Haddon, 2001; 陈子越等, 2019a)。
(3) 应用赤池信息准则(Akaike information criterion, AIC)比较生长模型, 选取AIC值最小的模型为最适生长模型(Hiramatsu, 1993; Haddon, 2001; 陈子越等, 2019a):
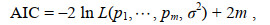 (9)
(9)(4) 将不同日龄阶段的各角质颚外形特征参数与其相对应ML的比值作为角质颚各部的变化指标, 分析随日龄的增长鸢乌贼角质颚各外形特征参数与ML间的变化趋势, 探究日龄生长对角质颚各部整体变化的影响(陈子越等, 2019b)。
(5) 采用绝对生长率AGR (Absolute growth rate)和瞬时相对生长率IGR (Instantaneous relative growth rate)来分析鸢乌贼角质颚外形特征参数的生长情况(陈新军等, 2017; 陆化杰等, 2020a), 公式为:
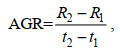 (10)
(10)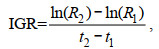 (11)
(11)本研究采用的日龄间隔为30 d, 数据分析在RStudio 3.4.0中进行。
2 结果 2.1 胴长、体重和角质颚外形特征参数分布经测量, 鸢乌贼的ML和BW范围见表 1, 鸢乌贼角质颚上、下颚各外形特征参数范围见表 2。按照鸢乌贼群体划分标准, 本研究中样本群体为微型群(Nesis, 1993; Jereb et al, 2010)。
| 项目 | 范围 | 均值 | 优势组 | 比例 |
| ML(mm) | 86—198 | 117.82±16.40 | 90—150 | 93.48% |
| BW(g) | 18—194 | 72.76±29.06 | 20—100 | 82.97% |
| 上颚 | 范围(mm) | 下颚 | 范围(mm) | |
| UHL | 3.58—19.67 | LHL | 1.04—6.80 | |
| UCL | 2.55—19.03 | LHL | 0.77—11.86 | |
| ULWL | 0.97—11.23 | LLWL | 2.74—17.35 | |
| UWL | 0.87—8.86 | LWL | 1.09—9.36 |
通过研磨, 鸢乌贼上角质颚RSS (图 2a)微结构中的日龄生长轮纹明显, 以明、暗带相交的方式排列(图 2b)。以内轴为界, 头盖部(上)与脊突部(下)的分界线从喙端延伸至叉口, 上下两部的日龄生长轮纹宽度、方向均存在差异(图 2c)。
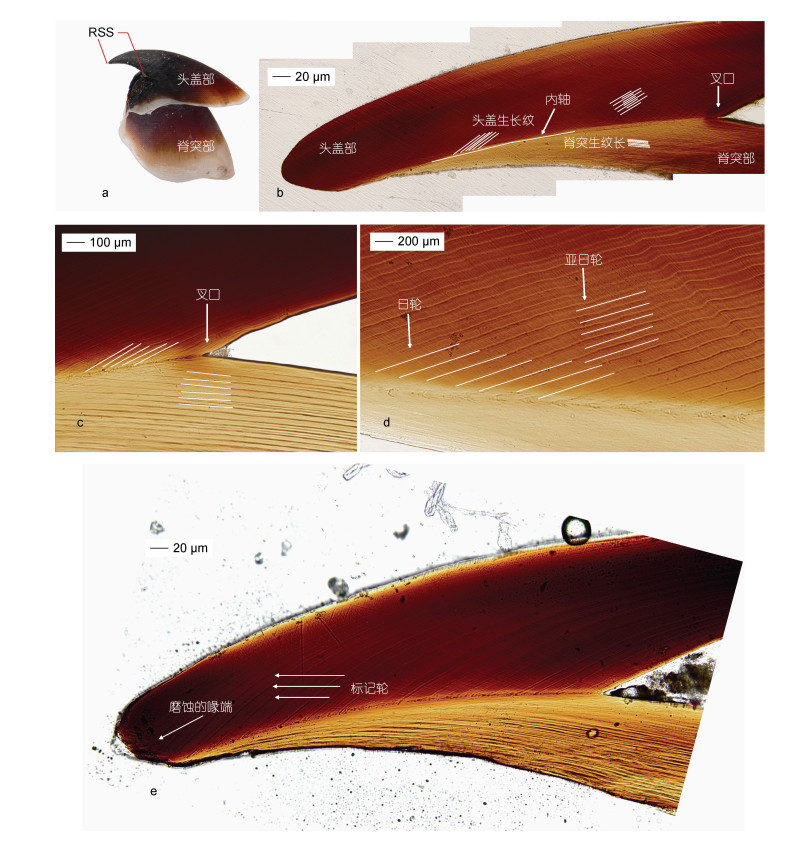 |
| 图 2 鸢乌贼上角质颚微结构示意图 Fig. 2 The upper beak microstructure of S. oualaniensis 注: a. 鸢乌贼上角质颚喙部; b. 鸢乌贼角质颚上颚喙部矢状切面微结构; c. 头盖部与脊突部日龄生长纹对比; d. 日轮与亚日轮; e. 标记轮及磨蚀的喙端 |
其中, 脊突前部的日龄生长轮纹在靠近内轴处逐渐与内轴平行, 头盖部的日龄生长轮纹则与内轴呈一定的夹角, 上下两部的生长轮纹相交于内轴处, 呈“ < ”形。不同部位的日龄生长轮纹宽度不同, 头盖部生长轮纹间距较脊突部生长轮纹宽, 且越靠近内轴处越宽, 反之较窄; 喙端的日龄生长轮纹间距相对较窄(图 2b, 2c), 且日龄生长纹中的标记轮较为明显, 颜色较其他轮纹更深(图 2e); 每两条日龄生长轮纹间存在一条或若干条亚日轮, 颜色较浅(图 2d)。
此外, 角质颚不同部位的色素沉积也各不相同, 头盖部的色素沉积较脊突部深, 喙端较叉口深; 并且一些样本的角质颚喙端存在破损、磨蚀的情况(图 2e)。
2.3 日龄与角质颚外形特征参数的关系单因素方差分析表明, 鸢乌贼的日龄与角质颚外形特征参数UHL (F=1.43, P=0.02 < 0.05)、UCL (F=1.26, P=0.03 < 0.05)、ULWL (F=1.14, P=0.02 < 0.05)、UWL (F=1.22, P=0.01 < 0.05)、LHL (F=1.36, P=0.03 < 0.05)、LCL (F=1.26, P=0.03 < 0.05)、LLWL (F=1.38, P=0.03 < 0.05)和LWL (F=1.21, P=0.01 < 0.05) 8项外形特征参数间存在显著性差异。
协方差分析表明, 鸢乌贼的日龄与UHL (F=0.53, P=0.47 > 0.05)、UCL (F=0.02, P=0.90 > 0.05)、ULWL (F=1.21, P=0.27 > 0.05)、UWL (F=0.53, P=0.47 > 0.05)、LHL (F=3.96, P=0.06 > 0.05)、LCL (F=1.63, P=0.20 > 0.05)、LLWL (F=0.05, P=0.82 > 0.05)和LWL (F=0.89, P=0.35 > 0.05) 8项外形特征参数间均不存在性别间的显著性差异, 因此将雌雄样本数据合并拟合其生长模型。
根据最小AIC值筛选出最适生长模型(表 3), 其中, UCL和LCL的生长最适用线性生长模型表示, ULWL和LLWL的生长最适用对数生长模型表示, 而UHL、LHL、UWL和LWL的生长则最适用逻辑斯蒂生长模型表示:
 (12)
(12)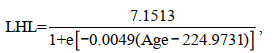 (13)
(13)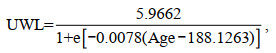 (14)
(14) (15)
(15)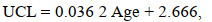 (16)
(16)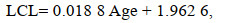 (17)
(17)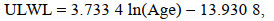 (18)
(18)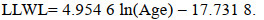 (19)
(19)| 模型 | 线性 | 幂 | 对数 | 指数 | 逻辑斯蒂 | von Bertalanffy | Gompertz | |||||||||||||
| R2 | AIC | R2 | AIC | R2 | AIC | R2 | AIC | R2 | AIC | R2 | AIC | R2 | AIC | |||||||
| UHL | 0.87 | 263.25 | 0.86 | 265.00 | 0.87 | 263.43 | 0.86 | 275.54 | 0.87 | 148.41 | 0.65 | 364.68 | 0.54 | 426.02 | ||||||
| UCL | 0.87 | 191.38 | 0.86 | 206.36 | 0.87 | 194.94 | 0.87 | 198.08 | 0.85 | 258.69 | 0.64 | 314.26 | 0.47 | 328.38 | ||||||
| ULWL | 0.58 | –50.06 | 0.57 | –39.03 | 0.59 | –55.83 | 0.57 | –37.38 | 0.55 | –23.83 | 0.54 | –25.27 | 0.53 | –13.14 | ||||||
| UWL | 0.57 | –343.34 | 0.56 | –336.04 | 0.54 | –301.49 | 0.58 | –348.20 | 0.58 | –354.97 | 0.54 | –301.69 | 0.43 | –284.12 | ||||||
| LHL | 0.53 | –409.05 | 0.43 | –291.52 | 0.52 | –405.41 | 0.52 | –407.91 | 0.59 | –422.54 | 0.49 | –366.57 | 0.44 | –360.99 | ||||||
| LCL | 0.87 | –149.92 | 0.83 | –106.49 | 0.85 | –141.32 | 0.87 | –146.80 | 0.63 | –49.17 | 0.66 | –57.83 | 0.48 | –25.43 | ||||||
| LLWL | 0.73 | 79.92 | 0.69 | 116.39 | 0.73 | 78.22 | 0.73 | 87.10 | 0.64 | 172.05 | 0.60 | 199.17 | 0.44 | 247.26 | ||||||
| LWL | 0.86 | –80.78 | 0.86 | –81.22 | 0.86 | –76.61 | 0.87 | –68.21 | 0.87 | –89.68 | 0.62 | –70.46 | 0.48 | –65.52 | ||||||
分析表明, 随着日龄的增加, 鸢乌贼角质颚外形特征参数与ML的比值基本稳定。其中, 除UWL/ML外, UHL/ML、UCL/ML、ULWL/ML、LHL/ML、LCL/ML、LLWL/ML和LWL/ML在121—150 d时的值较低, 之后随着日龄的增加而不断增加, 但在211—240 d时出现略微下降的趋势。除了个别日龄阶段存在小范围的波动外, 总体而言, 随着日龄的增加, 鸢乌贼角质颚8个外形特征参数与ML比值的变化趋势保持基本稳定(图 3)。
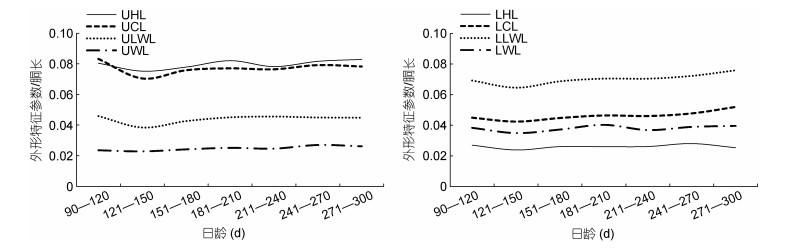 |
| 图 3 鸢乌贼角质颚外形特征参数与胴长比值和日龄的关系 Fig. 3 Relationships between ratios of morphological characteristic parameters of beak to mantle length and age for S. oualaniensis |
分析表明, UHL、UCL、ULWL、UWL、LHL、LCL、LLWL和LWL的AGR均随着日龄的增加而呈现明显增加的趋势, 上颚的AGR均大于下颚。其中, 在121—210 d时, UHL、UCL、ULWL、LLWL和LWL的AGR呈现明显增加的趋势, UWL、LHL和LCL的AGR则比较平缓, 但该阶段角质颚各个外形特征参数总体上呈现增长的趋势。在211—240 d时, UHL、LHL和LWL的AGR呈现较明显的下降趋势, 而UCL、UWL、LCL和LLWL的AGR较为平缓, ULWL的AGR较高但已呈现下降趋势, 该阶段的角质颚各个外形特征参数总体呈现下降或平稳的趋势(图 4)。UHL、UCL、UWL、LHL、LCL、LLWL和LWL的IGR随着日龄的增加而呈现增加的趋势, ULWL的IGR随着日龄的增加呈现明显的“W”形波动趋势, 其中, UHL、UWL和LWL的IGR在211—240 d时较低, 而UCL、LCL和LLWL的IGR则较为平缓(图 4)。
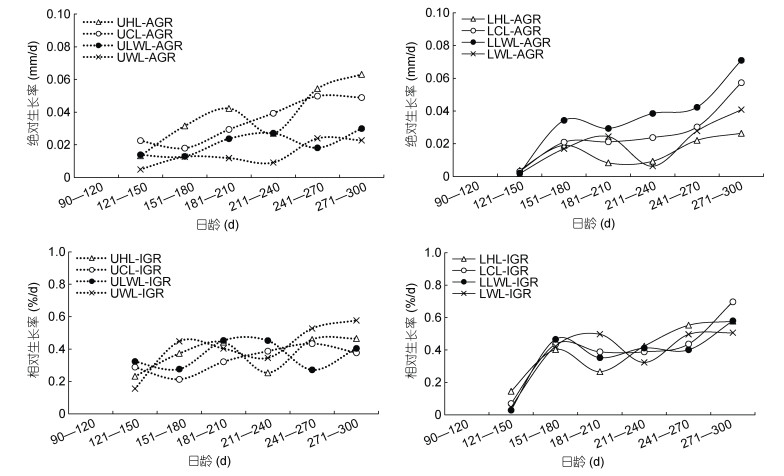 |
| 图 4 鸢乌贼角质颚外形特征参数生长率与日龄关系 Fig. 4 Relationship between growth rate of morphological characteristic parameters and age for S. oualaniensis beak |
研究结果表明, 同其他头足类相似, 鸢乌贼角质颚微结构中存在周期性生长纹, 且头盖部与脊突部的生长纹在形态上存在差异。角质颚微结构中存在反映日龄的生长纹早已被证实, 并且基本满足“一日一轮”的自然生长规律(Hernández-López et al, 2001), 但本研究发现, 鸢乌贼角质颚两条日轮间会存在一条或若干条亚日轮(图 2d), 在日龄读取时应加以辨认, 避免误读, 导致日龄数据偏大。脊突部与头盖部的生长纹由内轴隔开, 脊突部整体宽度较窄, 导致该部的生长纹间距较为紧密, 重叠现象严重, 不易进行读取(图 2b, 2c); 而头盖部的生长纹间距稀疏, 读取日龄时更为清晰便利(图 2b, 2c)。头盖部近喙端的日龄生长纹间距较窄, 而头盖部中部的生长纹间距较宽, 这可能与头足类在生活史前期和中期的生长速度较快有关(Arkhipkin, 2005)。一些样本的头盖部可见较清晰、明显的标记轮, 近喙端出现标记轮的概率较大(图 2e), 这可能与鸢乌贼在生活史后期所经历的生活史事件(交配、产卵)和外界环境刺激(海洋环境变化、掠食者袭击)有关(Arkhipkin, 2005; Perales-Raya et al, 2014)。
角质颚是鸢乌贼主要的摄食器官, 捕食中通过角质颚撕扯猎物常常致使尖锐的喙端折断或磨损(图 2e), 与此同时, 喙端的日龄生长纹也会受到损坏而无法读取, 通常可以通过头盖背侧边缘的日龄生长纹进行替代(Perales-Raya et al, 2010)。角质颚存在明显的色素沉积现象(陆化杰等, 2020b), 通常情况下头盖部的色素沉积较脊突部深, 头盖部喙端的色素沉积较叉口处深。颜色较深处日龄生长纹的研磨、观察和读取难度较大, 需要更加谨慎辨认亚日轮。但鉴于脊突部的日龄生长纹间距较窄且有重叠, 不易区分亚日轮, 因此角质颚微结构中日龄生长纹的读取多集中在头盖部。
3.2 日龄与角质颚外形特征参数的关系分析表明, 鸢乌贼头盖部HL (UHL和LHL)和翼部WL (UWL和LWL)的生长关系均适合用逻辑斯蒂生长模型表示, 脊突部CL(UCL和LCL)的生长关系则适合用线性生长模型表示, 侧壁部LWL(ULWL和LLWL)的生长关系适合用对数生长模型表示。
南海剑尖枪乌贼(Uroteuthis edulis)的角质颚头盖部HL、脊突部CL和翼部WL与日龄的生长关系均适用线性生长模型表示(林静远等, 2019); 秘鲁海域茎柔鱼(Dosidicus gigas)的头盖部HL、脊突部CL、侧壁部LWL和翼部WL与日龄的生长关系也均适用线性生长模型表示(胡贯宇等, 2017); 西南大西洋阿根廷滑柔鱼(Illex argentinus)秋、冬季产卵群的头盖部HL、脊突部CL和翼部WL与日龄的生长关系则分别适合用幂函数、指数和线性生长模型表示(陆化杰等, 2012); 而巴西南部真蛸(Octopus vulgaris)脊突部CL与日龄的生长关系则为指数生长模型(Castanhari et al, 2012)。本研究中脊突部CL的生长关系与秘鲁海域茎柔鱼脊突部CL的生长关系相符, 均适用线性生长模型表示(胡贯宇等, 2017)。不同种类或相同种类不同分布海域的头足类所经历的海洋环境不同, 造成水温和食物上的差异, 这些可能会导致头足类的生长差异性(Keyl et al, 2011)。
性腺发育成熟以前, 头足类的生长速度大多较快; 随着性腺的成熟, 生长速度趋于变缓, 总体的自然生长规律适用于逻辑斯蒂生长模型描述(Arkhipkin, 2005)。鸢乌贼的角质颚外形随着个体的生长逐渐增大(陈子越等, 2019b), 本研究中鸢乌贼头盖部HL(UHL和LHL)和翼部WL(UWL和LWL)的生长关系符合逻辑斯蒂生长模型, 这说明性腺发育成熟以后鸢乌贼的角质颚外形生长逐渐放缓。由于灯光罩网的网目较大, 本研究采集的鸢乌贼样本均为亚成鱼或成鱼, 缺乏仔鱼(Paralarvae)和稚鱼(Juvenile)样本, 因此上述生长模型不适用于描述西沙海域鸢乌贼仔、稚鱼阶段的生长特性, 仅适用于亚成鱼和成鱼阶段, 这与智利海域茎柔鱼的研究结果相似(Chen et al, 2011)。
3.3 角质颚外形特征参数与胴长比值和生长率结果表明, 鸢乌贼角质颚外形特征参数与ML的比值仅在121—150 d和211—240 d时呈现小范围波动, 但随着日龄的增加最终基本趋于稳定。柔鱼类的角质颚生长与胴体的生长基本同步(方舟等, 2014), 角质颚各部均匀增长且整体形态变化不大(陈子越等, 2019b)。本研究进一步证明了鸢乌贼角质颚不仅遵循各部均匀增长的生长规律, 同时伴随日龄的增长, 角质颚各部增长的比例也与胴体增长的比例基本一致, 仅在121—150 d、211—240 d这两个特定的生活史阶段存在波动。
本研究中, 鸢乌贼角质颚UHL、UCL、ULWL、UWL、LHL、LCL、LLWL和LWL的绝对生长率AGR在121—150 d时较低, 上颚的AGR在121—150 d均大于下颚。随着日龄的增加, UHL的AGR逐渐增加, 并在211—240 d时下降后继续增加; UCL、ULWL、LCL和LLWL呈现一直增加的趋势, 但在211—240 d时较平稳; UWL的AGR较为平缓, 在211—240 d时出现低值; LHL和LWL的AGR值在211—240 d时下降后继续增加。
生活史早期的鸢乌贼仔鱼主要营漂浮生活, 角质颚的功能尚未完善, 摄取食物的能力较差。鸢乌贼仔鱼期结束时的日龄范围约为50—60 d, 此后便进入稚鱼期发育阶段, 但鸢乌贼的胴体部分在仔、稚鱼期的整体生长速度相对较慢(Sajikumar et al, 2018)。柔鱼类角质颚的生长与胴体的生长基本同步(方舟等, 2014), 可认为鸢乌贼在仔、稚鱼期的角质颚发育也相对迟缓。鸢乌贼在稚鱼期中期逐步展现食性转换和同类相食行为, 说明该阶段的角质颚已经具备了一定强度和硬度, 能够适应捕食较小的猎物(Sajikumar et al, 2018)。仔鱼期结束的日龄范围约为50—60 d, 之后便进入稚鱼期, 而本研究中日龄范围121—150 d应处于稚鱼期后, 这一阶段角质颚各部与ML比值和AGR仍较低。这说明虽然鸢乌贼角质颚的生长速度经稚鱼期中期以后逐渐变快, 在稚鱼期后(121—150 d)已经具备了一定的硬度和捕食能力, 但该阶段角质颚的生长较胴体的生长发育仍相对滞后(图 3)。
鸢乌贼的腕部是主要的捕食器官, 鳍为主要的运动器官(董正之, 1991; 陈新军等, 2009), 均在仔、稚鱼期的生长较为迅速, 相比之下同一阶段头部和胴体部分的生长则较为缓慢(Sajikumar et al, 2018)。因此鸢乌贼在仔、稚鱼期的个体生长主要集中在腕部和鳍部, 胴体的生长相对滞后。鳍和腕部发育的日趋成熟使鸢乌贼的自主游动能力和摄食能力得到提升, 鸢乌贼在仔鱼期多栖息在近岸大陆坡海域, 稚鱼期则逐渐迁徙至大洋中的开阔海域(Sajikumar et al, 2018)。鸢乌贼仔鱼多以浮游甲壳类为食(董正之, 1991; Vecchione, 1991; 陈新军等, 2009; Uchikawa et al, 2009; Jereb et al, 2010); 长至稚鱼期中期时摄食对象逐渐转变为鱼类和头足类(董正之, 1991; 陈新军等, 2009; Jereb et al, 2010; Sajikumar et al, 2018)。这说明鸢乌贼稚鱼进入大洋的开阔海域后, 为了应对摄食对象的改变和猎物体型的增大, 角质颚的生长速度逐渐加快, 在121—210 d时的增长较为明显。角质颚的生长在121—150 d时比胴体的生长尚有滞后, 但在151—210 d时与胴体的生长已基本同步(图 3), 这也表明了121—210 d时鸢乌贼的个体生长重心已从鳍部和腕部转移至胴体部(方舟等, 2014)。
柔鱼(Ommastrephes bartramii)与鸢乌贼寿命均为1年左右(陈新军等, 2009; Jereb et al, 2010), 相关研究发现, 柔鱼的生长与性腺发育密切相关, 生活史前期和性成熟后所摄入的能量分别主要用于胴体发育和性腺发育(陈新军等, 2011)。日龄220 d以后, 西北太平洋柔鱼胴体的生长速率急剧下降, 摄取的能量主要用于性腺的发育成熟(陈新军等, 2011)。鸢乌贼的繁殖策略为多次产卵, 繁殖过程中具多个产卵期, 对能量的需求巨大(Harman et al, 1989; 陈新军等, 2009; Jereb et al, 2010; 朱凯等, 2019a, b)。鸢乌贼性腺发育的能量需求主要来源于即时摄取的饵料而非源于肌肉组织衰败所转化的能量, 其胴体的生长在此过程中逐渐停滞, 因而从饵料中摄入的营养主要用于性腺发育的能量积累(Rocha et al, 2001; 朱凯等, 2019a, b)。本研究中, 日龄范围为211—240 d时, 角质颚UHL、UCL、UWL、LCL、LLWL和LWL的AGR值变缓或降低, 240 d后的短时间内仍继续增加。角质颚头盖部(HL)、脊突部(CL)和侧壁部(LWL)的快速生长可以增强鸢乌贼的捕食能力, UHL和UCL的快速生长可以提升鸢乌贼撕扯猎物的能力(方舟等, 2014)。因此, 上颚的AGR在121—150 d比下颚的AGR高, 这说明上颚的生长较下颚更为提前且迅速; 同时UHL的AGR增幅较上颚各部更为明显, UCL的AGR更是呈现一直增长的趋势, 说明鸢乌贼UHL和UCL的生长较上颚其它部位更为迅速。LCL和LLWL的快速生长可以增强下颚固定猎物的能力, 同时为侧壁部LWL上附着的肌肉提供强大的支点(方舟等, 2014)。因此, LLWL的AGR增幅较明显, LCL的AGR也呈现一直增长的趋势, 并且LHL和LWL在211—240 d后均保持较为明显的增长趋势。单一阶段的角质颚迅速生长使鸢乌贼的捕食能力在短时间内得到有效的提升, 很好地保证了211—240 d以后性腺发育所需的能量供给, 为后续的繁殖活动做充分准备。角质颚各部在240 d以后的快速生长期短于121—210 d的快速生长期, 但增长的趋势更为显著, 这说明角质颚各部需要在更短的时间内迅速生长, 直至繁殖活动结束后生长放缓或停滞, 这一生长特性也与逻辑斯蒂生长模型相吻合。
总结发现, 日龄210 d以前, 未成熟和成熟的鸢乌贼样本分别占比79.83%和20.17%; 日龄240 d以后, 未成熟和成熟的鸢乌贼样本分别占比49.63%和50.37%, 性成熟个体比例显著增加(表 4)。相关研究表明, 南海西沙群岛海域的鸢乌贼生长至一定阶段(胴长121—150 mm和性腺成熟度Ⅲ期)后, 角质颚的外形生长速度减缓, 此阶段为鸢乌贼角质颚生长的拐点(陈子越等, 2019b)。本研究的鸢乌贼角质颚生长拐点正好约为211—240 d, 即日龄范围为121—210 d时, 鸢乌贼角质颚外形和胴体生长均较快, 此阶段大部分个体性腺发育未成熟; 日龄范围为211—240 d时, 鸢乌贼角质颚外形和胴体生长均减缓, 此阶段大部分个体性腺发育进入成熟期(Ⅰ—Ⅱ期减少, Ⅲ期增多); 240 d以后, 胴体生长逐渐停滞, 而角质颚外形继续生长, 此阶段大部分个体性腺发育逐渐趋于成熟。
| 日龄范围 | 性未成熟 | 性成熟 |
| 210 d前 | 79.83% | 20.17% |
| 240 d前 | 49.63% | 50.37% |
本研究结果表明, 南海西沙群岛海域的鸢乌贼角质颚外部形态生长拐点约为211—240 d (7—8个月)。同时, 鸢乌贼个体在拐点前的生长主要集中在胴体生长, 在拐点后的生长主要集中在性腺发育。本研究首次利用了角质颚微结构对南海西沙群岛海域的鸢乌贼日龄与生长进行研究, 初步对其关键生活史进行了分析和判断, 为今后充分、合理地开发和管理该资源提供了科学依据, 后续将扩大周边采样海域, 对比南海鸢乌贼多个群体的日龄与生长情况, 结合微化学方法进一步对南海鸢乌贼的关键生活史阶段开展深入研究。
方舟, 陈新军, 陆化杰, 等. 2014. 北太平洋两个柔鱼群体角质颚形态及生长特征. 生态学报, 34(19): 5405-5415 |
朱凯, 孙程婕, 陈新军, 等. 2019a. 南海鸢乌贼中型群雌性个体肌肉和性腺组织能量积累及其分配. 海洋渔业, 41(6): 641-651 |
朱凯, 张立川, 陈新军, 等. 2019b. 南海鸢乌贼中型群雄性个体肌肉和性腺组织能量积累及其分配. 热带海洋学报, 38(4): 41-51 |
江艳娥, 陈作志, 林昭进, 等. 2019. 南海海域鸢乌贼中型群与微型群渔业生物学比较. 水产学报, 43(2): 454-466 |
张鹏, 杨吝, 张旭丰, 等. 2010. 南海金枪鱼和鸢乌贼资源开发现状及前景. 南方水产, 6(1): 68-74 DOI:10.3969/j.issn.1673-2227.2010.01.012 |
张宇美, 颜云榕, 卢伙胜, 等. 2013. 西沙群岛海域鸢乌贼摄食与繁殖生物学初步研究. 广东海洋大学学报, 33(3): 56-64 DOI:10.3969/j.issn.1673-9159.2013.03.010 |
陆化杰, 宁欣, 刘维, 等. 2021. 不同气候条件下南海西沙海域鸢乌贼(Sthenoteuthis oualaniensis)渔业生物学比较研究. 海洋与湖沼, 52(4): 1029-1038 |
陆化杰, 张旭, 童玉和, 等. 2020a. 中国南海西沙群岛海域鸢乌贼耳石微结构及生长特性. 水产学报, 44(5): 767-776 |
陆化杰, 陈子越, 宁欣, 等. 2020b. 中国南海西沙群岛海域鸢乌贼角质颚色素沉积变化. 生态学杂志, 39(5): 1600-1608 |
陆化杰, 陈子越, 童玉和, 等. 2019. 中国南海西沙群岛海域鸢乌贼耳石元素组成. 应用生态学报, 30(2): 653-660 |
陆化杰, 陈新军, 方舟. 2012. 西南大西洋阿根廷滑柔鱼2个不同产卵群间角质颚外形生长特性比较. 中国海洋大学学报, 42(10): 33-40 |
陆化杰, 童玉和, 刘维, 等. 2018. 厄尔尼诺年春季中国南海中沙群岛海域鸢乌贼的渔业生物学特性. 水产学报, 42(6): 912-921 |
陈子越, 陆化杰, 童玉和, 等. 2019a. 中国南海西沙群岛海域鸢乌贼角质颚生长特性. 上海海洋大学学报, 28(3): 373-383 |
陈子越, 陆化杰, 童玉和, 等. 2019b. 个体差异对西沙群岛海域鸢乌贼角质颚外部形态变化的影响. 水产学报, 43(12): 2501-2510 |
陈新军, 马金, 刘必林, 等. 2011. 基于耳石微结构的西北太平洋柔鱼群体结构、年龄与生长的研究. 水产学报, 35(8): 1191-1198 |
陈新军, 叶旭昌. 2005. 印度洋西北部海域鸢乌贼渔场与海洋环境因子关系的初步分析. 上海水产大学学报, 14(1): 55-60 |
陈新军, 刘必林. 2017. 渔业资源生物学. 北京: 科学出版社, 99
|
陈新军, 刘必林, 王尧耕. 2009. 世界头足类. 北京: 海洋出版社, 312-313
|
招春旭, 陈昭澎, 何雄波, 等. 2017. 基于耳石微结构的南海春季鸢乌贼日龄、生长与种群结构的研究. 水生生物学报, 41(4): 884-890 |
林静远, 刘必林, 王立权. 2019. 基于角质颚微结构的剑尖枪乌贼的日龄与生长. 华东理工大学学报(自然科学版), 45(5): 775-782 |
胡贯宇, 金岳, 陈新军. 2017. 秘鲁外海茎柔鱼角质颚的形态特征及其与个体大小和日龄的关系. 海洋渔业, 39(4): 361-371 DOI:10.3969/j.issn.1004-2490.2017.04.001 |
董正之. 1991. 世界大洋经济头足类生物学. 济南: 山东科学技术出版社, 91-95
|
Arkhipkin A I, 2005. Statoliths as 'black boxes' (life recorders) in squid. Marine and Freshwater Research, 56(5): 573-583 DOI:10.1071/MF04158 |
Castanhari G, Tomás A R G, 2012. Beak increment counts as a tool for growth studies of the common octopus Octopus vulgaris in Southern Brazil. Boletim do Instituto de Pesca, 38(4): 323-331 |
Chen X J, Lu H J, Liu B L et al, 2011. Age, growth and population structure of jumbo flying squid, Dosidicus gigas, based on statolith microstructure off the Exclusive Economic Zone of Chilean waters. Journal of the Marine Biological Association of the United Kingdom, 91(1): 229-235 DOI:10.1017/S0025315410001438 |
Clarke M R, 1962. The identification of cephalopod 'beaks' and the relationship between beak size and total body weight. Bulletin of the British Museum (Natural History) (Zoology), 8(10): 421-480 |
Haddon M, 2001. Modelling and Quantitative Methods in Fisheries. Florida, USA: Chapman & Hall/CRC, 227-232
|
Harman R F, Young R E, Reid S B et al, 1989. Evidence for multiple spawning in the tropical oceanic squid Stenoteuthis oualaniensis (Teuthoidea: Ommastrephidae). Marine Biology, 101(4): 513-519 DOI:10.1007/BF00541653 |
Hernández-López J L, Castro-Hernández J J, Hernández-García V et al, 2001. Age determined from the daily deposition of concentric rings on common octopus (Octopus vulgaris) beaks. Fishery Bulletin, 99(4): 679-684 |
Hiramatsu K, 1993. Application of maximum likelihood method and AIC to fish population dynamics. In: Matsumiya Y ed. Fish Population Dynamics and Statistical Models. Tokyo: Koseisha Koseikaku, 9-21
|
Jereb P, Roper C F E, 2010. Cephalopods of the World: An Annotated And Illustrated Catalogue Of Cephalopod Species Known To Date. Volume 2: Myopsid and Oegopsid Squids. Rome, Italy: Food and Agriculture Organization of the United Nations, 315-318
|
Keyl F, Argüelles J, Tafur R, 2011. Interannual variability in size structure, age, and growth of jumbo squid (Dosidicus gigas) assessed by modal progression analysis. ICES Journal of Marine Science, 68(3): 507-518 DOI:10.1093/icesjms/fsq167 |
Nesis K, 1993. Population structure of oceanic ommastrephids, with particular reference to Sthenoteuthis oualaniensis: A review. In: Okutani T, O'Dor R K, Kubodera T eds. Recent Advances in Cephalopod Fisheries Biology. Tokyo, Japan: Tokai University Press, 375-383
|
Perales-Raya C, Bartolomé A, García-Santamaría M T et al, 2010. Age estimation obtained from analysis of octopus (Octopus vulgaris Cuvier. 1797) beaks: Improvements and comparisons. Fisheries Research, 106(2): 171-176 DOI:10.1016/j.fishres.2010.05.003 |
Perales-Raya C, Jurado-Ruzafa A, Bartolomé A et al, 2014. Age of spent Octopus vulgaris and stress mark analysis using beaks of wild individuals. Hydrobiologia, 725(1): 105-114 DOI:10.1007/s10750-013-1602-x |
Rocha F, Guerra Á, González A F, 2001. A review of reproductive strategies in cephalopods. Biological Reviews, 76(3): 291-304 DOI:10.1017/S1464793101005681 |
Sajikumar K K, Ragesh N, Venkatesan V et al, 2018. Morphological development and distribution of paralarvae and juveniles of purpleback flying squid Sthenoteuthis oualaniensis (Ommastrephidae), in the Southeastern Arabian Sea. Vie et Milieu-Life and Environment, 68(2/3): 75-86 |
Uchikawa K, Sakai M, Wakabayashi T et al, 2009. The relationship between paralarval feeding and morphological changes in the proboscis and beaks of the neon flying squid Ommastrephes bartramii. Fisheries Science, 75: 317-323 DOI:10.1007/s12562-008-0036-2 |
Vecchione M, 1991. A method for examining the structure and contents of the digestive tract in paralarval squids. Bulletin of Marine Science, 49(1/2): 300-308 |
 2021, Vol. 52
2021, Vol. 52


