中国海洋湖沼学会主办。
文章信息
- 李云凯, 冯丹, 高小迪, 陈新军, 贡艺. 2021.
- LI Yun-Kai, FENG Dan, GAO Xiao-Di, CHEN Xin-Jun, GONG Yi. 2021.
- 东太平洋赤道海域鸢乌贼(Sthenoteuthis oualaniensis)和茎柔鱼(Dosidicus gigas)的食性比较研究
- COMPARATIVE STUDY ON THE FEEDING HABITS OF STHENOTEUTHIS OUALANIENSIS AND DOSIDICUS GIGAS IN THE EASTERN EQUATORIAL PACIFIC OCEAN
- 海洋与湖沼, 52(5): 1303-1314
- Oceanologia et Limnologia Sinica, 52(5): 1303-1314.
- http://dx.doi.org/10.11693/hyhz20210300062
文章历史
-
收稿日期:2021-03-07
收修改稿日期:2021-03-30
2. 农业农村部远洋与极地渔业创新重点实验室 上海 200009;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266237;
4. 大洋渔业资源可持续开发省部共建教育部重点实验室 上海 201306
2. Key Laboratory of Oceanic and Polar Fisheries, Ministry of Agriculture and Rural Affairs of Chinese Academy of Fishery Sciences, Shanghai 200009, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
4. The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Shanghai Ocean University, Ministry of Education, Shanghai 201306, China
柔鱼科(Ommastrephidae)头足类动物广泛分布在除北冰洋以外的全球各大洋, 是海洋生态系统的重要生态类群, 也是头足类商业捕捞中产量最高的种类(De La Chesnais et al, 2019)。鸢乌贼(Sthenoteuthis oualaniensis)和茎柔鱼(Dosidicus gigas)同属柔鱼科、柔鱼亚科, 是各国头足类商业捕捞的主要物种(陈新军, 2004; 刘金立等, 2019; 陈新军等, 2019)。鸢乌贼分布于印度洋和太平洋的赤道与亚热带海域(38°N—40°S) (Roper et al, 1984), 而茎柔鱼分布于北至美国加利福尼亚(30°N), 南至智利圣地亚哥(45°S)的东太平洋海域, 并在赤道向西延伸到125°W。两种头足类在东太平洋赤道海域呈同域分布的状态(Staaf et al, 2010)。此外作为近缘种, 两种头足类外部形态相似, 且都具有生长快、摄食量大和昼夜垂直洄游等生物学特性(Bazzino et al, 2010; Staaf et al, 2010; 贡艺等, 2019; 韩飞等, 2019)。根据稳定进化对策(evolutionary stable strategy), 近缘种会通过调节自身的摄食策略来减少食物竞争, 从而可能达到平衡而共存(Schoener et al, 1974)。前期利用稳定同位素和脂肪酸分析技术研究发现, 同域分布的鸢乌贼和茎柔鱼存在营养生态位分化的现象(李云凯等, 2020)。但因缺少稳定同位素基线和饵料生物的稳定同位素和脂肪酸组成信息, 为了更直观反映鸢乌贼和茎柔鱼的摄食习性及其差异, 本研究拟利用胃含物分析法对两种头足类的饵料生物进行分析和比较。由于柔鱼科头足类特殊的摄食方式, 食物会被其角质颚(beak)和齿舌(radula)撕咬、磨锉成糜状或碎块状, 影响对食物组成的准确判断(Braley et al, 2010)。国内外学者已开始运用DNA条形码技术辅助识别头足类的食物组成(龚玉艳等, 2018; 刘梦娜等, 2020; Bo et al, 2020)。据此, 本文以东太平洋赤道海域的鸢乌贼和茎柔鱼为研究对象, 通过结合传统胃含物分析和DNA条形码技术对二者的食物组成开展研究, 分析同域分布头足类近缘种食性特化现象, 为解析头足类近缘种共存机制提供数据支撑。
1 材料与方法 1.1 样品采集与处理鸢乌贼和茎柔鱼均采自中东太平洋赤道海域(图 1), 由科学观察员2017—2019年于我国远洋鱿钓船捕捞作业期间采集(表 1)。样品采集后立即冷冻, 经冷冻运回实验室后进行生物学解剖和测量, 包括胴长(mm)和体质量(g), 胃含物样本编号装袋后保存于95%的乙醇中。为减少采样点时空分布、体型差异和样本量对研究结果的潜在影响, 仅选择相同月份捕获且胴长和体质量相近的两种头足类样品开展研究, 样本量均为80尾。
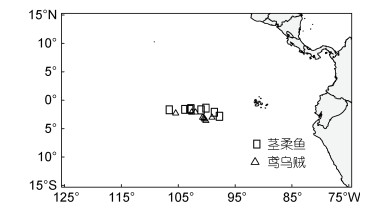 |
| 图 1 鸢乌贼与茎柔鱼采样站点图 Fig. 1 Sampling locations of S. oualaniensis and D. gigas |
| 年份 | 物种 | 样本量 | 采样范围 | 胴长(mm) | ANOVA |
| 2017 | S. oualaniensis | 29 | 2°37′—2°53′S | 280±44 | P=0.047 |
| 100°11′—102°20′W | |||||
| D. gigas | 31 | 1°53′—2°25′S | 260±31 | ||
| 99°37′—102°30′W | |||||
| 2018 | S. oualaniensis | 20 | 1°14′—2°35′S | 184±38 | P=0.007 |
| 98°50′—103°13′W | |||||
| D. gigas | 22 | 2°12′—2°56′S | 214±31 | ||
| 99°36′—102°54′W | |||||
| 2019 | S. oualaniensis | 31 | 2°46′—3°37′S | 231±42 | P=0.583 |
| 102°18′—105°20′W | |||||
| D. gigas | 27 | 1°43′—3°19′S | 237±44 | ||
| 102°34′—106°11′W |
用无菌镊子去除胃壁, 滤纸吸干多余的水分, 取全部胃含物称重。在Olympuss ZX7体视显微镜下对饵料生物进行鉴定并计数, 对照现场收集的饵料生物、海洋生物分类资料以及耳石图谱库等将胃含物尽可能鉴定至最低分类阶元, 然后用滤纸将食物团表面水分吸干, 并用Shimadzu精密电子天平(精确到0.000 1 g)分别称重。暂未能鉴定的耳石和头足类角质颚保存于95%乙醇中以便进一步鉴定, 未能通过形态鉴定的未知组织置于95%乙醇溶液中冷冻保存, 用DNA条形码技术进一步鉴定。
1.3 DNA条形码法鉴定饵料生物取适量糜烂程度较小的食物块, 用无菌水多次冲洗, 确保组织表面没有胃液沉积后, 取100 mg左右样品置于新的灭菌离心管中, 用PBS冲洗后换入新的离心管中, 使用无菌剪刀将组织剪碎用于DNA提取。采用海洋动物组织基因组DNA提取试剂盒(天根)提取胃含物基因组DNA, 利用Nano Drop 2000超微量分光光度计进行DNA浓度测试。
用Leray等(2013)设计改进的mlCOlintF、mlCOIintR和Lco1490、Hco2198两对引物(Geller et al, 2013), 选取线粒体基因细胞色素C氧化酶亚基I (mitochon-drial cytochrome oxidase subunit I, COI)作为分子标记进行PCR扩增, 引物由生工(上海)生物公司合成, 序列见表 2。
| 引物名称 | 引物序列(5′—3′) | 参考文献 |
| Lco1490 | GGTCAAATCATAAAGATATTGG | Geller et al, 2013 |
| Hco2198 | TAAACTTCAGGGTGACCAAAAAATCA | Geller et al, 2013 |
| mlCOIintF | GGWACWGGWTGAACWGTWTAYCCYCC | Leray et al, 2013 |
| mlCOIintR | GGRGGRTASACSGTTCASCCSGTSCC | Leray et al, 2013 |
PCR扩增25 μL体系: 6.5 μL H2O, 12.5 μL Premix Ex Taq酶(TaKaRa) (2×), 正反向引物(0.25 μmol/L) 各0.5 μL以及DNA模板5 μL。反应条件为: 95 ℃预变性5 min, 95 ℃变性10 s, 56 ℃退火30 s, 72 ℃延伸1 min, 退火温度以1 ℃降序进行变性、退火、延伸16个循环, 至退火温度为46 ℃时, 重复25次循环。72 ℃延伸10 min, 4 ℃结束反应(刘梦娜等, 2020)。在1%的琼脂糖凝胶电泳之后, 将PCR产物送生工(上海)生物公司进行纯化、反向测序。DNA测序结果在NCBI (National Center for Biotechnology Information)网站进行核酸比对, 对于鱼类及头足类, 将BLAST (Basic Local Alignment Search Tool)最高匹配相似度超过99%的饵料生物确定到种, 低于99%高于90%的确定到属(Ward et al, 2005); 对于甲壳类, 将超过90%的饵料生物确定到种, 低于90%高于80%的确定到属(Costa et al, 2007; Xu et al, 2019; 刘梦娜等, 2020)。
1.4 数据处理评价某一头足类胃含物中各饵料重要性的指标, 主要包括个数百分比N%、出现频率F%、饵料质量百分比W%、相对重要指数IRI, 相对重要性指数百分比IRI% (Hyslop, 1980)和Shannon-Wiener多样性指数, 计算公式如下:
 (1)
(1) (2)
(2)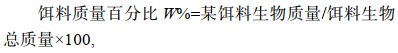 (3)
(3)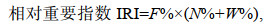 (4)
(4) (5)
(5)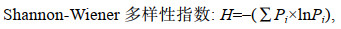 (6)
(6)式中, Pi为第i种饵料生物在食物组成中的数量百分比。
2 结果 2.1 食物组成鸢乌贼和茎柔鱼的胴长范围分别为143—380 mm和172—380 mm, 二者无显著差异(ANOVA, F=0.128, P=0.72)。体质量分别为101—1 552 g和165—1 577 g, 也无显著差异(ANOVA, F=0.86, P > 0.05)。
对鸢乌贼和茎柔鱼的传统胃含物分析共鉴定出饵料生物31种, 包括16种鱼类、3种头足类和1种腹足类可直接鉴定到种, 4种鱼类可鉴定至属, 2种鱼类、2种甲壳类和3种软体动物可鉴定至科(表 3)。而DNA条形码鉴定共识别出33种, 包括7种鱼类、6种头足类、9种甲壳类和1种海樽类, 剩下的3种鱼类、5种头足类和2种甲壳类可鉴定至属(表 4)。两种方法所获结果经比对后发现, 鸢乌贼和茎柔鱼共摄食饵料生物4大类64种, 分属37科, 包括甲壳动物、鱼类、软体动物和海樽类(表 3)。甲壳动物主要为桡足类(Copepods)、端足类(Amphipoda)、磷虾类(Euphausiacea)和十足类(Decapoda); 鱼类主要包括灯笼鱼科(Myctophidae)、光器鱼科(Phosichthyidae)、巨口鱼科(Stomiidae)、钻光鱼科(Gadidae)、鳕科(Gadidae)和圆鲳科(Nomeidae)等; 软体动物主要包括头足类(爪乌贼科Onychoteuthidae、手无贼科Chiroteuthidae、菱鳍乌贼科Thysanoteuthidae和小头乌贼科Cranchiidae等)、双壳类(胡桃蛤Nuculidae)和腹足类(螔螺科Limacinidae、翼管螺科Pterotracheidae、龟螺科Cavoliniidae)。鸢乌贼和茎柔鱼的饵料生物分别占其中的53和50种。
|
| 样品序号 | 形态学鉴定 | DNA鉴定 | 相似性(%) | 序列号 |
| 1 | 桡足类 | 伪细真哲水蚤E. pseudattenuatus | 99.51 | EU599529.1 |
| 2 | 桡足类 | 短平头水蚤C. curta | 98.52 | HM045360.1 |
| 3 | 端足类 | 长足似泉虫戎H. longipes | 86.78 | EF989685.1 |
| 4 | 端足类 | 触角扁鼻戎S. antennarius | 91.88 | HM053505.1 |
| 5 | 端足类 | 定居慎戎P. sedentaria | 99.02 | MT062492.1 |
| 6 | 不可辨虾 | 卷叶磷虾E. recurva | 93.94 | MG669394.1 |
| 7 | 不可辨虾 | 长额磷虾E. eximia | 99.68 | AY601080.1 |
| 8 | 不可辨虾 | Euphausia gibboides | 99.52 | AY601081.1 |
| 9 | 不可辨虾 | Thysanopoda monacantha | 97.60 | MH572669.1 |
| 10 | 糜* | 扇蟹科Xanthidae | 84.79 | KU285973.1 |
| 11 | 糜* | Cronius edwardsii | 97.69 | KT588227.1 |
| 12 | 糜* | 火体虫P. spinosum | 99.02 | MK466377.1 |
| 13 | 不可辨鱼 | 墨西哥标灯鱼S. reversus | 99.69 | KJ555469.1 |
| 14 | 不可辨鱼 | 双灯灯笼鱼M. lychnobium | 99.09 | GU440415.1 |
| 15 | 闪光灯笼鱼 | 闪光灯笼鱼M. nitidulum | 99.84 | GU440416.1 |
| 16 | 金焰灯笼鱼 | 金焰灯笼鱼M. aurolaternatum | 99.69 | KJ555427.1 |
| 17 | 不可辨鱼 | 黑壮灯鱼H. atratum | 99.68 | KJ555397.1 |
| 18 | 荧串光鱼 | 荧串光鱼V. lucetia | 99.84 | HQ010067.1 |
| 19 | 不可辨鱼 | 银腹似深海鲑B. argyrogaster | 98.33 | KU902900.1 |
| 20 | 不可辨鱼 | 少鳍方头鲳C. pauciradiatus | 97.62 | MH638789.1 |
| 21 | 不可辨鱼 | 舵鲣属Auxis spp. | 98.34 | MH638721.1 |
| 22 | 不可辨鱼 | 小鳍针飞鱼O. micropterus | 99.21 | KX579979.1 |
| 23 | 茎柔鱼 | 茎柔鱼D. gigas | 99.56 | KY446781.1 |
| 24 | 鸢乌贼 | 鸢乌贼S. oualaniensis | 99.67 | DQ885842.1 |
| 25 | 不可辨头足类 | 爪乌贼属Onychoteuthis spp. | 91.75 | AB199561.1 |
| 26 | 南太平洋爪乌贼 | 南太平洋爪乌贼Onychoteuthis meridiopacifica | 89.41 | MH570324.1 |
| 27 | 不可辨头足类 | 手乌贼科Chiroteuthidae | 94.86 | AY557529.1 |
| 28 | 不可辨头足类 | 拟钩腕鱿属Abraliopsis spp. | 91.10 | MK185878.1 |
| 29 | 不可辨头足类 | 菱鳍乌贼T. rhombus | 99.23 | EU735371.1 |
| 30 | 不可辨头足类 | 小头乌贼C. scabra | 98.93 | GQ853498.1 |
| 31 | 不可辨头足类 | 瓦尔迪瓦纺锤乌贼L. valdiviae | 99.22 | AF000050.1 |
| 32 | 不可辨头足类 | 翼鱿P. hoylei | 99.85 | JQ248117.1 |
| 33 | 糜* | 扁船艄A. argo | 100.00 | AB191273.1 |
| 注: “糜*”指无法通过形态鉴定的食物残渣, 通常是饵料生物的肌肉组织、未消化甲壳类软组织 | ||||
鸢乌贼胃含物中鱼类的N%最高(65.36%), 以灯笼鱼科(29.71%)和光器鱼科(19.56%)为主, 其次是桡足类(18.35%)和头足类(7.60%), 腹足类、端足类和磷虾类等数量较少。而茎柔鱼胃含物中桡足类的N%最高(49.70%), 其中大眼水蚤科(Corycaeidae)占比最高为44.70%, 其次是鱼类(39.58%)和腹足类(5.80%), 磷虾类、双壳类和端足类等的数量较少。
对饵料生物出现次数的分析显示, 鸢乌贼胃含物中F%最高的是鱼类(76.06%), 并以灯笼鱼科(66.20%)为主, 其次是头足类(47.89%)和桡足类(28.17%)。茎柔鱼胃含物同样以鱼类(84.93%)的F%最高, 其次是桡足类(65.75%)和头足类(61.64%)。但是与鸢乌贼相比, 茎柔鱼胃含物中F%最高的鱼类属于光器鱼科(67.12%)。
从饵料质量看, 头足类在鸢乌贼胃含物中的W%最高(58.41%), 其次为鱼类(39.72%), 而腹足类和桡足类仅占0.81%、0.35%; 茎柔鱼胃含物中头足类的W%也最高(61.24%), 鱼类(33.04%)次之, 腹足类和桡足类较鸢乌贼占比更大, 为1.75%和1.49%。
对比IRI和IRI%可知, 鱼类、头足类和甲壳类是研究海域鸢乌贼(IRI > 713.11; IRI% > 5.33%)和茎柔鱼(IRI > 3884.63; IRI% > 28.05%)最重要的饵料生物类群, 而端足类、磷虾类和海鳟类的IRI和IRI%均较低。
2.2 种间差异对各饵料指标差异性分析(ANOVA)结果显示, 饵料生物头足类和鱼类N%在鸢乌贼和茎柔鱼间存在显著差异, 但这两类的W%无显著性差异(表 5)。甲壳类的N%和W%也无种间差异。此外, 各饵料生物的F%在鸢乌贼和茎柔鱼间存在差异。甲壳类动物出现在约77%的茎柔鱼胃中, 而鸢乌贼胃含物中甲壳类F%及N%均低于茎柔鱼。此外, 在76%的鸢乌贼胃中发现了鱼类, 占饵料总个数的65%, 就F%及N%而言, 灯笼鱼科是最丰富的饵料生物。虽然鱼类在85%的茎柔鱼胃中出现, 但N%仅40%, 且以光器鱼科为主。为进一步比较相同取样时间两种头足类的食性, 对个体大小相似的2019年样品进行分析(表 1)。结果表明, 2019年鸢乌贼和茎柔鱼在鱼类N%、W%和头足类N%上存在显著性差异, 与2017—2019年的分析结果基本相符(表 5)。
| 指标 | 2017—2019年 | 2019年 | ||||
| F | P | F | P | |||
| 甲壳类 | N% | 0.630 | 0.430 | 0.025 | 0.874 | |
| W% | 0.253 | 0.617 | 0.989 | 0.332 | ||
| 鱼类 | N% | 5.629 | 0.019 | 5.878 | 0.019 | |
| W% | 1.955 | 0.165 | 10.157 | 0.003 | ||
| 头足类 | N% | 23.147 | 0.001 | 11.235 | 0.002 | |
| W% | 0.232 | 0.631 | 1.473 | 0.232 | ||
| 注: 下划线表示具有显著性差异 | ||||||
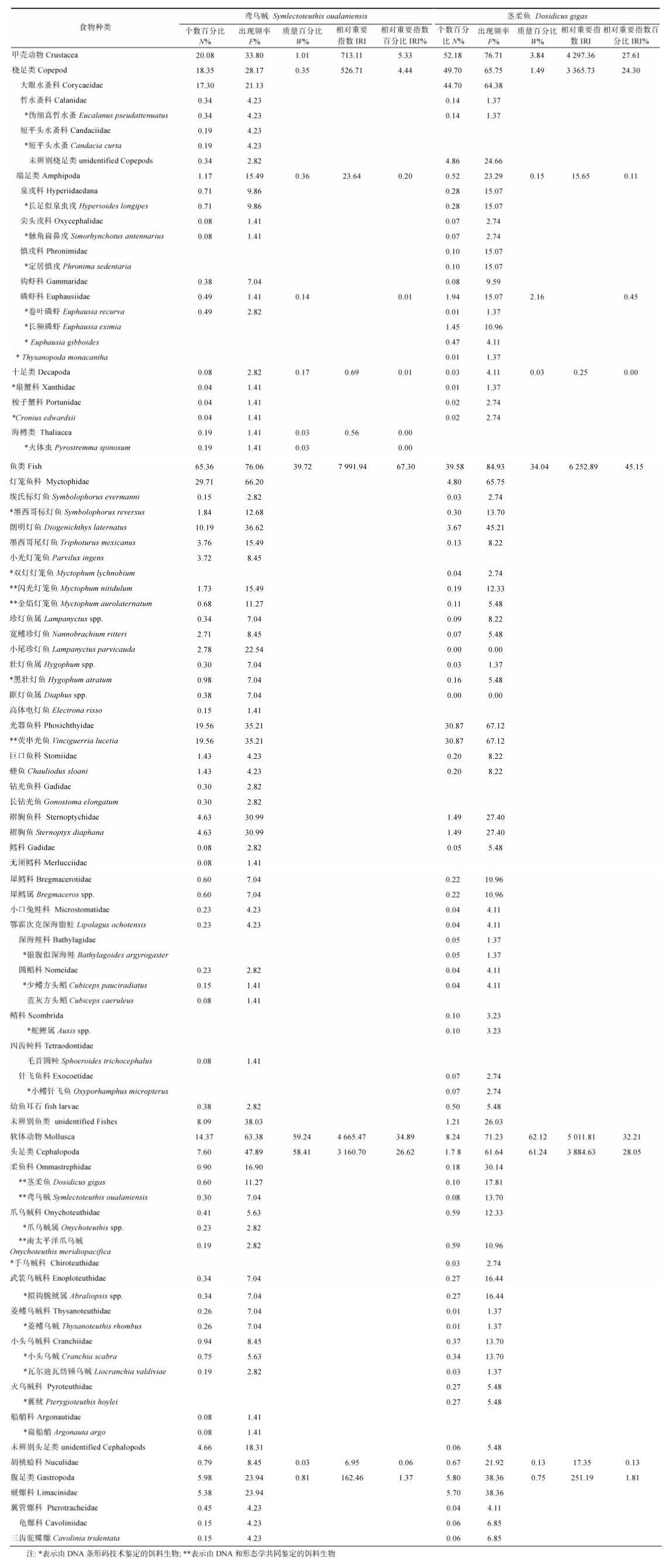
总体而言, 鸢乌贼(H=2.79)饵料生物的多样性要高于茎柔鱼(H=1.56; ANOVA, F=4.820, P=0.030)。多维尺度分析(multidimensional scaling analysis, MDS)也发现鸢乌贼食性更泛化, 茎柔鱼个体间食性较相似(图 2)。
 |
| 图 2 鸢乌贼和茎柔鱼食物组成多维尺度分析 Fig. 2 MDS analysis of S. oualaniensis and D. gigas food composition |
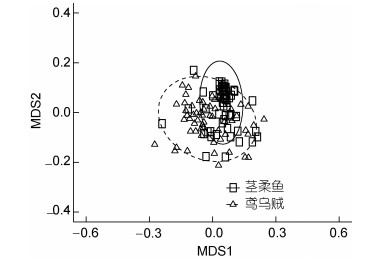
根据SIMPER分析结果(图 3), 鸢乌贼和茎柔鱼食物组成差异主要可以通过大眼水蚤科、荧串光鱼(Vinciguerria lucetia)、朗明灯鱼(Diogenichthys laternatus)、螔螺科、褶胸鱼(Sternoptyx diaphana)和闪光灯笼鱼(Myctophum nitidulum)的个数来描述。因此, 鱼类是体现两种头足类食物组成差异的最重要类别, 总非相似性贡献率达33%。
 |
| 图 3 鸢乌贼和茎柔鱼食物组成SIMPER分析 Fig. 3 SIMPER analysis of S. oualaniensis and D. gigas food composition |
由表 4形态学不可辨认部分与DNA分子鉴定结果可知, 分子鉴定通过提取胃含物中不可辨认组分, 经COI序列扩增测序, 共鉴定出饵料生物33种, 66.67%的序列可以确定到种。其中闪光灯笼鱼、金焰灯笼鱼、荧串光鱼、茎柔鱼、鸢乌贼和爪乌贼等6个物种通过两种鉴定方法均能准确鉴定, 但总体上两种方法得到的鉴定结果重叠较少, 纠其原因可能是因为形态学鉴定主要通过胃含物中较难消化的硬组织进行物种识别, DNA条形码则通过提取胃含物中未能辨认的食物糜、未知肌肉组织等的DNA片段进行鉴定。由于头足类会选择性摄食猎物的身体部位, 很多饵料生物的头部、骨骼等会被丢弃, 导致胃含物中缺少硬组织作为鉴定依据(Braley et al, 2010)。此外, 头足类极高的消化率也会使胃含物中残留的饵料生物消化程度过高, 无法辨别。因此, 造成了两种鉴定结果间的差异。
总的来说, 形态学鉴定对胃内留存时间较长的硬组织有较好的鉴定率, 但大多数鉴别的生物分类阶元较低不能准确鉴定至种, 且头足类的胃含物细碎存在大量不可辨认食物组分, 形态学观测无法发挥作用(Symondson, 2002)。采用DNA条形码可对形态学鉴定无法识别的较小体积生物组织、未消化的食物糜和表观相似度较高的物种进行鉴定, 且大部分能鉴定至种, 避开了传统胃含物分析对形态完整及特定硬组织的严格要求。因此, 在小型甲壳动物、软体动物和高度消化的饵料生物中更具优势(席晓晴等, 2015)。但DNA条形码技术也存在一定的局限性, 一方面是引物的选择, 需要根据不同的目的基因设计不同的特异性引物才能精准地扩增出目的片段, 或者采用多种引物结合使用才能获取更加精确的结果。另一方面, DNA条形码只能达到定性鉴定的目的, 而缺少定量分析数据, 刘梦娜等(2020)基于DNA条形码研究中国枪乌贼和鸢乌贼的食物种类组成中, 成功鉴定出中国枪乌贼饵料物种13种, 鸢乌贼饵料物种8种, 但未能进行定量分析。因此, DNA条形码并不能取代传统的分类学, 而是作为鉴定未知生物种类的辅助工具, 相比于仅采用单一种的鉴定方法, 两种方法结合能够获得更多样化的物种信息, 使得食性分析结果较为完整。此外, 在样品有限的情况下两种方法结合也可以反映更多的种类信息。
3.2 食性分析本研究发现东太平洋赤道海域鸢乌贼和茎柔鱼均以鱼类、头足类和甲壳类为主要饵料生物。根据各饵料重要性指标判断, 鱼类和头足类为鸢乌贼的优势饵料生物, 其中灯笼鱼科等小型深海鱼类出现频率最高, F%达66.20%, 而头足类在鸢乌贼胃含物中比重最大, W%达59.24%。这与Shchetinnikov(1992)对相同海域鸢乌贼胃含物的分析结果一致, 研究发现灯笼鱼(灯笼鱼属、标灯鱼属和壮灯鱼属)是该海域鸢乌贼的主要饵料生物。此外, 龚玉艳等(2016)等对我国南海鸢乌贼胃含物的研究也发现, 鱼类(主要为灯笼鱼科)、头足类和甲壳动物为鸢乌贼优势饵料生物。茎柔鱼同样以鱼类和头足类为优势饵料生物, 但胃含物中甲壳类的F%显著高于鸢乌贼, 达到65.75%, 而鸢乌贼胃含物中甲壳类F%仅33.80%。此外, 茎柔鱼饵料生物中出现频率最高的是荧串光鱼(67.12%), 占比最重的是头足类(61.24%), 这与已有研究结果基本一致。Markaida(2006)对加利福尼亚湾茎柔鱼胃含物研究表明, 其主要以荧串光鱼、巴拿马底灯鱼(Benthosema panamense)和墨西哥尾灯鱼等中上层鱼类为食。荧串光鱼是东太平洋温热带水域最丰富的中上层鱼类之一(Ahlstrom, 1968), 垂直迁移是此类鱼种最主要的行为特征之一(Frank et al, 2002), 并影响着鱼类及头足类(主要是茎柔鱼)的生活史及摄食行为(Benoit-Bird et al, 2002; Bertrand et al, 2002)。Rosas-Luis等(2011)结合胃含物分析和声学定位观测到东太平洋海域荧串光鱼的昼夜垂直移动与茎柔鱼的洄游密切相关, 两者均在夜晚洄游至海表面, 而白天则迁移至120—300 m的深海水域, 分布范围高度重合, 这是荧串光鱼在茎柔鱼胃含物中占优势地位的主导因素。综上所述, 同一海域的鸢乌贼和茎柔鱼虽都以鱼类、头足类和甲壳类为饵料生物, 但存在食性选择差异。可见, 灯笼鱼和头足类是鸢乌贼的优势饵料生物, 而茎柔鱼除头足类和鱼类外, 食物组成中甲壳类的出现频率也较高, 两者的摄食选择具有显著性差异。对各饵料重要性指标进一步分析显示。鸢乌贼和茎柔鱼胃含物中头足类和鱼类的N%存在显著差异。因此, 鸢乌贼和茎柔鱼食性差异主要体现在鱼类的组成差异。SIMPER分析也表明, 大眼水蚤科、荧串光鱼、朗明灯鱼、螔螺科、褶胸鱼和闪光灯笼鱼等6种饵料生物是导致鸢乌贼和茎柔鱼食性差异的主要种类。但有研究表明(Eduardo et al, 2006), 大眼水蚤等桡足类是荧串光鱼的主要饵料生物, 而荧串光鱼作为优势饵料生物被茎柔鱼摄食后, 会导致茎柔鱼胃含物中大眼水蚤的F%和N%过高; 此外, 在实验过程中观察到茎柔鱼胃含物中的大眼水蚤多包含于一胃囊状组织中, 所以推测大眼水蚤等桡足类并不是茎柔鱼和鸢乌贼主动摄食的饵料, 而是由鱼类带来的间接性饵料。因此本研究可能会高估大眼水蚤等桡足类在茎柔鱼饵料生物中的重要性。该结果有待引入新的判别方法或辅助方法, 以准确区分茎柔鱼主动摄食的饵料和饵料生物带来的间接性饵料。
此外, 本研究发现鸢乌贼和茎柔鱼均存在一定程度的同类相食。这在其他头足类研究中已得到广泛验证。头足类是贪婪的机会主义捕食者(Markaida et al, 2003), 由于快速生长和高代谢需求, 在种群密度过高或食物缺乏的情况下会发生同类相食的现象(Ibáñez et al, 2010; Bruno et al, 2021)。已有研究发现, 渔业活动会加剧头足类同类相食现象的发生。Ibarra-Garcia等(2014)对采集自加利福尼亚湾渔区和非渔区的茎柔鱼胃含物比较发现, 渔区内样本胃含物中茎柔鱼的总重量和质量百分比均显著高于非渔区, 认为是因捕捞作业聚集了大量易被捕食的同类个体, 导致自食现象的加剧。本研究中鸢乌贼和茎柔鱼均在捕捞作业时采集, 捕捞活动可能会导致较高程度的同类相食现象发生。
4 结论综上所述, 本研究通过结合胃含物分析和DNA条形码技术, 对东太平洋赤道海域鸢乌贼和茎柔鱼的食性进行了比较研究, 发现两者均以鱼类、头足类和甲壳类为主要饵料生物, 但它们在食物资源利用方面各有偏好, 在Shannon多样性指数和食物组成上均存在显著差异, SIMPER分析进一步表明, 鱼类是导致鸢乌贼和茎柔鱼食物组成差异的重要原因, 两者的摄食选择具有显著性差异。该结果验证了前期对两种头足类肌肉稳定同位素和特征脂肪酸的分析结果(李云凯等, 2020), 两者虽生物学特性相似且栖息在同一海域, 但两种头足类会通过食性分化降低种间竞争, 从而达到稳定共存。本研究中, 主要通过多种饵料重要性指标反映了鸢乌贼和茎柔鱼食物组成差异, 从食物分化的角度探讨了两者的摄食策略差异。此外, 摄食时间、水层等可能也是影响摄食策略差异的因素, 因此, 在未来的研究中, 应该全面考虑鸢乌贼和茎柔鱼在不同采样年份和水层等方面是否具有差异, 从而得到更加全面的食性分析结果。
刘金立, 陈新军. 2019. 世界大洋性鱿钓渔业研究评述. 上海海洋大学学报, 28(3): 331-343 |
刘梦娜, 徐磊, 王雪辉, 等. 2020. 基于DNA条形码研究中国枪乌贼和鸢乌贼的食物种类组成. 热带海洋学报, 39(4): 61-69 |
贡艺, 汪惠琼, 李云凯, 等. 2019. 茎柔鱼氨基酸氮稳定同位素特征及营养位置估算. 上海海洋大学学报, 28(3): 402-408 |
李云凯, 汪惠琼, 陈新军, 等. 2020. 柔鱼科近缘种茎柔鱼与鸢乌贼营养生态位及相互关系. 生态学报, 40(15): 5418-5423 |
陈新军. 2004. 渔业资源与渔场学. 北京: 海洋出版社, 51-52
|
陈新军, 钱卫国, 刘必林, 等. 2019. 主要经济大洋性鱿鱼资源渔场生产性调查与渔业概况. 上海海洋大学学报, 28(3): 344-356 |
席晓晴, 鲍宝龙, 章守宇. 2015. DNA条形码在鱼类胃含物种类鉴定中的应用. 上海海洋大学学报, 24(2): 203-210 |
龚玉艳, 孔啸兰, 杨玉滔, 等. 2018. 南海鸢乌贼微型群体的摄食习性研究. 海洋渔业, 40(4): 394-403 DOI:10.3969/j.issn.1004-2490.2018.04.002 |
龚玉艳, 詹凤娉, 杨玉滔, 等. 2016. 南海鸢乌贼摄食习性的初步研究. 南方水产科学, 12(4): 80-87 DOI:10.3969/j.issn.2095-0780.2016.04.010 |
韩飞, 陈新军, 林东明, 等. 2019. 东太平洋赤道海域茎柔鱼体征生长及生殖投入. 水产学报, 43(12): 2511-2522 |
Ahlstrom E H, 1968. Mesopelagic and bathypelagic fishes in the California Current region. California Cooperative Oceanic Fisheries Investigations Report, 13: 39-44 |
Bazzino G, Gilly W F, Markaida U et al, 2010. Horizontal movements, vertical habitat utilization and diet of the jumbo squid (Dosidicus gigas) in the Pacific Ocean off Baja California Sur, Mexico. Progress in Oceanography, 86(1/2): 59-71 |
Benoit-Bird K J, Au W W L, 2002. Target strength measurements of Hawaiian mesopelagic boundary community animals. The Journal of the Acoustical Society of America, 110(2): 812-819 |
Bertrand A, Bard F X, Josse E, 2002. Tuna food habits related to the micronekton distribution in French Polynesia. Marine Biology, 140(5): 1023-1037 DOI:10.1007/s00227-001-0776-3 |
Bo Q K, Zheng X D, Chen Z W, 2020. Feeding intensity and molecular prey identification of the common long-armed octopus, Octopus minor (Mollusca: Octopodidae) in the wild. PLoS One, 15(1): e0220482 DOI:10.1371/journal.pone.0220482 |
Braley M, Goldsworthy S D, Page B et al, 2010. Assessing morphological and DNA-based diet analysis techniques in a generalist predator, the arrow squid Nototodarus gouldi. Molecular Ecology Resources, 10(3): 466-474 DOI:10.1111/j.1755-0998.2009.02767.x |
Bruno C, Cornejo C F, Riera R et al, 2021. What is on the menu? Feeding, consumption and cannibalism in exploited stocks of the jumbo squid Dosidicus gigas in south-central Chile. Fisheries Research, 233: 105722 DOI:10.1016/j.fishres.2020.105722 |
Costa F O, Dewaard J R, Boutillier J et al, 2007. Biological identifications through DNA barcodes: the case of the Crustacea. Canadian Journal of Fisheries and Aquatic Sciences, 64(2): 272-295 DOI:10.1139/f07-008 |
De La Chesnais T, Fulton E A, Tracey S R et al, 2019. The ecological role of cephalopods and their representation in ecosystem models. Reviews in Fish Biology and Fisheries, 29(2): 313-334 DOI:10.1007/s11160-019-09554-2 |
Eduardo O A, Raul U H, Jorge B Z, 2006. Feeding habits of four species of mesopelagic fishes from the Northern Chilean. Revista De Biología Tropical, 54(2): 613-622 |
Frank T, Widder E, 2002. Effects of a decrease in downwelling irradiance on the daytime vertical distribution patterns of zooplankton and micronekton. Marine Biology, 140(6): 1 181-1 193 DOI:10.1007/s00227-002-0788-7 |
Geller J, Meyer C, Parker M et al, 2013. Redesign of PCR primers for mitochondrial cytochrome c oxidase subunit I for marine invertebrates and application in all-taxa biotic surveys. Molecular Ecology Resources, 13(5): 851-861 DOI:10.1111/1755-0998.12138 |
Hyslop E J, 1980. Stomach contents analysis-a review of methods and their application. Journal of Fish Biology, 17(4): 411-429 DOI:10.1111/j.1095-8649.1980.tb02775.x |
Ibáñez C M, Keyl F, 2010. Cannibalism in cephalopods. Reviews in Fish Biology and Fisheries, 20: 123-136 DOI:10.1007/s11160-009-9129-y |
Ibarra-Garcia L E, Camarillo-Coop S, Salinas-Zavala C A, 2014. Cannibalism assessment of jumbo squid Dosidicus gigas from the Gulf of California. Hidrobiológica, 24(1): 51-56 |
Leray M, Yang J Y, Meyer C P et al, 2013. A new versatile primer set targeting a short fragment of the mitochondrial COI region for metabarcoding metazoan diversity: application for Characterizing coral reef fish gut contents. Frontiers in Zoology, 10(1): 34 DOI:10.1186/1742-9994-10-34 |
Markaida U, 2006. Food and feeding of jumbo squid Dosidicus gigas in the Gulf of California and adjacent waters after the 1997-98 El Niño event. Fisheries Research, 79(1/2): 16-27 |
Markaida U, Sosa-nishizaki O, 2003. Food and feeding habits of jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae) from the Gulf of California, México. Journal of the Marine Biological Association of the United Kingdom, 83(3): 507-522 DOI:10.1017/S0025315403007434h |
Roper C F E, Sweeney M J, Nauen C E et al, 1984. FAO species catalogue: vol. 3. cephalopods of the world. An annotated and illustrated catalogue of species of interest to fisheries. FAO Fisheries Synopsis No. 125. Rome: FAO, 3: 180-181
|
Rosas-Luis R, Tafur-Jimenez R, Alegre-Norza A R et al, 2011. Trophic relationships between the jumbo squid (Dosidicus gigas) and the lightfish (Vinciguerria lucetia) in the Humboldt Current System off Peru. Scientia Marina, 75(3): 549-557 DOI:10.3989/scimar.2011.75n3549 |
Schoener T W, 1974. Resource partitioning in ecological communities. Science, 185(4145): 27-39 DOI:10.1126/science.185.4145.27 |
Shchetinnikov A S, 1992. Feeding spectrum of squid Sthenoteuthis oualaniensis (Oegopsida) in the eastern Pacific. Journal of the Marine Biological Association of the United Kingdom, 72(4): 849-860 DOI:10.1017/S0025315400060082 |
Staaf D J, Ruiz-Cooley R I, Elliger C et al, 2010. Ommastrephid squids Sthenoteuthis oualaniensis and Dosidicus gigas in the eastern Pacific show convergent biogeographic breaks but contrasting population structures. Marine Ecology Progress Series, 418: 165-178 DOI:10.3354/meps08829 |
Symondson W O C, 2002. Molecular identification of prey in predator diets. Molecular Ecology, 11(4): 627-641 DOI:10.1046/j.1365-294X.2002.01471.x |
Ward R D, Zemlak T S, Innes B H et al, 2005. DNA barcoding Australia's fish species. Philosophical Transactions of the Royal Society B: Biological Sciences, 360(1462): 1847-1857 DOI:10.1098/rstb.2005.1716 |
Xu L, Wang L G, Ning J J et al, 2019. Diversity of marine planktonic ostracods in South China Sea: a DNA taxonomy approach. Mitochondrial DNA Part A, 30(1): 118-125 DOI:10.1080/24701394.2018.1462349 |
 2021, Vol. 52
2021, Vol. 52


