中国海洋湖沼学会主办。
文章信息
- 张苗, 李明梦, 刘律, 李忠超, 苗滕, 余业鑫, 赵永晶, 李艳, 王海军, 王洪铸. 2021.
- ZHANG Miao, LI Ming-Meng, LIU Lyu, LI Zhong-Chao, MIAO Teng, YU Ye-Xin, ZHAO Yong-Jing, LI Yan, WANG Hai-Jun, WANG Hong-Zhu. 2021.
- 超富营养城市湖泊原位生态修复效果分析——以武汉南湖为例
- EFFECTS OF IN-SITU ECOLOGICAL RESTORATION IN NANHU LAKE, A HYPERTROPHIC URBAN LAKE, CHINA
- 海洋与湖沼, 52(6): 1399-1407
- Oceanologia et Limnologia Sinica, 52(6): 1399-1407.
- http://dx.doi.org/10.11693/hyhz20210500116
文章历史
-
收稿日期:2021-05-13
收修改稿日期:2021-08-28
2. 中国科学院大学 北京 100049;
3. 武汉市市政建设集团有限公司 武汉 430020;
4. 湖北省水利水电科学研究院 武汉 430070;
5. 华中农业大学水产学院 武汉 430070;
6. 云南大学生态学与环境学院高原湖泊生态与治理研究院 昆明 650504
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Wuhan Municipal Construction Group Co., Ltd., Wuhan 430020, China;
4. Hubei Water Resources Research Institute, Wuhan 430070, China;
5. College of Fisheries, Huazhong Agricultural University, Wuhan 430072, China;
6. Institute for Ecological Research and Pollution Control of Plateau Lakes, School of Ecology and Environmental Science, Yunnan University, Kunming 650504, China
湖泊富营养化可导致藻类水华、水生植被衰退、鱼类死亡等一系列不良后果, 最终导致生态系统退化甚至崩溃, 是水生态系统面临的主要环境问题之一(Wang et al, 2021), 除此之外水生态系统还面临盐碱化、水域面积减少等问题(朱香英等, 2017; Jeppesen et al, 2020)。城市湖泊是指位于市区或近郊的湖泊, 一般而言这类湖泊水域面积较小、水深较浅、流速小、污染受纳量较高且自净能力有限, 因此往往处于超富营养状态(Chen et al, 2020)。鉴于城市湖泊生态系统在供水、养殖、气候调节、景观提升等方面的重要作用, 以提升湖泊生态系统健康状况为目标的生态修复已成为近几十年来研究的热点之一(Qin, 2013)。沉水植物是水生态系统中重要的生产者, 在维持淡水湖泊生态系统健康方面起着至关重要的作用, 能够通过吸收营养、稳定底质、减少沉积物再悬浮、抑制浮游藻类生长等方式改善湖泊水质, 并能为其他水生生物提供栖息场所(Engelhardt et al, 2001)。因此, 以沉水植物恢复为核心的生态修复对于湖泊水质改善、水生态系统功能恢复及城市景观提升方面具有重要意义。
根据生态系统多稳态理论, 浅水湖泊常存在两种稳态, 即以沉水植被占优的清水稳态和以浮游藻类占优的浊水稳态, 这两种稳态各有内在正反馈机制维持其当前稳态, 但当外界干扰超过其耐受限值时, 生态系统状况会快速向另一种稳态转变(Scheffer, 1998)。据研究, 湖泊生态系统稳态转换的关键驱动因子是总磷, 且清-浊稳态转换的总磷阈值为80— 120 μg/L, 反向转换的总磷阈值为40—60 μg/L (Wang et al, 2014)。因此, 一般而言当水体总磷超过120 μg/L时, 湖泊只能处于浊水稳态, 沉水植被无法自然恢复。此时若要恢复沉水植被, 首先应该降低水体营养水平。然而, 研究显示, 即使外源污染得到有效控制, 内源营养释放可使得水体营养含量在相当长的时间(10—15 a)内维持在较高水平(Jeppesen et al, 2005)。因此, 若要在短时间内恢复湖泊中的沉水植物, 除开展营养控制措施外, 还需采取其他工程措施, 如构建生态围隔、鱼类结构优化、底质改良等以辅助植物的生存与发展(刁若贤等, 2017)。
南湖位于武汉市洪山区, 水域面积约7.67 km2, 是一个典型的超富营养湖泊。据2018—2019年调查, 南湖水质为劣Ⅴ类, 湖滨带挺水植物仅零星分布, 沉水植物几乎没有。为加快推进南湖水环境治理, 实现“水清、岸绿、景美”的治理目标, 武汉市于2019年启动南湖水环境提升工程, 其中水生态修复的主要内容是重建1 440 km2 (60%)的沉水植被和5 500 m2的挺水植物。然而以往生态修复的工程实践多见于中富营养水平湖泊中, 对南湖这类超富营养水体, 尚缺乏可供参考的成功案例。鉴于该工程的技术难度较大, 短时间内难以在全湖范围内实施, 项目组首先选择一处代表性区域开展水生态修复示范工程, 为整体工程的实施提供示范与参考。本文通过比较南湖生态修复示范区及外湖区水质变化, 分析鱼类群落结构优化及水生植被重建对水质改善的效果, 探究亚热带超富营养湖泊生态修复及水质改善技术。
1 材料和方法 1.1 示范区基本概况南湖是武汉市仅次于东湖和汤逊湖的第三大城中湖, 原有湖面近8.00 km2, 近年来由于各种建设与开发, 导致其水域面积不断减少, 现有水域面积约7.67 km2。此外, 该湖污染受纳量较大, 沿湖有20多个主要排污口分布, 且有大量未经处理的生活污水直接入湖(王银东等, 2005)。南湖水质常年较差, 据2018—2019年调查, 其水体总氮为2.0—10.0 mg/L, 总磷为0.2—0.9 mg/L, 浮游藻类叶绿素a为30— 200 μg/L, 为劣Ⅴ类水质; 湖滨带挺水植物仅零星分布, 主要种类为芦苇(Phragmites communis)、香蒲(Typha angustifolia)、菰(Zizania latifolia)和莲(Nelumbo nucifera), 大部分区域优势种是芦苇。沉水植物只有穗状狐尾藻(Myriophyllum spicatum), 且仅在极小范围的区域内有零星分布。不管从水生植物的种类, 还是其覆盖面积来看, 目前南湖中的水生植被已经无法发挥其应有的生态功能。
南湖生态修复示范区(一期, 2019年8月至12月)位于小南湖北侧靠近南湖大桥附近水域(图 1), 面积约2 400 m2, 平均水深为1 m, 最大水深1.8 m。在实验开始时, 区域内水体透明度为(0.2±0.1) m, 总氮(7.6±3.0) mg/L、总磷(0.8±0.1) mg/L, 均为劣Ⅴ类水平, 无沉水植物, 沿岸少量挺水植物(芦苇)。
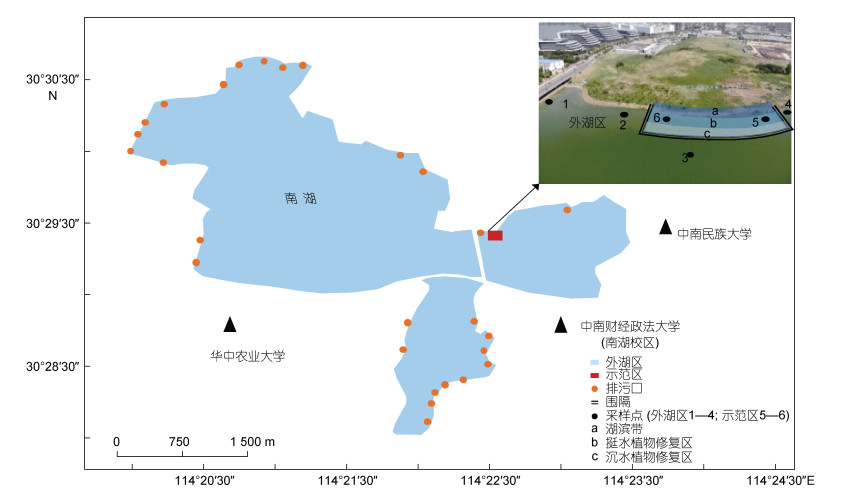 |
| 图 1 示范区位置及采样点示意图 Fig. 1 Location and sample sites of the demonstration area |
利用挖掘机对湖滨带硬质基底条件进行一定的生态化改造, 首先清除碎石及杂草, 然后构建缓坡式湖滨带, 为水生植物的定植创造有利条件。
1.2.2 围隔构建湖滨带改造完成后, 利用不透水围隔将该示范区包围成一个相对独立的区域, 以减少风浪、鱼类以及其他不良因素的干扰。围隔采用PVC防水布, 底部使用石笼将其压入底泥中, 顶部高出水平面10 cm左右, 确保围隔内外水体无明显交换。
1.2.3 鱼类群落结构优化鱼类群落结构对水生植物的生长有非常重要的影响, 草食性鱼类的主要食物来源之一是水生植物, 底层鱼类活动(尤其是摄食)过程会扰动底泥, 造成沉积物再悬浮, 降低水体透明度, 这些因素均不利于水生植物的恢复。围隔构建过程中通过赶鱼、捕鱼等相结合的方式去除围隔内的鱼类。
1.2.4 水生植被构建挺水植物修复物种选择香蒲和芦苇, 二者比例为1︰3, 种植密度约70株/m2, 香蒲高度约0.5 m, 芦苇高度约0.7 m。种植方法为成簇扦插法, 香蒲种植在岸线至湖心0.5 m处, 芦苇种植在距岸线0.5—2 m之间。
示范区内除挺水植物修复区外, 在距离湖滨带4 m处划分一处120 m × 8 m范围作为沉水植物修复区, 用于恢复沉水植物。示范区与沉水植物修复区之间相隔2 m, 用于水生植物的自然扩增。沉水植物修复物种选择苦草和轮叶黑藻, 二者比例为3︰2。种植密度为20—30株/m2, 苦草高度约0.5 m, 轮叶黑藻高度约0.8 m。种植方法为成簇扦插法。水生植被构建于2019年8月14日完成。
1.3 样品采集和分析采样点位设计原则参照《淡水生物资源调查技术规范》(DB43/T 432—2009), 湖泊应兼顾在近岸和中部设点。根据上述原则, 研究区域内共设置6个采样点(图 1), 其中示范区内2个(5#, 6#), 均位于沉水植物修复区; 外湖区4个(1#, 2#, 3#, 4#), 1#位于挺水植物修复区和出水口, 2#和4#位于沿岸带浅水区, 3#位于湖心区。各采样点物理、化学及生物指标每月测定2次。水温(WT, ℃)、溶解氧(DO, mg/L)、pH、电导率(Cond, μS/cm)等指标用Pro Plus YSI (Yellow Spring Instruments, 美国)在水深0.5 m处测定。水体浊度(Turb)使用浊度仪(2100Q, HACH, 美国)测定。水深(ZM)和透明度(ZSD)分别用超声波测深仪(Speedtech, 美国)和塞氏盘(武汉水天地科技有限公司, 中国)进行测定。水样使用1.5 m柱状采水器采集, 充分混合后取1 L水样带回实验室用于测定总氮(TN)、总磷(TP)、总溶解态磷(TDP)、浮游藻类叶绿素a (chl a)等参数。TN使用过硫酸钾氧化-紫外分光光度法测定。TP和TDP使用钼锑抗分光光度法测定。Chl a的测定使用GF/C膜(Whatman, GE Healthcare UK Limited, Buckinghamshire, 英国)过滤水样, 然后将滤膜置于90%丙酮中, 在4 ℃条件下萃取20—24 h, 再用分光光度法测定(王建等, 1984)。
种植挺水植物前, 将其顶部切除, 植株高度统一为0.5 m。完成种植后, 株高和覆盖度每月测定2次。株高测定时分别随机选取10株芦苇和10株香蒲测定其高度后取均值, 覆盖度使用目测法估算。沉水植物种植前, 分别随机选取10株苦草和10株轮叶测定初始高度, 均值分别为0.5和0.8 m。植物种植后其覆盖度每月测定2次, 同样使用目测法测定。
1.4 数据处理与分析数据处理使用R 3.6.2 (R core team, 2019)和Excel 2010。示范区和外湖区水质等参数的差异性检验使用Friendman test。为进一步分析各生态修复措施对水体不同组分浊度的影响, 本文依据Portielje等(1999)、Ibelings等(2007)的研究, 将总浊度(TurbTot)划分为藻类浊度(TurbAlg)、非藻类浊度(TurbNonAlg)和背景浊度(TurbBck)。TurbTot为ZSD的倒数; TurbAlg参照Portielje等(1999)的公式, 采用长江中下游浅水湖泊的数据推算而来(王海军等, 2017), 为0.011×chl a; TurbBck是数据集中最小的浊度值0.18 /m (ZSD最大时, 假定此时悬浮颗粒物不存在); 则TurbNonAlg计算公式为: TurbNonAlg=1/ZSD-0.011×chl a-0.18。
2 结果 2.1 水生植被生长状况示范工程实施后, 挺水植物植株高度显著增加: 芦苇平均株高由0.7 m增加至1.2 m (P < 0.01); 香蒲在种植2—3 d内, 地上部分枯萎, 由根部长出新叶, 新叶高度在种植50 d后高达1.4 m (P < 0.01)。芦苇和香蒲在种植后90 d, 其覆盖率均由种植当天低于10%上升至大于70% (图 2)。沉水植物总体生长情况良好, 生物量出现大幅度的增加, 覆盖率在种植后第100 d时达到约60%。
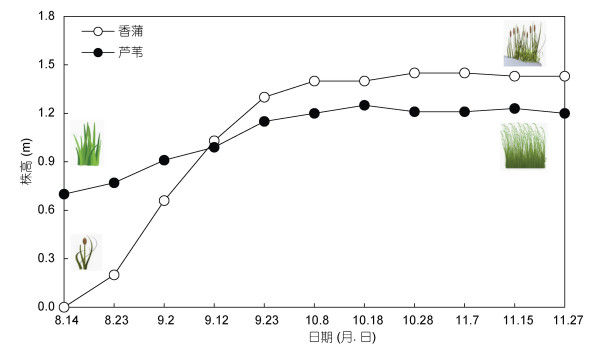 |
| 图 2 示范区内挺水植物香蒲和芦苇株高变化 Fig. 2 The change in the height of Typha angustifolia and Phragmites communis in the demonstration area |
自生态修复各项措施实施以后, 示范区水体透明度呈现持续上升趋势(图 3a), 由实施前的0.26 m上升至0.77 m (1—120 d均值), 上升了2.96倍。与外湖区相比, 前者显著高于后者(P < 0.01)。就水体营养水平而言, 示范区水体总磷(TP)有所下降(图 3b), 由实施前的0.76 mg/L降低至0.08 mg/L, 降低了89.5%。与外湖区相比, 前者略低于后者, 但差异不显著(P=0.71)。示范区水体总氮(TN)也有所下降(图 3c), 到100 d时, 由实施前的4.78 mg/L降低至2.60 mg/L (1—100 d均值), 降低了45.6%。整体而言, 示范区略低于外湖区(P=0.41)。对于浮游藻类数量而言, 示范区水体chl a呈现下降趋势(图 3d), 由实施前的38.90 μg/L降低至3.41 μg/L, 降低了91.2%。与外湖区相比, 前者显著低于后者(P < 0.01)。
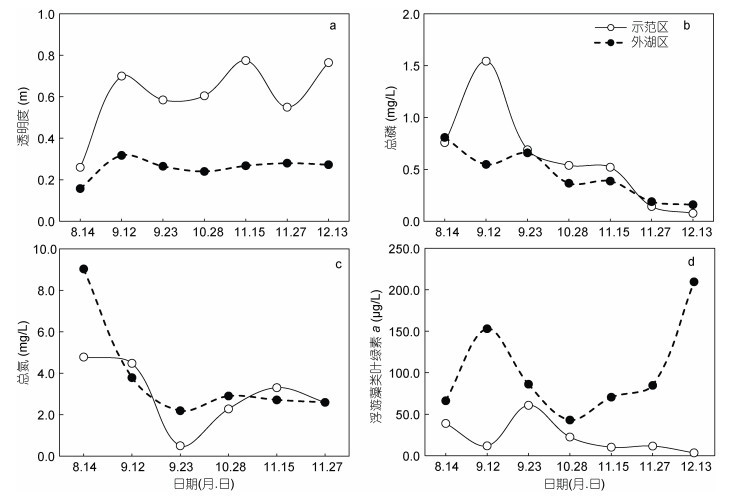 |
| 图 3 示范区与外湖区透明度(ZSD)、总磷(TP)、总氮(TN)和浮游藻类叶绿素a (chl a)随时间的变化 Fig. 3 Changes in transparency, total phosphorus, total nitrogen and chlorophyll a in the demonstration and outside area over time |
就水体浊度而言, 总浊度及各组分浊度均呈下降趋势。示范区总浊度由修复前的3.85 /m降低至1.31 /m (图 4a); 非藻类浊度由修复前的3.24 /m降低至1.09 /m (图 4b); 藻类浊度由修复前的0.43 /m降低至0.04 /m (图 4c)。此外, 与未开展修复的外湖区相比, 示范区的总浊度、非藻类浊度及藻类浊度均显著低于前者(P < 0.01), 其均值分别为前者的54.1%、48.0%和77.7%。
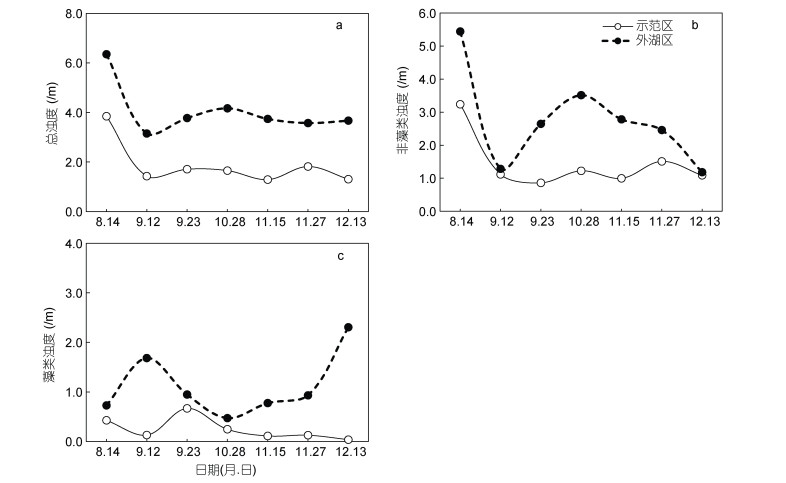 |
| 图 4 示范区与外湖区总浊度、非藻类浊度、藻类浊度随时间的变化 Fig. 4 Temporal changes of TurbTot, TurbNonAlg and TurbAlg in the demonstration and outside area |
本文进一步比较了示范区与外湖区水体总浊度(TurbTot)及浮游藻类叶绿素a (chl a)与营养的关系(图 5)。自生态修复各项措施实施以后, 就总浊度与总氮之比而言(图 5a), 示范区呈现先上升后下降趋势, 相较于外湖区而言, 后期(第60 d之后)低于外湖区, 但并未达到显著(P=0.08)。总体而言示范区始终低于外湖区, 其均值是后者的46.2%。示范区水体总浊度与总磷之比呈上升的趋势(图 5b), 但显著低于外湖区(P < 0.01), 是后者的53.3%。
 |
| 图 5 水体浊度与总氮之比(a)、浊度与总磷之比(b)、浮游藻类叶绿素与总氮之比(c)以及浮游藻类叶绿素与总磷之比(d)随时间的变化 Fig. 5 Temporal changes of Turb/TN (a), Turb/TP (b), chl a/TN (c), and chl a/TP (d) |
从浮游藻类叶绿素a与总氮之比来看(图 5c), 示范区整体呈现下降趋势, 相对于外湖区而言, 后期(第60 d之后)低于外湖区, 但这种关系并未达到显著性(P=0.08)。外湖区呈现先上升后稳定的趋势。总体而言, 示范区是外湖区的59.6%。就浮游藻类叶绿素a与总磷之比而言(图 5d), 示范区比较稳定, 并无明显差别, 外湖区则呈持续上升趋势, 总体而言示范区显著低于外湖区(P < 0.01), 仅为外湖区的13.1%。
3 讨论 3.1 示范区水质改善效果及原因分析本研究中, 围隔构建、鱼类结构优化及水生植被重建等修复措施对富营养湖泊水质有明显的改善效果。在修复后100 d内, 示范区透明度上升至修复前的2.96倍, 是外湖区的2倍; 浮游藻类叶绿素a则下降了91.2%, 仅为外湖区的20%。围隔的消浪作用是示范区水质提升的原因之一, 尤其是在提高水体透明度方面。水体透明度与水体浊度呈负相关, 无机悬浮颗粒物造成的非藻类浊度是长江中下游浅水湖泊水体浊度的主要组分, 通常占总浊度的70%以上(王海军等, 2017)。风浪扰动导致沉积物再悬浮作用是决定水体非藻类浊度的主要因素之一。自然湖泊中, 水域面积越大, 风的吹程越长, 水体对沉积物的剪切力越大, 沉积物的再悬浮作用越强烈, 水体非藻类浊度亦越高, 进而导致水体透明度越低(Dokulil, 1994)。不透水围隔的构建可将水体分隔为相对独立的小区域, 阻断风浪在水中传播的距离, 降低其对沉积物的扰动, 从而降低沉积物的再悬浮作用及水体非藻类浊度。本研究中, 示范区在围隔建成20 d后, 水体非藻类浊度便由3.24 /m降至1.12 /m, 总浊度由3.85 /m降至1.43 /m, 水体透明度由0.26 m提升至0.70 m, 表明围隔构建能够有效提升示范区水质。此外, 围隔除降低水体浊度外, 还可通过减少风浪对沉积物的扰动, 辅助水生植物的定植, 尤其是对底泥松软的富营养湖泊而言。胡旭等(2014)在武汉东湖水果湖开展的大型围隔实验也表明围隔的建立对于水生植被的恢复有较大的促进作用。因此, 无论是从水质改善还是稳定底质的角度而言, 构建不透水围隔均是促进水生植物存活的辅助措施。
清除鱼类也是示范区水质提升的主要原因之一。底层生活的鱼类在摄食或其他活动过程中可扰动底质, 造成沉积物再悬浮, 也可造成水体磷浓度的增加(Havens, 1991)。通过清除鱼类可在一定程度上降低沉积物的再悬浮。南湖养殖密度较大, 2019年调查显示, 鱼类资源总量约1 050 t, 以鲢鳙鱼为主(约占总量的80%), 其次便是底层生活的鲤、鲫类(未发表数据)。构建围隔及清除鱼类后, 示范区水体总磷虽下降不明显, 但单位总磷所支持的浊度与浮游藻类叶绿素a均明显低于外湖区(图6b, 6d)。然而由于本研究中围隔构建和鱼类清除为同步进行, 因此难以区分这二者对水质改善的贡献率。
水生植物种植后对底质的稳定作用、对营养的吸收利用及其对浮游藻类的抑制作用也能够促进示范区水质的改善。水生植物, 尤其是沉水植物可通过遮光、化感作用等抑制浮游藻类的生长。示范区在种植水生植物后约100 d, 其盖度便由种植时的低于10%扩增至约60%, 浮游藻类叶绿素a由38.9 µg/L降至3.4 µg/L。有研究显示, 当沉水植物覆盖率高于25%时, 水中浮游藻类可得到有效抑制(Norlin et al, 2005), 其中苦草、黑藻、狐尾藻、金鱼藻、菹草和马来眼子菜等沉水植物均能有效降低水体浮游藻类叶绿素a含量。此外, 水生植物的生命活动还可直接影响水体营养水平。一方面, 植物可通过吸收、利用的方式降低水体影响; 另一方面, 植物可通过光合作用释放溶解氧, 提高水体溶解氧, 抑制沉积物中Fe-P、Al-P等结合态磷的释放, 从而降低水中总磷含量(Ferreira et al, 2018)。本研究中, 示范区及外湖区水体总磷均呈缓慢下降趋势, 至修复100 d后, 示范区总磷略低于外湖区, 但差异未达到显著水平。示范区及外湖区水体总磷均下降这一趋势一方面可能受到温度影响(Søndergaard, 1989), 温度升高会加速沉积物磷的释放, 温度每上升1—3 ℃, 沉积物磷释放量将增加9%—57% (Panswad et al, 2003); 另一方面可能受到浮游植物藻类的影响。夏季是藻类的适宜生长期, 为满足其自身生长营养需求, 藻类从水体吸收磷(宋国栋等, 2008), 导致水体中生物活性磷(SRP)降低, 在外源磷输入少且滞后的条件下, 沉积物将作为磷源向藻类提供营养物质, 促使沉积物中的磷向上覆水迁移, 即“泵吸”作用(Xie et al, 2003)。这也是夏季沉积物磷释放量较高, 冬季普遍较低原因之一。
3.2 沉积物内源释放对水质的影响本研究中, 沉积物内源释放导致示范区水体总磷维持在较高水平。不透水围隔的构建可阻断示范区与外湖区的水体交换, 从而截断来自外湖区的污染, 且示范区所在区域无面源污染及排污口, 因此自围隔构建完成后, 示范区即不存在外源污染。然而, 示范区水体总磷仍维持在较高水平, 且与外湖区相差不多(图 4b)。因此, 内源释放可能是其水体营养含量一直较高的原因。根据研究, 内源营养消减是一个缓慢的过程, 外源控制后10—15年才能达到新的平衡(Jeppesen et al, 2005)。因此, 就南湖这类超富营养湖泊而言, 仅通过截断外源污染及生物群落调控等措施无法在短时间内降低水平营养水平, 需要通过底质改良控制沉积物内源营养释放。
沉水植物作为水生态系统主要的初级生产者之一, 在维持清水稳态和调控湖泊磷循环方面有重要作用(Granéli et al, 1988)。主要体现在通过根系作用直接吸收磷, 氧化表面沉积物, 增加磷与铁的结合能力, 减少内源磷释放及沉积物再悬浮。但是沉水植物的生存状况同样也受水体中营养含量的影响。根据谢贻发(2008)的研究, 中营养水平下的沉水植物生物量只有低营养水平下72.3%, 高营养负荷条件下则完全受到抑制。水中营养含量较高时会促使浮游藻类大量生长, 对沉水植物造成遮蔽效应(Yu et al, 2015)。沉积物中营养物质含量对沉水植物生长也有明显影响, 营养含量在一定范围内对水生植物生长是有利的, 过量则不利。根据以往沉积物总磷含量对沉水植物生长影响研究, 一般认为当沉积物总磷含量低于1 000 mg/kg时适宜沉水植被生存(赵海超等, 2008; Wang et al, 2012)。根据Carr (1998)的研究, 沉积物磷含量在40—950 mg/kg区间内促进水生植物的生长, 超过此区间, 出现抑制生长效果。南湖沉积物总磷含量高达2 740 mg/kg, 远高于沉水植被的适宜范围(< 1 000 mg/kg)。因此, 本研究中沉水植被恢复效果及其对水质的改善作用可能受沉积物营养含量过高导致的负面影响。虽然示范区沉水植物得以存活并开始扩增, 但由于持续时间较短(仅5个月, 8—12月), 无法确定其能否越冬并在次年春年萌发新生个体, 因此其恢复效果仍有待进一步研究。
4 结论综合本研究结果, 可以得出在超富营养湖泊南湖中, 围隔构建、鱼类清除、水生植被重建等修复措施能够通过消浪、稳定底质、阻隔污染及抑制浮游藻类生长等作用提升水体透明度、降低水体浮游藻类含量, 从而在一定程度上实现水质改善的目的。但是, 内源释放可使水体营养水平短时间内仍维持在较高水平。因此, 就超富营养湖泊而言, 仅通过此类物理阻隔或生物调控的修复措施难以达到水质全面改善的效果, 仍需要采取底质改良措施控制沉积物内源营养释放以控制水体的营养水平。
刁若贤, 徐兆安, 吴东浩. 2017. 太湖原位围隔中水深对苦草生长的影响. 水生态学杂志, 38(4): 43-47 |
王建, 王骥. 1984. 浮游植物叶绿素与脱镁叶绿素的测定方法. 武汉植物学研究, 2(2): 321-328 |
王海军, 王洪铸, 潘保柱, 等. 2017. 长江亚热带浅水湖群藻类浊度与非藻类浊度的变异规律. 水生生物学报, 41(2): 414-419 |
王银东, 熊邦喜, 杨学芬, 等. 2005. 武汉市南湖的环境现状及生态恢复建议. 水利渔业, 25(4): 65-66 DOI:10.3969/j.issn.1003-1278.2005.04.030 |
朱香英, 梁亚荣. 2017. 武汉市湖泊侵占现状分析与洪涝灾害. 环境保护科学, 43(4): 102-107 |
宋国栋, 石晓勇, 侯继灵, 等. 2008. 铁对浮游植物吸收营养盐的围隔实验初步研究. 海洋与湖沼, 39(3): 209-216 DOI:10.3321/j.issn:0029-814X.2008.03.003 |
胡旭, 何亮, 曹特, 等. 2014. 富营养化湖泊围隔中重建水生植被及其生态效应. 湖泊科学, 26(3): 349-357 |
赵海超, 赵海香, 王圣瑞, 等. 2008. 沉水植物对沉积物及土壤垂向各形态无机磷的影响. 生态环境, 17(1): 74-80 DOI:10.3969/j.issn.1674-5906.2008.01.015 |
谢贻发, 2008. 沉水植物与富营养湖泊水体、沉积物营养盐的相互作用研究. 广州: 暨南大学博士学位论文, 106-110
|
Carr G M, 1998. Macrophyte growth and sediment phosphorus and nitrogen in a Canadian prairie river. Freshwater Biology, 39(3): 525-536 DOI:10.1046/j.1365-2427.1998.00300.x |
Chen S N, He H Y, Zong R R et al, 2020. Geographical patterns of algal communities associated with different urban lakes in China. International Journal of Environmental Research and Public Health, 17(3): 1009 DOI:10.3390/ijerph17031009 |
Dokulil M T, 1994. Environmental control of phytoplankton productivity in turbulent turbid systems. Hydrobiologia, 289(1-3): 65-72 DOI:10.1007/BF00007409 |
Engelhardt K A M, Ritchie M E, 2001. Effects of macrophyte species richness on wetland ecosystem functioning and services. Nature, 411(6838): 687-689 DOI:10.1038/35079573 |
Ferreira T F, Crossetti L O, Marques D M L M et al, 2018. The structuring role of submerged macrophytes in a large subtropical shallow lake: clear effects on water chemistry and phytoplankton structure community along a vegetated-pelagic gradient. Limnologica, 69: 142-154 DOI:10.1016/j.limno.2017.12.003 |
Granéli W, Solander D, 1988. Influence of aquatic macrophytes on phosphorus cycling in lakes. Hydrobiologia, 170(1): 245-266 DOI:10.1007/BF00024908 |
Havens K E, 1991. Fish-induced sediment resuspension: effects on phytoplankton biomass and community structure in a shallow hypereutrophic lake. Journal of Plankton Research, 13(6): 1163-1176 DOI:10.1093/plankt/13.6.1163 |
Ibelings B W, Portielje R, Lammens E H R R et al, 2007. Resilience of alternative stable states during the recovery of shallow lakes from eutrophication: Lake Veluwe as a case study. Ecosystems, 10(1): 4-16 DOI:10.1007/s10021-006-9009-4 |
Jeppesen E, Beklioğlu M, Özkan K et al, 2020. Salinization increase due to climate change will have substantial negative effects on inland waters: a call for multifaceted research at the local and global scale. The Innovation, 1(2): 100030 DOI:10.1016/j.xinn.2020.100030 |
Jeppesen E, Søndergaard M, Jensen J P et al, 2005. Lake responses to reduced nutrient loading-an analysis of contemporary long-term data from 35 case studies. Freshwater Biology, 50(10): 1747-1771 DOI:10.1111/j.1365-2427.2005.01415.x |
Norlin J I, Bayley S E, Ross L C M, 2005. Submerged macrophytes, zooplankton and the predominance of low-over high-chlorophyll states in western boreal, shallow-water wetlands. Freshwater Biology, 50(5): 868-881 DOI:10.1111/j.1365-2427.2005.01366.x |
Panswad T, Doungchai A, Anotai J, 2003. Temperature effect on microbial community of enhanced biological phosphorus removal system. Water Research. 2003, 37(2): 409-415 |
Pørtielje R, Van Der Molen D T, 1999. Relationships between eutrophication variables: from nutrient loading to transparency. Hydrobiologia, 408-409: 375-387 DOI:10.1023/A:1017090931476 |
Qin B Q, 2013. A large-scale biological control experiment to improve water quality in eutrophic Lake Taihu, China. Lake and Reservoir Management, 29(1): 33-46 DOI:10.1080/10402381.2013.767867 |
Scheffer M, 1998. Ecology of Shallow Lakes. Boston: Kluwer Academic Publishers, 213-224
|
Søndergaard M, 1989. Phosphorus release from a hypertrophic lake sediment: experiments with intact sediment cores in a circulation system. Archiv fur Hydrobiologie, 116(1): 45-59 |
Wang S R, Jiao L X, Yang S W et al, 2012. Effects of organic matter and submerged macrophytes on variations of alkaline phosphatase activity and phosphorus fractions in lake sediment. Journal of Environmental Management, 113: 355-360 DOI:10.1016/j.jenvman.2012.09.007 |
Wang H J, Wang H Z, Liang X M et al, 2014. Total phosphorus thresholds for regime shifts are nearly equal in subtropical and temperate shallow lakes with moderate depths and areas. Freshwater Biology, 59(8): 1659-1671 DOI:10.1111/fwb.12372 |
Wang H J, Xu C, Liu Y et al, 2021. From unusual suspect to serial killer: cyanotoxins boosted by climate change may jeopardize megafauna. The Innovation, 2(2): 100092 DOI:10.1016/j.xinn.2021.100092 |
Xie L Q, Xie P, Li S X et al, 2003. The low TN: TP ratio, a cause or a result of Microcystis blooms?. Water research, 37(9): 2073-2080 DOI:10.1016/S0043-1354(02)00532-8 |
Yu Q, Wang H Z, Li Y et al, 2015. Effects of high nitrogen concentrations on the growth of submersed macrophytes at moderate phosphorus concentrations. Water Research, 83: 385-395 DOI:10.1016/j.watres.2015.06.053 |
 2021, Vol. 52
2021, Vol. 52


