中国海洋湖沼学会主办。
文章信息
- 刘岱, 应轲臻, 蔡中华, 黄洪辉, 毕洪生. 2021.
- LIU Dai, YING Ke-Zhen, CAI Zhong-Hua, HUANG Hong-Hui, BI Hong-Sheng. 2021.
- 大亚湾西南海域尖笔帽螺2020年7月暴发期内的分布特征
- OUTBURST OF CRESEIS ACICULA IN SOUTHWEST DAYA BAY IN JULY 2020
- 海洋与湖沼, 52(6): 1438-1447
- Oceanologia et Limnologia Sinica, 52(6): 1438-1447.
- http://dx.doi.org/10.11693/hyhz20210400086
文章历史
-
收稿日期:2021-04-11
收修改稿日期:2021-07-06
2. 深圳市绿洲光生物技术有限公司 深圳 518057;
3. 中国水产科学研究院南海水产研究所 广州 510300;
4. 马里兰大学环境中心 美国马里兰州 20688
2. Oasis Photobio Tech LTD., Shenzhen 518057, China;
3. South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China;
4. University of Maryland Center for Environmental Science, Maryland 20688, USA
翼足类是腹足纲的一个单系分支, 在海洋食物网、生物地球化学循环与海洋酸化中扮演着重要角色(Howes et al, 2014; Manno et al, 2019; Kohnert et al, 2020)。翼足类常随海流漂移的特性, 使它对不同水团有重要的指示作用(Chen et al, 1970)。尖笔帽螺(Creseis acicula)是一种分布广泛的翼足类生物, 南北纬50度范围内均有分布(Burridge et al, 2017), 在我国东海与南海的各个季节也有观测到较多种群(戴燕玉, 1995; 徐兆礼, 2005)。尖笔帽螺广泛的水平分布可能与其水平运动能力弱、随海流移动且温盐适应范围广的特性有关(Sakthivel et al, 1974; 齐钟彦等, 1986; Xu et al, 2006)。在垂直分布方面, 尖笔帽螺倾向于生活在海水表层, 总丰度往往与表层水温和海流有关(齐钟彦等, 1986; Xu et al, 2006), 这种垂直分布特征可能与其捕食活动有关, 尖笔帽螺在近岸的大规模出现经常与浮游植物的暴发(Sakthivel et al, 1974)和浮游动物的高生物量期吻合(Peter et al, 1978), 意味着尖笔帽螺可能更倾向于生活在浮游植物较为密集的上层水体。在种群丰度方面, 尖笔帽螺由于个体的繁殖可以发生在生命周期的早期, 不需要成长为成熟的雌性个体(Lalli et al, 1989), 其繁殖周期可能较短, 能够在适宜条件下实现快速地繁殖, 具备大规模暴发的条件。
目前, 尖笔帽螺的暴发日渐频繁。自20世纪60年代起, 尖笔帽螺在世界范围内的观测记录开始增多, 并在2010年后出现大幅度增长(GBIF, 2020)。2020年7月, 在南海北部大亚湾地区发现尖笔帽螺成群聚集, 暴发成“潮”, 给当地生态安全带来潜在风险(Hunt et al, 2008)。为研究大亚湾湾内尖笔帽螺的来源, 需要通过采样得到尖笔帽螺的分布状况。然而传统的浮游生物网与声呐探测等采样手段, 都面临诸多缺点与挑战。浮游生物网对于斑块状分布的生物采样效率低下, 在拖网采样中也难以获得物种精确地水平分布信息; 对于浅海生物, 浮游生物网难以获得样本精确地垂直分布信息, 且在采样过程中容易出现挂网、漏网等问题, 给数据的准确度带来影响(Remsen et al, 2004; Howes et al, 2014)。而声呐探测则不具备分辨生物个体的能力, 甚至同种生物的不同个体都需要不同频率才能准确分辨, 同时易受外界干扰, 如近表层的声波反射(Robison, 2004)。因此我们需要一种新的采样方式来克服传统采样方式的缺点。
浮游生物成像仪(PlanktonScope)是基于浮游生物可视化成像系统(ZOOplankton VISualization, ZOOVIS)而发展的远心背影水下成像系统(Bi et al, 2013; Song et al, 2020), 该系统能在浊度较高的复杂水体环境中对微小生物形成有效成像, 具有宽视野、大纵深、高分辨率等特点, 已在白令海、中国南海、东海、黄海、深圳湾、大亚湾等多个海域成功应用(Bi, 2017; Song et al, 2020)。浮游生物成像仪能够通过原位成像的方式准确获得尖笔帽螺的垂直分布情况以及在海洋中的活动状况, 并可以通过人工智能系统智能分辨所拍图片中浮游生物的种类与数量, 有效克服了传统采样方式所面临的困境。
本研究通过浮游生物成像仪在大亚湾海域的定点垂直投放, 获得尖笔帽螺在采样站点的密度和垂直分布情况, 并通过插值法预测尖笔帽螺在大亚湾西北部海域的分布, 追溯尖笔帽螺的可能来源, 为后续应对尖笔帽螺的爆发提供参考。
1 材料与方法 1.1 研究海域与采样方法本次研究的采样时间为2020年7月4日, 范围为大亚湾22.56°—22.68°N, 114.50°—114.70°E范围内海域(图 1)。采样方法为利用装有EXO (EXO1 Multiparameter Sonde)的浮游生物成像仪(PlanktonScope)在研究海域内的10个点位(S1—S10)进行定点垂直投放, 投放深度为0—12 m。投放时, 先将装有EXO的成像仪缓慢投放至近底部, 停留数分钟后再缓慢拉起进行回收, 过程中浮游生物成像仪以10 Hz的频率进行图像采样, 采样原位图如图 2所示; EXO则以1 Hz的频率实时测定海水的温度、盐度、深度和叶绿素浓度等指标, 得到海水的理化特征数据。
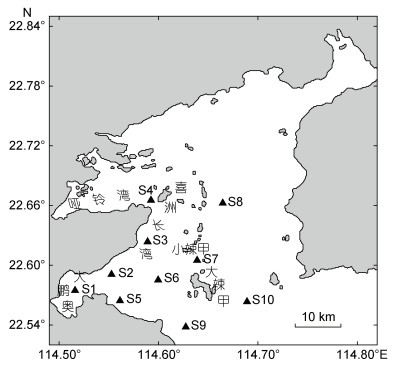 |
| 图 1 大亚湾采样站点图 Fig. 1 Map of study area and sampling sites in the Daya Bay |
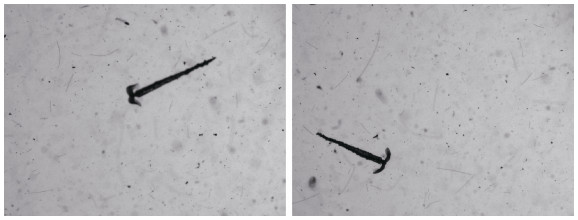 |
| 图 2 浮游生物成像仪原位采样图片 Fig. 2 Examples of in situ images collected by plankton imager PlanktonScope |
利用EXO采集到的温度与盐度数据, 结合海水热力学方程(TEOS-10)(Feistel et al, 2010; Wright et al, 2010), 计算出各个水层的海水密度, 并对1 m水深间隔的温度与盐度进行聚类分析。
将EXO采集到的温度、盐度、叶绿素浓度数据以1 m为间隔, 计算出不同水深的温度、盐度和叶绿素浓度; 将不同深度的环境因子求平均值, 作为当前采样站点对应的环境因子的数值; 最后使用Matlab (R2020b, Mathworks Inc.)工具箱Design and Analysis of Computer Experiments (DACE)中的克里金插值法(Kriging) (Lophaven et al, 2002), 对采样海域温度、盐度和叶绿素浓度的空间分布情况进行插值计算。其中回归模型选用0阶多项式, 即假设采样区域满足二阶平稳性假设:
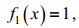 (1)
(1)式中, f1(x)是位置的函数, f1(x)=1表示估计值仅与距离相关。
相关模型选用球状模型(Spherical):
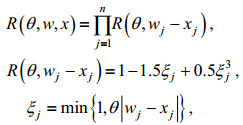 (2)
(2)式中, R(θ, w, x)表示与随机过程总协方差有关的函数, R(θ, wj–xj)表示其在第j个点上的分量; w、x表示已知点与未知点的位置函数, wj、xj为其在第j个点上的分量, wj-xj反映已知点与未知点之间的距离, θ反映计算值随距离衰减的速率, 上限值设为1.5, 下限值设为0.1, 初始猜测值设为0.5。
1.2 图像获取与生物提取浮游生物成像仪每小时能够采集约36 000张图片, 图像处理包括三部分: 第一步是利用动态下采样(Cheng et al, 2020)和自适应阈值法对潜在目标物进行提取及增强(Bi et al, 2015; Cheng et al, 2019); 第二步是基于卷积神经网络(CNN)的特征提取和描述; 第三步是多分类SVM模型进行分类(Cheng et al, 2019)。
首先利用自适应ROI提取(adaptive ROI extraction)获得图片中的潜在目标物。该方法将最大稳定极值区域(maximally stable extremal regions, MSER)和Sauvola局部二值化法相结合, 首先计算图像的平均信噪比(mean signal-to-noise ratio, MSNR), 计算公式如下:
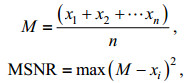 (3)
(3)式中, n代表像素数, xi代表第i个像素的像素值。如果MSNR > 0.1, 图片有较高的对比度, 则利用MSER方法对图片进行二值化处理; 如果MSER≤0.1, 说明图片对比度较低, 则利用Sauvola局部二值化法对图片进行二值化处理, 以1像素的步长, 1%—3%图片尺寸的大小对图片进行分割, 根据公式(4), 通过对T(x, y)/m(x, y)与设定阈值的大小进行比较, 来确定所有像素的二值化(Cheng et al, 2019)。
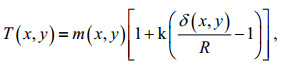 (4)
(4)式中, T(x, y)为每个矩形框的阈值大小, m(x, y)为矩形框内的平均像素值, R为整个图片所有像素的最大标准差, 对灰度图像来说, 这个值为128。δ(x, y)为矩形框内所有像素的标准差, k为固定值0.34。
然后利用ROI增强实现目标物特征的进一步增强。该步骤在提取ROI的基础上, 采用基于断点链接的降噪算法来实现目标特征增强。对自适应ROI提取步骤中所划分的矩形框, 设矩形框内的像素数为N, 如果以某像素为中心的矩形框内, 0.75N数量的像素点都为目标物, 那么该像素也会被认定为目标物的一部分(Cheng et al, 2019)。
在取得目标区域(ROI)后, 将目标区域以外的像素值保存在数组Pback中, 目标区域的数值设为0。对其中的所有非0像素值按以下公式进行增强, 对背景进行锐化:
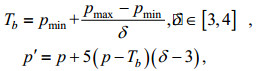 (5)
(5)式中, Tb表示目标物背景强度, pmin为区域内最低像素值, pmax为区域内最大像素值, δ为3到4之间的常数, p为原非0像素值, p′为增强后的像素值(Cheng et al, 2019)。
其次是利用卷积神经网络(CNN)中的卷积层和全连接层对上述步骤得到的ROI进行特征学习, 并利用训练集中的样本调整CNN, 最后将全连接层的输出作为多分类SVM模型训练与分类的输入(Cheng et al, 2019)。
最后利用具有较高容错性的多分类SVM模型, 使用一个简单的线性分类器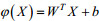
浮游生物成像仪采用平行光背影成像技术, 根据成像区间(8 cm×9 cm)和景深(5 cm), 可以估算清晰成像的水层体积为0.36 L。每张图片中清晰成像的尖笔帽螺数量即为0.36 L海水中尖笔帽螺的数量, 反映的尖笔帽螺密度为:
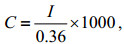 (6)
(6)其中C为尖笔帽螺密度, 单位为ind./m3; I为图片中清晰成像的尖笔帽螺数量。
对于尖笔帽螺在垂直方向上的分布, 选用1 m的深度间隔, 根据EXO所采集的深度数据, 收集1 m深度间隔范围内所有的图片, 统计图片数量Jdep、所有图片中尖笔帽螺总数量Idep, 得到该1 m水层内尖笔帽螺的密度Cdep为:
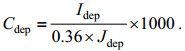 (7)
(7)以1 m为间隔, 对于所有采样站点不同深度的尖笔帽螺密度求平均值, 得到该采样站点尖笔帽螺的平均密度Cave为:
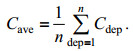 (8)
(8)并根据每个采样站点的平均密度, 使用DACE工具箱对尖笔帽螺在采样海域的水平分布情况进行预测(Lophaven et al, 2002), 其中回归模型选用0阶多项式, 即假设采样区域满足二阶平稳性假设:
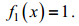 (9)
(9)式中, f1(x)是位置的函数, f1(x)=1表示估计值仅与距离相关。
相关模型选用高斯模型(Guass):
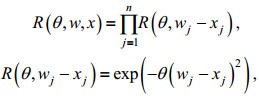 (10)
(10)式中, R(θ, w, x)表示与随机过程总协方差有关的函数, R(θ, wj-xj)表示其在第j个点上的分量; w、x为表示已知点与未知点的位置函数, wj、xj为其在第j个点上的分量, wj-xj反映已知点与未知点之间的距离, θ反映计算值随距离衰减的速率, 上限值设为1.5, 下限值设为0.1, 初始猜测值设为0.5。
1.4 尖笔帽螺体长统计方法 1.4.1 尖笔帽螺体长测量样本选取对于所有采样站点通过ROI提取与神经网络分类后的单个尖笔帽螺图像, 按照图像清晰、体长完整、避免重复与覆盖的原则进行挑选(表 1)。尖笔帽螺总数量小于10 000的站点, 挑选所有符合要求的单个尖笔帽螺图像; 尖笔帽螺数量大于10 000的站点, 利用随机数法按照上述原则进行挑选, 直至数量达到500张。由于S1、S4站点尖笔帽螺数量过少, S8站点无数据, 因而不进行挑选。
| 站点 | 尖笔帽螺数量 | 图片数量 | 尖笔帽螺出现的图片数量 | 一次挑选图片数量 | 二次挑选图片数量 |
| S2 | 5 204 | 20 792 | 4 544 | 207 | 37 |
| S3 | 816 | 2 162 | 680 | 215 | 38 |
| S5 | 615 | 8 188 | 615 | 38 | 6 |
| S6 | 1 064 | 11 343 | 977 | 127 | 22 |
| S7 | 9 367 | 34 255 | 7 462 | 498 | 90 |
| S9 | 202 969 | 59 271 | 45 998 | 500 | 90 |
| S10 | 152 | 2 979 | 147 | 72 | 13 |
| 总和 | 220 187 | 138 990 | 60 423 | 1 657 | 296 |
从已挑出的尖笔帽螺图片中, 随机挑选约300张图片, 用于建立公式模型(表 1)。每个站点二次挑选的图片数量依据各个站点一次挑选出的图片数量占总挑出图片数的比例来决定, 每个采样站点二次挑选的图片数量num为:
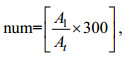 (11)
(11)其中, A1为特定站点一次挑选挑出的单个尖笔帽螺图片数量, At为一次挑选挑出的单个尖笔帽螺图片总数量。二次挑选占总挑出图片数量的18%—20%, 用于代表整体的体长状况。二次挑选同样通过随机数法来完成。
对二次挑选得到的单个尖笔帽螺图片进行二值化处理, 选出其中的最大连通区域, 并生成矩形框。成像仪采集到的图像每像素长度为31 μm, 据此可以得到矩形框的长边长度。尖笔帽螺与体长可由以下公式估算测量:
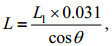 (12)
(12)其中, L为尖笔帽螺体长的估算测量值, L1为矩形框长边长度。θ为与最大连通区域具有相同标准二阶中心矩的椭圆的长轴与矩形框长边的夹角, 用于反映图像上尖笔帽螺主躯干的朝向。同时手动在每张图片上选取尖笔帽螺头尾两点, 计算出两点间距离Lr, 作为图像中尖笔帽螺的实际体长。对体长的估算值L与体长的实际值Lr进行一元线性回归, 得到体长估算修正公式:
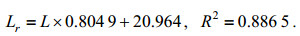 (13)
(13)F检验P<0.01, 证明两者线性关系显著。利用该模型, 可测量出一次挑选中所有尖笔帽螺的体长, 并对不同站点体长分布进行聚类分析, 将体长与温度、盐度、叶绿素浓度进行多元线性回归。
2 结果 2.1 环境因子对于温度分布, 在水平方向上, S3站点平均温度最高, S1、S2、S4、S5、S7站点次之, S6、S9、S10站点平均温度相对较低(图 3a)。在垂直方向上, S1—S5、S7站点随深度增加, 温度降低较为平缓; S6、S9、S10站点在水深5—6 m的水层内温度急剧下降(图 4a)。
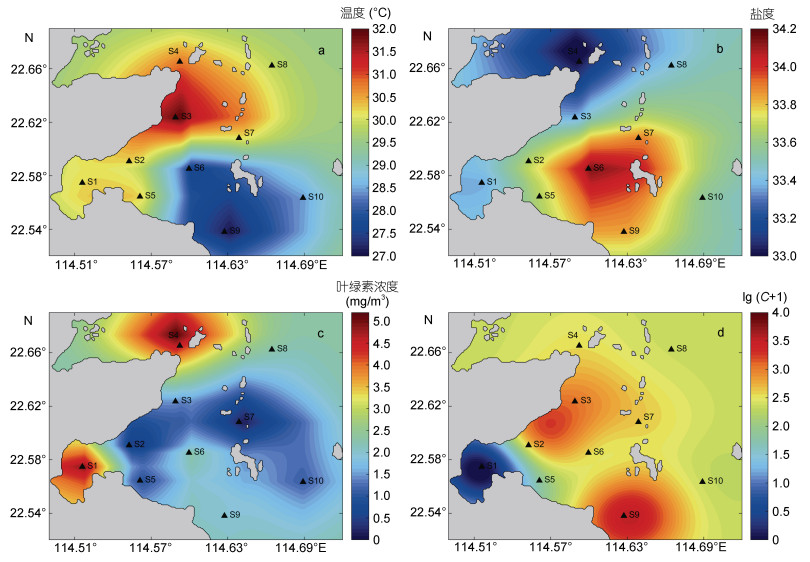 |
| 图 3 采样海域温度(a)、盐度(b)、叶绿素浓度(c)、尖笔帽螺密度(d)水平分布图 Fig. 3 Horizontal distribution of temperature (a), salinity (b), chlorophyll (c) and Creseis acicula density (d) in sampling area 注: C为尖笔帽螺密度, 单位为ind./m3 |
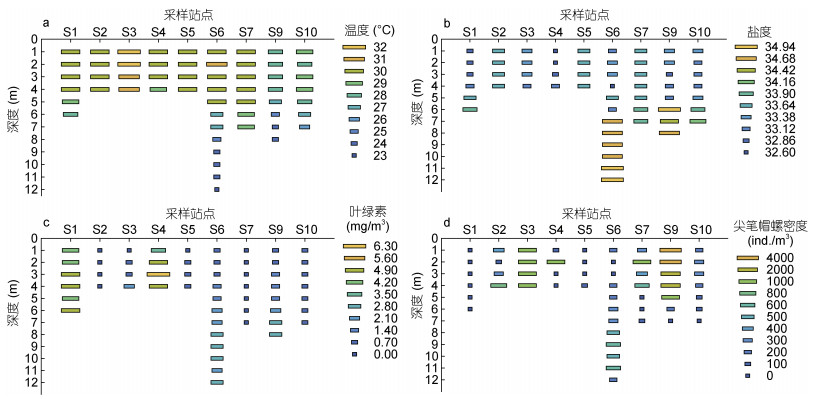 |
| 图 4 采样位点温度(a)、盐度(b)、叶绿素浓度(c)、尖笔帽螺密度(d)垂直分布图 Fig. 4 Vertical distribution of Temperature (a), salinity (b), chlorophyll (c) and Creseis acicula density (d) in sampling sites |
对于盐度分布, 在水平方向上, S6站点平均盐度最高, S7、S9站点相对较高, S2、S5、S10次之, S1、S3站点盐度相对较低, S4站点盐度最低(图 3b)。在垂直方向上, S2、S3、S5、S7站点盐度随深度变化较小; S1、S4、S6站点盐度随水深增加而增加, S6站点在6 m水深处盐度变化较大, 而S1、S4站点盐度随深度变化较为缓慢; S9、S10站点在水深5 m处盐度变化较大, 5 m水深以上的水层与5m水深以下的水层, 盐度变化较为平缓(图 4b)。
对于叶绿素浓度分布, S1、S4站点叶绿素浓度最高, 且随深度增加而增大, 在3 m水深处达到稳定; S6、S9站点叶绿素浓度相对较高, 约为S1、S4站点的一半, 且随深度增加而增大, 在7 m水深处达到稳定; S3、S5、S10站点叶绿素相对较低, 约为S6、S9站点的一半, S3、S5站点叶绿素浓度随深度增加而增大, S10则是各个水层叶绿素浓度相对均匀, 变化较小。S2、S7站点叶绿素浓度偏低, S7站点几乎为0 (图 3c, 4c)。
2.2 尖笔帽螺水平分布状况各采样站点的尖笔帽螺平均密度存在较大差异。其中S9站点尖笔帽螺密度最高, 超过3 000 ind./m3; S3站点相对较高, 约为1 000 ind./m3; S2、S4、S6、S7、S10站点尖笔帽螺密度介于200—500 ind./m3之间。S5站点尖笔帽螺密度较小, 不足100 ind./m3; S1站点未发现尖笔帽螺。根据克里金插值法, 对尖笔帽螺在采样区域的分布进行预测, 结果如图 3d所示, 可以看出湾口西部海域尖笔帽螺密度最高, 长湾附近密度相对较高, 大鹏澳海域内未发现尖笔帽。
2.3 尖笔帽螺垂直分布状况在不同采样站点中, 尖笔帽螺密度垂直分布的差异较为显著。其中S1点未发现尖笔帽螺; S2、S5、S6三个站点尖笔帽螺在采样水层的底部分布较多, 而S4、S7、S9、S10四个站点则在采样水层的上部分布较多, S3站点尖笔帽螺在整个水层内均匀分布。在深度超过5 m的站点中, S7、S9、S10站点尖笔帽螺主要分布在5 m以上水层, S6站点则主要分布在5 m以下水层(图 4d)。
根据不同水层温度、盐度与尖笔帽螺密度, 以及利用海水热力学方程(TEOS-10)得到的海水密度(Feistel et al, 2010; Wright et al, 2010), 可以得到尖笔帽螺主要分布的温度区间为27.50—32.50 ℃, 盐度区间为32.50—34.50, 密度区间为1 019.50— 1 021.50 kg/m3(图 5)。
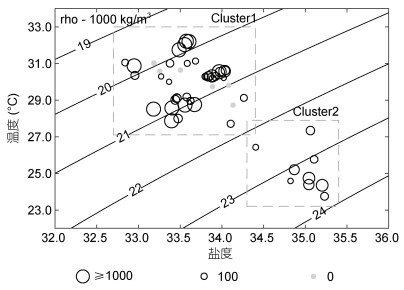 |
| 图 5 尖笔帽螺密度温盐变化图 Fig. 5 Creseis acicula density in TS-diagram 注: rho为海水密度, 圆圈大小表示尖笔帽螺密度, 单位为ind./m3 |
尖笔帽螺在不同站点体长的分布情况既存在相似性, 也存在一定差异。S2、S3、S5、S6、S7、S9站点体长在9—12 mm范围内的个体最多, 平均体长相近。其中S2站点体长长于12 mm的个体偏多; S3、S7两个站点体长短于9 mm的个体偏多。S10站点体长在6—9 mm范围内的个体最多, 平均体长偏短(图 6, 7)。
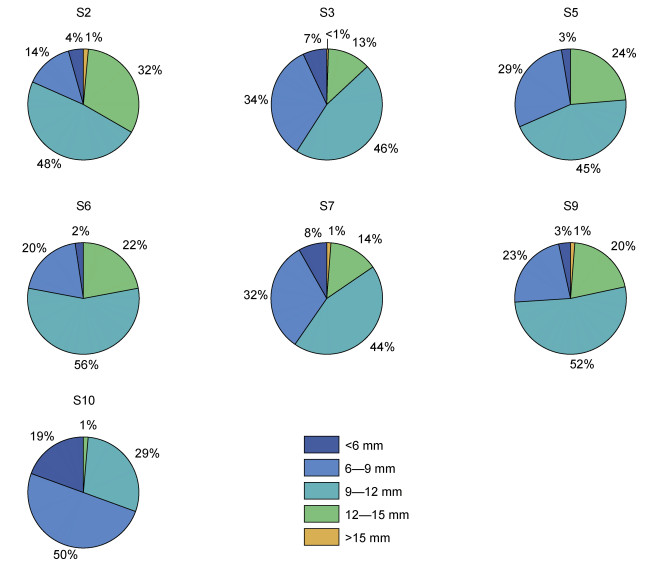 |
| 图 6 尖笔帽螺体长分布图 Fig. 6 Body length distribution of Creseis acicula |
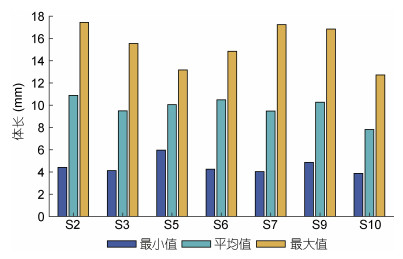 |
| 图 7 各站点尖笔帽螺体长最小值、平均值与最大值 Fig. 7 Minimum, average and maximum body length of Creseis acicula in sampling sites |
利用图 6中各个站点的体长分布占比进行聚类分析, 可以发现S3与S7站点的体长分布最为接近; S5、S6、S9站点的体长分布相差相对较小; S2、S10站点与其他站点相比, 体长分布相差较大(图 8)。将体长与温度、盐度、叶绿素浓度进行多元线性回归, 分析结果R2 < 0.4, F检验P值> 0.1, 体长与环境因子的线性相关性并不明显。
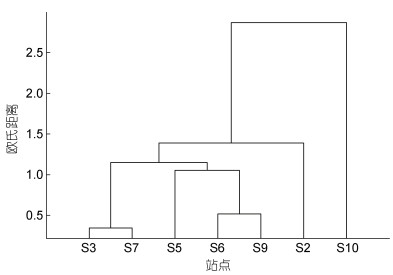 |
| 图 8 采样位点尖笔帽螺体长聚类分析 Fig. 8 Cluster analysis of body length in sampling sites |
尖笔帽螺本身水平运动能力较弱, 其分布受海流影响较大(Sakthivel et al, 1974; 齐钟彦等, 1986), 且从图 3可以看出, 尖笔帽螺水平分布与环境因子的关系并不明显, 因而湾口海域不同地点尖笔帽螺密度的差异, 可能主要受海流影响。武文等(2017)的研究表明, 湾口西部大辣甲西南侧海域(S9)往复流较弱, 余流较强流向湾内。从温度与盐度分布(图 3a, 3b)也可看出, 该片海域表现出低温高盐的特征, 受外来海水入侵的特征明显(韩舞鹰等, 1991), 因而湾外的尖笔帽螺可能更易随海流进入, 并在此处滞留, 形成高密度区域(图 3d)。
湾口中部海域(S10)往复流较强, 余流较弱斜向湾外东南方向(武文等, 2017)。此处相比湾口西部温度相对较高, 盐度相对较低, 可能是由于往复流较强受湾内与湾外海水影响均较大。受往复流影响, 尖笔帽螺可能更难在此处滞留, 密度较小(图 3d)。
3.2 湾内西南侧海域尖笔帽螺分布与来源对于湾内西南侧海域, 尖笔帽螺在长湾附近分布较多, 大鹏澳内部分布较少, 其余海区平均密度相近(图 3d)。通过尖笔帽螺温盐分布(图 5)可以发现, 尖笔帽螺更偏向于出现在高温低盐的水体, 长湾附近受核电站温排水影响, 水体温度较高, 同时距湾口相对较远, 盐度偏低, 尖笔帽螺可能更倾向于在此处聚集。同时该片海域流速较大, 余流较强, 尖笔帽螺可能更易在此处淤积(吴仁豪等, 2007; 武文等, 2017)。大辣甲北部S7附近海域尖笔帽螺密度低于长湾海域, 但体长分布与长湾相近(图 6, 7, 8), 且流经长湾的海流与流经大辣甲北部的海流均源于西部湾口(武文等, 2017; Zhang et al, 2019), 两片海域尖笔帽螺来源可能存在一定联系。
大辣甲西部S5、S6站点附近海域尖笔帽螺密度相对较低, 且体长分布与湾口西部(S9)相似, 平均体长相当(图 7, 8)。体长回归分析表明, 尖笔帽螺体长与温度、盐度和叶绿素浓度等环境因子无明显线性相关性, 这意味着尖笔帽螺体长分布可能受海流影响较大。湾口西部海域存在较强的指向湾内的余流, 因而该片海域的尖笔帽螺可能随海流进入湾内, 滞留于大辣甲西部。
3.3 影响尖笔帽螺垂直分布因素尖笔帽螺垂直分布受诸多因素影响, Karakas等(2020)发现尖笔帽螺具备垂直运动能力, 且受捕食活动和环境变化等因素驱动, 可能会对尖笔帽螺的垂直分布产生较大影响。在捕食活动方面, 尖笔帽螺以浮游植物为食(Howes et al, 2014), 从图 4c、4d中可以看出, S6站点尖笔帽螺密度与与叶绿素浓度变化趋势相近, 但在尖笔帽螺密度较高的S9站点, 变化趋势则相反, 浮游藻类分布与尖笔帽螺密度分布相关性并不明显, 表明尖笔帽螺垂直分布在不同的环境条件下可能对食物的响应不同。在环境方面, 从图 5可以看出尖笔帽螺主要分布于温度偏高, 盐度偏低的水域, 该类型的水域主要出现在海水表层, 这与Xu等(2006)的研究一致。同时温盐的变化受海流影响较大, 多项研究表明, 粤东地区夏季存在上升流, 低温高盐的海水易入侵大亚湾, 导致湾内海水分层(韩舞鹰等, 1988; 曾刚等, 1992; Zhang et al, 2019); Zhang等(2019)则发现大亚湾西南部海域夏季表层海流与深度平均海流方向并不一致。从图 4a、4b图中可以看出, 西部湾口及附近海域水深5—6 m处存在温盐变化较大的水层, 可能存在海水分层的现象。不同水层海流流向的差别, 可能是大辣甲西部海域尖笔帽螺在采样水层的下层分布较多的原因之一; 同时海流流速与垂直混合强度, 也可能会对尖笔帽螺的垂直分布带来影响。
4 结论本文通过利用浮游生物成像仪与EXO等设备对大亚湾西南海域进行图片及环境因子采样, 获得温度、盐度、叶绿素浓度等环境因子和尖笔帽螺在该片海域的分布情况, 得到以下结论:
(1) 利用浮游生物成像仪, 能够获得尖笔帽螺精细的水平、垂直分布特征。在水平方向上, 尖笔帽螺主要分布于西部湾口及长湾附近海域, 存在外源输入的可能。在垂直方向上, 尖笔帽螺多分布于表层, 但在大辣甲西侧海域, 尖笔帽螺在下层水体分布相对较多, 可能受温盐与海水分层影响。
(2) 在大亚湾海域内, 尖笔帽螺高丰度多出现于温度较高、盐度较低水层, 且该类温盐特征多出现于海水表层; 在低温高盐水域, 尖笔帽螺分布较少, 丰度较低。
(3) 尖笔帽螺在不同海域体长分布不同。大鹏澳东侧海域长个体偏多, 西部湾口体长适中, 靠近内侧的小辣甲西部、南部海域体长偏短, 湾口中部海域体长远小于其他区域。体长大小的分布与温度、盐度和叶绿素浓度相关性并不明显, 可能与海流存在一定关系。
齐钟彦, 林光宇, 张福绥, 等. 1986. 中国动物图谱: 软体动物第三册. 北京: 科学出版社
|
吴仁豪, 蔡树群, 王盛安, 等. 2007. 大亚湾海域潮流和余流的三维数值模拟. 热带海洋学报, 26(3): 18-23 DOI:10.3969/j.issn.1009-5470.2007.03.003 |
武文, 严聿晗, 宋德海. 2017. 大亚湾的潮汐动力学研究——I. 潮波系统的观测分析与数值模拟. 热带海洋学报, 36(3): 34-45 |
徐兆礼. 2005. 东海浮游翼足类(Pteropods)种类组成和多样性研究. 生物多样性, 13(2): 168-173 DOI:10.3321/j.issn:1005-0094.2005.02.011 |
韩舞鹰, 马克美. 1988. 粤东沿岸上升流的研究. 海洋学报, 10(1): 52-59 |
韩舞鹰, 马克美. 1991. 大亚湾海水混合交换特征. 海洋科学, (2): 64-67 |
曾刚, 李立, 许金殿, 等. 1992. 大亚湾西部和北部浅水区夏半年的温、盐度分析. 台湾海峡, 11(1): 28-34 |
戴燕玉. 1995. 南海中部翼足类和异足类生态的初步研究. 海洋学报, 17(6): 111-116 |
Bi H, 2017. Hongsheng Bi. 2014. Framework for mobile deployment of the ZOOplankton Visualization and Imaging System (ZOOVIS) and Dual-frequency IDentification SONar system (DIDSON) in the Bering Sea, July-August 2017. Research Workspace. 10.24431/rw1k57s, version: 10.24431_rw1k57s_20210316T191058Z
|
Bi H S, Cook S, Yu H et al, 2013. Deployment of an imaging system to investigate fine-scale spatial distribution of early life stages of the ctenophore Mnemiopsis leidyi in Chesapeake Bay. Journal of Plankton Research, 35(2): 270-280 DOI:10.1093/plankt/fbs094 |
Bi H S, Guo Z H, Benfield M C et al, 2015. A semi-automated image analysis procedure for in situ plankton imaging systems. PLoS One, 10(5): e0127121 DOI:10.1371/journal.pone.0127121 |
Burridge A K, Goetze E, Wall-Palmer D et al, 2017. Diversity and abundance of pteropods and heteropods along a latitudinal gradient across the Atlantic Ocean. Progress in Oceanography, 158: 213-223 DOI:10.1016/j.pocean.2016.10.001 |
Chen C, Hillman N S, 1970. Shell-bearing pteropods as indicators of water masses off cape hatteras, north carolina. Bulletin of Marine Science, 20(2): 350-367 |
Cheng X M, Cheng K C, Bi H S, 2020. Dynamic downscaling segmentation for noisy, low-contrast in situ underwater plankton images. IEEE Access, 8: 111012-111026 DOI:10.1109/ACCESS.2020.3001613 |
Cheng K C, Cheng X M, Wang Y Q et al, 2019. Enhanced convolutional neural network for plankton identification and enumeration. PLoS One, 14(7): 0219570 |
Feistel R, Wright D G, Jackett D R et al, 2010. Numerical implementation and oceanographic application of the thermodynamic potentials of liquid water, water vapour, ice, seawater and humid air-Part 1:background and equations. Ocean Science, 6(3): 633-677 DOI:10.5194/os-6-633-2010 |
GBIF, 2020. GBIF. org (17 July 2020) GBIF occurrence download. doi: 10.15468/dl.rfkdyz
|
Howes E L, Bednaršek N, Büdenbender J et al, 2014. Sink and swim: a status review of thecosome pteropod culture techniques. Journal of Plankton Research, 36(2): 299-315 DOI:10.1093/plankt/fbu002 |
Hunt B P V, Pakhomov E A, Hosie G W et al, 2008. Pteropods in Southern Ocean ecosystems. Progress in Oceanography, 78(3): 193-221 DOI:10.1016/j.pocean.2008.06.001 |
Karakas F, Wingate J, Blanco-Bercial L et al, 2020. Swimming and sinking behavior of warm water pelagic snails. Frontiers in Marine Science, 7: 556239 DOI:10.3389/fmars.2020.556239 |
Kohnert P C, Cerwenka A F, Brandt A et al, 2020. Pteropods from the kuril-kamchatka trench and the sea of okhotsk (Euopisthobranchia; Gastropoda). Progress in Oceanography, 181: 102259 DOI:10.1016/j.pocean.2019.102259 |
Lalli C M, Gilmer R W, 1989. Pelagic Snails: the Biology of Holoplanktonic Gastropod Mollusks. Stanford: Stanford University Press
|
Lophaven S N, Nielsen H B, Søndergaard J, 2002. Aspects of the matlab toolbox DACE. Technical University of Denmark
|
Manno C, Rumolo P, Barra M et al, 2019. Condition of pteropod shells near a volcanic CO2 vent region. Marine Environmental Research, 143: 39-48 DOI:10.1016/j.marenvres.2018.11.003 |
Peter K, Paulinose V, 1978. Swarming of creseis acicula rang (Pteropoda) in the Bay of Bengal. Indian Journal of Marine Sciences, 7(2): 126-127 |
Remsen A, Hopkins T L, Samson S, 2004. What you see is not what you catch: a comparison of concurrently collected net, Optical Plankton Counter, and Shadowed Image Particle Profiling Evaluation Recorder data from the northeast Gulf of Mexico. Deep Sea Research Part I: Oceanographic Research Papers, 51(1): 129-151 DOI:10.1016/j.dsr.2003.09.008 |
Robison B H, 2004. Deep pelagic biology. Journal of Experimental Marine Biology and Ecology, 300(1-2): 253-272 DOI:10.1016/j.jembe.2004.01.012 |
Sakthivel M, Harida P, 1974. Synchronization in the occurrence of Trichodesmium bloom and swarming of Creseis acicula Rang (Pteropoda) and Penilia avirostris Dana (Cladocera) in the area off Cochin. Mahasagar, 7: 61-67 |
Song J T, Bi H S, Cai Z H et al, 2020. Early warning of Noctiluca scintillans blooms using in-situ plankton imaging system: an example from Dapeng Bay, P.R. China. Ecological Indicators, 112: 106123 DOI:10.1016/j.ecolind.2020.106123 |
Wright D G, Feistel R, Reissmann J H et al, 2010. Numerical implementation and oceanographic application of the thermodynamic potentials of liquid water, water vapour, ice, seawater and humid air-Part 2:The library routines. Ocean Science, 6(3): 695-718 DOI:10.5194/os-6-695-2010 |
Xu Z L, Li C J, 2006. Study on abundance variation of pteropods in the East China Sea. Acta Oceanologica Sinica, 25(1): 100-107 |
Zhang H, Cheng W C, Chen Y R et al, 2019. Importance of large-scale coastal circulation on bay-shelf exchange and residence time in a subtropical embayment, the northern South China Sea. Ocean & Coastal Management, 168: 72-89 |
 2021, Vol. 52
2021, Vol. 52


