
中国海洋湖沼学会主办。
文章信息
- 张玲玲, 余莉, 李长红, 苗亮, 陈炯. 2021.
- ZHANG Ling-Ling, YU Li, LI Chang-Hong, MIAO Liang, CHEN Jiong. 2021.
- 香鱼(Plecoglossus altivelis)CC型趋化因子受体3(CCR3)基因的分子鉴定及其对鳗弧菌感染响应的研究
- MOLECULAR IDENTIFICATION OF CC MOTIF CHEMOKINE RECEPTOR 3 (CCR3) GENE AND ITS RESPONSE TO VIBRIO ANGUILLARUM INFECTION IN AYU PLECOGLOSSUS ALTIVELIS
- 海洋与湖沼, 52(6): 1456-1464
- Oceanologia et Limnologia Sinica, 52(6): 1456-1464.
- http://dx.doi.org/10.11693/hyhz20210500118
文章历史
-
收稿日期:2021-05-17
收修改稿日期:2021-06-20
2. 宁波大学海洋学院生物化学与分子生物学实验室 宁波 315832
2. Laboratory of Biochemistry and Molecular Biology, School of Marine Science, Ningbo University, Ningbo 315832, China
CC型趋化因子受体3 (CC chemokine receptor 3, CCR3)是CC型趋化因子的受体, 属于G蛋白耦联受体(G protein-coupled receptor, GPCR)家族成员。最早研究发现, CCR3选择性地在人嗜酸性粒细胞上表达, 并且嗜酸细胞活化趋化因子(eotaxin)是CCR3高特异性的拮抗剂(Kitaura et al, 1996)。随着研究的深入, CCR3被发现在嗜碱性粒细胞上也高表达(Uguccioni et al, 1997), 而且树突状细胞(dentric cells, DC) (Rubbert et al, 1998)、小角质细胞(microglia) (He et al, 1997; Ghorpade et al, 1998)、单核细胞(monocytes, MO) (Ghorpade et al, 1998; Rubbert et al, 1998)、巨噬细胞(macrophages, MФ) (Rubbert et al, 1998)和CD4+ T细胞(Rubbert et al, 1998)上也有表达。CCR3有许多CC型趋化因子配体, 包括CCL5 (C-C motif chemokine 5)、CCL7 (C-C motif chemokine 7)、CCL8 (C-C motif chemokine 8)、CCL11/eotaxin-1 (C-C motif chemokine 11)、CCL13 (C-C motif chemokine 13)、CCL15 (C-C motif chemokine 15)、CCL24/eotaxin-2 (C-C motif chemokine 24)和CCL26/eotaxin-3 (C-C motif chemokine 26) (Forssmann et al, 1997; Kitaura et al, 1999; Wang et al, 2013; Palomino et al, 2015)。其中, CCR3是CCL11的唯一受体。CCR3通过与这些配体结合, 在过敏性疾病中发挥重要作用(Wang et al, 2013; Zhu et al, 2017)。在过敏性炎症反应中, 特征效应细胞嗜酸性和嗜碱性粒细胞主要依赖于其上的CCR3向不同的趋化因子迁移进入到炎症组织中(Uguccioni et al, 1997)。因此, 研究者认为采用抑制剂或者CCR3抗体直接抑制CCR3可能作为一种新的途径来抑制过敏性炎症中效应细胞嗜酸性和嗜碱性粒细胞聚集(Uguccioni et al, 1997; Zhu et al, 2017; Grozdanovic et al, 2019)。在获得性免疫缺陷综合征(acquired immunodeficiency syndrome, AIDS)研究中, 研究者发现, 脑部小角质细胞上的CCR3能与CCR5协同作用作为促进HIV-1感染中枢神经系统(He et al, 1997), 并且单核细胞来源的树突状细胞(monocyte-derived DC, MDDC)上的CCR3也可能作为协同受体与CCR5和CCR2b等促进HIV-1进入MDDC (Rubbert et al, 1998)。
通过检索GenBank数据库以及鱼类基因公共数据库, 发现已有数十种硬骨鱼类CCR3基因的序列被递交, 主要包括斑马鱼(Danio rerio)、日本青鳉(Oryzias latipes)、红鳍东方鲀(Takifugu rubripes)、大菱鲆(Scophthalmus maximus)、大西洋鲑(Salmo salar)和
香鱼(Plecoglossus altivelis, ayu), 又名鲇鱼、油香鱼、仙胎鱼、年鱼, 是包括中国和日本等国在内的东亚地区特有的小型经济名贵鱼类。由于它体形优美、肉质鲜美, 有清香味, 经济价值颇高, 在我国的规模化人工养殖日益扩大。然而, 随着池塘养殖密度及饲料投饲频率增加等原因导致池塘水体污染严重, 使得香鱼养殖病害频发, 给养殖户带来极大的经济损失(李长红等, 2009)。香鱼以生态健康养殖出名, 养殖中抗生素等传统治疗方法易产生药残和耐药而受到诸多限制。近年来, 对硬骨鱼类免疫机制进行研究, 已成为水产经济动物研究的热点之一, 可为有效防治各类病害及选育抗病品种奠定理论基础。鉴于CCR3在动物免疫应答中的重要作用, 本研究从单核/巨噬细胞(monocytes/macrophages, MO/MФ)转录组中获得香鱼CCR3 (PaCCR3)基因cDNA序列, 拟分析其分子特征、进化关系及组织分布, 解析其在鳗弧菌感染后的香鱼重要免疫组织及在鳗弧菌体外刺激的MO/MФ中mRNA的表达变化; 化学合成PaCCR3胞外多肽并免疫新西兰大白兔制备抗血清, 分析香鱼MO/MФ经鳗弧菌感染后PaCCR3蛋白的表达变化。研究结果不仅丰富了鱼类免疫学知识, 也为深入探讨鱼类趋化因子受体在防御病原感染时发挥的功能提供了基础。
1 材料与方法 1.1 材料与试剂体重约20—30 g的健康香鱼, 购自浙江省宁海县凫溪陈家香鱼养殖场。新西兰大白兔购自宁波大学医学院实验动物中心。鳗弧菌ayu-H080701 (李长红等, 2009)和大肠杆菌(Escherichia coli) TOP10菌株由本实验室保存。RNAiso试剂、AMV逆转录酶、Ex Taq DNA聚合酶、Mighty TA-cloning Kit和TB GreenTM Premix Ex TaqTM (Tli RNaseH Plus)等购自大连TaKaRa公司。RIPA裂解液、BCA蛋白浓度测定试剂盒、超敏ECL化学发光试剂盒、显影定影试剂盒、兔源甘油醛-3-磷酸脱氢酶单克隆抗体(glyceraldehyde-3-phosphate dehydrogenase rabbit monoclonal antibody, anti-GAPDH)和辣根过氧化物酶标记山羊抗兔IgG(H+L) [(HRP-labeled goat anti-rabbit IgG (H+L), HRP-IgG)等购自上海碧云天生物技术有限公司。Ficoll-PaqueTM PREMIUM购瑞典GE Healthcare公司, RPMI 1640购自美国Life Technology公司, 胎牛血清(fetal bovine serum, FBS)购自阿根廷Natocor-Industria Biológica公司。预染蛋白质分子量标准品购自美国Thermo Fisher公司。引物合成及序列测序工作由生工生物工程(上海)股份有限公司完成。多肽由合肥国肽生物科技有限公司合成。
1.2 PaCCR3基因cDNA序列获得及序列分析从香鱼MO/MФ转录组测序结果中(Lu et al, 2013)获得PaCCR3基因cDNA序列, 进行PCR扩增、TA克隆后送公司测序验证。PaCCR3基因ORF预测采用DNAstar 5.0软件进行, 氨基酸序列跨膜区预测运用TMHMM Server v. 2.0和SMART在线软件, 多重序列比对运用ClustalW在线软件, 二硫键预测运用ScanProsite软件预测, 系统进化树构建采用MEGA 6.0软件(Tamura et al, 2013)。本研究用到的CCR3序列信息列于表 1中。
| 登录号 | 物种 | 基因名 | ||
| 拉丁学名 | 中文名 | 英文名 | ||
| MZ028605 | Plecoglossus altivelis | 香鱼 | ayu | CCR3 |
| BT074497 | Osmerus mordax | 胡瓜鱼 | rainbow smelt | CCR3 |
| KC914581 | Miichthys miiuy | 鮸鱼 | miiuy croaker | CCR3 |
| XM_020930730 | Boleophthalmus pectinirostris | 大弹涂鱼 | great blue-spotted mudskipper | CCR3l |
| XM_010754369 | Larimichthys crocea | 大黄鱼 | large yellow croaker | CCR3 |
| XM_035671379 | Morone saxatilis | 条纹鲈鱼 | striped sea bass | CCR3 |
| KJ818345 | Dicentrarchus labrax | 欧洲鲈鱼 | European sea bass | CCR3 |
| JF913465 | Scophthalmus maximus | 大菱鲆 | turbot | CCR3 |
| XM_005461527 | Oreochromis niloticus | 罗非鱼 | Nile tilapia | CCR3 |
| XM_004572950 | Maylandia zebra | 斑马拟丽鱼 | zebra mbuna | CCR3 |
| XM_020100734 | Paralichthys olivaceus | 牙鲆 | Japanese flounder | CCR3l |
| XM_029831947 | Takifugu rubripes | 红鳍东方鲀 | torafugu | CCR3 |
| KF857317 | Sparus aurata | 金头鲷 | gilthead seabream | CCR3 |
| XM_021470234 | Danio rerio | 斑马鱼 | zebrafish | CCR3-1 |
| XM_002666577 | D. rerio | 斑马鱼 | zebrafish | CCR3-2 |
| GFIL01003401 | D. rerio | 斑马鱼 | zebrafish | CCR3-3 |
| XM_017496243 | Ictalurus punctatus | 斑点叉尾鮰 | channel catfish | CCR3 |
| XM_025054673 | Cynoglossus semilaevis | 半滑舌鳎 | half-smooth tongue sole | CCR3l |
| XM_020462490 | Oncorhynchus kisutch | 银大马哈鱼 | coho salmon | CCR3l |
| XM_023976815 | Salvelinus alpinus | 红点鲑 | Arctic char | CCR3 |
| NM_001173762 | Salmo salar | 大西洋鲑 | Atlantic salmon | CCR3 |
| XM_021589382 | Oncorhynchus mykiss | 虹鳟 | rainbow trout | CCR3 |
| XM_018570071 | Nanorana parkeri | 高山倭蛙 | Tibetan frog | CCR3l |
| NM_001113862 | Xenopus tropicalis | 热带爪蟾 | tropical clawed frog | CCR3 |
| XM_018266965 | Xenopus laevis | 非洲爪蟾 | African clawed frog | CCR3 |
| JN948961 | Mus musculus | 小家鼠 | mouse | CCR3 |
| NM_053958 | Rattus norvegicus | 褐家鼠 | rat | CCR3 |
| U28694 | Homo sapiens | 人 | human | CCR3 |
| 注: CCR3l代表CCR3 like | ||||
从健康香鱼尾静脉抽取血液后, 取肝、脾、体肾、脑、心、鳃、肌肉、肠、皮肤和头肾10个组织, 立即液氮速冻后转至–70 ℃超低温冰箱保存。鳗弧菌腹腔注射香鱼的操作步骤参考杨智景等(2015)的方法, 将健康香鱼分为感染组和对照组, 感染组每尾香鱼腹腔注射100 μL (1.0×105 CFU)的鳗弧菌悬液, 对照组每尾香鱼按照同样方式注射100 μL的无菌PBS。注射后两组香鱼分别于4、8、12和24 h时取肝、脾和头肾等组织, 取样及保存方法同健康香鱼。
1.4 香鱼头肾来源的MO/MФ分离及体外培养用75%乙醇消毒香鱼体表, 在无菌条件下迅速取头肾, 放于装有RPMI1640培养基的培养皿中, 然后转到筛网中, 边研磨边加入RPMI1640培养基以获得单细胞悬液, 将细胞悬液轻加于Ficoll-Paque液上方后离心(2 000 r/min, 25 min), 吸取含MO/MФ的白膜层, 用含2% FBS的RPMI1640培养基离心洗涤2次, 最后将细胞沉淀重悬于含2% FBS的RPMI1640培养基中。取适量细胞悬液用血球计数板计数后, 制备成107 cells/mL细胞悬液, 均匀铺在直径为35 mm的培养皿中, 过夜培养(24 ℃, 5% CO2)后, 吸走非贴壁细胞后加入新鲜培养基(含10% FBS)后继续培养。取适量细胞用瑞氏-吉姆萨染色液染色后光镜下观察, 确定95%以上的细胞是MO/MФ后再进行后续实验。
1.5 鳗弧菌感染的香鱼MO/MФ样品制备鳗弧菌过夜培养后用无菌PBS洗涤数次后制备成细菌悬液, 按照感染复数(multiplicity of infection, MOI)=10的比例感染香鱼MO/MФ, 于4、8、12和24 h时, 用PBS洗涤3次, 吸净PBS, 加入适量RIPA裂解液(PMSF 1 mmol/L), 用枪吹打数下, 待细胞充分裂解后, 13 000 g离心3 min, 取上清保存于–70 ℃超低温冰箱备用。
1.6 qRT-PCR检测组织及MO/MФ总RNA的抽提、第一链cDNA的合成及qRT-PCR检测参考以往的方法进行(Ren et al, 2019)。根据PaCCR3基因cDNA序列设计检测引物, PaCCR3test (-): 5′-ACGATTGT TCCGAAGCTTT GG-3′和PaCCR3 test (+): 5′-GCGTTTGGACATCAGC TTGA -3′, 预期扩增大小140 bp; 选择香鱼18S rRNA (Pa18S rRNA)基因作为内参, 根据其cDNA序列(FN646593)设计引物Pa18S rRNA (+): 5′-GAATGTCTGCCCTATCAACT-3′和Pa18S rRNA (-): 5′-GATGTGGTAGCCGTTTCT-3′, 预期扩增大小为103 bp。qRT-PCR扩增反应在ABI StepOne荧光定量PCR仪(美国ABI公司)上进行, 每个样品重复3次。采用仪器自带程序读取每个样品目的基因和内参基因的循环阈值(cycle threshold, Ct)。根据2–ΔΔCt法计算PaCCR3基因mRNA的相对表达量(Livak et al, 2001)。
1.7 PaCCR3 N端胞外段多克隆抗体制备及检测将PaCCR3 N端胞外段43个氨基酸(MDTDEDYDLFLELFNESSNDSTYVTNELVTLCVKADVNKFGAT)合成多肽, 并偶联钥孔血蓝蛋白(keyhole limpet hemocyanin, KLH), 用于免疫新西兰大白兔。经过3次加强免疫后收集兔抗血清, Western blot检测特异性。
1.8 Western blot检测采用BCA蛋白浓度测定试剂盒对香鱼MO/MФ裂解液进行蛋白定量, 采用Western blot检测鳗弧菌感染下香鱼MO/MФ中PaCCR3的表达变化。香鱼MO/MФ总蛋白经SDS-PAGE分离后, 湿转至PVDF膜上。5%脱脂奶粉在37 ℃封闭2 h, 加入兔源PaCCR3抗血清(1:500), 37 ℃孵育2 h, PBS-T洗涤数次后加入HRP-IgG (1:5000)在37 ℃孵育1 h, PBS-T洗涤数次。香鱼MO/MФ中PaGAPDH的表达检测用兔源anti-GAPDH为一抗, 稀释倍数为1:2000。采用超敏ECL化学发光试剂盒进行显色, 暗室内进行压片、显影和定影。胶片扫描后采用Gel-Pro analyzer 4凝胶定量分析软件进行灰度值分析。
2 结果 2.1 PaCCR3基因cDNA序列分析PaCCR3基因cDNA全长1 624 bp (GenBank登录号: MZ028605), 包括一个长度为1 071 bp的完整开放阅读框, 编码356个氨基酸, 预测蛋白分子量大小为41.28 kDa, 等电点为8.37。
SMART和TMHMM软件分析结果表明, PaCCR3为7次跨膜受体(TM1-TM7), 由位于细胞膜外的N末端(N-terminus)和3个膜外环以及位于胞内的C末端(C-terminus)和3个膜内环组成(图 1)。ScanProsite软件预测结果表明, PaCCR3具有G蛋白耦联受体(G-protein coupled receptors, GPCRs)家族1的特征基序——SSILFLTLMTFDRYLAV, 并且膜外环上包含有2个高度保守的半胱氨酸残基, 可通过形成一个二硫键(Cys113-Cys191)稳定受体的空间结构(图 1)。因此, PaCCR3属于GPCRs家族成员。
 |
| 图 1 香鱼与部分鱼类CCR3氨基酸序列的多重比对 Fig. 1 Multiple alignment of CCR3 amino acid sequences of ayu and other fish 注: TM1—TM7: 7个跨膜结构域, “▼”: 胞外环上2个保守的半胱氨酸残基。相似度 > 60%, 灰色阴影: 部分相同的氨基酸, 黑色阴影: 完全相同的氨基酸。Pa: 香鱼(Plecoglossus altivelis); Om: 胡瓜鱼(Osmerus mordax); Oy: 虹鳟(Oncorhynchus mykiss); Ss: 大西洋鲑(Salmo salar); Lc: 大黄鱼(Larimichthys crocea); Mm: 鮸鱼(Miichthys miiuy) |
多序列分析显示, PaCCR3与其他鱼类CCR3氨基酸序列同源性为34.5%—84.6%, 与胡瓜鱼(Osmerus mordax) CCR3有最高的同源性。根据哺乳类、两栖类和鱼类CCR3的氨基酸全序列构建了系统进化树, 结果显示, 哺乳类、两栖类和鱼类CCR3各自成簇, 鱼类CCR3形成一个大簇, 香鱼与胡瓜鱼的CCR3独立成簇, 且与胡瓜鱼CCR3的进化相关性最高(图 2)。
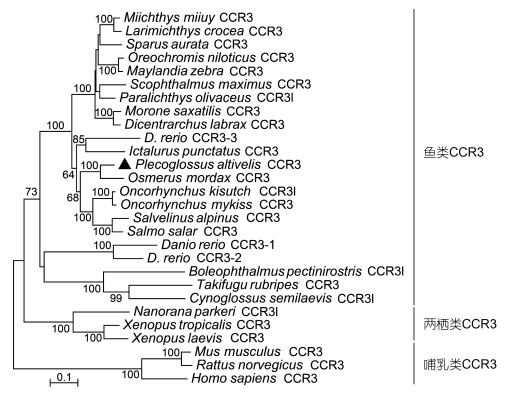 |
| 图 2 基于香鱼和其他动物CCR3全长氨基酸序列构建的系统进化树(邻接法) Fig. 2 Phylogenetic tree of the full-length amino acid sequences of ayu and other animals CCR3 using neighbor-joining method 注: 分枝上的数值表示用bootstrap (1000次)做置信检测得到的置信度百分比, 低于60%的数值不显示; 标尺长度表示每个位点发生0.1次置换 |
采用qRT-PCR检测健康香鱼的肝、体肾、头肾、脾、脑、心、鳃、肠、肌肉、皮肤及MO/MФ中PaCCR3基因mRNA的表达分布, 结果表明, 其在MO/MФ中的表达丰度最高, 其次是体肾(图 3a)。香鱼进行实验处理后, 对照组香鱼无明显异常, 处理组香鱼出现典型的弧菌病发病特征, 并能从腹腔液及主要脏器中分离培养出鳗弧菌。鳗弧菌感染后, 与对照组相比, 肝、脾和头肾中PaCCR3基因mRNA的表达量显著增加, 分别为对照组的6.74、30.81和14.30倍(P < 0.05); 此后, 3个组织中PaCCR3基因mRNA的表达量均开始下降, 头肾中PaCCR3基因mRNA表达量直到24 h时仍显著高于对照组(P < 0.05), 脾中PaCCR3基因mRNA表达量在12 h时与对照组无明显差异, 肝中PaCCR3基因mRNA表达量在8 h时已与对照组无明显差异(图 3b, 3c, 3d)。
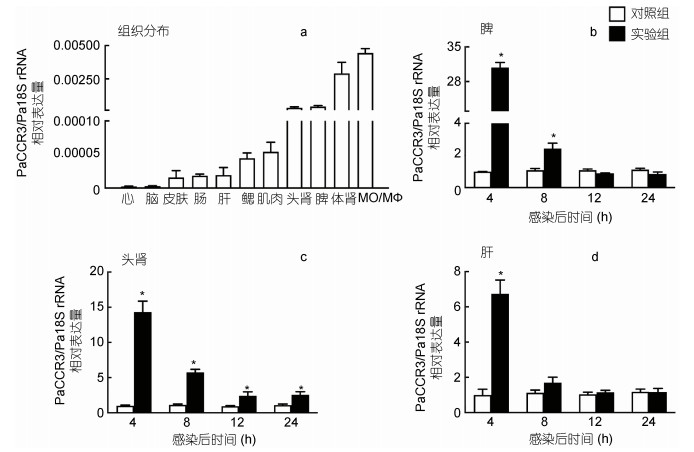 |
| 图 3 鳗弧菌感染后香鱼免疫组织中PaCCR3基因mRNA的表达变化 Fig. 3 Changes of the expression of PaCCR3 mRNA in the immune tissues of ayu infected with V. anguillarum 注: a. PaCCR3基因mRNA在健康香鱼不同组织中的表达; b—d. PaCCR3基因mRNA在鳗弧菌感染香鱼免疫组织中的表达。以Pa18S rRNA基因作为内参, *: 处理组PaCCR3基因的表达与对照组相比差异显著(P < 0.05) (n=4) |
Western blot分析显示, 所制备的PaCCR3抗血清能与香鱼MO/MФ上的PaCCR3杂交, 目的条带大小约为42 kDa与预测的PaCCR3蛋白分子量大小(41.28 kDa)基本一致, 且特异性较好(图 4)。因此, 该抗体可用于后续检测在鳗弧菌感染下香鱼MO/MФ上PaCCR3的表达变化。
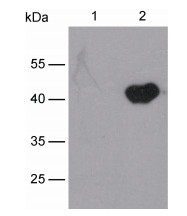 |
| 图 4 Western blot检测PaCCR3抗血清的特异性 Fig. 4 The Western blot detection on the specificity of PaCCR3 antibody 注: 1. 空白对照; 2. 香鱼MO/MФ总蛋白 |
qRT-PCR结果表明, 香鱼MO/MФ经鳗弧菌体外处理后, PaCCR3基因mRNA的表达量在4 h时开始增加, 在12 h和24 h时增加显著, 分别为对照组的2.01倍和2.42倍(P < 0.05) (图 5)。
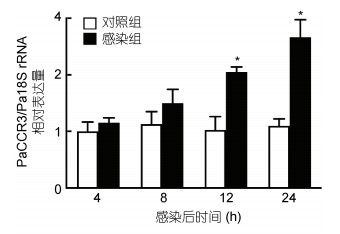 |
| 图 5 鳗弧菌处理前后香鱼MO/MФ中PaCCR3基因mRNA的表达变化 Fig. 5 Changes of the expression of PaCCR3 mRNA in ayu MO/MФ upon V. anguillarum challenge 注: 以Pa18S rRNA基因作为内参, *: 处理组PaCCR3基因的表达与对照组比较差异显著(P < 0.05) (n=4) |
在确认制备的兔源PaCCR3抗血清特异性后, 采用Western blot检测了香鱼MO/MФ中PaCCR3蛋白在鳗弧菌刺激下的表达变化。结果显示, 香鱼MO/MФ中PaCCR3的表达在鳗弧菌刺激下被诱导, 与其mRNA表达的变化趋势相似, 在4 h时略微增加, 在12 h和24 h时增加显著, 分别为对照组的2.15和2.09倍(P < 0.05) (图 6)。
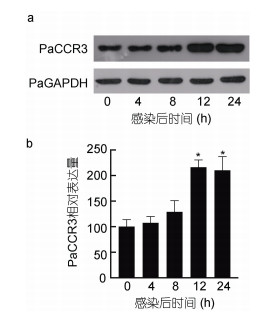 |
| 图 6 鳗弧菌刺激前后香鱼MO/MФ上PaCCR3蛋白的表达变化 Fig. 6 The changes of the expressions of PaCCR3 protein in ayu MO/MФ after V. anguillarum stimulation 注: a. 不同感染时间香鱼MO/MФ上PaCCR3和PaGAPDH的蛋白条带; b. PaCCR3蛋白的相对表达表达量。*: 与对照组相比差异显著(P < 0.05) (n=3) |
CCR3是CC型趋化因子的受体, 属于GPCRs家族成员, 与过敏等多种炎性疾病密切相关。本文从香鱼MO/MФ转录组测序数据中获得PaCCR3基因cDNA序列。序列分析揭示, PaCCR3氨基酸序列与其他鱼类CCR3具有GPCR的典型特征, 均具有7次跨膜结构。PaCCR3与胡瓜鱼CCR3氨基酸序列同源性最高, 为84.6%。系统进化树分析表明, 鱼类CCR3独立成簇, 香鱼与胡瓜鱼CCR3进化相关性最高。
表达特征分析表明, PaCCR3基因在健康香鱼被检组织中广泛表达, 且在体肾、脾和头肾的表达量较为丰富, 这与已报道的斑马鱼CCR3-1和CCR3-2基因及大菱鲆CCR3基因mRNA表达较为一致(Liu et al, 2009; 孟艳青等, 2013), 但与斑马鱼CCR3-3及鮸鱼CCR3基因的表达分布有较大差异。鮸鱼CCR3基因在鳃和心中表达量较为丰富(Zhu et al, 2013), 斑马鱼CCR3-3基因在脾、脑、体肾、肝、鳃和肠组织中均未检测到(Liu et al, 2009)。由于Liu等在测定斑马鱼CCR3-1、CCR3-2和CCR3-3基因在脾、脑、肾、肝、鳃和肠6个组织中的表达时采用了半定量RT-PCR技术, 我们推测可能由于该技术检测灵敏度有限, 导致未能在斑马鱼上述6个组织中检测到CCR3-3基因的表达。CCR3基因在硬骨鱼类中呈现不同的表达谱, 揭示其可能在不同组织中参与不同的生物学过程。
目前, 已有的文献揭示, 鱼类CCR3基因响应于病原体感染或免疫刺激而被诱导表达(孟艳青等, 2013; Zhu et al, 2013)。大菱鲆在注射LPS后(6—96 h), 其肝、脾、头肾和血液中CCR3基因mRNA的表达基本呈上调趋势, 分别在6、24、24和24 h时达到峰值(孟艳青等, 2013); 
尽管CCR3选择性地在人嗜酸性粒细胞上表达, 但它在包括MO和MФ在内的其他免疫细胞上也有分布(Kitaura et al, 1996; Ghorpade et al, 1998; Rubbert et al, 1998)。头肾是硬骨鱼类特有的、重要的造血组织和免疫器官, 其中含有丰富的MO和MФ, 在鱼类的天然免疫中发挥着重要作用(Geven et al, 2017)。因此, 我们从香鱼头肾中分离了MO/MФ, 首先测定了PaCCR3基因mRNA在未刺激的MO/MФ上的分布情况, 结果发现, 该基因在MO/MФ上表达量非常丰富, 高于它在体肾、脾和头肾3个组织中的表达。进一步分析发现, 鳗弧菌刺激不仅诱导了PaCCR3基因mRNA的表达, 也诱导了其蛋白的表达, 二者变化趋势相似。我们的研究揭示, CCR3在鱼类MO/MФ上表达丰富, 可能参与调控MO/MФ的趋化及其他功能活性。
4 结论本研究鉴定了香鱼CCR3基因cDNA序列, 序列分析揭示其氨基酸序列与胡瓜鱼CCR3最相似。健康香鱼中, PaCCR3基因mRNA在MO/MФ中表达量最高, 高于体肾、脾和头肾等组织; 鳗弧菌感染香鱼后, 其在肝、脾和头肾中的表达被诱导。头肾来源的MO/MФ经鳗弧菌体外刺激后PaCCR3基因mRNA及蛋白表达量均显著增加。研究结果首次揭示了香鱼CCR3基因mRNA及蛋白的表达响应于鳗弧菌侵染, 它可能通过介导MO/MФ的功能活性参与免疫应答, 为深入探究鱼类CCR3的功能及作用机制提供了新的切入点。
李长红, 陈炯, 史雨红, 等. 2009. 宁海地区香鱼弧菌病病原菌鉴定. 微生物学报, 49(7): 931-937 DOI:10.3321/j.issn:0001-6209.2009.07.014 |
杨智景, 李长红, 张浩, 等. 2015. 香鱼(Plecoglossus altivelis)肿瘤坏死因子-α(TNF-α)基因的分子克隆、鉴定及免疫相关性表达. 海洋与湖沼, 46(6): 1380-1389 |
孟艳青, 刘晓飞, 刘洋, 等. 2013. 大菱鲆趋化因子受体CCR3和CCR9基因的克隆及组织表达. 中国水产科学, 20(5): 918-930 |
Dixon B, Luque A, Abós B et al, 2013. Molecular characterization of three novel chemokine receptors in rainbow trout (Oncorhynchus mykiss). Fish & Shellfish Immunology, 34(2): 641-651 |
Forssmann U, Uguccioni M, Loetscher P et al, 1997. Eotaxin-2, a novel CC chemokine that is selective for the chemokine receptor CCR3, and acts like eotaxin on human eosinophil and basophil leukocytes. Journal of Experimental Medicine, 185(12): 2171-2176 DOI:10.1084/jem.185.12.2171 |
Geven E J W, Klaren P H M, 2017. The teleost head kidney: Integrating thyroid and immune signalling. Developmental & Comparative Immunology, 66: 73-83 |
Ghorpade A, Xia M Q, Hyman B T et al, 1998. Role of the β-chemokine receptors CCR3 and CCR5 in human immunodeficiency virus type 1 infection of monocytes and microglia. Journal of Virology, 72(4): 3351-3361 DOI:10.1128/JVI.72.4.3351-3361.1998 |
Grozdanovic M, Laffey K G, Abdelkarim H et al, 2019. Novel peptide nanoparticle-biased antagonist of CCR3 blocks eosinophil recruitment and airway hyperresponsiveness. Journal of Allergy and Clinical Immunology, 143(2): 669-680 DOI:10.1016/j.jaci.2018.05.003 |
He J L, Chen Y Z, Farzan M et al, 1997. CCR3 and CCR5 are co-receptors for HIV-1 infection of microglia. Nature, 385(6617): 645-649 DOI:10.1038/385645a0 |
Kitaura M, Nakajima T, Imai T et al, 1996. Molecular cloning of human eotaxin, an eosinophil-selective CC chemokine, and identification of a specific eosinophil eotaxin receptor, CC chemokine receptor 3. Journal of Biological Chemistry, 271(13): 7725-7730 DOI:10.1074/jbc.271.13.7725 |
Kitaura M, Suzuki N, Imai T et al, 1999. Molecular cloning of a novel human CC chemokine (eotaxin-3) that is a functional ligand of CC chemokine receptor 3. Journal of Biological Chemistry, 274(39): 27975-27980 DOI:10.1074/jbc.274.39.27975 |
Liu Y, Chang M X, Wu S G et al, 2009. Characterization of C-C chemokine receptor subfamily in teleost fish. Molecular Immunology, 46(3): 498-504 DOI:10.1016/j.molimm.2008.10.003 |
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt Method. Methods, 25(4): 402-408 DOI:10.1006/meth.2001.1262 |
Lu X J, Hang X Y, Yin L et al, 2013. Sequencing of the first ayu (Plecoglossus altivelis) macrophage transcriptome and microarray development for investigation the effect of LECT2 on macrophages. Fish & Shellfish Immunology, 34(2): 497-504 |
Palomino D C T, Marti L C, 2015. Chemokines and immunity. Einstein (São Paulo), 13(3): 469-473 DOI:10.1590/S1679-45082015RB3438 |
Ren Y, Liu S F, Nie L et al, 2019. Involvement of ayu NOD2 in NF-κB and MAPK signaling pathways: insights into functional conservation of NOD2 in antibacterial innate immunity. Zoological Research, 40(2): 77-88 DOI:10.24272/j.issn.2095-8137.2018.066 |
Rubbert A, Combadière C, Ostrowski M et al, 1998. Dendritic cells express multiple chemokine receptors used as coreceptors for HIV entry. The Journal of Immunology, 160(8): 3933-3941 |
Tamura K, Stecher G, Peterson D et al, 2013. MEGA6:Molecular evolutionary genetics analysis version 6.0. Molecular Biology and Evolution, 30(12): 2725-2729 DOI:10.1093/molbev/mst197 |
Uguccioni M, Mackay C R, Ochensberger B et al, 1997. High expression of the chemokine receptor CCR3 in human blood basophils. Role in activation by eotaxin, MCP-4, and other chemokines. The Journal of Clinical Investigation, 100(5): 1137-1143 DOI:10.1172/JCI119624 |
Wang M Q, Ge B S, Li R M et al, 2013. Milligram production and biological activity characterization of the human chemokine receptor CCR3. PLoS One, 8(6): e65500 DOI:10.1371/journal.pone.0065500 |
Zhu X H, Liao B, Xu Y et al, 2017. Downregulation of mouse CCR3 by lentiviral shRNA inhibits proliferation and induces apoptosis of mouse eosinophils. Molecular Medicine Reports, 15(2): 696-702 DOI:10.3892/mmr.2016.6085 |
Zhu Z H, Wang R X, Ren L P et al, 2013. Characterization of the CCR3 and CCR9 genes in miiuy croaker and different selection pressures imposed on different domains between mammals and teleosts. Developmental & Comparative Immunology, 41(4): 631-643 |
 2021, Vol. 52
2021, Vol. 52


