
中国海洋湖沼学会主办。
文章信息
- 杨磊, 胡伟华, 俞燕洁, 陈睿毅, 徐冬冬. 2021.
- YANG Lei, HU Wei-Hua, YU Yan-Jie, CHEN Rui-Yi, XU Dong-Dong. 2021.
- 白消安及其与高温联合处理对黄姑鱼(Nibea albiflora)性腺发育的影响
- EFFECTS OF BUSULFAN AND ITS COMBINED TREATMENT WITH HIGH TEMPERATURE ON GONADAL DEVELOPMENT OF YELLOW DRUM (NIBEA ALBIFLORA)
- 海洋与湖沼, 52(6): 1465-1473
- Oceanologia et Limnologia Sinica, 52(6): 1465-1473.
- http://dx.doi.org/10.11693/hyhz20210400104
文章历史
-
收稿日期:2021-04-25
收修改稿日期:2021-07-13
2. 浙江省海洋水产研究所 舟山 316021;
3. 浙江省海水增养殖重点实验室 舟山 316021
2. Marine Fisheries Research Institute of Zhejiang, Zhoushan 316021, China;
3. Key Laboratory of Mariculture and Enhancement of Zhejiang Province, Zhoushan 316021, China
鱼类生殖细胞移植是将供体(donor)的生殖细胞移植到同种或异种受体(recipient)中, 利用受体生产供体的配子, 繁育供体的后代, 也被形象地称为“借腹生子”或代孕亲鱼(surrogate broodstock)技术, 该技术在缩短鱼类的性成熟周期、性控育种、濒危物种保护和基因资源保存等方面具有巨大的应用前景(Yoshizaki et al, 2018)。因此, 鱼类生殖细胞移植研究受到学者的高度重视。一般而言, 生殖细胞移植主要包括: (1) 供体细胞的制备, (2) 受体的选择与制备, (3) 供体细胞注射到受体体内培育至性成熟。经过十多年的发展, 鱼类生殖细胞移植取得了一系列的进展: (1) 先后利用胚胎、仔鱼和成鱼作为受体, 建立了生殖细胞移植技术(Ciruna et al, 2002; Takeuchi et al, 2003, 2004; Okutsu et al, 2006); (2) 发现了鱼类性腺的精原或卵原干细胞, 从而拓宽了供体移植细胞的来源(Takeuchi et al, 2003); (3) 研发了多种方法制备受体, 其制备方法逐步完善。目前在多种海淡水鱼类中开展了生殖细胞移植的研究, 但成熟的移植体系报道较少, 究其原因, 主要受限于移植受体的制备。
在生殖细胞移植中, 由于受体自身的生殖细胞与供体的生殖细胞存在着竞争关系, 制备不育受体成为生殖细胞移植的关键。目前, 研究学者通过三倍体诱导(Yoshikawa et al, 2017)、人工杂交(Xu et al, 2019; Kawamura et al, 2020)、高温-化学药物处理(de Siqueira-Silva et al, 2015; Majhi et al, 2017)以及基因敲除或敲降(Yoshizaki et al, 2016; Yoshikawa et al, 2020)等方法制备不育受体。其中, 以白消安或白消安和高温联合处理的方法, 能够使鱼类的生殖细胞凋亡。该方法简便易行, 是制备不育受体的可行性途径。在罗非鱼(Oreochromis niloticus)、银汉鱼(Odontesthes hatcheri)、斑马鱼(Danio rerio)等鱼类中, 已经证实白消安或白消安-高温处理的方法能够消除其生殖细胞, 制备生殖细胞移植的不育受体(Majhi et al, 2009a; Lacerda et al, 2010; Nóbrega et al, 2010)。虽然白消安处理可以使生殖细胞凋亡, 但不同种类的处理浓度、方式及时间区别很大, 诱导效果也有较大差异(de Siqueira-Silva et al, 2015)。因此, 对于不同的鱼种, 有必要通过优化处理时间、温度和白消安的剂量等, 研制高温-联合化学药物的处理方法制备生殖细胞移植的受体。
石首鱼科(Sciaenidae)鱼类种类繁多, 包括许多重要的经济鱼类如大黄鱼(Larimichthys crocea)、小黄鱼(L. polyactis), 还有体型较大的经济鱼类, 如日本白姑鱼(Argyrosomus japonicus)、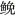
本试验于2019年10—11月在浙江省海洋水产研究所试验基地(西轩渔业科技岛, 舟山)实施。实验鱼选取150日龄(dph, day post hatching)黄姑鱼[全长: (16.13±0.95) cm; 体重: (45.77±8.79) g], 在实验开始前先逐步升温使各桶到达预定温度。
1.2 实验方法将实验鱼随机挑选到10个玻璃缸桶中(500 L, n=50尾/桶), 分成5组, 每组两个平行: 对照组(Con组), 白消安处理组1 (注射浓度: 10 mg/kg, Bu10组), 白消安-高温处理组1 (注射浓度: 10 mg/kg; 处理温度: 30 ℃, Bu10H组), 白消安处理组2 (注射浓度: 40 mg/kg, Bu40组), 白消安-高温处理组2 (注射浓度: 40 mg/kg; 处理温度: 30 ℃, Bu40H组)。温度处理组用温控仪控制水温, 实验开始前以2 ℃/d的幅度升温至30 ℃并稳定一周, 实验期间每日上午和下午投喂商品饲料各一次, 吸底换水一次, 记录每日死亡数并将死鱼捞出。
实验开始前测量实验鱼的全长、体长和体重。在实验开始第1天、第14天分别按照剂量腹腔注射白消安, 对照组注射生理盐水, 在第1天、第14天、第28天、第38天和第48天测量生长参数并称量性腺重量, 取样采用4%多聚甲醛(PFA)固定用于组织切片和原位杂交, RNA样品保存于RNA保护液于4 ℃过夜后置于–80 ℃冰箱保存。
1.3 组织切片学观察性腺组织取样后以PFA固定, 24 h后逐步更换30%、50%、75%、90%、100%的甲醇, 最终浸泡在100%甲醇中置于–20 ℃冰箱保存备用。将样品取出经透明浸蜡后包埋于石蜡中, 以5 μm厚度切片, 用苏木精-伊红染色, 最后用光学显微镜观察, 拍照。
1.4 基因表达分析性腺组织按照总RNA提取试剂盒(Solarbio, 总RNA提取试剂盒)操作方法提取总RNA, 用反转录试剂盒将RNA反转录成cDNA, 以β-actin为内参基因, 基因序列如表 1所示, 按照TB GreenTM Premix Ex TaqTM试剂盒说明书要求进行荧光定量PCR实验。最后用Spss19.0软件分析各基因表达差异性。
| 基因 | 引物序列(5′—3′) |
| dmrt 1 | F- AAACCACGGCTATGTCTCAC R- CGTCCTTCCATAGAGTACAAACAG |
| cyp19a | F- TACCTGTGAACGAGAAAGAGC R- TCTTGTGCCTCTGGTGAATC |
| vasa | F- GTGTGCGAAAACGGCTTTAG R- CCATCGCTTCCATCCTTATTTTC |
| β-actin | F- CCTCCCTGGAGAAGAGCTATGAG R- CGCACTTCATGATGCTGTTGTAG |
将固定在PFA中的样品取出, 经透明、浸蜡后包埋于石蜡中。随后以二甲苯脱蜡, 用梯度酒精水化后依次添加PBST、蛋白酶K、TEA、PBST、PFA、PBST, 再用HYB杂交液预杂交, 随后在HYB杂交液中加入探针(探针序列如表 2所示), 60 ℃杂交过夜。杂交过夜后用梯度SSC洗脱探针, blocking buffer室温封闭后加入抗体Fab-AP孵育过夜。孵育过夜后用MABT、PBST、AP buffer洗脱并用NBT/BCIP避光显色, 显色后用PBST终止反应, PFA固定后中性红复染。复染后用梯度酒精和二甲苯洗脱染料并封片观察。
| 基因 | 引物序列(5′—3′) |
| dmrt 1 | F- ATTTAGGTGACACTATAGAAGAGAAACCACGGCTATGTCTCAC R- TAATACGACTCACTATAGGGAGACGTCCTTCCATAGAGTACAAACAG |
| cyp19a | F- ATTTAGGTGACACTATAGAAGAGCCTGTCTGACGACATCAT R- TAATACGACTCACTATAGGGAGAAGAGTCTCTCAGAGTGTTTG |
| vasa | F- ATTTAGGTGACACTATAGAAGAGGTGTGCGAAAACGGCTTTAG R- TAATACGACTCACTATAGGGAGACCATCGCTTCCATCCTTATTTTC |
性腺成熟指数GSI按照公式GSI=W(性腺重)/W(体重)Í100%计算, 并进行反正弦平方根转换后比较; 用单因素方差分析及多重比较分析各组体重、性腺重的差异性(P < 0.05)。
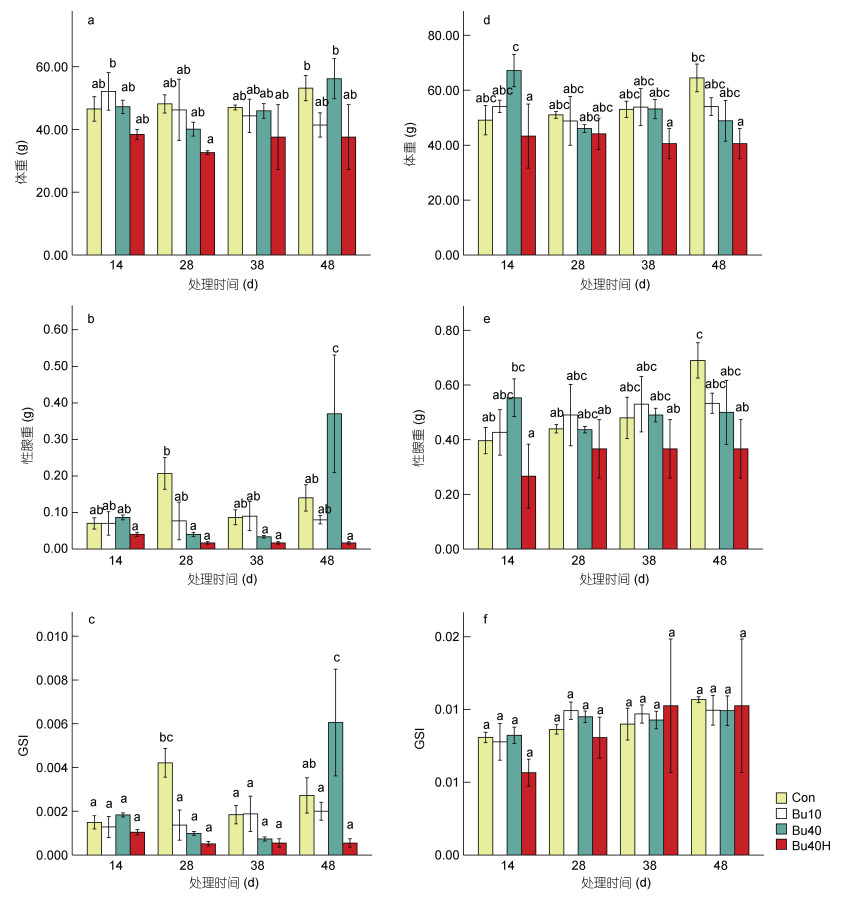
2 结果 2.1 生长指标和性腺成熟指数GSI实验期间, 各处理组(Bu10组, Bu40组及Bu40H组)雄鱼的体重较对照组相比无显著性差异(P > 0.05, 图 1a), 而处理组(Bu40组及Bu40H组)雄鱼的性腺重和GSI在处理第28天时较对照组显著下降(P < 0.05), Bu10组雄鱼的性腺重和GSI也低于对照组, 但差异不显著(P > 0.05, 图 1b, 1c); 在处理第18天、第38天、第48天时处理组(Bu10组, Bu40组及Bu40H组)雄鱼的性腺重和GSI与对照组相比无显著性差异(P > 0.05, 图 1b, 1c)。各处理组(Bu10组, Bu40组及Bu40H组)雌鱼的体重、性腺重和GSI与对照组相比没有显著性差异(P > 0.05, 图 1d, 1e, 1f)。Con组、Bu10组、Bu40组在实验期间无死亡现象, 而白消安-高温处理组Bu10H组和Bu40H组出现不同程度死亡, 存活率分别为11.4%±0.3%、41.8%±13.0% (图 2)。
 |
| 图 1 白消安及其与高温联合处理对黄姑鱼生长、性腺重及GSI的影响 Fig. 1 Effects of busulfan and its combined treatment with high temperature on the growth, gonad weight and GSI of yellow drum 注: a. 雄鱼体重; b. 雄鱼性腺重; c. 雄鱼GSI; d. 雌鱼体重; e. 雌鱼性腺重; f. 雌鱼GSI |
 |
| 图 2 不同处理组黄姑鱼的存活率比较 Fig. 2 Survival rate of yellow drum in different treatment groups |
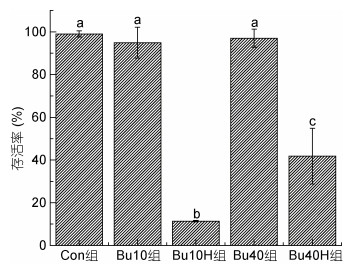
组织学观察发现处理组(Bu10组, Bu40组及Bu40H组)雄鱼性腺内的生殖细胞出现不同程度的凋亡(图 3)。在处理第14天、第28天时, 对照组雄鱼的精巢内充满精子(图 3a, 3e); 相比之下, Bu10组、Bu40和Bu40H组雄鱼的精小叶内均出现空腔(图 3b, 3f)。Bu40和Bu40H组雄鱼的精小叶内的空腔面积较大, 只剩下少量精原细胞(图 3c, 3d, 3g, 3h)。
 |
| 图 3 不同处理组雄鱼性腺的组织学观察 Fig. 3 Histological observation of gonadal gland of male fish in different treatment groups 注: a—d为各组第14天时的精巢, e—f为各组第28天的精巢; a & e. Con组; b & f. Bu10组; c & g. Bu40组; d & h. Bu40H组; 比例尺为20 μm |
不同的是, 处理组雌鱼在白消安及其与高温联合处理后并未发生生殖细胞凋亡现象(图 4)。在处理第14天、第28天时, 对照组雌鱼卵巢内存在大量卵母细胞(图 4a, 4e); 而Bu10组、Bu40组及Bu40H组雌鱼卵巢内同样存在大量卵母细胞, 卵母细胞完整, 并未出现空腔(图 4)。
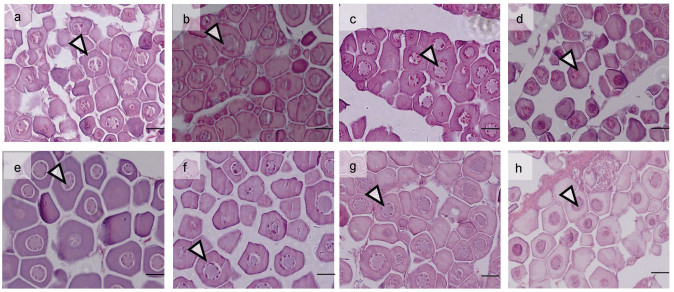 |
| 图 4 不同处理组雌鱼性腺组织学观察 Fig. 4 Histological observation of gonadal gland of female fish in different treatment groups 注: a—d为各组第14天时的卵巢, e—f为各组第28天的卵巢; a & e. Con组; b & f. Bu10组; c & g. Bu40组; d & h. Bu40H组; 比例尺为20 μm |
荧光定量PCR分析发现白消安及其与高温联合处理后, 处理组雄鱼精巢内vasa基因表达量下降, 而雌鱼卵巢内vasa基因表达量未受影响(图 5a, 5c)。Bu40组及Bu40H组雄鱼精巢内vasa基因表达量在处理第14天时与对照组相比显著下降(P < 0.05, 图 5a), 并在处理第28天、第38天、第48天仍处于显著下降状态(P < 0.05, 图 5a); Bu10组雄鱼精巢内vasa基因表达量在处理第14天时与对照组相比显著上升(P < 0.05, 图 5a), 但在处理第28天时显著下降, 且处理第38天、第48天仍处于显著下降状态(P < 0.05, 图 5a)。不同的是, 处理第14天至第48天间, 处理组(Bu10组, Bu40组及Bu40H组)雌鱼卵巢内vasa基因表达未出现显著下降现象(图 5c)。
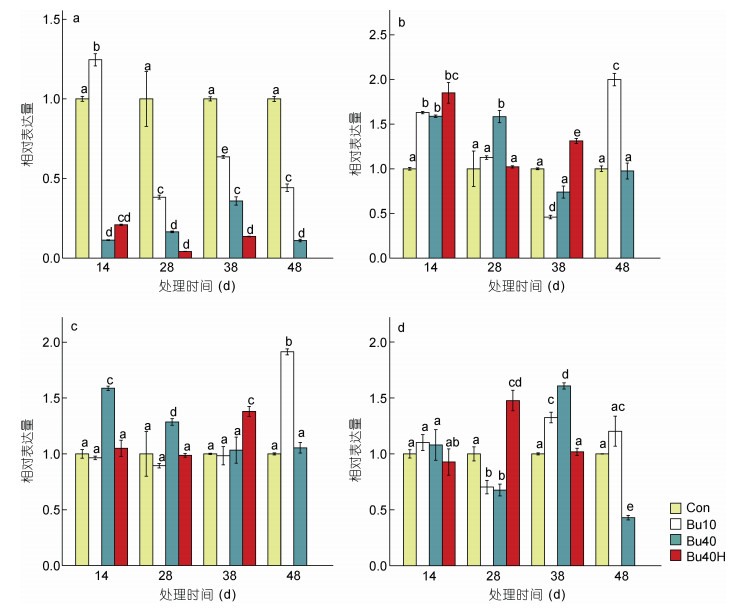 |
| 图 5 白消安及其与高温联合处理对黄姑鱼的vasa、dmrt1和cyp19a基因表达的影响 Fig. 5 Effects of busulfan and its combined treatment with high temperature on gene expression of yellow drum 注: a. 雄鱼vasa基因表达量; b. 雄鱼dmrt1基因表达量; c. 雌鱼vasa基因表达量; d. 雌鱼cyp19a基因表达量 |
处理后雄鱼精巢内dmrt1基因及雌鱼卵巢内cyp19a基因的表达量并未下降(图 5b, 5d)。在处理第14天时, 处理组(Bu10组, Bu40组及Bu40H组)雄鱼精巢内dmrt1基因表达量与对照组相比均显著上升(P < 0.05, 图 5b); 在处理28天时, Bu10组及Bu40H组雄鱼精巢内dmrt1基因表达量与对照组相比无显著差异(P > 0.05, 图 5b); 除Bu10组雄鱼精巢内dmrt1基因表达量在处理第38天有显著下降外(P < 0.05, 图 5b), 其余处理组(Bu40组及Bu40H组)在处理第38天、第48天精巢内dmrt1基因表达量均未显著下降(图 5b)。处理第14天时各处理组(Bu10组, Bu40组及Bu40H组)雌鱼卵巢内cyp19a基因表达量与对照组相比无显著差异(P > 0.05, 图 5d); Bu10组及Bu40组雌鱼在处理第28天cyp19a基因表达量显著下降(P < 0.05, 图 5d), 但在处理第38天恢复正常; 在处理第48天时Bu40组cyp19a基因表达量有显著下降(P < 0.05, 图 5d)。
2.4 原位杂交对处理14天时各组雌雄鱼性腺内的vasa基因进行原位杂交分析, 结果发现对照组雄鱼性腺内有强烈的vasa基因阳性信号(图 6a), 对照H.E染色图可知, 信号主要集中于生殖细胞(精母细胞)所在区域(图 6c); 而Bu40组雄鱼性腺内的vasa基因阳性信号较弱(图 6d), 组织切片发现此时精巢内基本没有生殖细胞(图 6f)。在雌鱼中, 对照组雌鱼性腺内有强烈的vasa基因阳性信号(图 7a), 组织切片发现信号主要集中于卵母细胞的胞质内(图 7c); 而Bu40组雌鱼性腺内也存在强烈的vasa基因阳性信号(图 7d), 集中于卵母细胞的胞质内(图 7f)。因此, 白消安处理后雄鱼vasa基因表达显著下降, 而雌鱼未受影响。
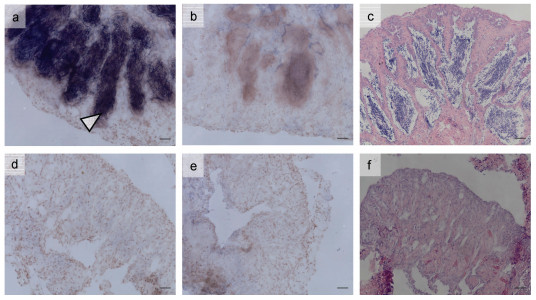 |
| 图 6 处理14 d时不同处理组雄鱼性腺vasa基因原位杂交图 Fig. 6 In situ hybridization of vasa gene in gonads of male fish in different treatment groups on the 14 th day 注: a—c为对照组第14天时的精巢, d—f为Bu40组第14天的精巢; a & d. vasa基因T7探针原位杂交图; b & e. vasa基因SP6探针原位杂交图; c & f. 性腺组织学切片图; 其中T7为反义探针, SP6为正义探针。原位杂交图中深色区域为阳性信号区域; 比例尺为20 μm |
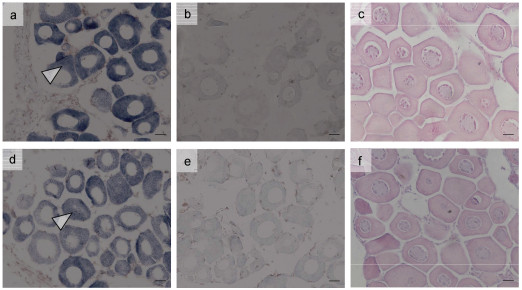 |
| 图 7 处理14 d时不同处理组雌鱼性腺vasa基因原位杂交图 Fig. 7 In situ hybridization of vasa gene in gonad of female fish in different treatment groups on the 14th day 注: a—c为对照组第14天时的卵巢, d—f为Bu40组第14天的卵巢; a & d. vasa基因T7探针原位杂交图; b & e. vasa基因SP6探针原位杂交图; c & f. 性腺组织学切片图; 其中T7为反义探针, SP6为正义探针。原位杂交图中深色区域为阳性信号区域; 比例尺为20 μm |
在鱼类生殖细胞移植中, 清除受体的内源性生殖细胞, 会显著提高移植效率(Nóbrega et al, 2009; Majhi et al, 2014)。在淡水和模式鱼类中, 已有研究证明白消安和高温处理会导致生殖细胞凋亡(Lacerda et al, 2006, 2010; Majhi et al, 2009a, b; Nóbrega et al, 2010), 然而针对海水鱼类的相关研究较少。本研究采用白消安和高温联合处理黄姑鱼, 我们观察到注射白消安后第14天各组的雄鱼性腺内均出现空腔, 其中Bu40组效果最佳, 基本消除了精子和精母细胞; 相比于白消安处理组, 高温-白消安联合处理组的效果并没有显著增强, 且出现较高的死亡率, 因此关于温度对黄姑鱼生殖细胞的影响还需要进一步研究。
本研究中, 白消安和温度处理仅对消除雄鱼生殖细胞有效, 对于雌鱼生殖细胞的消除并不理想, 因此白消安对雌雄黄姑鱼的影响表现出明显的性别差异。在鲤(Cyprinus carpio)中发现白消安处理后其雌雄鱼的生殖细胞均受到影响(Majhi et al, 2017), 而银汉鱼则是对雄鱼的消除效果要强于雌鱼(Majhi et al, 2009a), 这说明白消安对鱼类生殖细胞的影响可能因鱼种而异。高温对鱼类生殖细胞的影响也是值得注意的, 已有研究表明单独的高温处理(25 ℃)也能消除银汉鱼的生殖细胞(Majhi et al, 2009a)。在罗非鱼中还发现较低的温度(20 ℃)更易使雄鱼生殖细胞凋亡(de Alvarenga et al, 2009), 表明高温并不一定促进鱼类生殖细胞凋亡。本研究发现白消安-高温处理组与白消安处理组对生殖细胞的影响无明显差异, 并未表现出联合处理的累加效果。但是, 由于本研究仅设置了一个温度处理, 还需要进一步的试验来明确温度对黄姑鱼生殖细胞的影响。
性腺成熟指数GSI能反映鱼类性腺的饱满程度。在处理期间, 雄鱼的GSI有显著下降, 随后恢复正常, 雌鱼GSI并无明显变化, 这与组织学观察结果基本一致。vasa基因是生殖细胞的标记基因, 主要在鱼类的生殖细胞中表达(Boonanuntanasarn et al, 2016; Duangkaew et al, 2019)。本研究通过荧光定量PCR对黄姑鱼性腺vasa基因进行定量分析, 结果发现实验期间Bu10组、Bu40组、Bu40H组的雄鱼性腺内vasa基因表达较对照组均有显著下降且在处理结束后较长一段时间内仍处于下调状态, 而雌鱼性腺内vasa基因表达则无显著变化; 同样, vasa基因的原位杂交结果也表明vasa基因在处理组的雄鱼精巢内表达显著下降, 而在雌鱼卵巢内的表达并没有显著影响。在鲤鱼(Majhi et al, 2017)、银汉鱼(Majhi et al, 2009a)等鱼类上也发现白消安处理后实验鱼性腺内的vasa基因表达被抑制, 甚至在结束处理10周后仍被抑制。cyp19a和dmrt1分别是雌雄鱼的体细胞标记基因, 这两个基因的表达分析发现白消安和白消安-高温处理并没有显著影响其表达, 表明上述处理可能对性腺体细胞没有显著影响。
在高温和白消安的处理过程中, 鱼体受到的损伤也是非常值得关注。白消安具有毒性, 其安全剂量因物种而异, 过量的剂量可能会引起实验对象的死亡(Ogawa et al, 1999)。对小鼠的研究表明若是剂量过大会使小鼠中毒, 导致白消安无法有效清除其体内的生殖细胞(Brinster et al, 2003)。在鱼类中, 白消安的毒性存在性别差异性: 当以40 mg/kg剂量处理1龄银汉鱼时, 雌雄鱼内源性生殖细胞均凋亡, 雄鱼能正常存活而雌鱼皮肤出现溃疡并有较高的死亡率(Majhi et al, 2009a)。本研究中, 单独注射白消安并未造成黄姑鱼死亡, 因此推测实验的注射剂量是适宜的。但是, 高温-白消安联合处理组出现较高的死亡率, 这可能是由于二者联合作用导致鱼体机能受到影响, 容易造成病菌感染而引发死亡。
4 结论综上, 白消安处理能够消除黄姑鱼雄鱼精巢内的生殖细胞, 但对雌鱼生殖细胞的消除效果并不明显; 而且, 白消安处理并不会影响其体细胞。在实际应用中, 由于高温处理容易造成较高的死亡率, 因而不宜使用。通过上述实验的优化, 本研究认为采用40 mg/kg浓度两次间隔注射白消安能够制备不育黄姑鱼。
Boonanuntanasarn S, Bunlipatanon P, Ichida K et al, 2016. Characterization of a vasa homolog in the brown-marbled grouper (Epinephelus fuscoguttatus) and its expression in gonad and germ cells during larval development. Fish Physiology and Biochemistry, 42(6): 1621-1636 DOI:10.1007/s10695-016-0245-z |
Brinster C J, Ryu B Y, Avarbock M R et al, 2003. Restoration of fertility by germ cell transplantation requires effective recipient preparation. Biology of Reproduction, 69(2): 412-420 DOI:10.1095/biolreprod.103.016519 |
Ciruna B, Weidinger G, Knaut H et al, 2002. Production of maternal-zygotic mutant zebrafish by germ-line replacement. Proceedings of the National Academy of Sciences of the United States of America, 99(23): 14919-14924 DOI:10.1073/pnas.222459999 |
De Alvarenga É R, de França L R, 2009. Effects of different temperatures on testis structure and function, with emphasis on somatic cells, in sexually mature Nile tilapias (Oreochromis niloticus). Biology of Reproduction, 80(3): 537-544 DOI:10.1095/biolreprod.108.072827 |
De Siqueira-Silva D H, dos Santos Silva A P S, Ninhaus-Silveira A et al, 2015. The effects of temperature and busulfan (Myleran) on the yellowtail tetra Astyanax altiparanae (Pisces, Characiformes) spermatogenesis. Theriogenology, 84(6): 1033-1042 DOI:10.1016/j.theriogenology.2015.06.004 |
Duangkaew R, Jangprai A, Ichida K et al, 2019. Characterization and expression of a vasa homolog in the gonads and primordial germ cells of the striped catfish (Pangasianodon hypophthalmus). Theriogenology, 131: 61-71 DOI:10.1016/j.theriogenology.2019.01.022 |
Hamasaki M, Takeuchi Y, Miyaki K et al, 2013. Gonadal development and fertility of triploid grass puffer Takifugu niphobles induced by cold shock treatment. Marine Biotechnology, 15(2): 133-144 DOI:10.1007/s10126-012-9470-3 |
Kawamura W, Tani R, Yahagi H et al, 2020. Suitability of hybrid mackerel (Scomber australasicus×S. japonicus) with germ cell-less sterile gonads as a recipient for transplantation of bluefin tuna germ cells. General and Comparative Endocrinology, 295: 113525 DOI:10.1016/j.ygcen.2020.113525 |
Lacerda S M S N, Batlouni S R, Costa G M J et al, 2010. A new and fast technique to generate offspring after germ cells transplantation in adult fish: the Nile tilapia (Oreochromis niloticus) model. PLoS One, 5(5): e10740 DOI:10.1371/journal.pone.0010740 |
Lacerda S M S N, Batlouni S R, Silva S B G et al, 2006. Germ cells transplantation in fish: The Nile-tilapia model. Animal Reproduction, 3(2): 146-159 |
Majhi S K, Hattori R S, Rahman S M et al, 2014. Surrogate production of eggs and sperm by intrapapillary transplantation of germ cells in cytoablated adult fish. PLoS One, 9(4): e95294 DOI:10.1371/journal.pone.0095294 |
Majhi S K, Hattori R S, Rahman S M et al, 2009a. Experimentally induced depletion of germ cells in sub-adult Patagonian pejerrey (Odontesthes hatcheri). Theriogenology, 71(7): 1162-1172 DOI:10.1016/j.theriogenology.2008.12.008 |
Majhi S K, Hattori R S, Yokota M et al, 2009b. Germ cell transplantation using sexually competent fish: an approach for rapid propagation of endangered and valuable germlines. PLoS One, 4(7): e6132 DOI:10.1371/journal.pone.0006132 |
Majhi S K, Rasal A R, Kushwaha B et al, 2017. Heat and chemical treatments in adult cyprinus carpio (Pisces cypriniformes) rapidly produce sterile gonads. Animal Reproduction Science, 183: 77-85 DOI:10.1016/j.anireprosci.2017.05.015 |
Nóbrega R H, Batlouni S R, França L R, 2009. An overview of functional and stereological evaluation of spermatogenesis and germ cell transplantation in fish. Fish Physiology and Biochemistry, 35(1): 197-206 DOI:10.1007/s10695-008-9252-z |
Nóbrega R H, Greebe C D, van de Kant H et al, 2010. Spermatogonial stem cell niche and spermatogonial stem cell transplantation in zebrafish. PLoS One, 5(9): e12808 DOI:10.1371/journal.pone.0012808 |
Ogawa T, Dobrinski I, Brinster R L, 1999. Recipient preparation is critical for spermatogonial transplantation in the rat. Tissue and Cell, 31(5): 461-472 DOI:10.1054/tice.1999.0060 |
Okutsu T, Suzuki K, Takeuchi Y et al, 2006. Testicular germ cells can colonize sexually undifferentiated embryonic gonad and produce functional eggs in fish. Proceedings of the National Academy of Sciences of the United States of America, 103(8): 2725-2729 DOI:10.1073/pnas.0509218103 |
Takeuchi Y, Yatabe T, Yoshikawa H et al, 2018. Production of functionally sterile triploid Nibe croaker Nibea mitsukurii induced by cold-shock treatment with special emphasis on triploid aptitude as surrogate broodstock. Aquaculture, 494: 45-56 DOI:10.1016/j.aquaculture.2016.05.030 |
Takeuchi Y, Yoshizaki G, Takeuchi T, 2003. Generation of live fry from intraperitoneally transplanted primordial germ cells in rainbow trout. Biology of Reproduction, 69(4): 1142-1149 DOI:10.1095/biolreprod.103.017624 |
Takeuchi Y, Yoshizaki G, Takeuchi T, 2004. Surrogate broodstock produces salmonids. Nature, 430(7000): 629-630 DOI:10.1038/430629a |
Van Der Laan R, Eschmeyer W N, Fricke R, 2014. Family-group names of recent fishes. Zootaxa, 3882(2): 1-230 |
Xu D D, Yoshino T, Konishi J et al, 2019. Germ cell-less hybrid fish: ideal recipient for spermatogonial transplantation for the rapid production of donor-derived sperm. Biology of Reproduction, 101(2): 492-500 DOI:10.1093/biolre/ioz045 |
Yoshikawa H, Ino Y, Kishimoto K et al, 2020. Induction of germ cell-deficiency in grass puffer by dead end 1 gene knockdown for use as a recipient in surrogate production of tiger puffer. Aquaculture, 526: 735385 DOI:10.1016/j.aquaculture.2020.735385 |
Yoshikawa H, Takeuchi Y, Ino Y et al, 2017. Efficient production of donor-derived gametes from triploid recipients following intra-peritoneal germ cell transplantation into a marine teleost, Nibe croaker (Nibea mitsukurii). Aquaculture, 478: 35-47 DOI:10.1016/j.aquaculture.2016.05.011 |
Yoshizaki G, Lee S, 2018. Production of live fish derived from frozen germ cells via germ cell transplantation. Stem Cell Research, 29: 103-110 DOI:10.1016/j.scr.2018.03.015 |
Yoshizaki G, Takashiba K, Shimamori S et al, 2016. Production of germ cell-deficient salmonids by dead end gene knockdown, and their use as recipients for germ cell transplantation. Molecular Reproduction and Development, 83(4): 298-311 DOI:10.1002/mrd.22625 |
 2021, Vol. 52
2021, Vol. 52


