中国海洋湖沼学会主办。
文章信息
- 钟爱华, 代小新. 2021.
- ZHONG Ai-Hua, DAI Xiao-Xin. 2021.
- 黄颡鱼(Pelteobagrus fulvidraco)成体造血器官头肾和体肾转录组比较研究
- COMPARATIVE TRANSCRIPTOME ANALYSIS OF THE HEAD KIDNEY AND TRUNK KIDNEY IN ADULT YELLOW CATFISH (PELTEOBAGRUS FULVIDRACO)
- 海洋与湖沼, 52(6): 1486-1495
- Oceanologia et Limnologia Sinica, 52(6): 1486-1495.
- http://dx.doi.org/10.11693/hyhz20210500110
文章历史
-
收稿日期:2021-05-01
收修改稿日期:2021-06-03
硬骨鱼类免疫系统与哺乳动物不同, 硬骨鱼类骨髓没有造血功能, 取而代之的是头肾和体肾, 成体时头肾一般不具有肾小管, 因而没有排泄功能; 而体肾既有排泄功能又有造血功能。作为重要的中枢免疫器官, 头肾和体肾不仅能支持造血细胞分化、发育、成熟, 维持血细胞相对稳态, 还参与机体免疫防御反应, 以阻止和清除入侵病原体及其毒素(Zwollo et al, 2005)。
早在1951年, Catton就已证实硬骨鱼头肾和体肾具有造血功能(Catton, 1951), 后继许多研究也证实头肾和体肾中血细胞发育谱系相似, 但是两者造血及免疫功能是否完全相同还不十分清楚。形态学研究发现头肾和体肾中血细胞数量不一样, 军曹鱼(Rachycentron canadum)体肾中有更多红细胞、原粒细胞、未成熟红细胞和未成熟粒细胞(陈刚等, 2005), 卵形鲳鲹(Trachinotus ovatus)体肾中有更多原淋巴细胞(张健东等, 2007), 斑点叉尾
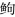
黄颡鱼(Pelteobagrus fulvidraco)隶属于辐鳍鱼纲、鲶形目、鲿科、黄颡鱼属, 俗名嘎牙子、黄姑子、黄腊丁、黄骨鱼等, 广泛分布于我国广大江河流域。黄颡鱼是一种耐低氧、广温性淡水鱼类, 溶氧大于2 mg/L、水温1—38 ℃之间均能正常生存, 诸多优点使其成为重要的淡水养殖鱼类。中国渔业统计年鉴统计数据显示, 2017年全国黄颡鱼产量为480 032 t, 2018年产量为509 610 t, 2019年产量为536 964 t, 连续两年产量不断增加。随着养殖规模扩大, 高密度养殖环境中, 黄颡鱼常常感染细菌、寄生虫以及病毒, 如爱德华氏菌、嗜水气单胞菌等, 轻则影响黄颡鱼生长, 重则导致其大规模死亡(Li et al, 2018)。目前有关黄颡鱼研究主要集中在养殖技术、人工繁殖、病害防控等方面(胡伟华等, 2019; 王国霞等, 2020; 郭勋等, 2020; 蔺凌云等, 2020), 笔者在进行黄颡鱼血细胞发生研究时发现头肾中有更多的原红细胞, 为了探索头肾和体肾造血以及免疫功能异同, 笔者进行了转录组高通量测序, 以期望探明两者造血和免疫功能的分子机制, 为黄颡鱼病害防治奠定理论基础。
1 材料与方法 1.1 样本准备实验用黄颡鱼(Pelteobagrus fulvidraco) [体质量(200±25) g]来自浙江省宁波市养殖农场, 选择健康无伤、体表无寄生虫、反应敏捷的健康黄颡鱼, 带回实验室暂养, 暂养水体为100 L, 温度(20±2) ℃、溶解氧大于5 mg/L。暂养5 d后, 随机挑选9尾大小相近的黄颡鱼, 丁香酚麻醉后取其头肾和体肾, 冻存于液氮中用于抽提RNA, 因头肾较小, 为保证测序质量, 每3个个体组成一个样本。
1.2 RNA抽提先采用Trizol (Invitrogen)试剂盒提取头肾和体肾中总RNA, 然后使用DNase I (TaKaRa)去除基因组DNA, 获得的RNA样品用2100 Bioanalyser (Agilent)、ND-2000 (NanoDrop Technologies)检测质量, 以保证合格样品(OD260/280=1.8—2.2, OD260/230≥2.0, RIN≥9.0, 28S: 18S≥1.0, 总量 > 2 μg)用于转录组测序。
1.3 文库建立和测序文库建立采用TruSeqTM RNA sample preparation Kit (Illumina, San Diego, CA)试剂盒进行。首先用带有Oligo(dT)的磁珠从1 μg总RNA中富集含有poly-A尾巴的mRNA, 再加入片段化缓冲液, 将mRNA随机断裂成200 bp左右的小片段; 接着采用SuperScript double-stranded cDNA synthesis kit (Invitrogen, CA)试剂盒, 加入六碱基随机引物(Illumina), 以mRNA为模板反转录合成一链cDNA, 然后合成第二链, 形成稳定的双链结构。双链的cDNA结构为粘性末端, 加入End Repair Mix将其补成平末端, 随后在3′末端加上A碱基, 用于连接Y字形的接头。获得的cDNA经过15个PCR扩增, 扩增试剂盒采用sample preparation Kit (Illumina, San Diego, CA), 采用琼脂糖电泳筛选200—300 bp的条带, 经TBS380 (Picogreen)定量后, 用于用Illumina HiSeq NovaSeq 6000测序平台进行高通量测序, 测序读长为PE150。
1.4 有参考基因转录组组装测序获得的原始数据(Raw Date)使用SeqPrep v1.3.2去除reads中接头, 过滤掉不合格的序列后所获得的序列即为有效数据。具体为先去除reads中的接头序列, 去除因接头自连等原因导致没有插入片段的reads; 然后将序列末端(3′端)低质量(质量值小于20)的碱基修剪掉, 若剩余序列中仍然有质量值小于10的碱基, 则将整条序列剔除, 否则保留; 去除含N(模块碱基)的reads, 舍弃去接头和质量修剪后长度小于30 bp的序列, 余下的序列为有效数据。使用HISAT2软件将过滤后的高质量数据(Clean reads)比对到黄颡鱼基因组上, 基因组来自NCBI (https://www.ncbi.nlm.nih.gov/genome/term=txid1234273), 然后采用StringTie2软件进行组装, 具体为先将重合的reads对组装成super-reads, 然后将super-reads比对到参考基因组, 并构建剪接(splice)位点的结构图(graph), 最后将read覆盖高的路径进行组装从而形成转录本(transcript)序列和Unigenes序列。
1.5 基因注释和功能分析采用软件DIAMOND (Buchfink et al, 2015), 将组装获得的Unigenes序列在NCBI-NR (http://www.ncbi.nlm.nih.gov/)、Pfam (http://pfam.xfam.org/)、GO (http://www.geneontology.org)、KEGG (http://www.genome.jp/kegg/)和Swiss-Prot (https://www.uniprot.org/)数据库中进行比对(期望值E value < 1e-5), 从而全面获得Unigenes注释信息。
1.6 差异表达基因分析先采用RSEM v1.3.3将Clean reads比对到组装的Unigene序列上, 获得每个转录本序列read数目, 然后计算TPM (Transcripts Per Kilobase Million)值, 以获得Unigene的表达量。采用R软件包中的Deseq筛选两组织中表达量显著差异的基因, 筛选标准为|log2Fold Change| > 1.5且错误发现率(FDR) < 0.05。
获得的差异表达基因, 以注释的所有基因作为参考, 采用Goatools和KOBAS3.0分析差异表达基因所在的GO类别和KEGG信号通路, 显著富集的判断标准为Bonferroni方法对P值进行校正, 校正的P值(FDR) < 0.05时, 此GO类别和KEGG信号通路存在显著富集情况。
1.7 qRT-PCR (实时荧光定量PCR)验证从头肾和体肾中随机挑选出4个差异表达免疫基因, 分别为2个在头肾中上调基因以及2个在体肾中上调基因, 进行qRT-PCR分析。先从3个生物学样本中提取RNA, 然后采用HiScript Q RT SuperMix for qPCR (+gDNA wiper) (诺唯赞)试剂盒反转录为cDNA, 以反转录cDNA为模板, 采用ChamQ SYBR Color qPCR Master Mix (2×) (诺唯赞)试剂盒进行PCR扩增。扩增引物由Primer premier 5软件设计(表 1), 内参基因为β-肌动蛋白(β-actin), 基因相对表达量按2–ΔΔCt法计算(Livak et al, 2001), 结果使用SPSS 20.0软件进行单因素方差分析, 统计学差异水平为P < 0.05。
| 基因名 | NCBI序列号 | 正向引物序列(5′—3′) | 反向引物序列(5′—3′) |
| β-actin | XM_027148463.1 | ATTGCCGCACTGGTTGTT | CAGGGTCAGGATACCTCTTT |
| TLR1 | XM_027171867.1 | AGGCTGCTTGAGATCACCTG | CTTTGCACGGGTCCATTTCC |
| TLR2 | XM_027142860.1 | ATGCCACAGGTTTGCGATTG | GGGAAGATGGAGGTGGAACG |
| CCL 19 | XP_027018641.1 | GGCTCGATCTGCCTTTCT | CAGGCGATTATGCGTTTT |
| C9 | XM_027165452.1 | TGGCAGAGTACAGTGTGTGC | CGTCTCCGGATGCCTTCATT |
测序后黄颡鱼体肾和头肾中获得超过8 Gb的原始碱基(raw bases), 原始数据经过修剪、过滤不合格序列后, 体肾中获得超过56 440 624条有效数据(clean reads), 头肾中获得超过63 788 540条有效序列, 头肾和体肾有效序列的质量得分Q20均大于98%, Q30均大于94%。获得的有效reads与参考基因组进行比对, 体肾中93%以上的有效reads能定位到基因组上, 头肾中92%的有效reads能定位到基因组上(见表 2)。
| 样本名 | 原始碱基 | 质控碱基 | 有效数据 | 质量得分Q20(%) | 质量得分Q30(%) | GC含量(%) | 比对到基因组的有效数据(%) |
| 头肾1 | 10 847 107 784 | 9 377 152 765 | 63 788 540 | 98.33 | 95.03 | 53.52 | 92.04 |
| 头肾2 | 10 832 563 464 | 9 484 601 411 | 63 814 548 | 98.25 | 94.86 | 54.16 | 92.36 |
| 头肾3 | 10 180 754 666 | 9 662 856 003 | 65 894 180 | 98.21 | 94.81 | 55.96 | 92.35 |
| 体肾1 | 8 622 294 186 | 8 361 116 089 | 56 440 624 | 98.28 | 94.94 | 54.01 | 93.03 |
| 体肾2 | 8 896 853 862 | 8 567 126 549 | 58 197 718 | 98.26 | 94.77 | 53.35 | 93.17 |
| 体肾3 | 8 840 763 402 | 8 598 302 583 | 57 899 632 | 98.23 | 94.78 | 52.53 | 93.61 |
有效序列经组装后, 共获得59 979个转录本, 最长转录本长度为95 343 bp, 转录本N50值为3 919 bp, 大部分转录本的长度超过1 800 bp, 有40 134个转录本, 占比66.91% (图 1)。
 |
| 图 1 转录本长度分布 Fig. 1 Length distribution of transcript sequence |
组装获得的转录本在五个数据库(NR、Swiss-Prot、Pfam、GO和KEGG)中进行比对, 以全面获得转录本功能信息, 五个数据库中共注释24 487个Unigenes, 注释率为40.82%, 12 791个Unigenes在5个数据库中均获得注释(图 2)。五个数据库中, NR数据库注释的Unigenes最多。
 |
| 图 2 基因注释信息韦恩图 Fig. 2 The Venn diagram of Unigenes annotation in five databases |
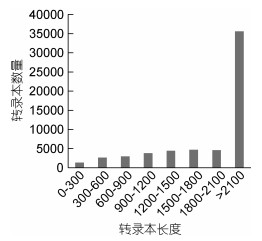
GO (Gene Ontology)数据库是一个对基因和蛋白功能进行统一限定和描述的数据库, 在GO数据库中, 共注释到17 838个基因, 这些基因分属于三个GO类别: 细胞成分(cellular component, CC)、生物过程(biological process, BP)和分子功能(molecular function, MF), 细胞成分类别中以“细胞部分”和“细胞膜部分”为主, 生物过程类别中以“细胞过程”和“生物调节”为主, 分子功能中以“结合”和“催化活性”为主(图 3)。
 |
| 图 3 基因功能GO类别统计 Fig. 3 GO (Gene Ontology) function annotation of Unigenes 注: BP为生物过程, CC为细胞成分, MF为分子功能 |
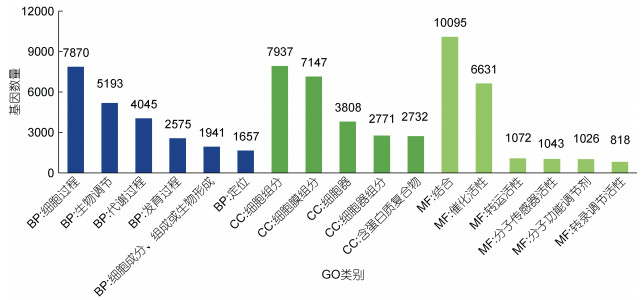
KEGG数据库是一个整合了基因组、化学和系统功能信息的数据库, 在KEGG数据库中共注释到15 319个基因, 这些基因涉及KEGG代谢通路的5个分支: 环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、细胞过程(cellular processes)、代谢(metabolism)、机体系统(organismal systems), 5个分支中基因数量最多的类别为: 信号转导(signal transduction)、免疫系统(immune system)、内分泌系统(endocrine system)、信号分子与相互作用(signaling molecules and interaction)以及转运和分解代谢(transport and catabolism) (图 4)。
 |
| 图 4 基因功能KEGG类别统计 Fig. 4 KEGG classification of Unigenes 注: A为代谢, B为遗传信息处理, C为环境信息处理, D为细胞过程, E为机体系统 |
根据5个数据库注释的基因信息, 258个基因在头肾中特异性表达, 1 974个基因在体肾中特异性表达。根据KEGG数据库注释信息, 大部分免疫通路组成元件均在头肾和体肾中表达, 如Toll样受体信号通路、NOD样受体信号通路等组成元件; 但部分免疫相关基因仅在体肾中表达(图 5), 包括C-X-C趋化因子9、补体C8γ链、抗体重链可变区编码基因(如可变区V3-6、V5A、V914等)、抗体轻链κ链可变区编码基因(如V-V区MOPC 149)。
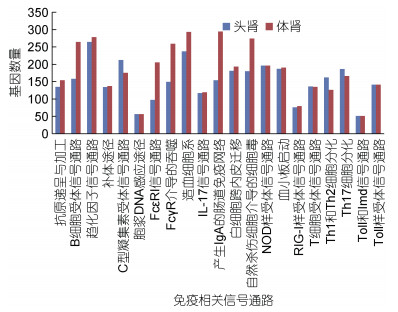 |
| 图 5 头肾和体肾中免疫相关信号通路基因注释分析 Fig. 5 KEGG classification of Unigenes in immune system between head kidney and trunk kidney |
黄颡鱼头肾和体肾Unigenes表达差异分析表明, 1 112个基因在头肾中上调(图 6), 根据GO注释, 头肾中上调差异基因注释到结合GO类别的最多, 有566个; 其次是注释到细胞过程和细胞部分GO类别, 分别有437和384个基因。2 737个基因在体肾中上调(图 6), 注释到催化活性GO类别的差异基因数目最多, 有978个; 其次是注释到膜部分GO类别, 有890个基因; 再次是注释到细胞过程GO类别, 有819个基因。
 |
| 图 6 差异表达基因分布火山图 Fig. 6 The volcano plot of differential expressed genes 注: 蓝色点为头肾中上调基因; 红色点为体肾中上调基因 |
头肾中上调的差异基因富集到263条KEGG代谢通路中, 显著富集的KEGG通路有皮质醇的合成和分泌、甲状旁腺激素的合成与分泌、B细胞受体信号通路、MAPK信号通路和ErbB信号通路等(图 7a)。另外, 与免疫功能相关的显著富集通路有B细胞受体信号通路、趋化因子信号通路、Th1和Th2细胞分化、Th17细胞分化、C-型凝集素受体信号通路、Toll受体信号通路以及T细胞受体信号通路。
 |
| 图 7 差异表达基因富集的KEGG通路 Fig. 7 The top 20 KEGG enriched pathway of differential expressed genes 注: a. 头肾中上调基因富集的前20条通路; b. 体肾中上调基因富集的前20条通路 |
体肾中上调的差异基因富集到324条KEGG代谢通路中, 显著富集的通路有谷胱甘肽代谢、氧化磷酸化、产生IgA的肠道免疫网络、造血细胞系以及甘氨酸、丝氨酸和苏氨酸代谢等(图 7b)。与免疫系统相关的显著富集通路有产生IgA的肠道免疫网络、造血细胞系、FcεRI信号通路、FcγR介导的吞噬作用和自然杀伤细胞介导的细胞毒性。
2.5 差异表达关键造血和免疫基因分析根据差异表达基因KEGG代谢通路富集分析, 头肾中筛选到差异表达关键免疫基因有: CD97A、CD97B、CD124、C-C趋化因子受体3 (C-C chemokine receptor type 3)、C-C趋化因子受体7 (C-C chemokine receptor type 7)、C-X-C趋化因子受体1 (C-X-C chemokine receptor type 1)、C-X-C趋化因子受体3 (C-X-C chemokine receptor type 3)、Notch蛋白2和3、白细胞介素4受体(interleukin 4 receptor)、TGFβ受体1 (TGF-beta receptor type-1)、Toll样受体1和2 (Toll-like receptor1、2)、KIT配体(KIT ligand)、血红蛋白亚基α和β、凝血因子Ⅷ (coagulation factor VIII)、早期B细胞因子1 (EBF transcription factor 1)。
体肾中筛选到差异表达关键免疫基因有: 部分抗体重链可变区编码基因、部分抗体轻链κ链可变区编码基因、C-C趋化因子19和25 (C-C motif chemokine19、25)、CD9、CD10、CD13、凝血因子II和V (coagulation factor II, V)、羧肽酶B2 (carboxypeptidase B2)、补体因子D (complement factor D)、补体5和9 (complement5、9)、白细胞介素17受体C (interleukin 17 receptor C)、RIG-I、白细胞介素27 (interleukin 27)、C-X-C趋化因子14 (motif chemokine ligand 14)、非典型趋化因子受体4 (atypical chemokine receptor 4)、P2Y嘌呤受体12 (P2Y purinoceptor 12)、肿瘤坏死因子受体超家族成员16 (tumor necrosis factor receptor superfamily member 16)。
2.6 差异表达关键信号转导通路基因分析信号转导通路组成基因在头肾和体肾中呈现不同的表达模式, 这些通路包括PI3K-AKT信号通路、MAPK信号通路、Jak-STAT信号通路、钙离子信号通路、Wnt信号通路、ECM信号通路、cAMP信号通路以及AMPK信号通路等。
体肾中筛选到差异表达关键信号转导通路基因有: 囊性纤维化跨膜传导调节蛋白(cystic fibrosis transmembrane conductance regulator)、整合素β6和8 (integrin beta 6、8)、Wnt9蛋白、钙调蛋白4 (calmodulin 4)。
头肾中筛选到差异表达基因有: TAK1、TAK1结合蛋白1 (TAK1-binding protein 1)、核因子NF-κB p105亚单位(nuclear factor NF-kappa-B p105 subunit)、磷脂酰肌醇-4, 5-二磷酸3-激酶催化亚单位α/δ (phosphatidylinositol-4, 5-bisphosphate 3-kinase catalytic subunit alpha/delta)、丝氨酸/苏氨酸蛋白激酶(RAC serine/threonine-protein kinase)、肌醇1, 4, 5-三磷酸受体2型和3型(inositol 1, 4, 5-triphosphate receptor type 2、3)、丝裂原活化蛋白激酶1 (mitogen-activated protein kinase kinase kinase 1, or MAP3K1)、磷脂酰肌醇磷脂酶Cγ1 (phosphatidylinositol phospholipase C, gamma-1)、转化生长因子β受体1型(TGF-beta receptor type-1)、转录共激活因子YAP1 (transcriptional coactivator YAP1)、STAT6 (signal transducer and activator of transcription 6)、叉头框蛋白O4 (forkhead box protein O4)。
2.7 qRT-PCR验证为验证转录组测序结果可靠性, 采用qRT-PCR分析了4个差异表达免疫基因在头肾和体肾中的表达(表 3)。qRT-PCR获得的结果与高通量测序结果比较表明, Toll样受体在头肾中上调, 补体C9和C-C趋化因子19在体肾中上调, 与转录组测序获得的结果基本一致, 转录组测序获得的基因表达谱具有可靠性。
| 基因ID | 基因名 | log2(头肾/体肾) | |
| RNA-seq | qRT-PCR | ||
| gene-LOC113659204 | TLR1 | 1.94 | 2.17 |
| gene-tlr2 | TLR2 | 1.52 | 1.64 |
| gene-LOC113653321 | CCL19 | –2.21 | –2.16 |
| gene-c9 | C9 | –6.69 | –5.44 |
mRNA即信使核糖核酸, 是由一条DNA链为模板转录而来、携带遗传信息并能指导蛋白质生物合成的RNA分子。对一个物种某一组织或器官中mRNA进行全貌分析, 不仅能明了特定组织或器官中表达的基因及其功能, 还能揭示特定生物学过程中的分子机理。高通量转录组测序技术(mRNA-Seq)的出现, 使得对特定组织、器官以及个体mRNA进行全貌分析成为可能。本研究通过转录组测序, 体肾中获得58 197 718条有效序列, 头肾中获得78 436 252条有效序列, 与湖栖鳍虾虎鱼(Gobiopterus lacustris)性腺、克氏原螯虾(Procambarus clarkii)肝脏等转录组研究中获得的有效序列相当(江红霞等, 2021; 董忠典等, 2021), 表明本研究获得的测序数据能反映两组织器官中mRNA表达谱。获得的测序序列经过组装获得转录本或Unigene后, 才能与已有的数据库进行比对, 对基因功能进行注释, 因此组装后的转录本或Unigene长度越长, 注释结果越准确。本研究中60%组装序列长度超过2 000 bp以上, N50大于3 900 bp, 获得的基因注释信息能反映两器官所表达的基因及其功能。
3.2 头肾和体肾造血功能鱼类血细胞发生一直是研究热点, 早在1951年, Catton就对几种硬骨鱼类血细胞发生过程中形态变化规律以及血细胞发生部位进行了研究, 证实硬骨鱼头肾和体肾具有造血功能(Catton, 1951)。研究进一步发现, 头肾是鱼类胚胎时期的泌尿器官, 随着个体发育失去泌尿机能, 成体时成为造血器官, 成体头肾一般不具有肾单位; 体肾中的造血组织又称为肾小管间造血组织(renal intertubular hematopoietic tissue), 其造血位置位于肾小管间(Milano et al, 1997)。黄颡鱼头肾和体肾转录组结果显示造血细胞系通路相关的重要基因均在头肾和体肾中表达, 如KIT配体、CD34、受体型酪氨酸蛋白激酶FLT3 (CD135)和DNA核苷酸转移酶(TdT)等, 表明头肾和体肾是重要的造血器官, 与其他研究相一致(曹伏君等, 2014; 钟爱华等, 2018)。
形态学研究发现, 多种鱼类头肾和体肾中各种原始细胞和幼稚细胞比例并不完全一致。斑点叉尾鮰头肾和体肾中粒细胞系(原粒细胞、早幼粒细胞、中幼粒细胞)和红细胞系(原红细胞、早幼红细胞、中幼红细胞、晚幼红细胞)细胞比例相近、原淋巴细胞比例也接近, 但头肾中有更多幼淋巴细胞(Fijan, 2002a, b); 达氏鲟红细胞系细胞在头肾中比例更高, 体肾中没有原粒细胞(Liu et al, 2017); 军曹鱼体肾中有更多原红细胞和原粒细胞(陈刚等, 2005)。本研究通过转录组测序也发现黄颡鱼头肾和体肾中血细胞谱系比例存在差异。KIT配体又称干细胞因子, 是造血干细胞和造血祖细胞生存、增殖和分化的一种重要生长因子(Broudy, 1997), KIT配体在黄颡鱼头肾和体肾中均表达, 表明各类原始造血祖细胞均存在于两器官中。人类和小鼠的KIT配体对红细胞的正常发育至关重要, KIT配体能促使红系爆式祖细胞BFU-E向红系祖细胞CFU-E细胞转变(Broudy, 1997; Antonchuk et al, 2004); 斑马鱼KIT配体功能研究发现其在红细胞系分化发育中发挥重要作用, 斑马鱼KIT配体a是红系祖细胞erythroid progenitors体外扩增的必须因子(Oltova et al, 2020); 这些研究表明KIT配体在脊椎动物中具有功能保守性。黄颡鱼头肾中KIT配体表达量显著高于其在体肾中的表达量, 且血红蛋白亚基α和β在头肾中的表达量显著高于体肾中的表达量, 表明更多红系祖细胞在头肾中分化形成幼稚红细胞, 与达氏鲟形态学研究结构相一致(Liu et al, 2017)。KIT配体也是诱导髓样干细胞、粒细胞巨噬细胞系集落生成单位CFU-GEMM和淋巴干细胞增殖和分化的重要因子, KIT配体与受体结合后, 会触发各种信号传导级联反应, 包括磷脂酰肌醇3激酶、MAPK、SRC和Jak-STAT信号转导途径, 丝裂原活化蛋白激酶1、磷脂酰肌醇-4, 5-二磷酸3-激酶催化亚单位α/δ和STAT6基因均在黄颡鱼头肾中上调, 这意味着更多的淋巴干细胞、粒系祖细胞、单核系祖细胞在头肾中增殖和分化。早期B细胞因子1在B细胞早期分化过程中起重要作用(Lin et al, 1995), 其功能在动物中高度保守, 斑马鱼、鳐和小鼠EBF1中DNA结合域几乎100%同源(Zwollo, 2011); 在哺乳动物中, 早期B细胞因子1主要存在淋巴干细胞CLPs、pro-B细胞以及部分pre-B细胞中(Hystad et al, 2007); 早期B细胞因子1在黄颡鱼头肾中显著上调, 头肾中表达量是体肾中表达量的10倍以上(log2FoldChange=3.69), 表明更多的淋巴干细胞和pro-B细胞存在于黄颡鱼头肾中。
3.3 头肾和体肾免疫功能鱼类头肾和体肾除具有造血功能外, 还是重要的免疫器官, 鱼类肾造血组织存在黑色素巨噬细胞中心, 其中有大量含色素的巨噬细胞, 这些黑色素巨噬细胞能吞噬降解体内各种外源性和内源性物质以及在免疫应答中递呈抗原(Agius et al, 2003; Zwollo et al, 2005; Abdel-Aziz et al, 2010)。本研究发现, 黄颡鱼头肾和体肾中免疫信号通路相关基因的表达存在差异。头肾中多个差异表达基因富集到Toll信号通路, 而Toll信号通路能激活NF-κB核转录因子, 从而导致促炎症因子、抗炎症细胞因子和趋化因子表达(任美玉, 2006)。Toll样受体如同天然免疫的眼睛, 能识别各种不同的病原相关分子模式(PAMP), Toll样受体1和2能识别多种细菌和真菌PAMP, 如脂蛋白、脂壁酸和酵母多糖。Toll样受体1和2在黄颡鱼头肾中上调, 表明黄颡鱼头肾是识别和抵抗细菌和真菌感染的重要器官。
补体是存在于脊椎动物血清蛋白质中的一组蛋白, 攻膜复合体C5b6789n能在细胞膜上形成亲水性孔道, 是补体发挥免疫功能的重要途径。趋化因子是一类介导免疫细胞迁移的细胞因子。C-C趋化因子19和25、C-X-C趋化因子14、补体因子D、C5和C9均在体肾中显著上调, 尤其是补体C9, 其在体肾中的表达量显著高于头肾(表 3), 表明体肾是重要的免疫分泌器官。
4 结论本研究对黄颡鱼成体造血组织头肾和体肾进行了RNA-Seq转录组测序, 并对获得的测序有效序列进行组装、基因信息注释和表达量分析, 头肾中共注释20 956个基因、体肾共注释24 487个基因, 1 112个基因在头肾中上调, 包括KITL、EBF1、CD124、CCL3等; 2 737个基因在体肾中上调, 包括CCL25、C5、C9、RIG-I、IL-17RC等, 部分抗体编码基因仅在体肾中表达; 结果表明黄颡鱼头肾和体肾在造血和免疫功能上具有差异性, 头肾中有更多的原始造血细胞, 体肾在免疫防御中发挥重要作用。
王国霞, 陈冰, 孙育平, 等. 2020. 脱脂亮斑扁角水虻幼虫粉替代鱼粉对黄颡鱼幼鱼生长性能、营养素沉积率、血清生化指标和消化酶活性的影响. 水产学报, 44(6): 987-998 |
江红霞, 刘慧芬, 马晓, 等. 2021. 转录组测序筛选克氏原螯虾卵巢发育、免疫和生长相关基因. 水产学报, 45(3): 396-414 |
任美玉. 2006. Toll样受体的研究进展. 现代免疫学, 26(4): 340-342 |
陈刚, 周晖, 张健东, 等. 2005. 军曹鱼血液指标及血细胞发生的观察. 水生生物学报, 29(5): 564-570 DOI:10.3321/j.issn:1000-3207.2005.05.015 |
张健东, 周晖, 陈刚, 等. 2007. 卵形鲳鲹血细胞发生的观察. 水生生物学报, 31(6): 780-787 DOI:10.3321/j.issn:1000-3207.2007.06.003 |
苑淑宾, 朱爱意, 江丽华, 等. 2011. 日本黄姑鱼血细胞发生的观察. 水产学报, 35(9): 1374-1383 |
郭勋, 程珂, 马春松, 等. 2020. 饲料中维生素D3的添加水平对黄颡鱼幼鱼生长和Toll样受体TLR18、TLR19和TLR21的影响. 水生生物学报, 44(3): 461-469 |
胡伟华, 丹成, 郭稳杰, 等. 2019. 黄颡鱼和杂交黄颡鱼"黄优1号"形态及性腺发育的比较. 水生生物学报, 43(6): 1231-1238 |
钟爱华, 储张杰, 牟毅, 等. 2018. 斜带髭鲷(Hapalogenys nitens)血细胞发生及外周血细胞化学染色观察. 海洋与湖沼, 49(6): 1341-1349 |
曹伏君, 叶宁, 罗杰, 等. 2014. 长鳍裸颊鲷(Lethrinus erythropterus)血细胞的发生. 海洋与湖沼, 45(2): 387-394 |
董忠典, 黎学友, 黄承勤, 等. 2021. 湖栖鳍虾虎鱼性腺转录组比较分析. 水产学报, 45(3): 365-380 |
蔺凌云, 冯东岳, 潘晓艺, 等. 2020. 黄颡鱼拟态弧菌的鉴定、毒力相关因子及药敏特性. 水生生物学报, 44(4): 799-810 |
Abdel-Aziz E S H, Abdu S B S, Ali T E S et al, 2010. Haemopoiesis in the head kidney of tilapia, Oreochromis niloticus (Teleostei: Cichlidae): a morphological (optical and ultrastructural) study. Fish Physiology and Biochemistry, 36(3): 323-336 DOI:10.1007/s10695-008-9297-z |
Agius C, Roberts R J, 2003. Melano-macrophage centres and their role in fish pathology. Journal of Fish Diseases, 26(9): 499-509 DOI:10.1046/j.1365-2761.2003.00485.x |
Antonchuk J, Hyland C D, Hilton D J et al, 2004. Synergistic effects on erythropoiesis, thrombopoiesis, and stem cell competitiveness in mice deficient in thrombopoietin and steel factor receptors. Blood, 104(5): 1306-1313 DOI:10.1182/blood-2004-04-1522 |
Arockiaraj J, Bhatt P, Harikrishnan R et al, 2015. Molecular and functional roles of 6C CC chemokine 19 in defense system of striped murrel Channa striatus. Fish & Shellfish Immunology, 45(2): 817-827 |
Broudy V C, 1997. Stem cell factor and hematopoiesis. Blood, 90(4): 1345-1364 DOI:10.1182/blood.V90.4.1345 |
Buchfink B, Xie C, Huson D, 2015. Fast and sensitive protein alignment using DIAMOND. Nature Methods, 12(1): 59-60 DOI:10.1038/nmeth.3176 |
Catton W T, 1951. Blood cell formation in certain teleost fishes. Blood, 6(1): 39-60 DOI:10.1182/blood.V6.1.39.39 |
Fijan N, 2002a. Morphogenesis of blood cell lineages in channel catfish. Journal of Fish Biology, 60(4): 999-1014 DOI:10.1111/j.1095-8649.2002.tb02424.x |
Fijan N, 2002b. Composition of main haematopoietic compartments in normal and bled channel catfish. Journal of Fish Biology, 60(5): 1142-1154 DOI:10.1111/j.1095-8649.2002.tb01711.x |
Han F, Zhang Y, Qin G et al, 2021. Genome-wide characterization of Toll-like receptors in Japanese meagre Argyrosomus japonicus and their response to poly (I: C) injection. Aquaculture, 542: 736907 DOI:10.1016/j.aquaculture.2021.736907 |
Hystad M E, Myklebust J H, Bø T H et al, 2007. Characterization of early stages of human B cell development by gene expression profiling. Journal of Immunology, 179(6): 3662-3671 DOI:10.4049/jimmunol.179.6.3662 |
Li D P, Xie C X, He X G et al, 2018. The Success of Yellow Catfish Aquaculture in China: from rare wild fish to popular farmed fish. In: Gui J F, Tang Q S, Li Z J eds. Aquaculture in China: Success Stories and Modern Trends. Hoboken: John Wiley & Sons Ltd, 270-282
|
Lin H, Grosschedl R, 1995. Failure of B-cell differentiation in mice lacking the transcription factor EBF. Nature, 376(6537): 263-267 DOI:10.1038/376263a0 |
Liu Y, Xiao Q, Yang S et al, 2017. Characterization of hematopoiesis in Dabry's sturgeon (Acipenser dabryanus). Aquaculture and Fisheries, 2(6): 262-268 DOI:10.1016/j.aaf.2017.10.007 |
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 25(4): 402-408 DOI:10.1006/meth.2001.1262 |
Lu Z J, Zhan F B, Yang M X et al, 2021. The immune function of heme oxygenase-1 from grass carp (Ctenopharyngodon idellus) in response to bacterial infection. Fish & Shellfish Immunology, 112: 168-178 |
Milano E G, Basari F, Chimenti C, 1997. Adrenocortical and adrenomedullary homologs in eight species of adult and developing teleosts: morphology, histology, and immunohistochemistry. General and Comparative Endocrinology, 108(3): 483-496 DOI:10.1006/gcen.1997.7005 |
Ohtani M, Hikima J I, Kondo H et al, 2011. Characterization and antiviral function of a cytosolic sensor gene, MDA5, in Japanese flounder, Paralichthys olivaceus. Developmental & Comparative Immunology, 35(5): 554-562 |
Oltova J, Svoboda O, Machonova O et al, 2020. Zebrafish Kit ligands cooperate with erythropoietin to promote erythroid cell expansion. Blood Advances, 4(23): 5915-5924 DOI:10.1182/bloodadvances.2020001700 |
Ou M, Huang R, Luo Q et al, 2019. Characterisation of scavenger receptor class B type 1 in rare minnow (Gobiocypris rarus). Fish & Shellfish Immunology, 89: 614-622 |
Wang Q, Wang S W, Zhang Y et al, 2019. The CXC chemokines and CXC chemokine receptors in orange-spotted grouper (Epinephelus coioides) and their expression after Singapore grouper iridovirus infection. Developmental & Comparative Immunology, 90: 10-20 |
Zhu Q, Fan Z J, Cai S X et al, 2020. Molecular and immunological characterizations of interleukin-11 in large yellow croaker (Larimichthys crocea). Fish & Shellfish Immunology, 100: 9-17 |
Zwollo P, 2011. Dissecting teleost B cell differentiation using transcription factors. Developmental & Comparative Immunology, 35(9): 898-905 |
Zwollo P, Cole S, Bromage E et al, 2005. B cell heterogeneity in the teleost kidney: evidence for a maturation gradient from anterior to posterior kidney. Journal of Immunology, 174(11): 6608-6616 DOI:10.4049/jimmunol.174.11.6608 |
 2021, Vol. 52
2021, Vol. 52

