
中国海洋湖沼学会主办。
文章信息
- 杨千元, 滕爽爽, 蔡逸龙, 肖国强, 蔡西栗. 2021.
- YANG Qian-Yuan, TENG Shuang-Shuang, CAI Yi-Long, XIAO Guo-Qiang, CAI Xi-Li. 2021.
- 哈维氏弧菌浸泡感染下泥蚶(Tegillarca granosa)不同组织弧菌载量的变化规律分析
- LOAD VARIATION OF VIBRIO HARVEYI IN THE BLOOD CLAM TEGILLARCA GRANOSA
- 海洋与湖沼, 52(6): 1506-1513
- Oceanologia et Limnologia Sinica, 52(6): 1506-1513.
- http://dx.doi.org/10.11693/hyhz20210300074
文章历史
-
收稿日期:2021-03-30
收修改稿日期:2021-05-18
2. 浙江省海洋水产养殖研究所 浙江省近岸水域生物资源开发与保护重点实验室 温州市海洋生物遗传育种重点实验室 温州 325005;
3. 浙江省平阳县农业农村局 平阳 325499
2. Zhejiang Mariculture Research Institute; Zhejiang Key Laboratory of Exploitation and Preservation of Coastal Bioresource; Wenzhou Key Laboratory of Marine Biological Genetics and Breeding, Wenzhou 325005, China;
3. Pingyang Agriculture and Rural Bureau of Zhejiang Province, Pingyang 325499, China
泥蚶(Tegillarca granosa), 俗称“血蛤”, 隶属于软体动物门(Mollusca)、瓣鳃纲(Lamellibranchia)、列齿目(Taxodonta)、蚶科(Arcidae)、泥蚶属(Tegillarca), 是一种典型的广温、广盐性滩涂贝类, 广泛分布于印度洋和西太平洋地区, 在我国主要分布于山东半岛以南沿海地区, 是我国四大经济养殖贝类之一, 并在沿海生态系统中发挥着至关重要的生态作用(李太武等, 2003; Shao et al, 2016; Shi et al, 2016)。近年来养殖泥蚶的流行性疾病和大规模死亡时有发生(金珊等, 2002), 其中, 弧菌性疾病最为常见, 并且导致的死亡最为严重, 已然成为制约泥蚶养殖产业健康发展的瓶颈问题之一(陈爱平, 2005; 陈爱平等, 2007)。弧菌普遍分布于河口、海湾、近岸海域的海水和海洋动物体内, 截至目前弧菌科共发现8个属, 159个种, 其中主要致病菌有副溶血弧菌(Vibrio parahaemolyticus)、哈维氏弧菌(Vibrio harveyi)、鳗弧菌(Vibrio anguillarum)、创伤弧菌(Vibrio vulnificus)、溶藻弧菌(Vibrio alginolyticus)等(张晓华等, 2018)。目前关于泥蚶致病弧菌的研究主要集中在副溶血弧菌(刘文伟等, 2010; 汪青, 2012; Bao et al, 2013a, b; Yang et al, 2020b)、鳗弧菌(钟爱华等, 2020)、溶藻弧菌(Yang et al, 2020a)和哈维氏弧菌(Song et al, 2017; Zha et al, 2017)等。其中, 有关泥蚶感染哈维氏弧菌后, 机体免疫响应的研究报道较少。
细菌性疾病的暴发主要取决于宿主的体质、病原菌的数量和宿主与病原菌之间的相互作用(Asplund et al, 2014)。当外来病原微生物入侵宿主机体时, 宿主的免疫系统被激活, 主要通过识别和消除的方式, 来保护自身避免受到病原体侵害。为了避免病原微生物侵害, 维持机体各项功能正常运行, 宿主必须控制病原菌在体内的荷载(Howick, 2017)。宿主的免疫系统通过消化、降解、吞噬等方式来控制靶组织中病原体的增殖, 以此来降低体内病原菌的数量, 这种宿主抵御病原微生物的能力被称为免疫抗性(Boots et al, 1999; Roy et al, 2000)。因此, 免疫抗性常以感染后宿主体内靶组织中病原体数量来衡量(Murphy, 1987)。宿主体内菌载量的变化规律反映了外来病原菌入侵后, 宿主与病原菌之间的相互作用, 是一种重要的衡量免疫抗性的指标。
本研究采用浸泡感染实验模拟泥蚶在自然环境下遭受哈维氏弧菌胁迫的环境。通过绘制哈维氏弧菌的计数标准曲线, 检测攻毒水体中24 h内哈维氏弧菌的浓度变化, 分析感染后不同时间点泥蚶组织弧菌载量的变化趋势, 进而研究在不同浓度弧菌感染下, 攻毒水体的弧菌浓度与泥蚶肝胰腺的弧菌载量的变化及相关性, 以期为泥蚶感染弧菌发病过程中, 免疫识别及免疫响应机制的研究提供参考。
1 材料与方法 1.1 实验材料实验所用的泥蚶[壳长(28.67±1.97) mm, 总重(9.08±1.61) g]取自浙江省温州市乐清湾(121°E, 28°N), 小心冲洗除去壳表污物后, 用浓度为5 mg/L的高锰酸钾溶液浸泡5—10 min, 将泥蚶置于室内500 L大桶中暂养一周[砂滤海水的pH 8.3±0.1, 盐度22.5±0.1, 温度(28.0±2.0) ℃]。暂养期间, 桶内海水保持连续充气, 每24 h换水一次, 每日早晚定时各投喂硅藻(密度为5×104个/mL) 1次。
实验所用的哈维氏弧菌菌株是本实验室2014年从浙江滩涂发生规模性死亡的泥蚶中分离、鉴定并于–80 ℃冰箱中长期保存。将菌株划线于2216E固体培养基上, 28 ℃培养24 h后挑取单菌落于5 mL的2216E液体培养基试管中, 28 ℃摇床中培养12 h, 摇床转速为160 r/min, 然后将其接种于大体积的2216E液体培养基扩大培养。
1.2 实验方法 1.2.1 弧菌计数标准曲线绘制将哈维氏弧菌接种至50 mL 2216E液体培养基中, 在28 ℃摇床中培养12 h。用无菌PBS溶液稀释成不同浓度的菌悬液。具体操作为: 以无菌PBS溶液二次重悬弧菌培养液, 分别吸取10 μL、20 μL、50 μL、100 μL、200 μL、0.5 mL、1 mL、2 mL加PBS至终体积10 mL, 稀释成8个不同浓度的菌悬液。以分光光度计测定的8个菌液的OD560值为横坐标, 用硫代硫酸盐柠檬酸盐胆盐蔗糖(TCBS)琼脂培养基平板计数法得到的相应的弧菌浓度为纵坐标, 建立弧菌数与OD560值关系曲线, 获得直线回归方程(沈锦玉等, 2009)。
1.2.2 哈维氏弧菌感染实验(1) 哈维氏弧菌感染水体中, 哈维氏弧菌含量的日变化。将已知浓度的哈维氏弧菌, 按照设定浓度1×107 CFU/mL添加至砂滤海水中。20 L海水中放入30颗泥蚶, 感染期间海水温度保持(28.5±0.5) ℃, 持续充气, 每天早晚定时投喂硅藻一次。分别在弧菌添加前和添加后0、3、6、12、18、24 h对实验水体进行取样, 每次在不同位置、不同深度随机取3个水样检测水体中的哈维氏弧菌数量。24 h后更换实验海水并重新添加弧菌, 所有设置和取样时间同第一次实验, 连续三天检测水体中哈维氏弧菌的数量变化, 取平均值。实验设置3个感染组, 同时设置对照组, 即不放置泥蚶, 其他操作同感染组。采用SPSS22.0单因子方差分析(Analysis of variance, ANOVA), 检验不同处理组间海水中哈维氏弧菌浓度日变化, 显著性水平设定为P < 0.05。
(2) 哈维氏弧菌感染过程中, 泥蚶组织弧菌载量变化。设置感染浓度为1×107 CFU/mL, 对400只泥蚶进行连续7 d的哈维氏弧菌浸泡感染, 期间海水温度保持(28.5±0.5) ℃, 持续充气, 每24 h更换海水和弧菌。分别在感染实验前和感染实验后1、3、6 d, 每次取50颗泥蚶, 解剖取鳃、外套膜、闭壳肌、肝胰腺、血液用于弧菌载量检测。攻毒前后同一时间点泥蚶不同组织、同一组织不同个体间弧菌载量差异显著性检验采用One-way ANOVA方法, 显著性水平设定为P < 0.05。
(3) 泥蚶体内弧菌载量与弧菌感染强度的相关性分析。实验设置1×105、1×106、1×107、5×107 CFU/mL四个不同强度的哈维氏弧菌刺激, 每个实验组设置6个重复, 每个重复50颗泥蚶, 以不添加哈维氏弧菌的砂滤海水为对照组。实验共进行15 d, 浸泡感染7 d, 后8 d停止添加弧菌, 实验期间保持海水温度(28.5±0.5) ℃, 每24 h全换水并重新添加弧菌。在感染实验开始后的1 d和5 d, 在3个重复组中随机各取10颗泥蚶用于检测泥蚶肝胰腺的弧菌载量。同时, 每天观察记录另外3个重复组泥蚶的死亡情况。采用SPSS22.0 Spearman秩相关性分析泥蚶肝胰腺与实验水体中弧菌含量的相关关系; 感染后1 d和5 d在不同浓度下泥蚶体内弧菌载量差异显著性检验采用One-way ANOVA方法, 显著性水平设定为P < 0.05。
1.2.3 哈维氏弧菌数量检测通过涂板计数的方式检测海水中弧菌总数和泥蚶组织中的弧菌载量。泥蚶组织先用无菌生理盐水冲洗, 定性滤纸吸干表面水分, 经分析天平称重后, 按1︰9 (质量体积分数)加无菌生理盐水稀释, 用眼科剪破碎, 将组织原液和血液梯度稀释10×、100×、1 000×, 分别吸取100 μL涂于TCBS琼脂培养基平板上。28 ℃培养20—24 h后进行菌落计数, 组织弧菌载量根据稀释倍数和组织重换算成CFU/mg, 血液弧菌载量根据稀释倍数换算成CFU/mL。数据经过lg值转换后进行分析。
2 结果 2.1 弧菌计数标准曲线以不同浓度菌悬液在OD=560 nm处的吸光值为横坐标, TCBS平板计数值为纵坐标, 拟合得到一条直线, 其回归方程为y=(95.64x+0.291 3)×107 (y为菌液浓度, x为OD560值), R2=0.992 6, 表明OD560值在0.01—0.60之间, 菌液含菌量呈良好的线性关系(图 1)。利用该标准曲线能快速检测本研究培养的哈维氏弧菌浓度, 为后续感染实验中弧菌浓度的快速测定提供依据。
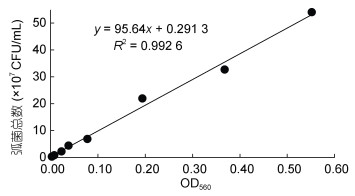 |
| 图 1 哈维氏弧菌数与OD560值关系曲线 Fig. 1 The relationship between the number of V. harveyi and the OD560 |
为了检测哈维氏弧菌浸泡感染实验中, 海水中弧菌浓度能否达到预设浓度要求, 我们监测了感染过程中弧菌在水体中的动态变化过程。结果表明, 砂滤海水中弧菌浓度为(32.25±5.14) CFU/mL, 按照设定的1×107 CFU/mL的浓度添加哈维氏弧菌后, 0 h弧菌感染组海水中活菌初始浓度为(1.06±0.08)×107 CFU/mL, 对照组活菌初始浓度为(1.07±0.04)×107 CFU/mL, 均能够达到预期的弧菌浓度。弧菌感染组6 h和12 h活菌浓度与0 h无显著差异, 随后海水中活菌浓度逐渐下降, 24 h最低为(7.83±0.15)×106 CFU/mL。对照组活菌浓度在弧菌加入后, 逐渐上升, 在12 h达到最大, 为(1.54±0.93)×107 CFU/mL, 之后缓慢下降至(1.20±0.05)×107 CFU/mL (图 2)。24 h内弧菌感染组有约1/2的时间里海水中的弧菌浓度维持在1×107 CFU/mL, 对照组海水中的有效浓度基本维持在1×107 CFU/mL以上; 并且对照组的弧菌浓度高于感染组。
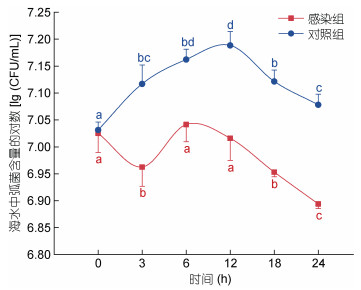 |
| 图 2 攻毒水体中哈维氏弧菌数量的日变化(h) Fig. 2 Daily variation of bacterial number in seawater under V. harveyi challenge (h) 注: 图中同一曲线中标有不同字母表示组间差异显著(P < 0.05), 标相同字母表示组间差异不显著(P > 0.05) |
哈维氏弧菌浸泡感染过程中, 对泥蚶不同组织弧菌载量的变化趋势进行分析, 结果显示(表 1), 哈维氏弧菌感染前, 50颗泥蚶鳃、外套膜、闭壳肌、肝胰腺、血液中哈维氏弧菌的检出率分别为34.0%、28.0%、30.0%、30.0%、36.0%, 血液弧菌载量显著高于其他4个组织。感染后1 d泥蚶组织中哈维氏弧菌载量较感染前有显著增加, 其中血液弧菌载量最高为(31 946.00±19 633.84) CFU/mL, 增加了591倍, 绝对弧菌载量和相对增加倍数均显著高于其他各组织。在持续感染的3 d, 泥蚶各组织的弧菌载量较1 d显著下降(P < 0.05); 除肝胰腺组织外, 感染后6 d其他组织的弧菌载量均处于与3 d相当的水平(P > 0.05)。
| 组织 | 弧菌载量 | |||
| 感染前 | 感染后1 d | 感染后3 d | 感染后6 d | |
| 鳃(CFU/mg) | 0.88±1.97aA | 53.19±76.90aC | 7.41±10.41aB | 10.17±14.01aB |
| 外套膜(CFU/mg) | 1.06±2.40aA | 116.51±184.63abC | 13.71±18.73aB | 13.21±14.34aB |
| 闭壳肌(CFU/mg) | 0.71±1.65aA | 90.56±114.65abC | 10.85±13.43aB | 12.34±18.40aB |
| 肝胰腺(CFU/mg) | 0.98±2.03aA | 125.21±123.07bC | 36.14±60.44bB | 67.89±73.06bC |
| 血液(CFU/mL) | 54.60±113.73bA | 31 946.00±19 633.84cC | 6 872.60±10 242.83cB | 9 009.60±12 744.11cB |
| 注: 表中数据不同小写字母表示相同时间下不同组织弧菌载量之间的差异显著(P < 0.05); 不同大写字母表示相同组织下不同时间弧菌载量之间的差异显著(P < 0.05) | ||||
攻毒后泥蚶同一组织不同个体弧菌载量存在较大差异(图 3)。感染前泥蚶鳃、外套膜、闭壳肌和肝胰腺有90%的个体弧菌载量处于100 CFU/mg数量级。感染1 d, 鳃组织的弧菌载量为(53.19±76.90) CFU/mg, 16%的泥蚶处于100 CFU/mg数量级, 72%处于101 CFU/mg数量级, 12%处于102 CFU/mg数量级; 外套膜的弧菌载量为(116.51±184.63) CFU/mg, 16%的泥蚶处于100 CFU/mg数量级, 60%处于101 CFU/mg数量级, 24%处于102 CFU/mg数量级; 闭壳肌的弧菌载量为(90.56±114.65) CFU/mg, 16%的泥蚶处于100 CFU/mg数量级, 58%处于101 CFU/mg数量级, 26%处于102 CFU/mg数量级; 肝胰腺的弧菌载量为(125.21±123.07) CFU/mg, 12%的泥蚶处于100 CFU/mg数量级, 44%处于101 CFU/mg数量级, 44%处于102 CFU/mg数量级; 血液的弧菌载量为(31 946.00±19 633.84) CFU/mL, 14%的泥蚶处于103 CFU/mL数量级, 86%处于104 CFU/mL数量级。在感染后3 d, 泥蚶体内弧菌载量下降, 鳃、外套膜、闭壳肌的弧菌载量主要分布在100 CFU/mg数量级, 分别占比82.0%、72.0%和68.0%; 肝胰腺弧菌载量主要在101 CFU/mg数量级, 占比62.0%; 血液中弧菌载量在102 CFU/mL数量级占比26.0%, 在103 CFU/mL数量级占比58.0%。在感染后6 d, 鳃、闭壳肌、外套膜的弧菌载量在100 CFU/mg较多, 分别占比74.0%、58.0%、72.0%; 肝胰腺的弧菌载量在101较多, 占比68.0%; 血液的弧菌载量在103较多, 占比64.0%。
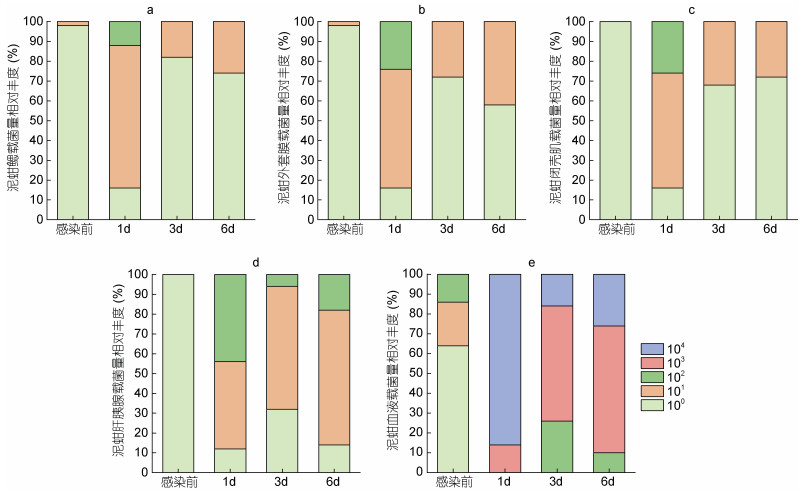 |
| 图 3 哈维氏弧菌攻毒过程中泥蚶组织中弧菌载量的分布 Fig. 3 The distribution of Vibrio load in clam T. granosa tissues under V. harveyi challenge 注: a. 鳃, b. 外套膜, c. 闭壳肌, d. 肝胰腺, e. 血液 |
不同浓度的哈维氏弧菌感染实验结果表明, 在感染1 d, 随着弧菌感染浓度的增加, 泥蚶肝胰腺中弧菌载量也呈现出升高的趋势, 与对照组相比, 感染组肝胰腺弧菌载量增加了81.0—667.8倍, 显著高于对照组, 且与水体中的弧菌含量呈显著的正相关(Spearman’s ρ=0.762, P < 0.001)。在感染5 d, 四个弧菌浓度感染组泥蚶肝胰腺弧菌载量较1 d均明显减少, 除1×105 CFU/mL感染组外, 其余感染组泥蚶肝胰腺弧菌载量仍然显著高于对照组(P < 0.05), 1×105 CFU/mL浓度组1 d的弧菌载量是5 d的16.2倍, 5×107 CFU/mL浓度组1 d则为5 d的7.0倍(图 4)。同时我们统计了不同浓度哈维氏弧菌感染过程中泥蚶的死亡情况(图 5), 发现在1×105 CFU/mL感染浓度下, 泥蚶未出现死亡; 在1×107 CFU/mL条件下泥蚶累计死亡率为(6.67±2.31)%; 在5×107 CFU/mL条件下泥蚶累计死亡率高达100%。以上结果表明弧菌感染导致泥蚶死亡是一个阈值性状, 泥蚶健康或死亡与其体内弧菌载量之间的关系有待于进一步研究。
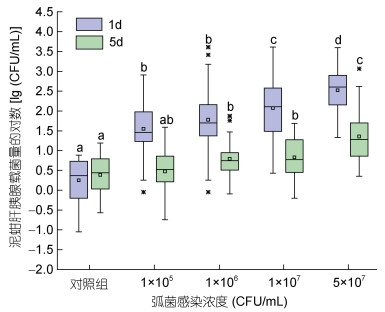 |
| 图 4 不同浓度哈维氏弧菌感染后1 d和5 d泥蚶肝胰腺哈维氏弧菌载量变化 Fig. 4 Bacterial load of T. granosa hepatopancreas challenged by different dose of V. harveyi at 1- and 5-day post infection 注: 图中含有不同字母表示在同一天弧菌载量之间的差异显著(P < 0.05) |
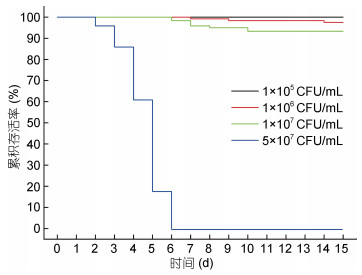 |
| 图 5 不同浓度哈维氏弧菌感染下泥蚶存活率 Fig. 5 Survival rate of T. granosa challenged by different dose of V. harveyi |
目前, 在水产动物的免疫学研究中, 常常利用外界病原菌刺激的方法来模拟宿主在自然条件下的胁迫环境, 然而宿主体内的病原菌及其含量阈值是激活宿主机体免疫系统的前提条件(王瑞等, 2019)。本研究通过人工浸泡感染的方法模拟自然条件下哈维氏弧菌的感染过程, 获得泥蚶在自然环境死亡相同的症状。为了明确弧菌添加到水体后的生长繁殖规律, 及能否达到预期设定的浓度。本研究采用TCBS琼脂培养基平板计数法, 对实验水体中的哈维氏弧菌活菌数量进行计数。弧菌添加到海水后实测的初始浓度与设定浓度基本一致, 证明了弧菌计数标准曲线的准确性。感染组在0—3 h弧菌数量呈现下降趋势, 推测可能是泥蚶通过滤食作用, 同时摄食了单胞藻和哈维氏弧菌。经过一段时间的适应, 弧菌开始繁殖, 海水中出现大量泡沫, 水体变得浑浊, 臭味变浓, 因此, 海水中弧菌浓度在3—6 h呈现上升的趋势。6 h后攻毒水体的的弧菌数量下降, 可能由于水体中营养物质的消耗以及泥蚶的滤食作用导致。实验过程中, 感染组至少有1/2的时间弧菌浓度维持在1×107 CFU/mL, 表明人工浸泡感染实验能很好的模拟泥蚶在自然环境中的弧菌胁迫, 为进一步研究弧菌载量提供了可能。
3.2 弧菌攻毒过程泥蚶不同组织中弧菌载量变化分析弧菌持续感染泥蚶过程中, 弧菌与宿主细胞间的相互作用, 包括体表吸附、侵袭、体内增殖、产生毒素等(Elston et al, 1980), 会激发宿主的一系列免疫反应。泥蚶不同组织中弧菌载量检测结果, 显示了弧菌在泥蚶体内增殖、死亡的过程。与感染前泥蚶相比, 感染后1 d弧菌在各组织中数量显著上升。随着泥蚶细胞免疫和体液免疫系统被激活, 吞噬作用、溶酶体降解作用、抗菌肽抑菌作用启动, 体内大多数病原弧菌被杀死, 因此, 感染后3 d检测到的弧菌数量迅速下降, 后期维持较低水平。王瑞等(2019)在对文蛤(Meretrix petechialis)进行副溶血弧菌感染的实验中, 也发现了文蛤体内弧菌载量总体变化趋势表现为先急剧上升, 后迅速下降, 并在后期维持一个较低的水平。Wang等(2010)利用副溶血弧菌人工感染长牡蛎(Crassostrea gigas), 结果发现牡蛎各组织的副溶血载量的变化趋势也与本文一致。
贝类致病弧菌的特异性富集组织仍然没有统一的认识, 有研究表明副溶血弧菌可在牡蛎(Tiostrea chilensis)消化腺(包括肠胃和消化盲囊)和鳃组织中高效富集(Cabello et al, 2005), 创伤弧菌可在美洲牡蛎(Crassostrea virginica)淋巴、闭壳肌和外套膜中大量增殖(Tamplin et al, 1992)。本研究发现在哈维氏弧菌感染下, 泥蚶鳃、闭壳肌、外套膜、肝胰腺和血液中均能检出弧菌, 血液中弧菌载量最高, 且显著高于其他组织, 不同组织呈现弧菌载量的富集差异性。在感染过程中, 泥蚶处于开口状态, 外界高浓度的弧菌与泥蚶血窦直接接触, 弧菌可能通过扩散作用进入血液中, 导致血液中弧菌载量大量富集。外套膜直接接触外界环境, 是泥蚶过滤防御细菌、病毒等第一道屏障(周永灿等, 1997); 鳃是泥蚶的呼吸摄食器官, 直接与水环境接触, 具有气体交换与滤食水中颗粒物的作用(陈彩芳等, 2012), 在此过程中可能伴随弧菌的侵入。肝胰腺的主要功能是饵料消化, 弧菌会随饵料一同被泥蚶摄食, 导致肝胰腺中有大量的弧菌累积。闭壳肌的功能是控制泥蚶两壳开合, 在外套膜的免疫防线之内(赵丹等, 2020), 推测弧菌随体液循环导致闭壳肌中有弧菌被检测到。贝类的细胞免疫和体液免疫协同作用, 共同保护机体免受病原体的损害。因此, 我们推测泥蚶体内弧菌载量的迅速降低以及弧菌载量的个体差异, 可能与机体的免疫应答的强弱有关, 这种泥蚶个体水平和不同组织的载菌差异为我们进行免疫抗病性状指标的筛选提供了素材。
3.3 泥蚶体内弧菌载量与弧菌感染浓度的相关性分析无脊椎动物的免疫防御主要依赖于其先天免疫系统, 其中肝胰腺是一个重要的免疫器官(Rőszer, 2014)。本研究发现在感染早期, 随着水体中弧菌浓度的升高, 泥蚶肝胰腺的弧菌载量也随之变高。王瑞等(2019)在副溶血弧菌感染文蛤的研究中发现与本文相一致的结果, 即攻毒前期, 文蛤肝胰腺的弧菌载量随攻毒水体中弧菌浓度的升高而升高。不同强度的弧菌对泥蚶的死亡率有极大影响, 高浓度组会提前宿主的死亡时间, 且导致高死亡率。同样在哈维氏弧菌感染皱纹盘鲍(Haliotis discus hannai)的研究中也发现类似的结果(何婷婷, 2018)。不同强度的病原菌感染导致宿主产生不同程度的免疫响应。例如, 用不同浓度灿烂弧菌(Vibrio splendidus)感染厚壳贻贝(Mytkilus coruscus)能引起宿主体内免疫相关因子发生不同程度的变化, 导致宿主体内免疫机制响应的差异(梁箫等, 2018)。不同强度的弧菌感染造成泥蚶体内弧菌载量的差异, 可能会引起泥蚶免疫系统产生不同程度的响应, 最终导致死亡率差异。受到病原侵染的宿主会产生一系列免疫反应, 通过水解ATP, 消耗机体能量, 产生大量活性氧, 免疫反应过强的个体, 其活性氧分子在清除外来入侵的病原菌的同时也会对宿主的细胞、组织和器官造成损伤, 从而导致宿主生理功能的损伤和免疫系统的破坏, 这可能是除了高浓度致病菌对宿主的伤害外, 另一个造成宿主高死亡率的原因(Yu, 1994)。
4 结论本研究通过哈维氏弧菌浸泡感染来模拟泥蚶在自然界的弧菌胁迫环境。采用比浊法获得了哈维氏弧菌的计数标准曲线。通过TCBS平板计数对攻毒水体中24 h内哈维氏弧菌的浓度进行检测, 发现24 h内浓度为1×107 CFU/mL的弧菌感染组有约1/2的时间里海水中的弧菌浓度维持在预设浓度。分析了弧菌感染前后不同时间点泥蚶组织中弧菌载量的变化规律, 发现泥蚶组织中的弧菌载量呈现先上升, 再下降, 最后维持较低水平的变化趋势, 其中血液中的弧菌载量显著高于其他4个组织。采用不同浓度的哈维氏弧菌浸泡感染实验, 分析攻毒水体中的弧菌浓度与泥蚶体内肝胰腺弧菌载量的相关性分析, 发现1 d时各感染组肝胰腺弧菌载量均较对照组显著增加, 且与浸泡水体中弧菌浓度呈显著正相关, 5 d时各侵染组肝胰腺弧菌载量均较1 d明显降低, 但仍然高于对照组。研究结果为泥蚶感染弧菌发病过程中免疫识别及免疫响应机制的研究提供了参考。
王瑞, 于佳佳, 王鸿霞, 等. 2019. 副溶血弧菌攻毒过程中文蛤肝胰腺弧菌载量变化的分析. 海洋科学, 43(4): 29-35 |
刘文伟, 沈晓盛, 刘承初. 2010. 茶多酚对泥蚶中副溶血性弧菌的抑制效果. 食品与发酵工业, 36(5): 41-44 |
李太武, 李成华, 宋林生, 等. 2003. 5个泥蚶群体遗传多样性的RAPD分析. 生物多样性, 11(2): 118-124 DOI:10.3321/j.issn:1005-0094.2003.02.004 |
何婷婷, 2018. 哈维氏弧菌胁迫下不同规格皱纹盘鲍和绿盘鲍免疫应答研究. 厦门: 厦门大学硕士学位论文
|
汪青, 2012. 泥蚶血红蛋白克隆、表达与免疫相关性研究. 上海: 上海海洋大学硕士学位论文
|
沈锦玉, 潘晓艺, 尹文林, 等. 2009. 大黄鱼细菌性病原哈维氏弧菌培养特性的研究. 生物技术通报, (S1): 232-235 |
张晓华, 林禾雨, 孙浩. 2018. 弧菌科分类学研究进展. 中国海洋大学学报, 48(8): 43-56 |
陈爱平. 2005. 2004年中国水产养殖病害监测报告(二). 科学养鱼, (10): 53-54 |
陈爱平, 朱泽闻, 王立新, 等. 2007. 2006年中国水产养殖病害监测报告(一). 科学养鱼, (7): 48-49 |
陈彩芳, 沈伟良, 霍礼辉, 等. 2012. 重金属离子Cd2+对泥蚶鳃及肝脏细胞显微和超微结构的影响. 水产学报, 36(4): 522-528 |
金珊, 赵青松, 王达根, 等. 2002. 虾塘养殖泥蚶大规模死亡原因及防治对策. 水产科学, 21(6): 31-32 |
周永灿, 潘金培. 1997. 贝类细胞和体液的防御机制研究进展. 水产学报, 21(4): 449-454 |
赵丹, 周丽青, 吴彪, 等. 2020. 魁蚶各组织溶菌酶活性对鳗弧菌侵染的响应. 水产学报, 44(3): 480-486 |
钟爱华, 储张杰, 王伟洪, 等. 2020. 泥蚶(Tegillarca granosa)血细胞转录组序列中免疫相关基因的结构与mRNA表达量分析. 海洋与湖沼, 51(2): 354-363 |
梁箫, 张亚, 刘钰珠, 等. 2018. 灿烂弧菌对厚壳贻贝免疫指标和消化酶活性的影响. 水产学报, 42(9): 1438-1445 |
Asplund M E, Baden S P, Russ S et al, 2014. Ocean acidification and host-pathogen interactions: blue mussels, Mytilus edulis, encountering Vibrio tubiashii. Environmental Microbiology, 16(4): 1029-1039 DOI:10.1111/1462-2920.12307 |
Bao Y B, Li P F, Dong Y H et al, 2013b. Polymorphism of the multiple hemoglobins in blood clam Tegillarca granosa and its association with disease resistance to Vibrio parahaemolyticus. Fish & Shellfish Immunology, 34(5): 1320-1324 |
Bao Y B, Shen H P, Zhou H S et al, 2013a. A tandem-repeat galectin from blood clam Tegillarca granosa and its induced mRNA expression response against bacterial challenge. Genes & Genomics, 35(6): 733-740 |
Boots M, Bowers R G, 1999. Three mechanisms of host resistance to microparasites-avoidance, recovery and tolerance-show different evolutionary dynamics. Journal of Theoretical Biology, 201(1): 13-23 DOI:10.1006/jtbi.1999.1009 |
Cabello A E, Espejo R T, Romero J, 2005. Tracing Vibrio parahaemolyticus in oysters (Tiostrea chilensis) using a Green Fluorescent Protein tag. Journal of Experimental Marine Biology and Ecology, 327(2): 157-166 DOI:10.1016/j.jembe.2005.06.009 |
Elston R, Leibovitz L, 1980. Pathogenesis of experimental Vibriosis in larval American oysters, Crassostrea virginica. Canadian Journal of Fisheries and Aquatic Sciences, 37(6): 964-978 DOI:10.1139/f80-126 |
Howick V M, Lazzaro B P, 2017. The genetic architecture of defence as resistance to and tolerance of bacterial infection in Drosophila melanogaster. Molecular Ecology, 26(6): 1533-1546 DOI:10.1111/mec.14017 |
Murphy F A, 1987. Genetic control of host resistance to infection and malignancy: Emil Skamene, 1985, 848 pages, $98.00, New York: Alan R. Liss, Inc. Diagnostic Microbiology and Infectious Disease, 6(1): 85-86
|
Rőszer T, 2014. The invertebrate midintestinal gland ("hepatopancreas") is an evolutionary forerunner in the integration of immunity and metabolism. Cell and Tissue Research, 358(3): 685-695 DOI:10.1007/s00441-014-1985-7 |
Roy B A, Kirchner J W, 2000. Evolutionary dynamics of pathogen resistance and tolerance. Evolution, 54(1): 51-63 DOI:10.1111/j.0014-3820.2000.tb00007.x |
Shao Y Q, Chai X L, Xiao G Q et al, 2016. Population genetic structure of the blood clam, Tegillarca granosa, along the Pacific coast of Asia: isolation by distance in the sea. Malacologia, 59(2): 303-312 DOI:10.4002/040.059.0208 |
Shi W, Zhao X G, Han Y et al, 2016. Ocean acidification increases cadmium accumulation in marine bivalves: a potential threat to seafood safety. Scientific Reports, 6(1): 20197 DOI:10.1038/srep20197 |
Song D, Lin Z, Fu W et al, 2017. Hemoglobin from the blood clam Tegillarca granosa (Tg-HbIIA, Tg-HbIIB): expression and antibacterial activity of recombinant proteins. Invertebrate Survival Journal, 14(1): 149-156 |
Tamplin M L, Capers G M, 1992. Persistence of Vibrio vulnificus in tissues of Gulf Coast oysters, Crassostrea virginica, exposed to seawater disinfected with UV light. Applied and Environmental Microbiology, 58(5): 1506-1510 DOI:10.1128/aem.58.5.1506-1510.1992 |
Wang D P, Yu S J, Chen W Y et al, 2010. Enumeration of Vibrio parahaemolyticus in oyster tissues following artificial contamination and depuration. Letters in Applied Microbiology, 51(1): 104-108 |
Yang M H, Chen M L, Liu G S et al, 2020a. Molecular cloning and characterization of a cDNA encoding extracellular signal-regulated kinase (ERK) from the blood clam Tegillarca granosa. Developmental & Comparative Immunology, 105: 103602 |
Yang S, Dong Y T, Aweya J J et al, 2020b. Antimicrobial activity and acting mechanism of Tegillarca granosa hemoglobin-derived peptide (TGH1) against Vibrio parahaemolyticus. Microbial Pathogenesis, 147: 104302 DOI:10.1016/j.micpath.2020.104302 |
Yu B P, 1994. Cellular defenses against damage from reactive oxygen species. Physiological Reviews, 74(1): 139-162 DOI:10.1152/physrev.1994.74.1.139 |
Zha S J, Liu S X, Su W H et al, 2017. Laboratory simulation reveals significant impacts of ocean acidification on microbial community composition and host-pathogen interactions between the blood clam and Vibrio harveyi. Fish & Shellfish Immunology, 71: 393-398 |
 2021, Vol. 52
2021, Vol. 52


