
中国海洋湖沼学会主办。
文章信息
- 崔梦露, 郇聘, 刘保忠. 2021.
- CUI Meng-Lu, HUAN Pin, LIU Bao-Zhong. 2021.
- 笠贝(Lottia goshimai)早期发育过程的扫描电镜观察
- EARLY DEVELOPMENT OF LOTTIA GOSHIMAI REVEALED BY SCANNING ELECTRON MICROSCOPY
- 海洋与湖沼, 52(6): 1514-1520
- Oceanologia et Limnologia Sinica, 52(6): 1514-1520.
- http://dx.doi.org/10.11693/hyhz20210300068
文章历史
-
收稿日期:2021-03-15
收修改稿日期:2021-05-06
2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
软体动物(Mollusca)是第一大海洋动物类群, 其身体结构模式存在巨大的多样性, 典型类群如头足类(章鱼等)、腹足类(螺等)、双壳类(牡蛎等)等表观差异很大(Haszprunar et al, 2012; Wanninger et al, 2019)。与之相对的是, 软体动物的早期发育过程十分相似。多数间接发育的软体动物都有面盘幼虫阶段(veliger), 其中的相当一部分如双壳类和部分腹足类还共享更早的担轮幼虫阶段(trochophore)。
除头足类等特化类型外, 软体动物胚胎早期发育主要存在两种模式。在以牡蛎等为代表的物种中, 其前两次卵裂不对称, 形成A、B、C、D四个卵裂球, 其中D卵裂球体积最大, 大体对应胚胎背部。而在另外一些动物如笠贝、鲍中, 其前两次卵裂为均等分裂, 形成的四个卵裂球没有形态上的差异, 其背腹向的极性要等到第五次卵裂后(32细胞期)才会开始形成。对这类胚胎而言, 接近64细胞期的胚胎才能观察到背腹方向上的不对称。研究表明, 虽然发育模式存在差别, 在分子水平上, 两类胚胎背腹轴的建立依赖相同的信号网络, MAPK信号通路在其中发挥重要功能(Lambert et al, 2001; Lambert et al, 2003)。在背腹极性形成后, 很快开始原肠作用及器官发生等重要的发育事件。由于前期卵裂模式的差异, 两类胚胎的后续发育也有很大差别。例如双壳类等不等裂类型的动物中, 原肠作用主要依赖于内胚层细胞的内陷, 细胞运动较少(Kurita et al, 2009), 而等裂类型胚胎的原肠作用则涉及大量细胞的运动, 体现为外包等形式(Lartillot et al, 2002)。最终, 通过上述迥异的发育模式, 不同类群的软体动物均能形成形态和结构均极为相似的担轮幼虫。
典型担轮幼虫的身体被一个由纤毛组成的前担轮环(prototroch)分为前后两部分。前部包括顶纤毛、幼虫眼等结构, 后部包括了主要的身体结构如位于背侧及腹侧的贝壳和足原基, 部分类群动物的担轮幼虫在身体末端还存在后端纤毛环(telotroch)。许多软体动物中后端纤毛环可简化为几束纤毛, 本文中称作端纤毛。与其他多数原口动物相同, 神经系统及胚孔(幼虫口)分布在担轮幼虫腹侧。担轮幼虫时期后, 幼虫逐渐出现软体动物门乃至更低级分类阶元(纲、亚纲等)特异性的性状, 如形状各异的贝壳及足等。软体动物如何采用不同的策略来发育为担轮幼虫, 担轮幼虫形成后又如何形成各个类群的独特特征(lineage-specific characters), 是软体动物发育生物学研究的重要科学问题。要解答这个问题, 需要对不同类群软体动物的发育模式开展精细分析, 并在分子和细胞水平开展比较研究。
山东青岛沿海分布的笠贝(Lottia goshimai Nakayama, Sasaki & Nakano, 2017)隶属于软体动物门腹足纲, 其发育过程属于典型的等裂类型, 是研究该类发育模式的理想研究对象。在前面的工作中, 我们研究了其贝壳和足等重要器官的发育过程(谭素建等, 2018; 王倩等, 2019)。本研究基于扫描电子显微镜观察全面分析了笠贝早期发育过程。结果表明, 笠贝的早期发育过程呈现诸多与近缘门类动物可类比的特点, 同时也存在其自身的特殊性, 是发育和演化研究的理想对象。
1 材料与方法 1.1 笠贝采集及幼虫培养成体笠贝采集自山东青岛沿海。在夏季繁殖期, 采集的成熟亲贝可在数小时内产卵排精, 将精卵混合进行人工受精后, 受精卵置于25 ℃的海水中恒温培养。收集不同发育阶段胚胎或幼虫, 利用2.5%戊二醛固定。对于面盘幼虫, 先使用氯化镁溶液麻醉后再固定, 以免幼虫肌肉收缩干扰观察效果。
在本文中, 利用受精后的发育时长(hours post fertilization, hpf)来衡量胚胎及幼虫的发育阶段, 例如6 hpf即是指受精后6 h的胚胎样品。本研究所选择的发育时期主要包括卵裂期胚胎(3 hpf)、原肠胚(4—8 hpf)、担轮幼虫(9—13 hpf)以及面盘幼虫(14—24 hpf)。需要说明的是, 笠贝的发育是一个连续、渐变的过程, 上述对不同发育阶段的界定办法是根据特征性结构大体划定的, 并不绝对。目前在贝类发育领域对该问题尚无一个统一的标准, 其他学者可能有不同的观点(如认为8 hpf的样品为担轮幼虫)。前述界定标准可以将笠贝的发育与其他动物进行最大程度的类比, 因此本文选择了这种方式。
1.2 扫描电子显微镜观察戊二醛固定的样品经乙醇脱水后梯度转移至乙酸异戊酯中, 经超临界二氧化碳干燥后喷金, 于扫描电子显微镜下观察。
2 结果 2.1 原肠作用前的笠贝胚胎(4 hpf前)同其他多数软体动物一样, 笠贝的卵裂模式是典型的螺旋卵裂。3.5 hpf左右, 胚胎发育至60—64细胞阶段, 进入原肠作用的起始阶段。在原肠作用发生之前, 胚胎形态是规则的球状, 结构比较简单。在此阶段胚胎背腹轴尚未形成, 通过扫描电镜观察不到背侧和腹侧的区别, 早期受精时形成的极体尚能分辨(图 1a, 黄色箭头)。该阶段比较明显的变化是纤毛细胞的发育(图 1)。3 hpf时已经可以观察到胚胎表面的部分细胞有纤毛形成, 4个细胞为一组, 共4组, 这是将来形成前担轮环(prototroch)的主要细胞群体。
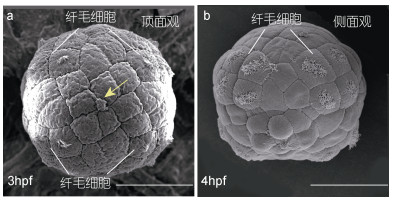 |
| 图 1 原肠作用前的笠贝胚胎 Fig. 1 Embryos of L. goshimai before gastrulation 注: a. 3 hpf; b. 4 hpf。黄色箭头表示极体。比例尺为50 μm |
笠贝胚胎从3.5—4 hpf进入原肠作用阶段, 8 hpf时原肠作用基本完成。在这一阶段细胞分化和运动剧烈, 胚胎的形态发生了巨大的变化, 产生了一系列特征性结构。
(1) 前担轮环逐渐形成
3 hpf时观察到的四簇纤毛细胞逐渐变形并相互靠拢, 临近的一些其他细胞也开始逐渐长出纤毛。5 hpf时, 纤毛细胞细胞已经较为规律围绕胚胎形成一个圆环, 构成前担轮环的雏形(图 2a), 在6 hpf时前担轮环已经基本形成(图 2c, 2h)。
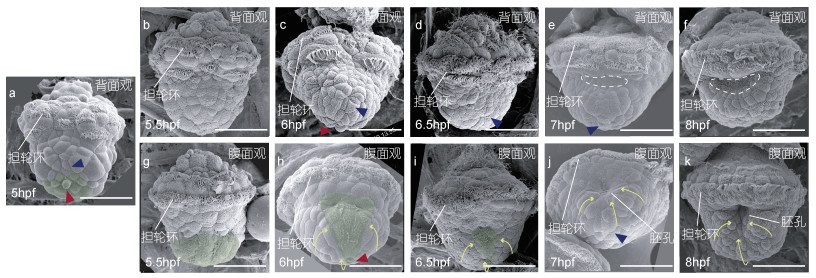 |
| 图 2 原肠胚阶段的笠贝胚胎 Fig. 2 Embryos of L. goshimai during gastrulation 注: 绿色阴影: 内胚层细胞; 白色虚线: 贝壳形成区; 蓝色三角: 端纤毛细胞; 红色三角: 一个发育过程中出现的特殊细胞, 形态与其他细胞存在差别; 黄色箭头: 背侧细胞运动方向。比例尺为50 μm |
(2) 细胞剧烈运动
通过原肠作用, 胚胎形成外胚层在外部而中、内胚层细胞在内部的三个胚层。在笠贝中, 主要的中胚层细胞在原肠作用早期形成时即已经位于胚胎内部, 而内胚层则还暴露在外部。因此笠贝的原肠作用主要涉及内胚层细胞的内化, 这主要通过细胞运动完成。在这个时期, 外胚层和内胚层细胞可以根据细胞表面是否存在微绒毛状结构区分开来(该结构仅存在于内胚层细胞中, 见图 2绿色阴影部分)。扫描电镜观察可见, 随着原肠作用地进行, 内胚层细胞逐渐被外胚层细胞所包被, 呈现经典的外包过程。这种外包由背侧外胚层细胞引发, 分别向左、右、后三个方向包裹内胚层细胞, 直至在腹侧愈合(图 2g—2k)。内胚层细胞逐渐进入胚胎内部, 并将部分与其相连的外胚层细胞带入, 最终在7—8 hpf时二者共同形成了胚孔(blastopore) (图 2j, 2k), 这是将来幼虫口的雏形。从以上过程可以看出, 笠贝胚胎原肠作用中向腹侧的细胞运动导致形成了腹侧结构, 包括胚孔和腹板(ventral plate, 见下方描述)。另外需要指出的是, 尽管从外表上看起来笠贝原肠作用仅限于由背侧向腹侧的细胞运动(外包), 但有证据表明在靠近前担轮环的区域存在一个反方向的、腹侧向背侧的外胚层细胞运动(Yang et al, 2020)。相应的, 向背侧运动的细胞形成了胚胎的背侧结构(贝壳发育区, 见下方描述)。
(3) 背腹侧发育差异逐渐显现, 典型的背腹侧结构出现
除了明显的细胞运动过程, 在原肠作用开始的前50%阶段, 没有明显的组织和细胞分化。如上所述, 胚孔大约在7 hpf形成于腹侧组织中。此时, 腹侧的其他外胚层细胞呈现一种两侧对称分布的模式, 即腹板(图 2j, 2k)。腹板细胞可以大致认为是神经外胚层, 是将来足原基的一部分(王倩等, 2019)。在背侧, 多数外胚层细胞逐渐形成同心圆状排列, 从7 hpf开始, 靠近前担轮环的区域开始出现凹陷(图 2e), 开始形成贝壳形成区(shell field)。随着内陷区域细胞的表面逐渐发育出绒毛状结构, 至8 hpf时一个典型的贝壳形成区形成, 包括内陷的表面密布微绒毛的细胞, 以及外缘部分同心圆状排列的细胞(图 2f)。
(4) 原肠作用过程存在一些外观独特的细胞
在观察笠贝胚胎发育的过程中, 我们在某些时间点观测到一些明显与邻近细胞形态不一致的细胞。5—6 hpf时, 靠近背侧的底面有一呈圆形并且比较突出的细胞(图 2a, 2c, 2h, 红色三角)。分析其位置发现该细胞似乎是内陷细胞群中最边缘且最靠近背侧的一个细胞, 出现在三角形内陷细胞群体的尖端(图 2a, 2h)。从5 hpf开始, 可以观察到胚胎的底部有两到三个表面有纤毛生长的细胞, 这是端纤毛细胞(图 2, 蓝色三角)。
2.3 幼虫发育过程(9—24 hpf)笠贝幼虫贝壳自9 hpf即形成, 同时腹侧的胚孔也进一步缩小, 与之后幼虫期的口没有明显差异。因此, 可以大体认为笠贝在9 hpf进入了担轮幼虫时期。担轮幼虫是软体动物的重要发育阶段, 具备特征性的结构, 主要包括背侧的贝壳和腹侧的足原基以及幼虫口。但是我们没有在身体末端观察到肛门, 可能与笠贝幼虫摄食现象不明显相关。在这个阶段, 前担轮环部位的纤毛细胞变化不大。笠贝的担轮幼虫期很短, 仅数小时, 14 hpf左右贝壳已经包被了大部分幼虫身体(图 3i), 进入早期面盘幼虫阶段, 至24 hpf时形成典型的面盘幼虫(图 3j)。这两个幼虫阶段尽管形态存在差别, 但是其发育过程是连续和渐变的, 因此下面整体介绍这个阶段的幼虫发育情况。
 |
| 图 3 笠贝幼虫发育过程 Fig. 3 Larval development of L. goshimai 注: a—g为担轮幼虫阶段, h—j为面盘幼虫阶段。虚线表示幼虫贝壳, 蓝色三角表示端纤毛细胞。比例尺为50 μm |
在背侧, 贝壳形成区逐渐重新外翻并且面积迅速扩大(图 3a—3d)。9 hpf时的贝壳形成区还具有较深的凹陷, 凹陷内部的细胞表面有绒毛样结构, 可能是伪足(lamellipodia), 凹陷区外围的细胞呈规律的长条形紧密的分布(图 3a)。我们之前的研究表明, 此时幼虫贝壳已经开始形成(Yang et al, 2020)。10 hpf时, 贝壳形成区进一步变大, 凹陷深度变浅, 凹陷区细胞表面伪足消失, 贝壳十分明显, 周围长条形的细胞变得扁平(图 3b)。11—12 hpf, 贝壳飞速扩张, 中央部位略微突起(图 3c, 3d)。到12 hpf时, 贝壳基本覆盖整个背部(图 3d)。在之后的发育中, 贝壳继续向后端和腹侧生长, 逐渐包被整个幼虫(图 3h—3j)。
在腹侧, 胚孔逐渐收缩形成口, 口两侧的腹板部位逐渐形成两团隆起且对称的细胞(图 3e), 标志着足原基开始逐渐形成。在10—11 hpf时, 这些隆起的细胞团之间原本存在的凹陷消失, 这些细胞团融合成一个完整的组织, 构成足原基的雏形(图 3f, 3g)。在之后的发育中, 由于贝壳的包裹和入侵, 足原基逐渐埋入贝壳的生长缘下方。本来位于身体末端的端纤毛细胞随着贝壳的推挤也向腹侧移动, 并始终位于足原基后方, 其上的纤毛进一步变长变多, 形成1簇长纤毛(图 3f, 3h—3j)。在24 hpf, 这些纤毛细胞尚未被卷入胚胎内部, 而是形成了一个单独的突起结构(图 3j)。这些细胞是否整合入了足原基的发育, 抑或者形成了别的结构, 尚待进一步研究。
3 讨论作为典型的等裂型发育的软体动物, 笠贝的早期发育过程呈现几个关键特点。首先, 前几次卵裂为等裂, 其早期胚胎没有明显的不对称性, 无法分辨背腹侧。其次, 其原肠作用体现为内陷和外包合并进行的特点, 涉及大量的细胞运动过程。最后, 其发育过程中出现典型的担轮幼虫和面盘幼虫阶段, 既呈现出软体动物乃至螺旋卵裂动物(Spiralia)的共同特点, 又有种系特异性特征。对这些发育过程的系统分析, 可为比较不同软体动物的发育模式、深入探讨软体动物的发育机制提供基础支持。
前担轮环是担轮幼虫最有特色的结构。在前担轮环形成过程中, 早期的纤毛细胞呈现四个细胞一组、共四组细胞同时出现、同步发育的特点。软体动物早期的螺旋卵裂方式极其保守, 每个卵裂球均有标准命名, 可以用于追踪细胞谱系并开展不同种类间的比较。卵裂球的命名规则主要包括具体的谱系(A、B、C、D)、是否是大卵裂球(大写或小写字母)、来自第几次卵裂(前缀及上标)等。例如1a1细胞即指第四次卵裂时, 位于动物极的1a细胞分裂后形成的偏向动物极一侧的子细胞。在某些情况下需要描述地位相当的全部四个谱系的细胞, 此时用q/Q来指代(quartet的缩写)。例如, 1q1即是1a1—1d1四个细胞的统称。贝类早期胚胎纤毛细胞的起源比较清楚, 细胞谱系分析表明它们来自于第四次卵裂形成的1q2细胞(Dictus et al, 1997)。这种发育模式十分普遍, 此前我们在牡蛎胚胎中也发现了这种现象(Tan et al, 2017)。事实上, 1q2细胞发育成前担轮环, 并进一步将胚胎分为前后两个部分, 是包括软体动物在内的螺旋卵裂动物发育的一个共有模式(Nielsen, 2004, 2005)。因此, 前担轮环的发育可能是螺旋卵裂动物演化过程中十分重要的一环, 也是历来发育与演化生物学研究所关注和强调的重点(Nielsen, 2018)。在最近的一项研究中, 研究人员筛选了只在螺旋卵裂动物存在的特异性基因, 发现一部分这类基因仅表达于前担轮环部位(Wu et al, 2020)。这些结果再次强调了前担轮环在螺旋卵裂动物中的重要地位。前担轮环的发育机制研究将继续是螺旋卵裂动物发育与演化研究的关键科学问题。
原肠作用及背腹轴的建立是本研究的重点问题。在包括笠贝在内的多种软体动物中, 背腹轴的形成及原肠作用深度整合(Lyons et al, 2014), 我们的扫描电镜观察结果再次证实了这个观点。例如, 从4 hpf至8 hpf能够观察到多个细胞由背侧逐渐迁移到腹侧的过程(图 2)。因此从某种意义上说, 对原肠作用的研究是解析笠贝背腹轴形成机制的关键问题。事实上, 软体动物原肠作用方式与早期卵裂方式、背腹轴形成机制似乎已经完全联系在一起。例如, 履螺(Crepidula fornicata)的早期卵裂中虽然存在极叶, 但其极叶极小(Henry et al, 2008)。虽然严格意义上其早期分裂应该属于不等分裂, 但四个卵裂球差异不明显, 与等裂型胚胎极为相似。相应地, 履螺的原肠作用也主要是外包, 背腹轴向的差异也是在这个过程中逐渐发育出来(Lyons et al, 2015)。这些结果提示, 存在一些遗传上的限制, 使软体动物的等裂型胚胎(以及近似等裂的胚胎)不约而同地选择外包式的原肠化过程, 并采取相应的背腹轴形成机制。这与其他动物存在显著区别。例如半索动物或者棘皮动物中, 等裂型胚胎的原肠作用多仅限于内陷而无明显的外包过程(Lowe et al, 2006; Lapraz et al, 2009)。这一方面体现了不同类群动物在发育模式上的不同选择, 另一方面也反映了其祖先传递给它们基因“工具箱”(gene toolkit)存在差异(Erwin, 2009)。这些动物为分析不同发育过程的遗传限制提供了绝佳的研究对象。深入解析软体动物卵裂模式—原肠作用—背腹轴形成三者紧密联系背后的遗传机制, 可能是理解软体动物发育的重要方面。
笠贝背腹轴形成除上述提到的外包这一主要内容外, 我们还通过扫描电镜观察到了一些之前研究中尚未描述的典型细胞, 例如位于内陷细胞群最边缘的突起细胞(图 2a)。目前, 该细胞的本质及其发育功能尚不能确定, 但独特的形态特征提示它可能有较为特殊的功能和地位。对于发育生物学研究而言, 这类细胞可以作为特定的路标指示物, 辅助分辨胚胎期的结构, 其发育状态和空间定位也可以作为发育分期的依据。目前对于软体动物早期发育基因的研究十分活跃, 在后续的研究中有望鉴定这类细胞特有的标记基因, 进而解析其发育功能。
担轮幼虫形成后的发育过程中, 笠贝幼虫既体现出软体动物的共有特点, 也存在其种系特异性的发育过程。其中, 软体动物幼虫的共有特征包括背部的贝壳和腹部的足(图 3)。从扫描电镜结果可以看出, 幼虫贝壳形成后经历了一个快速的生长过程, 并在几小时内包裹整个幼虫。与之相反, 足的发育则十分缓慢, 在我们的研究窗口中一直局限在一个原基的状态。在前面的研究中我们解析了足原基的早期形成过程(王倩等, 2019), 在此不再赘述。笠贝种系特异性的发育特点主要体现在贝壳和面盘上。首先, 笠贝幼虫贝壳的生长方向为背部—后方—腹部, 这是腹足纲动物的一个典型特点。而与此相对的是, 双壳类及掘足类(角贝)的幼虫贝壳则由背部向左右两侧生长(Wanninger et al, 2001; Huan et al, 2013), 这体现出不同类群软体动物贝壳生长模式的显著差别。其次, 笠贝幼虫的面盘并不显著扩张, 这与其他腹足纲动物显著不同。在其他贝类(如脉红螺及许多双壳贝类等)中, 前担轮环在面盘幼虫期极度扩张, 形成两片巨大的叶状结构, 辅助幼虫游泳。目前, 对于这种面盘发育模式的差异还没有一个统一的解释, 可能与它们的生存策略有关。这些差异是理解不同软体动物发育机制和适应策略的重要方面。
4 结论本研究中利用扫描电镜观察了典型海洋软体动物笠贝的早期发育过程。研究结果发现笠贝胚胎在前担轮环形成、原肠作用等方面体现出与诸多螺旋卵裂动物相似的保守特征, 同时还描述了笠贝胚胎在贝壳生长方式及面盘发育上的独特特点。这些结果为理解软体动物的发育机制, 探讨不同软体动物类群的演化机制提供了基础支持。
王倩, 郇聘, 刘保忠. 2019. 笠贝soxb、mox基因的鉴定及在足原基发育中的表达模式. 海洋与湖沼, 50(5): 1091-1097 |
谭素建, 郇聘, 刘保忠. 2018. 一种酪氨酸酶基因在笠贝初生壳形成中的表达分析. 海洋科学, 42(9): 17-21 |
Dictus W J A G, Damen P, 1997. Cell-lineage and clonal-contribution map of the trochophore larva of Patella vulgata (mollusca). Mechanisms of Development, 62(2): 213-226 DOI:10.1016/S0925-4773(97)00666-7 |
Erwin D H, 2009. Early origin of the bilaterian developmental toolkit. Philosophical Transactions of the Royal Society B: Biological Sciences, 364(1527): 2253-2261 DOI:10.1098/rstb.2009.0038 |
Haszprunar G, Wanninger A, 2012. Molluscs. Current Biology, 22(13): R510-R514 DOI:10.1016/j.cub.2012.05.039 |
Henry J J, Perry K J, 2008. MAPK activation and the specification of the D quadrant in the gastropod mollusc, Crepidula fornicata. Developmental Biology, 313(1): 181-195 DOI:10.1016/j.ydbio.2007.10.019 |
Huan P, Liu G, Wang H X et al, 2013. Identification of a tyrosinase gene potentially involved in early larval shell biogenesis of the Pacific oyster Crassostrea gigas. Development Genes and Evolution, 223(6): 389-394 DOI:10.1007/s00427-013-0450-z |
Kurita Y, Deguchi R, Wada H, 2009. Early development and cleavage pattern of the Japanese purple mussel, Septifer virgatus. Zoological Science, 26(12): 814-820 DOI:10.2108/zsj.26.814 |
Lambert J D, Nagy L M, 2001. MAPK signaling by the D quadrant embryonic organizer of the mollusc Ilyanassa obsoleta. Development (Cambridge, England), 128(1): 45-56 DOI:10.1242/dev.128.1.45 |
Lambert J D, Nagy L M, 2003. The MAPK cascade in equally cleaving spiralian embryos. Developmental Biology, 263(2): 231-241 DOI:10.1016/j.ydbio.2003.07.006 |
Lapraz F, Besnardeau L, Lepage T, 2009. Patterning of the dorsal-ventral axis in echinoderms: insights into the evolution of the BMP-chordin signaling network. PLoS Biololgy, 7(11): e1000248 DOI:10.1371/journal.pbio.1000248 |
Lartillot N, Lespinet O, Vervoort M et al, 2002. Expression pattern of Brachyury in the mollusc Patella vulgata suggests a conserved role in the establishment of the AP axis in Bilateria. Development, 129(6): 1411-1421 DOI:10.1242/dev.129.6.1411 |
Lowe C J, Terasaki M, Wu M et al, 2006. Dorsoventral patterning in hemichordates: Insights into early chordate evolution. PLoS Biology, 4(9): e291 DOI:10.1371/journal.pbio.0040291 |
Lyons D C, Henry J Q, 2014. Ins and outs of spiralian gastrulation. International Journal of Developmental Biology, 58(6-8): 413-428 |
Lyons D C, Perry K J, Henry J Q, 2015. Spiralian gastrulation: germ layer formation, morphogenesis, and fate of the blastopore in the slipper snail Crepidula fornicata. EvoDevo, 6(1): 24 DOI:10.1186/s13227-015-0019-1 |
Nielsen C, 2004. Trochophora larvae: Cell-lineages, ciliary bands, and body regions. 1. Annelida and Mollusca. Journal of Experimental Zoology, 302B(1): 35-68 DOI:10.1002/jez.b.20001 |
Nielsen C, 2005. Trochophora larvae: cell-lineages, ciliary bands and body regions. 2. Other groups and general discussion. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution, 304B(5): 401-447 DOI:10.1002/jez.b.21050 |
Nielsen C, 2018. Origin of the trochophora larva. Royal Society Open Science, 5(7): 180042 DOI:10.1098/rsos.180042 |
Tan S J, Huan P, Liu B Z, 2017. Expression patterns indicate that BMP2/4 and Chordin, not BMP5-8 and Gremlin, mediate dorsal-ventral patterning in the mollusk Crassostrea gigas. Development Genes and Evolution, 227(2): 75-84 DOI:10.1007/s00427-016-0570-3 |
Wanninger A, Haszprunar G, 2001. The expression of an engrailed protein during embryonic shell formation of the tusk-shell, Antalis entalis (Mollusca, Scaphopoda). Evolution & Development, 3(5): 312-321 |
Wanninger A, Wollesen T, 2019. The evolution of molluscs. Biological Reviews, 94(1): 102-115 DOI:10.1111/brv.12439 |
Wu L J, Hiebert L S, Klann M et al, 2020. Genes with spiralian-specific protein motifs are expressed in spiralian ciliary bands. Nature Communications, 11(1): 4171 DOI:10.1038/s41467-020-17780-7 |
Yang W H, Huan P, Liu B Z, 2020. Early shell field morphogenesis of a patellogastropod mollusk predominantly relies on cell movement and F-actin dynamics. BMC Developmental Biology, 20(1): 18 DOI:10.1186/s12861-020-00223-3 |
 2021, Vol. 52
2021, Vol. 52


