
中国海洋湖沼学会主办。
文章信息
- 李萌, 李秀保, 顾志峰, 夏景全, 王爱民, 刘春胜. 2021.
- LI Meng, LI Xiu-Bao, GU Zhi-Feng, XIA Jing-Quan, WANG Ai-Min, LIU Chun-Sheng. 2021.
- 海南岛近海砗磲(Tridacninae)资源时空变化——以蜈支洲岛为例
- TEMPORAL AND SPATIAL VARIATION OF GIANT CLAMS (TRIDACNINAE) RESOURCES IN COASTAL WATERS OF HAINAN: A CASE STUDY OF WUZHIZHOU ISLAND
- 海洋与湖沼, 52(6): 1521-1529
- Oceanologia et Limnologia Sinica, 52(6): 1521-1529.
- http://dx.doi.org/10.11693/hyhz20210500113
文章历史
-
收稿日期:2021-05-08
收修改稿日期:2021-06-27
2. 海南大学海洋学院 海口 570228
2. The Ocean College, Hainan University, Haikou 570228, China
砗磲隶属于软体动物门、双壳纲、帘蛤目、砗磲科(张素萍, 2008)。世界现存有12种(Richter et al, 2008; Huelsken et al, 2013; Penny et al, 2014; Su et al, 2014; Borsa et al, 2015), 在我国砗磲共计有8种, 主要分布于台湾和南海各岛礁近海海域(刘小霞等, 2017; Zhang et al, 2020; Liu et al, 2021)。在20世纪60年代之前, 砗磲是我国南海珊瑚礁生态系统的优势种类之一, 也是海南当地渔民重要的海产品(丁导生, 1958; 李元超等, 2015)。近年来, 由于海洋环境改变、珊瑚礁系统退化及偷捕滥采等原因, 包括我国在内的全球砗磲的资源量急剧下降, 某些地区的部分种类甚至濒临灭绝(Gomez et al, 2006; Othman et al, 2010; Neo et al, 2012; 李元超等, 2015)。
为系统厘清我国砗磲资源现状, 崔丹等(2019)和刘春胜等(2021)分别对海南岛近岸, 尤其是三亚近海的砗磲进行了调查, 结果表明海南岛周边砗磲资源量不容乐观, 三亚珊瑚礁国家自然保护区砗磲密度仅为0.94×10–2 ind./m2 (刘春胜等, 2021), 临高和文昌等部分海域砗磲已经绝迹(崔丹等, 2019)。然而, 相较于珊瑚、鱼类等其他物种, 我国对砗磲资源动态变化缺乏长期持续监测数据。此外, 尽管砗磲为珊瑚礁生态系统的重要组成部分, 且其在相同单位面积内的初级生产力是硬珊瑚类(Manicina sp.)的50倍左右, 但砗磲在珊瑚礁生态系统的重要性在国内尚未引起足够重视(Neo et al, 2015)。
蜈支洲岛位于三亚海棠湾, 早期为荒僻海岛, 受人类活动影响相对较少, 2001年后, 该岛作为旅游区对外开放。项目组自2017年, 持续对蜈支洲岛周边珊瑚礁生物及水质指标进行了系统调查, 获得了2017—2020年四年相关调查数据。为查明我国海南本岛临近海域砗磲资源时空变动规律及主要影响因素, 本文以三亚蜈支洲岛为代表性海域, 通过对前期调查数据分析, 研究了: (1) 蜈支洲岛周边海域砗磲时空分布规律, 及其与珊瑚覆盖率和水质变化的相关性; (2) 不同调查站位和调查时间下, 砗磲外套膜颜色与周边底质颜色相关性。
1 材料与方法 1.1 站位选择与现场调查本研究基于李秀保等(2019b)在2017年对蜈支洲岛水质环境因子和珊瑚礁群落调查的基础上, 同时根据各站位海底地形、海岸线特征及旅游扰动等因素, 最终选取蜈支洲岛北侧站位9、11和13, 三个站位, 以及南侧站位3和4, 两个站位进行长期监测(李秀保等, 2019b) (图 1)。
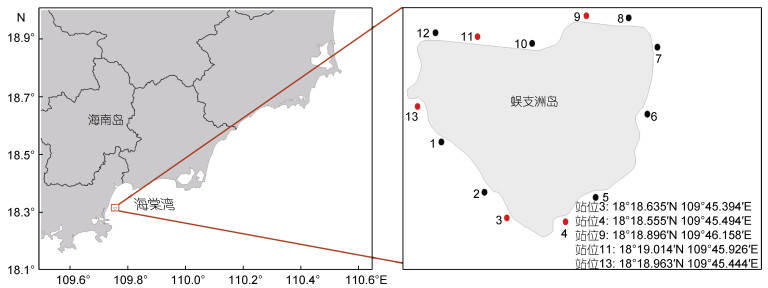 |
| 图 1 蜈支洲岛周边海域砗磲调查站位图 Fig. 1 Map of giant clam survey sites in Wuzhizhou Island 注: 站位1—13参考李秀保等(2019b)系统调查命名 |
砗磲资源及水质因子具体调查方法为: 在每个调查站位平潮线下3 m和8 m处分别设置一条长100 m、宽25 cm的调查断面; 将100 m的皮尺分成4段长25 m的样带, 并使样带断面布设与岸线平行(用钢钎和轧带水下固定、标记, 在样带的头部尾部用GPS标记定位) (许慧丽, 2020); 使用水下数码摄像机进行拍摄, 从样带的一端开始并沿着断面线拍摄直至另一端结束。拍摄中如遇砗磲, 使用水下照相机对其外套膜及周边底质进行拍照, 并且对壳长进行测量。现场调查过程中, 2017年站位3的8 m水深、2018年站位3的3 m水深和站位4的3 m水深数据, 因风浪原因未采集。
1.2 砗磲生物量及个体大小统计将影像资料用计算机回放, 对视频和照片资料重新判读, 统计砗磲数量及规格。
1.3 水温及水质参数测定水环境参数获取参考国际上通用的珊瑚礁调查方法(English et al, 1997)。用CTD温盐深仪现场观测海水的温度, 用GFF玻璃纤维滤膜过滤水样后冷冻保存, 带回实验室后用营养盐自动分析仪对海水溶解的无机营养盐进行测量(每组至少三个重复)。测定并记录海水温度T, 溶解无机氮DIN、亚硝酸盐NO2-、硝酸盐NO3-、磷酸盐PO43-和硅酸盐SiO42-浓度。
1.4 调查站位底质分析参考国际通用的截线样条法(linear point intercept method)对各站位底质类型进行分析(Nadon et al, 2006)。具体为, 将25 m皮尺分成250个点, 统计这250个点下对应的底质类型(分为珊瑚、礁石和砂石3类), 最后再进行不同底质类型覆盖率的统计, 并且对各底质包含的砗磲数进行统计。
1.5 砗磲外套膜及周边底质颜色参数的获取及相关性分析基于现场调查砗磲影像资料, 选取图像清晰、外套膜舒展个体, 对砗磲外套膜与周边环境的颜色进行采集与分析, 方法参考Todd等(2009)和刘春胜等(2021), 并稍作修改, 具体如下:
(1) 图片采集: 于晴天10:00—14:00光线充足时间段对砗磲及周边底质进行图片采集。图片采集过程中使用同一相机(佳能EOS 6D MarkⅡ)。拍照时相机距砗磲0.5 m且与底质呈45°角, 拍照参数为M (快门速度) 1/15, F (光圈大小) 5.0, ISO (感光度) 200, 放大倍数1.9倍。
(2) 图片分析: 从砗磲照片中选取清晰且外套膜舒展的个体进行颜色数据分析。先用Photoshop作图软件截取待测砗磲外套膜及周边底质照片, 而后将截取的待分析照片导入ImageJ图像处理软件进行颜色分析。砗磲外套膜和周边底质各随机选取5个点, 获得其R、G和B值(分别对应三原色中的红色、绿色、蓝色, 数值范围均为0—255)。而后将五个点R、G和B值的平均值作为相应图片的颜色参数。
1.6 数据统计实验结果用平均值±标准误(Means±S.E.)表示。不同站位和不同年份间砗磲密度、珊瑚覆盖率采用二因素方差分析(ANOVA), 并进行Turkey多重比较。利用R语言corrplot包对水质环境因子与砗磲密度之间进行相关性分析。砗磲外套膜与周边底质颜色相关性采用一元直线回归及相关性统计方法进行分析。数据分析采用DPS统计学软件, 差异显著水平为P < 0.05。
2 结果 2.1 不同调查站位和年份下砗磲分布规律及种群结构如表 1所示, 蜈支洲岛周边3 m水深或者8 m水深海域砗磲密度与站位呈显著相关性(P < 0.05), 与调查年份无显著相关性(P > 0.05)。此外, 3 m水深海域, 站位与调查年份对砗磲密度有显著交互作用(P < 0.05)。各站位间砗磲密度分析表明: 3 m水深处, 2017年站位3和站位11的砗磲密度分别为30.00×10–2 ind./m2和25.00×10–2 ind./m2, 显著高于站位9和站位13各年的砗磲密度(P < 0.05)。8 m水深处2019年站位3的砗磲密度为15.00×10–2 ind./m2也显著高于其他年份其他站位的砗磲密度(P < 0.05); 同一站位不同年份砗磲密度分析表明: 3 m水深处, 站位3和4的砗磲密度随时间显著降低(P < 0.05)。站位11在2018年调查的砗磲密度显著低于其他各调查年份(P < 0.05)。站位9和13各调查年份几乎未发现砗磲。
| 站位 | 年份 | 砗磲密度(×10–2 ind./m2) | |
| 3 m水深 | 8 m水深 | ||
| 3 | 2017 | 30.00±2.89a(6) | ND |
| 2018 | ND | 5.00±2.50b(1) | |
| 2019 | 5.00±2.50c(1) | 15.00±4.79a(3) | |
| 2020 | 5.00±2.50 c (1) | 0.00±0.00 b | |
| 4 | 2017 | 10.00±2.89 ab(2) | 0.00±0.00 b |
| 2018 | ND | 5.00±2.50 b(1) | |
| 2019 | 0.00±0.00 c | 0.00±0.00 b | |
| 2020 | 5.00±2.50 c(1) | 0.00±0.00 b | |
| 9 | 2017 | 0.00±0.00 c | 0.00±0.00 b |
| 2018 | 0.00±0.00 c | 0.00±0.00 b | |
| 2019 | 0.00±0.00 c | 0.00±0.00 b | |
| 2020 | 5.00±2.50 c(1) | 5.00±2.50 b(1) | |
| 11 | 2017 | 25.00±2.50 a(5) | 0.00±0.00 b |
| 2018 | 5.00±2.50 c(1) | 0.00±0.00 b | |
| 2019 | 15.00±2.50 ab(3) | 0.00±0.00 b | |
| 2020 | 25.00±2.50 a(5) | 0.00±0.00 b | |
| 13 | 2017 | 0.00±0.00 c | 5.00±2.50 b(1) |
| 2018 | 0.00±0.00 c | 0.00±0.00 b | |
| 2019 | 0.00±0.00 c | 0.00±0.00 b | |
| 2020 | 0.00±0.00 c | 0.00±0.00 b | |
| ANOVA: P-values | 站位 | 0.006 4 | 0.024 1 |
| 年份 | 0.243 4 | 0.122 4 | |
| 站位*年份 | 0.001 6 | 0.958 0 | |
| 注: 平均值±标准误; ND指无调查数据; 括号中数字指发现砗磲数量; 不同小写字母表示同列具有显著差异(P < 0.05) | |||
本研究根据砗磲的生长发育规律, 将其分为四种规格(壳长 < 5 cm、5—10 cm、10—15 cm和 > 15 cm), 对所拍摄测量的砗磲进行不同发育阶段的统计和分析(图 2)。2017年蜈支洲岛海域砗磲种群结构合理, 4种规格砗磲均有发现, 其中壳长 < 5 cm、5—10 cm和10—15 cm个体分别占总数量的28.57%、35.71%和28.57%, 高于大规格个体(7.14%); 2018和2019年仅发现壳长 < 5 cm和5—10 cm个体; 2020年仅发现壳长 < 5 cm、5—10 cm和10—15 cm三种规格个体。
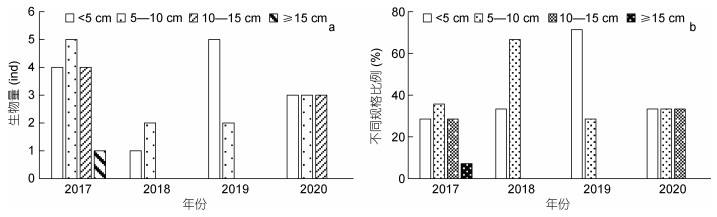 |
| 图 2 蜈支洲岛不同时间各发育阶段砗磲数量(a)及大小比例(b) Fig. 2 The number (a) and the percentage of different-sized individuals (b) of giant clams in Wuzhizhou Island in different years |
由图 3可知, 温度及各水质因子均与砗磲密度相关性不显著(P > 0.05), 但NO3-浓度与砗磲密度相关系数最高, 为0.29。温度、SiO42-和NO2-浓度相关系数为0.11—0.12, PO43-浓度与砗磲密度之间相关系数为–0.13。各环境因子间, 温度与DIN浓度、NH4+浓度、PO43-浓度、SiO42-浓度之间, DIN浓度与PO43-浓度、SiO42-浓度之间, NH4+浓度与PO43-浓度、SiO42-浓度之间都存在显著的相关性(P < 0.05)。
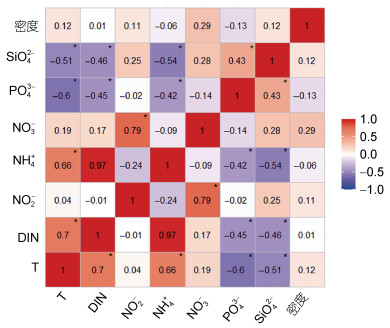 |
| 图 3 水温、各水质环境因子及砗磲密度之间的相关性矩阵热图 Fig. 3 Heat map of correlation matrix among water temperature, various water factors and giant clam density 注: 红色表示正相关, 蓝色表示负相关, 而颜色的渐变则表示相关性的大小, 颜色越深相关性越高, 颜色越浅证明相关性越低, 数值为两个交叉因子之间的相关系数R, 图中*表示P < 0.05 |
如图 4所示, 珊瑚、礁石和砂石底质中均有砗磲分布。进一步比较发现, 珊瑚礁区砗磲分布最多, 为66.67%, 其次为礁石区, 砂石区极少。如表 2所示, 对蜈支洲岛5个调查站位珊瑚礁覆盖率分析发现: 在3 m水深, 珊瑚覆盖率与调查站位显著相关(P < 0.05), 而与调查年份无关, 且不同站位与调查年份间存在显著的交互作用(P < 0.05); 在8 m水深, 珊瑚覆盖率与调查站位、调查年份, 以及调查站位与调查年份交互作用间存在显著相关性(P < 0.05)。其中2017年站位3的3 m水深珊瑚覆盖率最高, 为66.50%, 显著高于站位9、11和13中4个调查年份的3 m水深的珊瑚覆盖率(P < 0.05)。各调查站位8 m水深不同年份珊瑚覆盖率波动性较大, 如站位3为4.93%—46.00%、站位4为13.87%—67.74%、站位9为1.24%—13.63%、站位11为0.60%—50.83%、站位13为0.76%—17.23%。
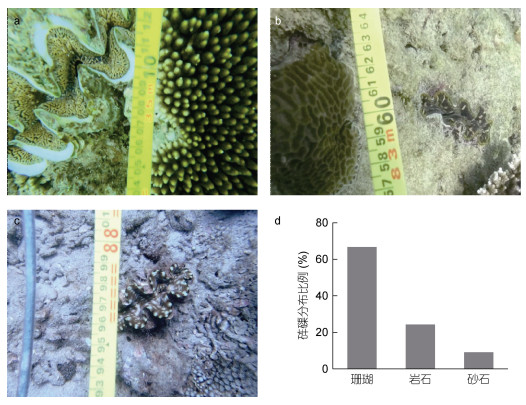 |
| 图 4 不同底质砗磲及分布比例 Fig. 4 Giant clams and their distribution on different substrates 注: a、b和c分别为珊瑚、礁石和砂石底质; d为砗磲在不同底质中分布比例 |
| 站位 | 年份 | 珊瑚覆盖率(%) | |
| 3 m水深 | 8 m水深 | ||
| 3 | 2017 | 66.50±7.28a | ND |
| 2018 | ND | 4.93±2.92def | |
| 2019 | 35.30±2.34abcd | 35.23±5.05abc | |
| 2020 | 40.81±2.50abc | 46.00±2.00ab | |
| 4 | 2017 | 58.22±1.51abc | 13.87±4.06cdef |
| 2018 | ND | 30.92±1.16bcd | |
| 2019 | 60.93±6.93ab | 52.22±0.76ab | |
| 2020 | 61.26±1.56 ab | 67.74±1.64a | |
| 9 | 2017 | 1.43±0.28 e | 1.24±1.85f |
| 2018 | 1.16±0.95 e | 2.83±1.65f | |
| 2019 | 20.35±3.45bcd | 6.09±1.24def | |
| 2020 | 23.34±0.76bcd | 13.63±2.85cdef | |
| 11 | 2017 | 7.23±1.32 de | 8.43±2.65def |
| 2018 | 36.44±8.73abcd | 0.60±0.30f | |
| 2019 | 16.28±1.44 cd | 16.45±4.69cdef | |
| 2020 | 18.49±4.47 cd | 50.83±5.51ab | |
| 13 | 2017 | 24.34±5.73bcd | 0.76±0.83f |
| 2018 | 11.88±3.24 de | 7.93±2.16def | |
| 2019 | 20.74±4.24bcd | 15.43±6.20cdef | |
| 2020 | 46.34±6.54abc | 17.23±3.36cdef | |
| ANOVA: P-values | 站位 | 0.001 6 | 0.006 9 |
| 年份 | 0.700 5 | 0.001 3 | |
| 站位*年份 | 0.009 6 | 0.003 3 | |
| 注: 不同小写字母表示同列具有显著差异(P < 0.05) | |||
对于不同调查站位(选择站位3和11, 共2个砗磲密度较高站位)和年份(2017与2020年)中, 砗磲外套膜颜色与周边底质颜色相关性分析见图 5和表 3。从空间上看: 站位3外套膜颜色参数R、G和B值均与周边底质颜色呈显著相关性, 相关系数分别为0.863、0.953和0.884 (P < 0.05), 而站位11外套膜各颜色参数值与周边底质颜色无显著相关性(P < 0.05); 从时间上看: 2017年调查砗磲外套膜颜色R和B值与周边底质颜色呈显著相关性(P < 0.05), 而参数G无显著相关性。2020年调查砗磲外套膜颜色参数中仅B值与周边底质颜色呈显著相关性(P < 0.05)。进一步比较发现2020年砗磲外套膜与底质颜色参数B相关系数为0.899, 高于2017年(0.712)。
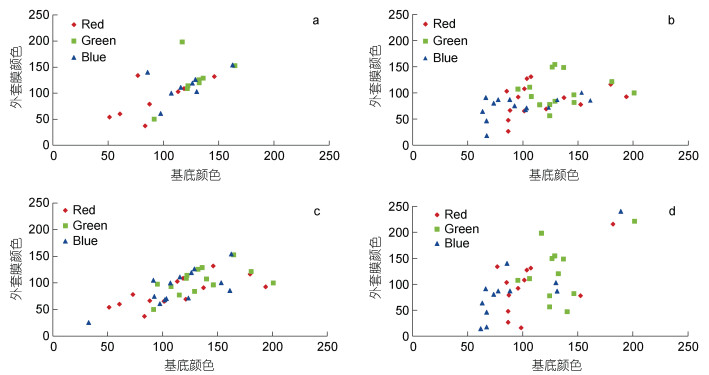 |
| 图 5 蜈支洲岛砗磲外套膜与周边底质RGB颜色参数相关性 Fig. 5 The relationship between the mean red, blue and green (RGB) values of giant clam mantles and their surrounding substrates 注: a. 4年调查站位3砗磲; b. 4年调查站位11砗磲; c. 2017年所有站位砗磲; d. 2020年所有站位砗磲 |
| 颜色参数 | 站位 | 年份 | F值 | P值 | 回归方程 |
| R | 3 | 18.49 | 0.008 | Rg3 =–2.475 30+0.894 2×Rs3 (R=0.863) | |
| 11 | 1.09 | 0.316 | Rg11 = 58.285 45+0.243 5×Rs11(R=0.085) | ||
| G | 3 | 60.31 | 0.001 | Gg3=–65.397 03+1.396 4×Gs3 (R=0.953) | |
| 11 | 0.10 | 0.757 | Gg11 = 91.420 08+0.095 7×Gs11 (R=0.273) | ||
| B | 3 | 22.49 | 0.005 | Bg3 = –42.196 02+1.232 5×Bs3 (R=0.884) | |
| 11 | 3.67 | 0.080 | Bg11 = 43.260 25+0.309 9×Bs11 (R=0.413) | ||
| R | 2017 | 10.38 | 0.008 | Rg17 = 31.920 48+0.444 5×Rs17 (R=0.697) | |
| 2020 | 5.40 | 0.059 | Rg20 =–42.615 45+1.381 6×Rs20 (R=0.688) | ||
| G | 2017 | 3.81 | 0.077 | Gg17 = 47.554 44+0.420 0×Gs17 (R=0.507) | |
| 2020 | 1.49 | 0.268 | Gg20 = –16.016 69+1.073 8×Gs20 (R=0.266) | ||
| B | 2017 | 11.30 | 0.006 | Bg17 = 12.587 08+0.687 2×Bs17(R=0.712) | |
| 2020 | 25.41 | 0.002 | Bg20 = –48.050 01+1.575 4×Bs20 (R=0.899) | ||
| 注: R、G和B分别指颜色参数R、G和B值; g、s分别代表砗磲外套膜和周边底质; 数字3、11分别表示站位3和站位11; 数字17、20分别表示2017年和2020年 | |||||
调查结果显示, 2017—2020年间, 蜈支洲5个站位砗磲密度为0—30.00×10–2 ind./m2, 低于日本冲绳岛(5.03 ind./m2) (Neo et al, 2019)和澳大利亚的美人鱼礁(1.58×102 ind./m2) (Rees et al, 2003), 高于埃及亚喀巴湾(4.70×10–3 ind./m2)和新加坡南部群岛(7.92×10–4 ind./m2) (Guest et al, 2008)。对不同年份蜈支洲岛海域砗磲种群结构分析发现, 2017年4种规格砗磲均有分布, 且小规格个体多于大规格; 至2020年却未发现大规格个体, 种群数量亦有所下降, 因此, 蜈支洲岛周边砗磲资源的保护迫在眉睫。此外, 基于崔丹等(2019)和刘春胜等(2021)前期对海南岛沿海砗磲资源调查结果, 表明整个海南岛沿海砗磲资源保护工作亟待加强。
对蜈支洲岛不同站位间砗磲密度分析发现, 站位3、4和11砗磲密度较高, 而站位9和13几乎未发现砗磲。大量研究表明, 包括砗磲在内的珊瑚礁生物种群数量与捕捞和旅游等人类活动程度呈显著的负相关(施祺等, 2010; 李秀保等, 2019b; 刘春胜等, 2021)。蜈支洲岛为著名海上旅游区, 年接待游客超200万人次, 码头及海上项目多分布于北侧(周扬等, 2018)。其中站位9为夏季潜水区, 站位13为海上运动区, 因此在这两个站位4年几乎未发现砗磲; 与之相比, 岛南侧站位3和4海域尚未开发, 砗磲密度相对较高。砗磲为珊瑚礁生物, 其分布与珊瑚覆盖率密切相关(刘春胜等, 2021), 本次调查亦表明砗磲主要分布于珊瑚礁区(为66.67%)。对比各站位珊瑚覆盖率发现, 站位3、4和11珊瑚覆盖率较高, 且近两年呈现稳定的增加趋势; 而站位9在2017和2018两年珊瑚覆盖率仅为1.16%和1.43%, 尽管2019和2020年该站位珊瑚覆盖率已达20%以上, 但受原种群数量影响, 砗磲种群恢复尚需时日。此外, 为提高珊瑚覆盖率, 作者所在团队长期在站位3和11开展人工种植和保护相关工作, 这些管理措施也从一定程度上恢复了砗磲栖息环境, 提高了其种群数量(许慧丽, 2020)。
砗磲密度除直接受人类活动影响外, 亦受温度波动及水质因子变化等影响。如Dubousquet等(2016)和Zhou等(2019)分别对长砗磲(T. maxima)和番红砗磲(T. crocea)进行高温刺激(32 ℃)后, 砗磲呈现显著的应激反应; Grice等(1999)报道, 添加适当的铵肥能够利于长砗磲生长。本实验对水温及其他调查水质因子统计学分析发现, 各水质参数与调查年份呈显著相关性(P < 0.05), 这可能与气候、洋流波动, 以及岛上的不定时排污有关(李秀保等, 2019a)。在比较分析各水质因子与砗磲密度相关性结果中, 未发现环境因子与砗磲密度的显著相关性, 这可能与实验调查次数及样本量少, 重复性不足有关。但在所测定的水质参数中, 砗磲密度与硝酸盐NO3-浓度相关性最高(0.29), 这一结果与Grice等(1999)报道适当铵肥浓度有利于砗磲存活的结果相一致。
3.2 时空变化对砗磲外套膜颜色与周边底质颜色相关性的影响颜色多态性是砗磲逃避敌害生物捕食的一种方式(刘春胜等, 2021)。Todd等(2009)和Ozog(2009)分别对帕劳番红砗磲和法属波利尼西亚长砗磲外套膜颜色分析, 得出其与底质环境颜色呈现显著相关性的结论。本研究对站位3和站位11共2个站位砗磲外套膜与周边环境颜色分析发现, 站位3砗磲外套膜的颜色RGB参数值与周边底质颜色均呈显著相关性(P < 0.05), 但站位11外套膜与周边底质却无显著相关性(P > 0.05), 这可能与蜈支洲岛北侧人为干扰程度较高, 底质环境变化较快有关。对2017年和2020年砗磲外套膜颜色分析发现, 2020年砗磲外套膜与周边底质B颜色参数值相关性极显著(P < 0.01), 相关系数为0.899, 高于2017年。这可能是因为随着非法捕捞行为的加剧, 外套膜与周边底质颜色差异较大砗磲更易被发现和采捕, 进而导致两者相似性增高, 该结果与刘春胜等(2021)报道一致。
4 结论蜈支洲岛周边海域砗磲密度为0—30.00×10–2 ind./m2, 岛南砗磲密度要优于岛北, 3 m水深海区砗磲密度高于8 m水深海区; 在部分站位砗磲密度随调查年份显著下降; 蜈支洲岛海域砗磲外套膜与周边底质颜色呈一定的相关性, 且受人类活动影响。因此, 今后应重视砗磲野生资源及生境保护, 同时通过人工育苗和增殖放流等措施来迅速补充砗磲资源。
丁导生. 1958. 西沙群岛贝类资源丰富. 中国水产, (7): 19-20 |
刘小霞, 李乐, 郑兴, 等. 2017. 光照对不同规格番红砗磲(Tridacna crocea)氧、氨氮及活性磷酸盐代谢的影响. 渔业科学进展, 38(5): 92-99 |
刘春胜, 吴川良, 李秀保, 等. 2021. 三亚近海诺亚砗磲分布特征及底质对其外套膜颜色的影响. 水生生物学报, 45(3): 645-651 |
许惠丽, 2020. 三亚蜈支洲岛造礁石珊瑚对环境变化的响应. 海口: 海南大学硕士学位论文, 27-28
|
李元超, 韩有定, 陈石泉, 等. 2015. 砗磲采挖对珊瑚礁生态系统的破坏——以西沙北礁为例. 应用海洋学学报, 34(04): 518-524 DOI:10.3969/J.ISSN.2095-4972.2015.04.009 |
李秀保, 王爱民, 刘胜等, 2019a. 海南岛珊瑚礁的保护与修复. 见: 第三届现代海洋(淡水)牧场学术研讨会论文集. 海口: 中国水产学会海洋牧场研究会
|
李秀保, 李元超, 许强等, 2019b. 珊瑚礁生态系统调查的内容及方法. 见: 李秀保, 李元超, 许强. 三亚蜈支洲岛珊瑚礁的现状、生态修复及保护对策. 北京: 科学出版社, 9-14
|
张素萍. 2008. 中国海洋贝类图鉴. 北京: 海洋出版社, 317-328
|
周扬, 高亚龙, 黄学彬. 2018. 基于整合营销传播的旅游营销策略研究——以三亚蜈支洲岛风景区为例. 科教导刊, (33): 33-35 |
施祺, 赵美霞, 黄玲英, 等. 2010. 三亚鹿回头岸礁区人类活动及其对珊瑚礁的影响. 热带地理, 30(5): 486-490, 509 DOI:10.3969/j.issn.1001-5221.2010.05.006 |
崔丹, 王辉, 刘君, 等. 2019. 海南岛沿岸海域砗磲资源调查及保护前景展望. 海洋通报, 38(5): 527-532 |
Borsa P, Fauvelot C, Tiavouane J et al, 2015. Distribution of Noah's giant clam, Tridacna noae. Marine Biodiversity, 45(2): 339-344 DOI:10.1007/s12526-014-0265-9 |
Dubousquet V, Gros E, Berteaux-Lecellier V et al, 2016. Changes in fatty acid composition in the giant clam Tridacna maxima in response to thermal stress. Biology Open, 5(10): 1400-1407 DOI:10.1242/bio.017921 |
English S, Wilkinson C, Baker V, 1997. Survey manual for tropical marine resources. Ferguson, Australia: Australian Institute of Marine Science
|
Gomez E D, Mingoa-Licuanan S S, 2006. Achievements and lessons learned in restocking giant clams in the Philippines. Fisheries Research, 80(1): 46-52 DOI:10.1016/j.fishres.2006.03.017 |
Grice A M, Bell J D, 1999. Application of ammonium to enhance the growth of giant clams (Tridacna maxima) in the land-based nursery: effects of size class, stocking density and nutrient concentration. Aquaculture, 170(1): 17-28 DOI:10.1016/S0044-8486(98)00388-3 |
Guest J R, Todd P A, Goh E et al, 2008. Can giant clam (Tridacna squamosa) populations be restored on Singapore's heavily impacted coral reefs. Aquatic Conservation: Marine and Freshwater Ecosystems, 18(5): 570-579 DOI:10.1002/aqc.888 |
Huelsken T, Keyse J, Liggins L et al, 2013. A novel widespread cryptic species and phylogeographic patterns within several giant clam species (Cardiidae: Tridacna) from the Indo-Pacific Ocean. PLoS One, 8(11): e80858 DOI:10.1371/journal.pone.0080858 |
Liu C S, Yang X Y, Sun Y et al, 2021. Effects of the daily light/dark cycle on photosynthetic performance, oxidative stress and illumination-related genes in boring giant clam Tridacna crocea. Marine Biology, 168(5): 71 DOI:10.1007/s00227-021-03883-2 |
Nadon M O, Stirling G, 2006. Field and simulation analyses of visual methods for sampling coral cover. Coral Reefs, 25(2): 177-185 DOI:10.1007/s00338-005-0074-5 |
Neo M L, Eckman W, Vicentuan K et al, 2015. The ecological significance of giant clams in coral reef ecosystems. Biological Conservation, 181: 111-123 DOI:10.1016/j.biocon.2014.11.004 |
Neo M L, Lim K K, Yang S Y et al, 2019. Status of giant clam resources around Okinawa-Jima Island, Ryukyu Archipelago, Japan. Aquatic Conservation: Marine and Freshwater Ecosystems, 29(6): 1002-1011 DOI:10.1002/aqc.3033 |
Neo M L, Todd P A, 2012. Giant clams (Mollusca: Bivalvia: Tridacninae) in Singapore: history, research and conservation. Raffles Bulletin of Zoology, (S25): 67-78 |
Othman A S B, Goh G H S, Todd P A, 2010. The distribution and status of giant clams (family Tridacnidae)-a short review. Raffles Bulletin of Zoology, 58(1): 103-111 |
Ozog S T, 2009. Balancing anti-predation and energetic needs: color polymorphism in the giant clam Tridacna maxima. Oakland: University of California
|
Penny S S, Willan R C, 2014. Description of a new species of giant clam (Bivalvia: Tridacnidae) from Ningaloo Reef, Western Australia. Molluscan Research, 34(3): 201-211 DOI:10.1080/13235818.2014.940616 |
Rees M, Colquhoun J, Smith L L et al, 2003. Surveys of Trochus, Holothuria, giant clams and the coral communities at Ashmore Reef, Cartier Reef and Mermaid Reef, northwestern Australia. Townsville: Australian Institute of Marine Science, 64 |
Richter C, Roa-Quiaoit H, Jantzen C et al, 2008. Collapse of a new living species of giant clam in the Red Sea. Current Biology, 18(17): 1349-1354 DOI:10.1016/j.cub.2008.07.060 |
Su Y, Hung J H, Kubo H et al, 2014. Tridacna noae (Röding, 1798)-a valid giant clam species separated from T. maxima (Röding, 1798) by morphological and genetic data. Raffles Bulletin of Zoology, 62: 124-135 |
Todd P A, Lee J H, Chou L M, 2009. Polymorphism and crypsis in the boring giant clam (Tridacna crocea): potential strategies against visual predators. Hydrobiologia, 635(1): 37-43 DOI:10.1007/s10750-009-9859-9 |
Zhang Y H, Zhou Z H, Qin Y P et al, 2020. Phenotypic traits of two boring giant clam (Tridacna crocea) populations and their reciprocal hybrids in the South China Sea. Aquaculture, 519: 734890 DOI:10.1016/j.aquaculture.2019.734890 |
Zhou Z, Liu Z Q, Wang L G et al, 2019. Oxidative stress, apoptosis activation and symbiosis disruption in giant clam Tridacna crocea under high temperature. Fish & Shellfish Immunology, 84: 451-457 |
 2021, Vol. 52
2021, Vol. 52


