
中国海洋湖沼学会主办。
文章信息
- 吴俊虹, 曹子豪, 郑利兵, 迟长凤. 2021.
- WU Jun-Hong, CAO Zi-Hao, ZHENG Li-Bing, CHI Chang-Feng. 2021.
- 曼氏无针乌贼(Sepiella japonica)促性腺激素释放激素(GnRH)基因的鉴定、特征及成熟期的表达研究
- IDENTIFICATION, CHARACTERIZATION, AND EXPRESSION ANALYSIS OF A GNRH-LIKE GENE AT MATURE STAGE IN THE CEPHALOPOD SEPIELLA JAPONICA (SEPⅡDAE)
- 海洋与湖沼, 52(6): 1530-1539
- Oceanologia et Limnologia Sinica, 52(6): 1530-1539.
- http://dx.doi.org/10.11693/hyhz20210400083
文章历史
-
收稿日期:2021-04-07
收修改稿日期:2021-05-14
促性腺激素释放激素(GnRH)主要由下丘脑神经元合成和分泌, 调节下丘脑-垂体-性腺轴, 参与控制许多脊椎动物和无脊椎动物的生殖过程(Gottsch et al, 2004; Chaiyamoon et al, 2020)。无脊椎动物的GnRH与脊椎动物的GnRH在结构和功能上同源, 参与调节生殖相关功能, 包括卵巢成熟和产卵(Tinikul et al, 2014; Chaiyamoon et al, 2020)。脊椎动物的GnRH可刺激促性腺激素的产生和分泌(Ma et al, 2020), 且对性别分化的开始和整个生殖过程都至关重要(Counis et al, 2005)。脊椎动物中的GnRH主要分为三种类型: GnRH-Ⅰ、GnRH-Ⅱ和GnRH-Ⅲ, 且在同一个物种中GnRH可有多种形式(Chang et al, 2018)。GnRH-Ⅰ存在于鸟类、两栖动物和鱼类中, 包括哺乳动物形式(mGnRH)和各种鱼类特有的形式, 如cfGnRH、hrGnRH、mdGnRH、sbGnRH和wfGnRH。GnRH-Ⅰ存在于视前区(POA)和下丘脑的神经元中(Selvaraj et al, 2012);GnRH-Ⅱ存在于所有脊椎动物中, 主要表达部位集中在中脑区域(Schneider et al, 2008);GnRH-Ⅲ仅存在于硬骨鱼中, 集中表达在嗅球、末梢神经节和POA的神经元中(Kah et al, 2007)。在七鳃鳗中的lGnRH-Ⅰ和lGnRH-Ⅲ一开始被分为GnRH-Ⅳ型(Nozaki et al, 2000; Silver et al, 2004), 但后来分析证明, 其与GnRH-Ⅱ和GnRH-Ⅲ有共同的祖先, 因此不再被归类为GnRH-Ⅳ型(Decatur et al, 2013);GnRH-Ⅴ目前仅包含软体动物的两种类型, 分别为真蛸(Octopus vulgaris)分离出的octGnRH, 以及海蜗牛(Aplysia calfornica)分离出的apGnRH (Zhang et al, 2008), 其主要表达在中枢神经系统与外周神经系统中(陈蕾等, 2003), octGnRH还可刺激真蛸的卵巢和精巢产生睾酮、孕酮和雌二醇(Kanda et al, 2006)。有趣的是, 所有脊椎动物的GnRH亚型都是十肽(Zhou et al, 2012), 而octGnRH是十二肽, apGnRH是十一肽(Tsai et al, 2010)。GnRH除参与软体动物生殖外, 还影响其基本生理活动, 如心率、脂肪代谢和行为等(Tsai, 2018)。
曼氏无针乌贼(Sepiella japonica)曾是东海具有较高经济价值的四大海产之一。自20世纪70年代以来, 由于过度捕捞和环境变化, 资源逐渐衰减, 因此, 发展人工养殖具有重要意义。然而, 在人工养殖过程中, 人们发现该物种出现性早熟现象(Cao et al, 2016)。因此, 本研究首次克隆曼氏无针乌贼GnRH基因的全长, 并分析该基因在不同组织中表达的特异性和在脑中的表达位置, 旨在为曼氏无针乌贼的人工繁育提供一定的理论依据。
1 材料与方法 1.1 实验样品成熟时期曼氏无针乌贼采自浙江舟山东极岛曼氏无针乌贼养殖基地, 体重为80—120 g。乌贼饲养温度23—25 ℃, 盐度28—30, 光照周期为光照14 h, 黑暗10 h, 定时投喂虾, 2次/d。
1.2 总RNA提取及cDNA合成用0.1%乙醇将乌贼麻醉5—10 min, 解剖取脑、鳃、心脏、肌肉、肝脏、卵巢、缠卵腺、副缠卵腺和精巢组织, 放至液氮速冻, –80 ℃保存备用。采用Trizol法提取组织总RNA (TaKaRa), 采用PowerScript逆转录酶(TaKaRa)合成第一链cDNA, 42 ℃反应90 min后使用NucleoSpin柱(TaKaRa)进行纯化。
1.3 SjGnRH基因全长克隆根据真蛸(BAB 86782.1)和剑尖枪乌贼(Uroteuthis edulis, BAH 09303.1)序列设计兼并引物GnRH-F/GnRH-R (表 1), 扩增反应按照本实验室的前期工作进行, 并稍做改动(Cao et al, 2016)。根据引物GnRH-F/GnRH-R扩增出来的核心序列设计用于cDNA末端快速扩增(RACE)的特异性引物, 5′-RACE和3'-RACE操作均根据Firstchoice RLM-RACE试剂盒(Ambion)的说明书进行, 然后将PCR产物克隆到pUCm-T载体(Bio Basic), 并送至生工生物工程(上海)公司进行测序。
| 引物 | 序列(5′—3′) |
| GnRH-F | CAGACNCAAGCACARAAYTA |
| GnRH-R | TYTCTATCAAAGCYTTTGT |
| 5′-GnRH-outter | TTACCACCAGGGTGCCATCC |
| 5′-GnRH-inner | TTGCTAAAATGGTAATTCTG |
| 3′-GnRH-outter | AGGAAATCACTCGTATAATT |
| 3′-GnRH-inner | AATTACTACATGTACCAATA |
| M13-F | TGTAAAACGACGGCCAGT |
| M13-R | CAGGAAACAGCTATGACC |
| 5′RACE Adapter | GGCCAGGCGTCGACTAGTACGGGGGGGGGG |
| 5′RACE Outer Primer | ACUACUACUAGGGGCGTCGACGTA |
| 5′RACE Inner Primer | ACUACUACUAGGGGCGTCGA |
| 3′RACE Adapter | GCGAGCACAGAATTAATATTTTTTTTTTTT |
| 3′RACE Outer Primer | GCGGATCCGAATTAATACGACT |
| 3′RACE Inner Primer | GCGAGCACAGAATTAATACGACT |
以Premier 5.0设计核心片段扩增引物和RACE引物;NCBI ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找序列的开放阅读框(ORF);运用软件DNAMAN 8.0将SjGnRH基因的cDNA序列翻译成氨基酸序列, 并用Laser gene软件(DNAStar, Inc., Madison, Wisconsin, USA)分析cDNA序列。使用生物序列分析中心(http://www.cbs.dtu.dk/services/SignalP)的SignalP 4.1鉴定潜在的信号肽及信号肽切割位点;通过SMART (http://smart.embl-heidelberg.de/)预测其蛋白结构域;多序列比对分析通过ClustalW (http://www.ebi.ac.uk/tools/msa/clustalw2/)完成;ExPASy ProtParam Server (http://web.expasy.org/protparam/)用来预测蛋白的理化性质如蛋白分子量(MW)及等电点(pI);Phylogeny.fr Gblocks 0.91b Server (http://phylogeny.lirmm.fr/phylo_cgi/one_task.cgi?task_type=gblocks)提取待建树氨基酸序列的保守区间。利用软件MEGA-X根据推导的氨基酸序列进行最大似然法进化树的构建。
1.5 qRT-PCR检测SjGnRH基因表达qRT-PCR使用SYBR PreMix Ex TaqTM Ⅱ试剂盒(TaKaRa), 按照7500荧光定量PCR仪(Applied Biosystems)的说明书进行, 反应体系和反应条件参考本实验室先前的工作积累进行(Cao et al, 2016), 选用曼氏无针乌贼β-actin (JN564496.1)作为内参基因。
1.6 原位杂交检测SjGnRH基因mRNA在脑中的表达原位杂交插入片段为SjGnRH基因cDNA中位于第49—305位的核苷酸, 将其克隆至pSPT 18质粒, 再以EcoR I和Hind Ⅲ将质粒线性化, 用SP6/T7 Dig RNA标记试剂盒(Roche Diagnostics)引入地高辛标记正、反义RNA探针, 样品处理和操作流程按照我们实验室先前的工作稍有改动(Cao et al, 2016)。
1.7 数据分析用2–ΔΔCt法分析SjGnRH在mRNA水平的表达, 所有数据均与心脏的mRNA表达水平进行对比, 结果以平均值±标准差(S.D.) (n=3), 数据分析采用单因素方差分析(One-way ANOVA), 然后进行t检验, 显著性由P < 0.05表示。
2 实验结果 2.1 SjGnRH基因的鉴定及特性分析SjGnRH基因(KP 982885.1)的cDNA全长为710 bp, 包含273 bp的ORF、86 bp的5′-非编码区(UTR)以及352 bp的3′-UTR(图 1);SjGnRHMW为10.1 kDa, 预测pI为7.71;BLASTn分析结果表明, SjGnRH与剑尖枪乌贼和真蛸的序列具有较高的相似性;预测的SjGnRH蛋白序列包括31个氨基酸的信号肽、高度保守的十二肽和44个氨基酸的GnRH相关肽(GAP);在十二肽的C末端之后存在一个切割位点(GKR, Gly-Lys-Arg), 这表明酰胺化发生在翻译后的加工过程中。
 |
| 图 1 SjGnRH基因的序列分析 Fig. 1 Sequence analysis of the GnRH gene in S. japonica 注: 预测的N-末端信号肽用黑色下划线表示。预测的跨膜区域用灰色阴影表示, 预测的磷酸化位点用红色线框标记。预测的起始密码子(ATG)、终止密码子(TGA)和多聚腺苷酸信号(AATAAA)用黑色线框标记。序列中所含的GnRH的十二肽以红色字体标出, 碱性切割位点以绿色字体标出, C末端酰胺化甘氨酸以蓝色字体标出。GnRH相关肽(GAP)以虚线标出 |
将预测的SjGnRH氨基酸序列与不同物种的GnRH氨基酸序列在ClustaW2网站上进行了比对(图 2), 所用序列的GenBank登录号分别如下: 曼氏无针乌贼(KP 982885.1)、真蛸(BAB 86782.1)、剑尖枪乌贼(BAH 09303.1)、皱纹盘鲍(Haliotis discus hannai, ARE 30281)、澳大利亚绿边鲍(Haliotis laevigata, AKR 13997.1)、美洲牡蛎(Crassostrea virginica, XP 022319572.1)、长牡蛎(Crassostrea gigas, ADZ 17180.1)、虾夷扇贝(Mizuhopecten yessoensis, XP 021347551.1)和法螺(Charonia tritonis, AQS 80512.1)。对比结果表明, 预测的SjGnRH与剑尖枪乌贼和真蛸中的相似度分别为86.7%和73.3%;SjGnRH高度保守的十二肽与剑尖枪乌贼和真蛸的octGnRH有100%的相似性,其中,信号肽区的相似性分别为66.7%和54.8%,GAP区的相似性分别为95.5%和77.3%。
 |
| 图 2 曼氏无针乌贼与其他物种的GnRH氨基酸序列比对 Fig. 2 Multiple alignments of the deduced amino acid sequences of GnRH from S. japonica and other species 注: 序列中相同的氨基酸用黑色表示, 保守序列标记为灰色 |
软体动物GnRH的氨基酸序列如图 3所示。头足类物种之间有高度保守的序列和结构上的相似性。到目前为止, 已在三种双壳纲海洋贝类长牡蛎(Bigot et al, 2012)、虾夷扇贝(Nagasawa et al, 2015b)和菲律宾蛤仔(Ruditapes philippinarum) (Song et al, 2015)中发现了invGnRH, 这些研究表明, 神经节内存在以下两种形式的invGnRH肽: invGnRH 12 aa-OH和invGnRH 11 aa-NH2。
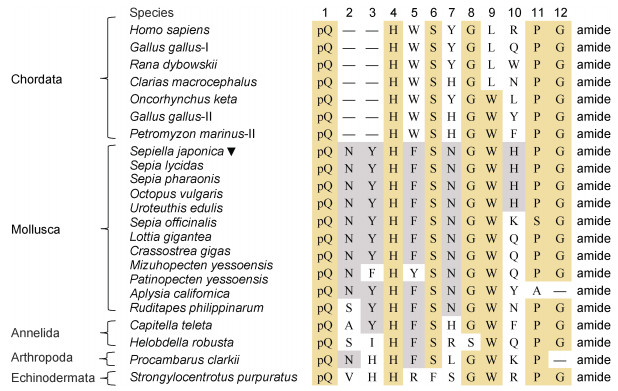 |
| 图 3 不同种类GnRH与氨基酸序列对比图(验证或推导) Fig. 3 Amino acid sequences of representative notochord GnRH and non-chord GnRH molecules (validation or derivation) 注: 黄色表示在大多数动物中高度保守的氨基酸, 灰色表示更为保守的氨基酸 |
为确定SjGnRH的进化位置, 利用脊椎动物和无脊椎动物的GnRH前体蛋白序列, 以最大似然法构建了系统发育树(图 4)。分析结果表明, SjGnRH与无脊椎动物GnRH聚在一起, 且与拟目乌贼(Sepia lycidas)、虎斑乌贼(Sepia pharaonis) GnRH的亲缘关系较近。
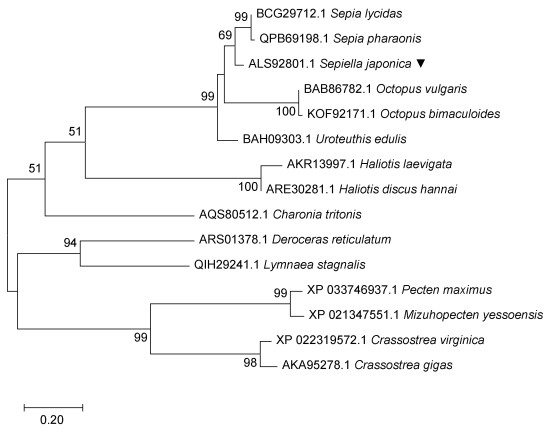 |
| 图 4 SjGnRH的氨基酸序列与其他物种的GnRH氨基酸序列通过最大似然法构建系统进化树 Fig. 4 The phylogenetic tree was constructed by maximum likelihood method between the amino acid sequence of SjGnRH and the amino acid sequence of GnRH of other species |
SjGnRH在曼氏无针乌贼不同性别组织中的表达模式如图 5所示。实验结果表明, SjGnRH在不同性别的组织中均有表达, 但表达水平不同;其中, 在雌性和雄性的脑中表达量较高, 与其他组织表达水平呈显著性差异(P < 0.05)。
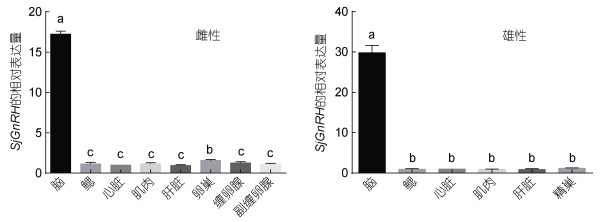 |
| 图 5 SjGnRH基因mRNA在不同曼氏无针乌贼组织中的分布 Fig. 5 Distribution of SjGnRH mRNA in various S. japonica tissues 注: 以心脏表达水平作为参考值。结果以平均±标准差(S.D.)(n=3)表示, 分别分析在雌性与雄性不同组织中的表达含量, 包括脑、鳃、心脏、肌肉、肝脏、卵巢、缠卵腺、副缠卵腺和精巢。以β-actin作为内参基因, 对组织表达量进行LSD(Least significant Difference)多重比较, 图中的a、b和c代表组织表达量之间存在显著性差异(P < 0.05) |
如图 6所示, SjGnRH mRNA阳性信号广泛存在于大脑中, 当与正义探针(阴性对照)杂交时, 没有检测到明显的信号(图 6a);乌贼的大脑由三个主要部分组成: 食道上神经团、食道下神经团和视叶(于新秀等, 2011);SjGnRH特异性表达存在于食道上神经团的多个区域, 且主要在胞体表达, 表达最强的是脑亚脚叶和亚垂直叶(图 6b), 其次是下额叶(图 6c)和后基底叶(图 6d), 而最弱的表达出现在前基底叶;在食道下神经团(图 6e), 三个形态不同的区域(前、中、后区)均有阳性表达。其中, 在食道下神经团前部, 腕叶呈阳性染色;在食道下神经团中部, 足叶呈阳性染色;在食道下神经团后部, SjGnRH主要表达在巨细胞叶和外套内脏叶;SjGnRH探针在视叶的髓质中(图 6f)也出现阳性信号, 而在视腺或嗅叶中未见阳性表达。
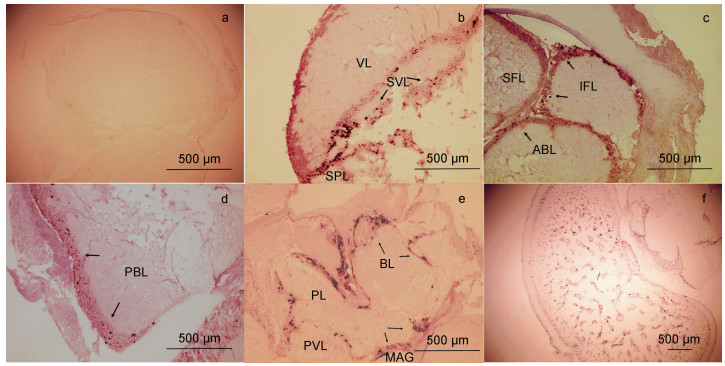 |
| 图 6 SjGnRH基因mRNA在脑组织的原位杂交 Fig. 6 The expression of SjGnRH mRNA in the brain 注: a. SjGnRH正义探针对照图; 反义探针组: b. 亚垂直叶; c. 下额叶; d. 后基底叶; e. 食道下神经团; f. 视叶。阳性信号以黑色箭头标出。VL. 垂直叶; SVL. 亚垂直叶; SPL. 脑亚脚叶; SFL. 上额叶; IFL. 下额叶; ABL. 前基底叶; PBL. 后基底叶; BL. 腕叶; PL. 足叶; PVL. 外套内脏叶; MAG. 巨细胞叶 |
SjGnRH的cDNA全长为710 bp, 包含273 bp的开放阅读框(ORF), 编码90个氨基酸, 其信号肽由31个氨基酸组成, 具有高度保守的十二肽, GAP序列为44个氨基酸;在十二肽的C末端之后存在一个切割位点(GKR, Gly-Lys-Arg), 这与脊椎动物相似, 表明酰胺化发生在翻译后的加工过程中, 无脊椎动物促性腺激素释放激素活性的C末端结构可能是保守的(Onitsuka et al, 2009)。
根据预测的SjGnRH氨基酸序列与其他物种多序列比对的结果, 我们认为SjGnRH在成熟肽区高度保守, 但在N端信号肽和C端GAP区表现出变异;ClustalW分析表明, SjGnRH的氨基酸序列与剑尖枪乌贼和真蛸中的GnRH分别有86.7%和73.3%的相似性, 信号肽区的相似性分别为66.7%和54.8%, GAP区的相似性分别为95.5%和77.3%;且SjGnRH高度保守的十二肽与剑尖枪乌贼和真蛸的octGnRH有100%的相似性;进化树结果显示: SjGnRH与真蛸和剑尖枪乌贼的GnRH聚于一类, 与海兔(Ovula ovum)、网纹野蛞蝓(Deroceras reticulatum)等腹足纲的亲缘关系较远, 其中与真蛸GnRH的亲缘关系比剑尖枪乌贼GnRH的更近。这表明在曼氏无针乌贼中克隆的SjGnRH属于仅存在于软体动物中的GnRH-Ⅴ类型, 且属于其中的octGnRH。对枪乌贼(Loligo bleekeri)脑内的GnRH神经元进行免疫组织化学分析, 观察到两种类型的GnRH神经元, 表明在枪乌贼脑中至少存在两种类型的GnRH神经系统(Amano et al, 2008);在双壳动物中发现了两种GnRH多肽, 即十一肽和十二肽, 如长牡蛎(Bigot et al, 2012; In et al, 2016)、虾夷扇贝(Nagasawa et al, 2015a, b), 这些数据进一步表明, 在无脊椎动物同一物种中可能存在不同形式的GnRH, 在曼氏无针乌贼中是否存在多种形式的GnRH还需进一步证明。
3.2 SjGnRH在不同性别组织中的表达分布与组织定位qRT-PCR结果表明, SjGnRH在曼氏无针乌贼的雌性脑、卵巢和雄性脑中均表达显著, 这一结果与其他头足类动物相似。对商乌贼(Sepia officinalis)的RT-PCR分析结果表明GnRH在脑、卵巢和卵中都有表达(Di Cristo et al, 2009);在剑尖枪乌贼中, RT-PCR和Southern blot分析结果表明, GnRH基因的前体主要在中枢神经系统表达(Onitsuka et al, 2009);在海蜗牛中, apGnRH-like肽(Tsai et al, 2010)存在于中枢神经和外周组织;长蛸(Octopus minor)的qRT-PCR研究结果中显示, octGnRH主要表达于神经系统及神经纤维所控制的部分组织, 在雌雄个体的食道上、下神经团中表达量都较高, 在雄性的精巢中表达次之, 而在雌性的卵巢中表达则较低(朱之发等, 2020), 本文实验结果显示在雌、雄脑中的表达量最高, 在卵巢中的表达较高, 精巢的表达则较低, 推测SjGnRH的表达量可能与性腺发育时期相关。
有研究显示: GnRH-Ⅰ与GnRH-Ⅱ的类似物能够促进大西洋鳕鱼(Gadus morhua)的排卵(Hildahl et al, 2011);sbGnRH和sGnRH在大菱鲆中的表达量具有周期性变化(赵春彦, 2017), 这两种类型的GnRH在进化上趋同(Imanaga et al, 2014; Andrea et al, 2016), sGnRH可辅助sbGnRH表达;sbGnRH在性腺与脑中的表达模式相似, 可能具有一定的关联性(赵春彦, 2017), 另外, sbGnRH在性腺中的高表达表明了GnRH系统同时具有刺激性腺成熟和调控性腺发育作用(赵春彦, 2017), 同时说明GnRH与繁殖作用联系紧密, 还能促进生殖腺的生长发育和精卵细胞的产生(Gray et al, 2002);且sbGnRH在条斑星鲽的卵巢发育与排出过程中也具有重要作用(Masafumi et al, 2008);GnRH类似物对LH的释放以及产卵作用也具有促进作用(Nyuji et al, 2013);有研究发现GnRH多肽在金头鲷(Sparus aurata)和鲭鱼(Gothilf et al, 1997; Selvaraj et al, 2012)中, 也有参与生殖调控的功能。GnRH在性腺的高表达表明了GnRH系统在刺激性腺成熟、调控性腺发育(Powell et al, 1996)和调节雌雄性腺激素含量的作用(Soverchia et al, 2007)。在软体动物中的研究显示, 如真蛸octGnRH肽的转录本在食道上神经团、食道下神经团、视腺以及脑脚叶中均有表达(Iwakoshi et al, 2002);先前的一项研究提供了有关表达octGnRH基因mRNA的神经元胞体在中枢神经系统的定位, 以及在真蛸中枢和外周器官中的octGnRH免疫反应胞体和纤维分布的详细信息(Iwakoshi-Ukena et al, 2004), 在该研究中, octGnRH的mRNA表达定位在食道上神经团的前后背侧基底叶、下额叶以及后颊叶, 与食道下神经团的外套内脏叶、足叶、后腕叶、前臂叶、血管舒缩叶以及视叶中;在本研究中, SjGnRH基因mRNA在食道上神经团的脑亚脚叶、亚垂直叶、前基底叶、后基底叶和下额叶均出现不同程度的阳性表达, 在食道下神经团的巨细胞叶、外套内脏叶、足叶和腕叶以及视叶也有阳性表达, 这与先前的结果研究结果基本一致。在真蛸的中枢和外周器官中octGnRH样免疫反应胞体和纤维的分布表明, octGnRH参与了脑亚脚叶-视腺轴, 这与脊椎动物的下丘脑-垂体轴相似, 都有参与生殖的功能(Di Cosmo et al, 1998; Iwakoshi et al, 2002; Iwakoshi-Ukena et al, 2004)。octGnRH除了促进生殖作用之外, 还参与很多其他重要的生理作用, 包括进食(Newth, 1972)、触觉和记忆(Balaban, 1996)、运动和自主行为(Iwakoshi-Ukena et al, 2004)等。此外, 在枪乌贼脑组织中分别进行了cGnRH-Ⅱ和GnRH类似物抗体的免疫组织化学, 显示cGnRH-Ⅱ免疫阳性的胞体主要存在于巨细胞叶和视叶(Amano et al, 2008), 阳性神经纤维广泛分布于脑组织(Osada et al, 2013)。GnRH类似物免疫阳性的细胞体广泛分布于巨细胞叶中, 但在嗅叶和垂直叶中分布较少。束状轴突从腹部巨细胞叶延伸到脑内部, 免疫阳性神经纤维主要分布在食道上神经团与食道下神经团中, 但视叶中只有神经纤维有免疫阳性反应(Amano et al, 2008);在真蛸的脑亚脚叶、嗅叶和视叶中均发现octGnRH神经肽, 在视腺细胞上也发现含有GnRH神经肽的神经末梢, 而视腺分泌活动受神经肽的调控, 因此, 推测嗅叶可能是GnRH神经肽的来源(Di Cosmo et al, 1998; Iwakoshi-Ukena et al, 2004);而本研究结果表明, SjGnRH探针在视叶的髓质中出现阳性信号, 但在视腺或嗅叶却未见阳性表达。对GnRH的免疫反应也出现在其他物种的大脑中, 如淡水硬骨鱼高身丽脂鲤(Atyanax altiparae)的嗅球、末梢神经节、视前区、中脑被盖核, 也存在于纵环核、肾小球核以及丘脑背侧中央和背侧后核(Gomes et al, 2013)。我们推测, 这几项研究结果之间的差异可能是由于物种差异性所致, 也可能是由于不同物种的在生殖周期内受到周围环境刺激的影响所致, 如光周期、温度等(Andrea et al, 2016)。在本研究中, 针对我国重要的经济乌贼——曼氏无针乌贼, 进行了SjGnRH基因的克隆鉴定以及系统发育特征分析, 这将有助于我们理解GnRH在无脊椎动物中的适应和进化过程, 关于SjGnRH在曼氏无针乌贼中的生理调控机制还有待进一步研究。
4 结论(1) 在曼氏无针乌贼中克隆的SjGnRH基因属于仅存在于软体动物中的GnRH-Ⅴ类型, 且属于其中的octGnRH。
(2) SjGnRH具有高度保守的十二肽, 与真蛸GnRH的亲缘关系比剑尖枪乌贼GnRH的更近。
(3) SjGnRH在雌、雄无针乌贼脑中的表达量显著高于其他组织。
(4) SjGnRH在食道上神经团的脑亚脚叶和亚垂直叶表达最强, 其次是下额叶、后基底叶以及前基底叶;在食道下神经团的腕叶、足叶、巨细胞叶和外套内脏叶中均有阳性表达;在视叶的髓质中也出现阳性信号, 而在视腺或嗅叶未见阳性表达。
于新秀, 吴常文, 迟长凤. 2011. 曼氏无针乌贼(Sepiella maindroni)脑显微结构及视腺超微结构观察. 海洋与湖沼, 42(2): 300-304 |
朱之发, 边力, 王亚美, 等. 2020. 长蛸oct-GnRH基因的cDNA克隆及组织表达分析. 海洋渔业, 42(5): 585-594 DOI:10.3969/j.issn.1004-2490.2020.05.008 |
陈蕾, 冯俏丽, 纪惠玲, 等. 2003. 合浦珠母贝生殖腺及消化道GnRH及其受体的免疫组织化学研究. 第四军医大学学报, 24(22): 2081-2083 DOI:10.3321/j.issn:1000-2790.2003.22.019 |
赵春彦, 2017. 大菱鲆性腺分化以及Mtnrs, kiss/kissr和GnRH在性腺成熟过程中的表达特征. 青岛: 中国科学院大学(中国科学院海洋研究所)博士学位论文
|
Amano M, Oka Y, Nagai Y et al, 2008. Immunohistochemical localization of a GnRH-like peptide in the brain of the cephalopod spear-squid, Loligo bleekeri. General and Comparative Endocrinology, 156(2): 277-284 DOI:10.1016/j.ygcen.2008.01.008 |
Andrea M, Ike O, Andrea D F et al, 2016. Characterization and transcriptional profiles of Engraulis encrasicolus' GnRH forms. Reproduction (Cambridge, England), 152(6): 727-739 DOI:10.1530/REP-16-0405 |
Balaban P, 1996. Cephalopod neurobiology. Trends in Neurosciences, 19(3): 115 DOI:10.1016/S0166-2236(96)80041-5 |
Bigot L, Zatylny-Gaudin C, Rodet F et al, 2012. Characterization of GnRH-related peptides from the Pacific oyster Crassostrea gigas. Peptides, 34(2): 303-310 DOI:10.1016/j.peptides.2012.01.017 |
Cao Z H, Sun L L, Chi C F et al, 2016. Molecular cloning, expression analysis and cellular localization of an LFRFamide gene in the cuttlefish Sepiella japonica. Peptides, 80: 40-47 DOI:10.1016/j.peptides.2015.10.005 |
Chaiyamoon A, Tinikul R, Nontunha N et al, 2020. Characterization of TRH/GnRH-like peptides in the sea cucumber, Holothuria scabra, and their effects on oocyte maturation. Aquaculture, 518: 734814 DOI:10.1016/j.aquaculture.2019.734814 |
Chang J P, Pemberton J G, 2018. Comparative aspects of GnRH-Stimulated signal transduction in the vertebrate pituitary-contributions from teleost model systems. Molecular and Cellular Endocrinology, 463: 142-167 DOI:10.1016/j.mce.2017.06.002 |
Counis R, Laverriere J N, Garrel G et al, 2005. Gonadotropin-releasing hormone and the control of gonadotrope function. Reproduction Nutrition Development, 45(3): 243-254 DOI:10.1051/rnd:2005017 |
Decatur W A, Hall J A, Smith J J et al, 2013. Insight from the lamprey genome: glimpsing early vertebrate development via neuroendocrine-associated genes and shared synteny of gonadotropin-releasing hormone (GnRH). General and Comparative Endocrinology, 192: 237-245 DOI:10.1016/j.ygcen.2013.05.020 |
Di Cosmo A, Di Cristo C, 1998. Neuropeptidergic control of the optic gland of Octopus vulgaris: FMRF-amide and GnRH immunoreactivity. The Journal of Comparative Neurology, 398(1): 1-12 DOI:10.1002/(SICI)1096-9861(19980817)398:1<1::AID-CNE1>3.0.CO;2-5 |
Di Cristo C, De Lisa E, Di Cosmo A, 2009. GnRH in the brain and ovary of Sepia officinalis. Peptides, 30(3): 531-537 DOI:10.1016/j.peptides.2008.07.008 |
Gomes C C, Costa F G, Borella M I, 2013. Distribution of GnRH in the brain of the freshwater teleost Astyanax altiparanae (Garutti & Britski, 2000). Micron, 52-53: 33-38 DOI:10.1016/j.micron.2013.07.008 |
Gothilf Y, Meiri I, Elizur A et al, 1997. Preovulatory changes in the levels of three gonadotropin-releasing hormone- encoding messenger ribonucleic acids (mRNAs), gonadotropin beta-subunit mRNAs, plasma gonadotropin, and steroids in the female gilthead seabream, Sparus aurata. Biology of Reproduction, 57(5): 1145-1154 DOI:10.1095/biolreprod57.5.1145 |
Gottsch M L, Cunningham M J, Smith J T et al, 2004. A role for kisspeptins in the regulation of gonadotropin secretion in the mouse. Endocrinology, 145(9): 4073-4077 DOI:10.1210/en.2004-0431 |
Gray Sarah L, Adams Bruce A, Warby Carol M et al, 2002. Transcription and translation of the salmon gonadotropin-releasing hormone genes in brain and gonads of sexually maturing rainbow trout (Oncorhynchus mykiss). Biology of Reproduction, 67(5): 1621-1627 DOI:10.1095/biolreprod.102.004788 |
Hildahl J, Sandvik G K, Edvardsen R B et al, 2011. Identification and gene expression analysis of three GnRH genes in female Atlantic cod during puberty provides insight into GnRH variant gene loss in fish. General and Comparative Endocrinology, 172(3): 458-467 DOI:10.1016/j.ygcen.2011.04.010 |
Imanaga Y, Nyuji M, Amano M et al, 2014. Characterization of gonadotropin-releasing hormone and gonadotropin in jack mackerel (Trachurus japonicus): comparative gene expression analysis with respect to reproductive dysfunction in captive and wild fish. Aquaculture, 428-429: 226-235 DOI:10.1016/j.aquaculture.2014.03.003 |
In V V, Ntalamagka N, O'Connor W et al, 2016. Reproductive neuropeptides that stimulate spawning in the Sydney Rock Oyster (Saccostrea glomerata). Peptides, 82: 109-119 DOI:10.1016/j.peptides.2016.06.007 |
Iwakoshi E, Takuwa-Kuroda K, Fujisawa Y et al, 2002. Isolation and characterization of a GnRH-like peptide from Octopus vulgaris. Biochemical and Biophysical Research Communications, 291(5): 1187-1193 DOI:10.1006/bbrc.2002.6594 |
Iwakoshi-Ukena E, Ukena K, Takuwa-Kuroda K et al, 2004. Expression and distribution of octopus gonadotropin-releasing hormone in the central nervous system and peripheral organs of the octopus (Octopus vulgaris) by in situ hybridization and immunohistochemistry. The Journal of Comparative Neurology, 477(3): 310-323 DOI:10.1002/cne.20260 |
Kah O, Lethimonier C, Somoza G et al, 2007. GnRH and GnRH receptors in metazoa: a historical, comparative, and evolutive perspective. General and Comparative Endocrinology, 153(1/3): 346-364 |
Kanda A, Takahashi T, Satake H et al, 2006. Molecular and functional characterization of a novel gonadotropin- releasing-hormone receptor isolated from the common octopus (Octopus vulgaris). The Biochemical Journal, 395(1): 125-135 DOI:10.1042/BJ20051615 |
Ma Y, Ladisa C, Chang J P et al, 2020. Multifactorial control of reproductive and growth axis in male goldfish: Influences of GnRH, GnIH and thyroid hormone. Molecular and Cellular Endocrinology, 500: 110629 DOI:10.1016/j.mce.2019.110629 |
Masafumi Amano, Ky Xuan Pham, Noriko Amiya et al, 2008. Changes in brain seabream GnRH mRNA and pituitary seabream GnRH peptide levels during ovarian maturation in female barfin flounder. General and Comparative Endocrinology, 158(2): 168-172 DOI:10.1016/j.ygcen.2008.06.008 |
Nagasawa K, Oouchi H, Itoh N et al, 2015a. In vivo administration of scallop GnRH-like peptide influences on gonad development in the Yesso Scallop, Patinopecten yessoensis. PLoS One, 10(6): e0129571 DOI:10.1371/journal.pone.0129571 |
Nagasawa K, Osugi T, Suzuki I et al, 2015b. Characterization of GnRH-like peptides from the nerve ganglia of Yesso scallop, Patinopecten yessoensis. Peptides, 71: 202-210 DOI:10.1016/j.peptides.2015.07.022 |
Newth D R, 1972. The anatomy of the nervous system of Octopus vulgaris. Journal of Neurology, Neurosurgery and Psychiatry, 35(3): 421 |
Nozaki M, Ominato K, Gorbman A et al, 2000. The distribution of lamprey GnRH-Ⅲ in brains of adult sea lampreys (Petromyzon marinus). General and Comparative Endocrinology, 118(1): 57-67 DOI:10.1006/gcen.1999.7451 |
Nyuji M, Fujisawa K, Imanaga Y et al, 2013. GnRHa-induced spawning of wild-caught jack mackerel Trachurus japonicus. Fisheries Science, 79(2): 251-258 DOI:10.1007/s12562-013-0599-4 |
Onitsuka C, Yamaguchi A, Kanamaru H et al, 2009. Molecular cloning and expression analysis of a GnRH-like dodecapeptide in the swordtip squid, Loligo edulis. Zoological Science, 26(3): 203-208 DOI:10.2108/zsj.26.203 |
Osada M, Treen N, 2013. Molluscan GnRH associated with reproduction. General and Comparative Endocrinology, 181: 254-258 DOI:10.1016/j.ygcen.2012.09.002 |
Powell J F, Prakash M O, Fischer W H et al, 1996. Two new forms of gonadotropin-releasing hormone in a protochordate and the evolutionary implications. Proceedings of the National Academy of Sciences of the United States of America, 93(9): 10461-10464 |
Schneider J S, Rissman E F, 2008. Gonadotropin-releasing hormone Ⅱ: a multi-purpose neuropeptide. Integrative and Comparative Biology, 48(5): 588-595 DOI:10.1093/icb/icn018 |
Selvaraj S, Kitano H, Amano M et al, 2012. Molecular characterization and expression profiles of three GnRH forms in the brain and pituitary of adult chub mackerel (Scomber japonicus) maintained in captivity. Aquaculture, 356-357: 200-210 DOI:10.1016/j.aquaculture.2012.05.015 |
Silver M R, Kawauchi H, Nozaki M et al, 2004. Cloning and analysis of the lamprey GnRH-Ⅲ cDNA from eight species of lamprey representing the three families of Petromyzoniformes. General and Comparative Endocrinology, 139(1): 85-94 DOI:10.1016/j.ygcen.2004.07.011 |
Song Y, Miao J J, Cai Y F et al, 2015. Molecular cloning, characterization, and expression analysis of a gonadotropin-releasing hormone-like cDNA in the clam, Ruditapes philippinarum. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 189: 47-54 DOI:10.1016/j.cbpb.2015.07.005 |
Soverchia L, Carotti M, Andreu-Vieyra C et al, 2007. Role of gonadotropin-releasing hormone (GnRH) in the regulation of gonadal differentiation in the gilthead seabream (Sparus aurata). Molecular Reproduction and Development, 74(1): 57-67 DOI:10.1002/mrd.20484 |
Tinikul Y, Poljaroen J, Tinikul R et al, 2014. Effects of gonadotropin-releasing hormones and dopamine on ovarian maturation in the Pacific white shrimp, Litopenaeus vannamei, and their presence in the ovary during ovarian development. Aquaculture, 420-421: 79-88 DOI:10.1016/j.aquaculture.2013.10.036 |
Tsai P S, 2018. Gonadotropin-releasing hormone by any other name would smell as sweet. General and Comparative Endocrinology, 264: 58-63 DOI:10.1016/j.ygcen.2017.09.010 |
Tsai P S, Sun B, Rochester J R et al, 2010. Gonadotropin- releasing hormone-like molecule is not an acute reproductive activator in the gastropod, Aplysia californica. General and Comparative Endocrinology, 166(2): 280-288 DOI:10.1016/j.ygcen.2009.09.009 |
Zhang L H, Tello J A, Zhang W M et al, 2008. Molecular cloning, expression pattern, and immunocytochemical localization of a gonadotropin-releasing hormone-like molecule in the gastropod mollusk, Aplysia californica. General and Comparative Endocrinology, 156(2): 201-209 DOI:10.1016/j.ygcen.2007.11.015 |
Zhou X S, Yi Q L, Zhong Q W et al, 2012. Molecular cloning, tissue distribution, and ontogeny of gonadotropin-releasing hormone Ⅲ gene (GnRH-Ⅲ) in half-smooth tongue sole (Cynoglossus semilaevis). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 163(1): 59-64 DOI:10.1016/j.cbpb.2012.04.010 |
 2021, Vol. 52
2021, Vol. 52


