中国海洋湖沼学会主办。
文章信息
- 金岳, 李楠, 俞骏, 方舟, 陈新军. 2021.
- JIN Yue, LI Nan, YU Jun, FANG Zhou, CHEN Xin-Jun. 2021.
- 基于耳石微化学的南海北部海域两种枪乌贼洄游路线初步研究
- PRELIMINARY STUDY ON THE MIGRATION CHARACTERISTIC OF TWO LOLIGO SPECIES IN THE NORTHERN SOUTH CHINA SEA BASED ON OTOLITH MICROCHEMISTRY
- 海洋与湖沼, 52(6): 1540-1548
- Oceanologia et Limnologia Sinica, 52(6): 1540-1548.
- http://dx.doi.org/10.11693/hyhz20210400080
文章历史
-
收稿日期:2021-04-02
收修改稿日期:2021-05-23
2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东省渔业资源与生态环境重点实验室 青岛 266071;
3. 大洋渔业资源可持续开发教育部重点实验室 上海 201306;
4. 国家远洋渔业工程技术研究中心 上海 201306;
5. 农业农村部大洋渔业开发重点实验室 上海 201306;
6. 农业农村部大洋渔业资源环境科学观测实验站 上海 201306
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory for Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Key Laboratory of Fishery Resources and Ecological Environment, Shandong Province, Qingdao 266071, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
5. Key Laboratory of Ocean Fisheries Exploitation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
6. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
枪乌贼科(Loliginidae)隶属于头足纲(Cephalopoda)、闭眼亚目(Myopsida), 种类繁多, 广泛分布于全球近岸和浅海海域(李楠等, 2020a)。我国近岸海域分布着约十余种枪乌贼, 其中南海北部海域以其优良的地理位置, 丰富的营养盐和适宜的温度, 适宜各种头足类在此栖息(蔡研聪等, 2020)。中国枪乌贼(Uroteuthis chinensis)和剑尖枪乌贼(U. edulis)是我国重要的渔业经济物种, 生长迅速, 资源量丰富, 且对环境较为敏感(金岳, 2018)。了解枪乌贼的洄游路线是揭示个体生命历程的关键研究点, 同时也是掌握其渔业生物学研究特征的重要基础。目前对上述两种枪乌贼在南海海域洄游特征了解较少, 亟待深入进行相关研究。
研究头足类洄游路线的方法众多, 近些年来兴起的微化学研究法可以较为准确地反映出头足类在整个生活史过程中的经历(方舟, 2016; 金岳, 2018)。作为头足类重要的硬组织之一, 耳石是一种有着稳定结构的钙化组织, 有着丰富的生态信息, 包含了头足类整个生活史过程(Arkhipkin, 2005)。耳石中还存在较多的微量元素, 其含量与外界环境中对应的微量元素关系密切。已有诸多研究结果建立了头足类耳石中的微量元素与环境因素之间的关系。太平洋褶柔鱼(Todarodes pacificus)耳石中的Sr/Ca与温度呈负相关关系(Ikeda et al, 1996)。Yatsu等(1998)认为由于季节性洄游的影响, 不同生活史阶段柔鱼耳石的Sr/Ca存在差异。同时某些底层头足类(水蛸Enteroctopus dofleini)中的耳石Sr/Ca同样与其栖息的底层温度呈现负相关关系(Ikeda et al, 1999)。在日本近岸海域研究剑尖枪乌贼耳石中Sr/Ca与环境水温之间也呈现类似关系(Yamaguchi et al, 2015)。头足类耳石中的另一种元素钡(Ba)也与环境间有着紧密的关系。Arkhipkin等(2004)发现不同生活史过程中巴塔哥尼亚枪乌贼(Doryteuthis gahi)耳石的钡钙比(Ba/Ca)差异可能是由上升流或深水洄游造成的。也有学者通过耳石中Ba/Ca值区分黵乌贼(Gonatus fabricii)在不同生活史阶段所栖息的水层, 并分析其潜在的变化规律(Zumholz et al, 2007)。综合考虑多种微量元素, 并与不同时期环境因素相结合, 已成功地应用在逆推和重构几种经济性柔鱼类的洄游规律中(Ikeda et al, 2003; Liu et al, 2016; Yamaguchi et al, 2018)。由此可见, 通过研究头足类耳石中微量元素含量, 并将其与环境因子建立关系, 从而来逆推测物种洄游路线的方法是可行的。
因此, 本研究拟根据南海北部中国枪乌贼和剑尖枪乌贼耳石中的微量元素, 比较不同生长时期微量元素的变化, 构建微量元素与环境之间的关系, 进一步推测两种枪乌贼可能的洄游路线, 以期为后续的合理保护利用以及禁渔期的管理提供参考。
1 材料与方法 1.1 样品采集中国枪乌贼和剑尖枪乌贼样本于2016年5月委托拖网渔船“粤汕城渔16118”号在南海北部海域(113.5°—117.5°E, 20.5°—23.5°N)采样获得(表 1)。
| 种类 | 采集范围 | 样本数量 | 日龄范围(d) | 胴长范围(mm) |
| 中国枪乌贼U. chinensis | 113.5°—117.5°E 20.5°—22.5°N |
39 | 88—188 | 73—476 |
| 剑尖枪乌贼U. edulis | 113.5°—115.5°E 21.5°—23.5°N |
43 | 84—161 | 76—241 |
根据不同水层的特点和两种枪乌贼的栖息特征, 本研究主要获取以50 m为间隔的大陆架内不同水层温度(0, 50, 100, 150, 200 m)。数据来源于从美国国家海洋和大气管理局(NOAA)网站(http://apdrc.soest.hawaii.edu/las/v6), 分辨率为0.25°×0.25°。
1.2.2 孵化日龄推算首先将耳石从枪乌贼的平衡囊内取出, 并通过研磨至核心, 抛光后在显微镜下读取轮纹数, 最终得到耳石日龄。根据已有研究表明, 枪乌贼类的第一日轮出现在孵化前8—16 d左右, 均值为12 d, 因此最终日龄需要加上12 d (Yamaguchi et al, 2015, 2018)。因此对上述的39尾中国枪乌贼和43尾剑尖枪乌贼进行日龄逆推算。推算的方法为: 孵化日期=捕捞日期–日龄+12。最终本研究所得的日龄结果请参考Jin等(2019)。
1.2.3 微量元素测定耳石微量元素含量利用激光剥蚀等离子质谱仪(LA-ICP-MS)进行测定, 主要测定元素为钙Ca、锶Sr、钡Ba。激光剥蚀系统为UP-213, ICP-MS为Agilent7700x。激光剥蚀过程中以氦气(He)作为载气, 氩气(Ar)作为补偿气体以调节灵敏度(Hu et al, 2008), 每个采样点数据包括20—30 s的空白信号和50 s的采样信号(表 2) (方舟, 2016; 许巍等, 2020)。以NIST610、MACS-3、BHVO-2G和BIR-1G为校正标准样品, 并采用外标和无内标法对元素浓度进行定量分析(林静远等, 2019)。采用ICPMS- Data-Cal软件对采样数据进行离线处理以获取元素含量(Liu et al, 2008)。
| UP-213激光剥蚀系统 | Agilent 7700x ICP-MS系统 | |||
| 波长 | 193 nm | 射频功率 | 1350 W | |
| 能量密度 | 11.9 J/cm2 | 等离子体流速(氩气) | 15.0 L/min | |
| 剥蚀直径 | 40 μm | 辅助气流速(氩气) | 1.0 L/min | |
| 频率 | 5 Hz | 补偿气(氩气) | 0.7 L/min | |
| 载气(氩气) | 0.65 L/min | 采样深度 | 5 mm | |
| 剥蚀方式 | 单点 | 检测器模式 | 双重 | |
测定前将抛光后的耳石切片置于超纯水的超声波震荡仪中清洗5 min, 以便清除切片上的杂质(刘玉等, 2019)。本研究参考前人的结果, 分布不同区域的耳石部位代表不同生长阶段, 从核心至耳石边缘依次提取5个点样, 各采样点分别代表个体的胚胎期(核心区, 点1)、仔鱼期(后核心区, 点2)、稚鱼期(暗区, 点3)、亚成鱼期(外围区, 点4)和成鱼期(外围边缘区, 点5) (图 1) (Liu et al, 2011)。
 |
| 图 1 耳石激光剥蚀打点位置示意图 Fig. 1 Schematic of laser ablation for sample spots in the statolith |
本研究主要依据如下假设条件:
假设条件1: 根据目前文献报道, 本研究中的两种枪乌贼均为浅海性种类, 适宜栖息地主要在大陆架水域内, 同时常发现两种枪乌贼会在水深100—200 m处集群, 在大陆架外水域较少发现(陈新军等, 2013)。据此, 合理假设中国枪乌贼和剑尖枪乌贼在本研究中分布的最远边界即为水深200 m大陆架附近。
假设条件2: 已有研究发现, 尽管不同种群剑尖枪乌贼洄游移动速度不同, 但均在0.74 km/h范围内(Natsukari et al, 1991)。同时, 洄游距离较远的种类, 其最大速度一般不超过0.55 km/h。因此, 合理假设本研究中两种枪乌贼移动速度最大为0.55 km/h。
假设条件3: 大量研究已建立起耳石中Sr/Ca与温度间的关系(Arkhipkin et al, 2004; Yamaguchi et al, 2015, 2018), 多数研究结果表明Sr/Ca与温度呈负相关。据此, 假设本研究两种枪乌贼Sr/Ca与水温也有着负相关关系。
假设条件4: Ba/Ca含量的变化从海表至底层呈现出逐步升高的情况(Chan et al, 1977), 在某些海域中, Ba/Ca与上升流事件有着密切的关系(Lea et al, 1989)。上述结论在后续头足类耳石研究中也得到印证(Zumholz et al, 2007; Yamaguchi et al, 2015)。据此, 假设水深越深, 两种枪乌贼耳石Ba/Ca值越高。
参照上述假设条件, 进行如下实施方案:
实施方案1: 通过逆推算法, 对耳石的每一个取样位置的孵化月份进行估算。从核心到边缘打点的轮纹数分别为0、60、90、120和150 d。通过个体的总日龄与具体轮纹数相减的方式, 得出每一个耳石取样点具体的孵化月份。
实施方案2: 依据Ba/Ca与栖息水深的假设关系, 推测不同种类不同生长阶段的平均水层深度。结合两种枪乌贼主要的分布范围, 同时考虑枪乌贼早期的繁殖特征及移动能力, 因此以水深100 m的水温设定为孵化温度, 仔鱼期所处温度的水深稍高于孵化期, 为0—50 m, 剩余时期均以海表面温度(0 m)作为栖息适宜温度。
实施方案3: 通过卫星遥感数据获取南海北部近岸0、50和100 m水温。利用各水层水温建立与Sr/Ca的关系。
实施方案4: 根据上述结果, 结合历史资料数据(Yamaguchi et al, 2015, 2018; 李楠等, 2020a), 综合推测洄游路线。
2 结果 2.1 不同种类孵化月份分布依据Jin等(2019)所获得的日龄结果, 本研究测定的样品中, 中国枪乌贼的日龄范围为86—179 d, 剑尖枪乌贼的日龄范围为100—165 d。经过逆推算可知2015年10月—2016年1月是中国枪乌贼的主要孵化月份, 而剑尖枪乌贼的孵化月份集中在2015年11月—2016年2月(表 3)。后续研究中也将选取对应月份的环境因子进行分析。
| 种类 | 月份 | ||||
| 10月 | 11月 | 12月 | 1月 | 2月 | |
| 中国枪乌贼U. chinensis | 7 | 16 | 7 | 9 | 0 |
| 剑尖枪乌贼U. edulis | 0 | 15 | 14 | 7 | 7 |
从中国枪乌贼耳石分析结果来看, 在10月孵化的个体, Sr/Ca从孵化期到成鱼期呈现逐步下降的趋势, 在亚成鱼至成鱼期时变化较小; Sr/Ca在11月孵化个体的初期缓慢升高, 仔鱼期后逐步下降, 在最后的成鱼期有所回升。12月和1月孵化个体的Sr/Ca从孵化期到亚成鱼期均明显下降, 直至成鱼期有大幅回升, 尤其是1月个体。总体来看, 中国枪乌贼耳石Sr/Ca随月份推移呈现出降低—回升的趋势变化(图 2)。
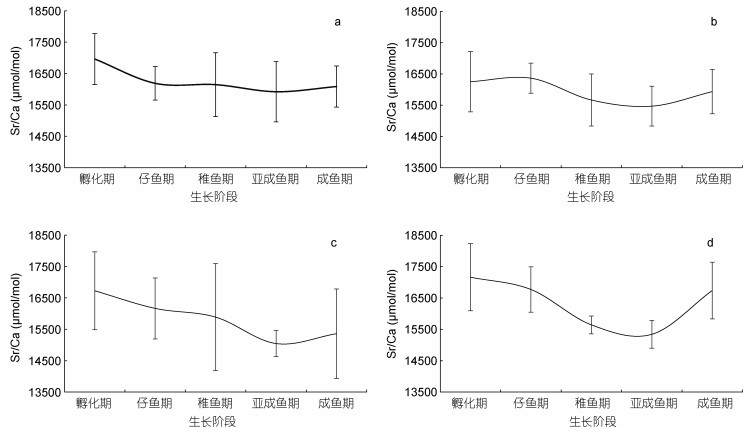 |
| 图 2 不同孵化月份中国枪乌贼各生长阶段Sr/Ca值 Fig. 2 Ontogenetic variation in Sr/Ca ratio of U. chinensis in different spawning months 注: a为10月孵化个体, b为11月孵化个体, c为12月孵化个体, d为1月孵化个体 |
剑尖枪乌贼有着更为丰富的变化。稚鱼期Sr/Ca在11月孵化个体中最低, 亚成鱼期和成鱼期变化不明显。Sr/Ca在12月孵化个体从孵化期和至稚鱼期缓慢下降, 随后迅速上升。1月份孵化个体, Sr/Ca在除孵化期外, 其他几个时期依次呈现出U型变化。2月孵化个体, 孵化期中的Sr/Ca最高, 到亚成鱼期降到最低, 随后略有回升(图 3)。
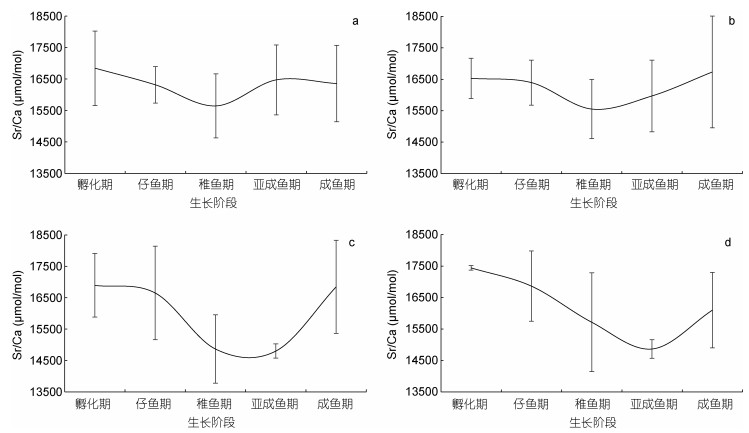 |
| 图 3 不同孵化月份剑尖枪乌贼各生长阶段Sr/Ca值 Fig. 3 Ontogenetic variation in Sr/Ca ratio of U. edulis in different spawning months 注: a为11月孵化个体, b为12月孵化个体, c为1月孵化个体, d为2月孵化个体 |
10月孵化的中国枪乌贼个体, Ba/Ca随着个体生长缓慢下降, 成鱼期略有增长; Ba/Ca的仔鱼期在11月孵化个体最高, 随后的生长过程中呈现出U型变化趋势; Ba/Ca的变化在12月孵化个体于11月基本类似; 1月孵化个体, Ba/Ca随着生长过程逐步下降, 成鱼期时迅速增高(图 4)。
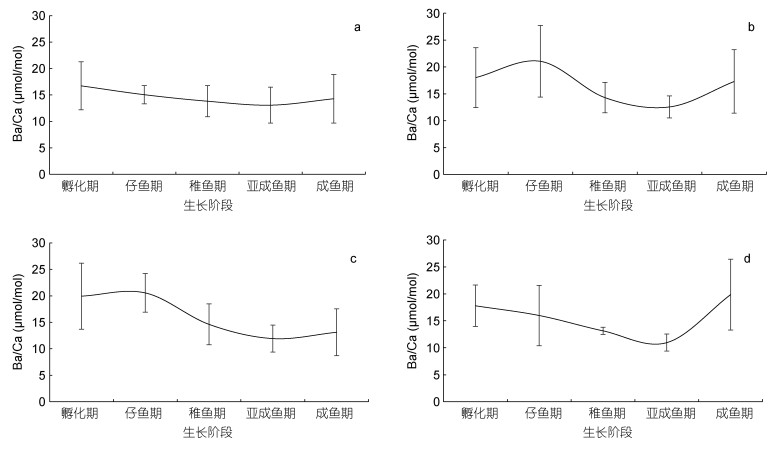 |
| 图 4 不同孵化月份中国枪乌贼各生长阶段Ba/Ca值 Fig. 4 Ontogenetic variation in Ba/Ca ratio of U. chinensis in different spawning months 注: a为10月孵化个体, b为11月孵化个体, c为12月孵化个体, d为1月孵化个体 |
相比而言, 剑尖枪乌贼耳石Ba/Ca的变化, 不同月份孵化个体均呈现类似的趋势, 孵化期和仔鱼期变化不明显, 随后逐渐下降, 至成鱼期逐步回升(图 5)。
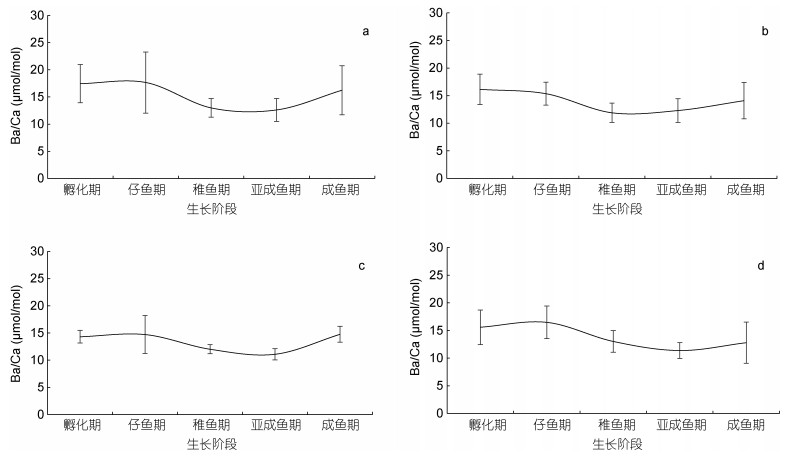 |
| 图 5 不同孵化月份剑尖枪乌贼各生长阶段Ba/Ca值 Fig. 5 Ontogenetic variation of Ba/Ca ratio of U. edulis in different spawning months 注: a为11月孵化个体, b为12月孵化个体, c为1月孵化个体, d为2月孵化个体 |
根据假设中对不同生活史阶段水深的推测, 建立不同时期与温度的关系。结果发现, 在任一时期, 不同月份两个种类的栖息温度均在21—27 ℃间, 且中国枪乌贼的栖息温度略高于剑尖枪乌贼。
通过建立枪乌贼各生长阶段耳石Sr/Ca与不同月份栖息温度的关系(图 6和图 7), 可以发现, 中国枪乌贼中温度与Sr/Ca的关联度逐月升高, 仅在1月中两者的关系为负相关, 其他月均为正相关关系; 剑尖枪乌贼的所有个体均遵循Sr/Ca与温度呈负相关关系的现象。其中, 两个物种在1月和2月的孵化个体与温度的关系更为紧密(图 6, 图 7)。
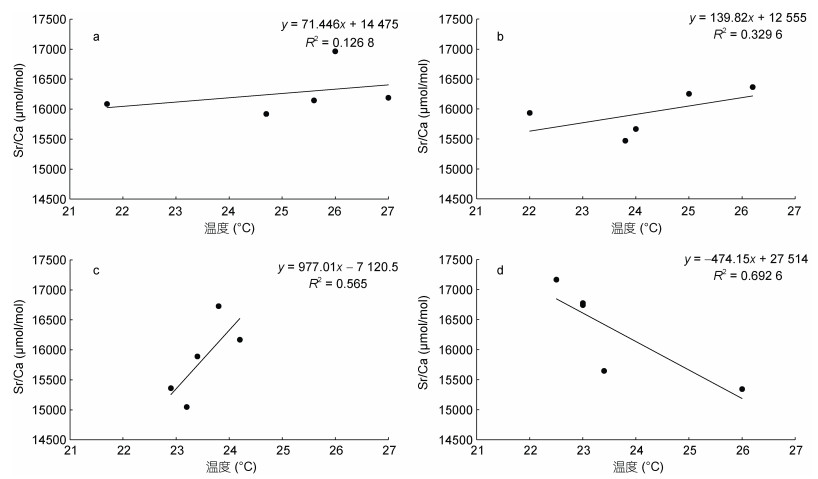 |
| 图 6 不同孵化月份中国枪乌贼耳石Sr/Ca与温度的关系 Fig. 6 Relationships between Sr/Ca and temperature of U. chinensis statolith in different months 注: a为10月孵化个体, b为11月孵化个体, c为12月孵化个体, d为1月孵化个体 |
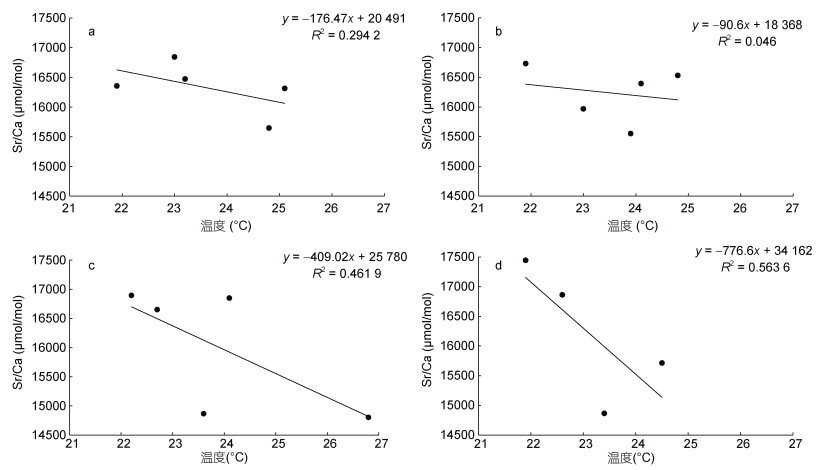 |
| 图 7 不同孵化月份剑尖枪乌贼耳石Sr/Ca与温度的关系 Fig. 7 Relationships between Sr/Ca and temperature of U. edulis statolith in different months 注: a为11月孵化个体, b为12月孵化个体, c为1月孵化个体, d为2月孵化个体 |
本研究中的中国枪乌贼和剑尖枪乌贼样本经过逆推算均为10月—翌年2月孵化的个体, 即秋冬季孵化群体。由于南海北部地处低纬度地区, 全年水温变化不大(蔡研聪等, 2020)。Wang等(2013)研究了环境对不同种群剑尖枪乌贼的影响, 结果认为冬生群个体较大, 生长速度较快, 主要是由于其主要生长阶段处于春夏季, 有着较高的水温和摄食状况, 有利于剑尖枪乌贼快速生长, 因此枪乌贼类在秋冬季的群体资源量较大。因此, 海洋环境状况是影响枪乌贼生长的重要因素, 也是通过影响个体摄食、繁殖, 进而促使其洄游的诱因之一(Jackson et al, 2003; Moreno et al, 2007)。
3.2 两种枪乌贼耳石Sr和Ba元素变化规律海水中富含较高浓度的Sr, 因此许多海洋物种的耳石微量元素中, Sr是含量仅次于Ca的次重要元素。栖息温度是影响Sr/Ca的关键因素(Ikeda et al, 2003; Arkhipkin et al, 2004; Zumholz et al, 2007; Yamaguchi et al, 2018)。有学者研究了北太平洋柔鱼Sr/Ca从核心区到外围区的变化情况, 整体结果也呈现出了U型变化规律, 即核心与外围值高, 而中间阶段低的情况(方舟, 2016), 这可能与其在产卵场至索饵场的洄游规律有关, 且不同海域水温有着差异(Yatsu et al, 1998)。同时在其他头足类物种中也有较多研究证明了水温与Sr/Ca呈现出显著负相关关系(Ikeda et al, 2003; Yamaguchi et al, 2015)。从本研究结果发现, 仅1月份孵化的中国枪乌贼个体耳石的Sr/Ca与假设水温为负相关, 其他月份均为正相关。10—12月Sr/Ca与水温的关联度相对较低, 1月的关联度相对较高, 可以说明1月孵化个体与水温关系最为显著。而剑尖枪乌贼在各孵化月份个体耳石的Sr/Ca与水温均呈现负相关关系。该结论在其他海域的剑尖枪乌贼研究中也有所证实(Yamaguchi et al, 2018), 但由于所处海域不同, 因此栖息水温范围存在较大的差异。根据本研究结果可以认为, 冬季孵化的两种枪乌贼耳石Sr/Ca与水温关系基本呈现了与假设结果一致的情况。
在海洋中, Ba含量随水深而增加(Lea et al, 1989), 因此该元素含量也会在海洋生物的耳石中有所提现, 这在巴塔哥尼亚枪乌贼与黵乌贼等的研究中均有类似发现。根据本研究所得的结果, 认为枪乌贼在生长中期(稚鱼期和亚成鱼期)耳石所含Ba/Ca较低, 生长初期和捕获期的值相对较高, 根据Ba/Ca与水深间关系假设, 可以合理推测: 由于两种枪乌贼的卵均产于海底(Sauer et al, 1992; Shashar et al, 2013), 因此它们在早期所栖息的水层较深, 故选择100 m左右的水温表征孵化期温度; 孵化后根据摄食特征则会向浅水区移动, 因此以0—50 m水温表征仔鱼期温度; 随着个体的生长, 其自主移动能力逐渐增强, 因此会逐渐在表层进行摄食活动, 因此在生长中后期均选择了表层水温表征此阶段的栖息温度。此结果可以帮助后续洄游路径确定枪乌贼在不同时期所生活的水层, 具有重要意义。
3.3 两种枪乌贼洄游路径推测在诸多头足类洄游路径研究方法中, 基于耳石微化学研究应用地最为广泛, 其中又以Sr/Ca值的利用率为最高(Yamaguchi et al, 2015; Liu et al, 2016; Yamaguchi et al, 2018)。本研究首先根据Ba/Ca与水深的关系, 推测不同生长阶段所应选取温度的水层, 然后建立Sr/Ca与对应水层水温的关系, 从而来推测两种枪乌贼的洄游路径。近岸的枪乌贼类往往洄游的范围不及大洋性鱿鱼类, 因此不同时期水层变化是其中的关键点(陈新军等, 2013)。本研究也首次将两种元素综合考虑, 得到了较为合理的结果。已有学者研究发现, 两种枪乌贼的主要栖息水深在15—170 m之间, 会在近海海域进行不同水深的定向南北洄游。同时在夏季, 南海北部近海100—200 m深度的海域内, 会形成一条密集的鱿鱼聚集带, 主要进行繁殖产卵活动(李楠等, 2020a, b)。因此, 根据上述结果, 本研究可以推测冬季孵化的枪乌贼的洄游路径基本为: 每年冬季, 枪乌贼在海底礁石或砂砾上产卵(70—100 m), 卵孵化后, 由于没有移动能力, 基本在海底越冬(约到3月左右); 随着个体逐渐增长, 初步具备移动能力, 因此逐步向北, 靠近近岸的方向进行索饵洄游, 栖息水层也逐步上升至表层; 到每年夏季(7—9月), 枪乌贼个体会在100—200 m的大陆架海域进行繁殖活动, 随后雌性个体返回产卵场进行产卵。
4 结论本研究利用耳石中Sr和Ba两种微量元素, 首次对分布于南海北部海域的中国枪乌贼和剑尖枪乌贼的洄游路径进行了推测, 并得到了合理的结果。该研究方法充分考虑了枪乌贼在不同生活史阶段的栖息特点, 并通过微量元素与环境因子结合, 进行了合理的预测。同时, 也应注意到, 水温虽然是头足类洄游的主要影响因素, 但其洄游特征同样也会受到饵料分布以及诸如海流、盐度、溶解氧等其他环境因素的影响。因此, 在后续的研究中, 应该综合考虑其他环境因子, 合理地纳入洄游预测方法中, 并结合其他分析方法(如多元分析方法) (Vignon, 2015), 更准确地预测枪乌贼的洄游路径。
方舟, 2016. 基于角质颚的北太平洋柔鱼渔业生态学研究. 上海: 上海海洋大学博士学位论文, 103-117
|
刘玉, 王雪辉, 杜飞雁, 等. 2019. 南海鸢乌贼耳石微量元素差异性分析. 南方水产科学, 15(5): 15-24 |
许巍, 陈新军, 刘必林, 等. 2020. 基于眼睛晶体核心微量元素的茎柔鱼地理种群判别. 水产学报, 44(6): 947-958 |
李楠, 方舟, 陈新军. 2020a. 剑尖枪乌贼渔业研究进展. 大连海洋大学学报, 35(4): 637-644 |
李楠, 方舟, 陈新军. 2020b. 东海北部外海剑尖枪乌贼渔业生物学特征. 上海海洋大学学报, 29(4): 622-631 |
陈新军, 王尧耕, 钱卫国. 2013. 中国近海重要经济头足类资源与渔业. 北京: 科学出版社, 23-36
|
金岳. 2018. 基于硬组织的中国近海枪乌贼渔业生物学研究. 上海: 上海海洋大学, 80-94
|
林静远, 刘必林, 王立权. 2019. 基于角质颚微结构的剑尖枪乌贼的日龄与生长. 华东理工大学学报(自然科学版), 45(5): 775-782 |
蔡研聪, 孙铭帅, 许友伟, 等. 2020. 南海北部近海头足类优势种及其生态位特征. 应用生态学报, 31(8): 2793-2803 |
Arkhipkin A I, 2005. Statoliths as 'black boxes' (life recorders) in squid. Marine and Freshwater Research, 56(5): 573-583 DOI:10.1071/MF04158 |
Arkhipkin A I, Campana S E, Fitzgerald J et al, 2004. Spatial and temporal variation in elemental signatures of statoliths from the Patagonian longfin squid (Loligo gahi). Canadian Journal of Fisheries and Aquatic Sciences, 61(7): 1212-1224 DOI:10.1139/f04-075 |
Chan L H, Drummond D, Edmond J M et al, 1977. On the barium data from the Atlantic GEOSECS expedition. Deep Sea Research, 24(7): 613-649 DOI:10.1016/0146-6291(77)90505-7 |
Hu Z C, Gao S, Liu Y S et al, 2008. Signal enhancement in laser ablation ICP-MS by addition of nitrogen in the central channel gas. Journal of Analytical Atomic Spectrometry, 23(8): 1093-1101 DOI:10.1039/b804760j |
Ikeda Y, Arai N, Kidokoro H et al, 2003. Strontium: calcium ratios in statoliths of Japanese common squid Todarodes pacificus (Cephalopoda: Ommastrephidae) as indicators of migratory behavior. Marine Ecology Progress Series, 251: 169-179 DOI:10.3354/meps251169 |
Ikeda Y, Arai N, Sakamoto W et al, 1996. Relationship between statoliths and environmental variables in Cephalopod. International Journal of PIXE, 6(1/2): 339-345 |
Ikeda Y, Arai N, Sakamoto W et al, 1999. Preliminary report on PIXE analysis for trace elements of Octopus dofleini statoliths. Fisheries Science, 65(1): 161-162 DOI:10.2331/fishsci.65.161 |
Jackson G D, Domeier M L, 2003. The effects of an extraordinary el Niño/la Niña event on the size and growth of the squid Loligo opalescens off southern California. Marine Biology, 142(5): 925-935 DOI:10.1007/s00227-002-1005-4 |
Jin Y, Li N, Chen X J et al, 2019. Comparative age and growth of Uroteuthis chinensis and Uroteuthis edulis from China Seas based on statolith. Aquaculture and Fisheries, 4(4): 166-172 DOI:10.1016/j.aaf.2019.02.002 |
Lea D W, Shen G T, Boyle E A, 1989. Coralline barium records temporal variability in equatorial pacific upwelling. Nature, 340(6232): 373-376 DOI:10.1038/340373a0 |
Liu B L, Cao J, Truesdell S B et al, 2016. Reconstructing cephalopod migration with statolith elemental signatures: a case study using Dosidicus gigas. Fisheries Science, 82(3): 425-433 DOI:10.1007/s12562-016-0978-8 |
Liu B L, Chen X J, Chen Y et al, 2011. Trace elements in the statoliths of jumbo flying squid off the exclusive economic zones of Chile and Peru. Marine Ecology Progress Series, 429: 93-101 DOI:10.3354/meps09106 |
Liu Y S, Hu Z C, Gao S et al, 2008. In situ analysis of major and trace elements of anhydrous minerals by LA-ICP-MS without applying an internal standard. Chemical Geology, 257(1-2): 34-43 DOI:10.1016/j.chemgeo.2008.08.004 |
Moreno A, Azevedo M, Pereira J et al, 2007. Growth strategies in the squid Loligo vulgaris from Portuguese waters. Marine Biology Research, 3(1): 49-59 DOI:10.1080/17451000601129115 |
Natsukari Y, Tashiro M, 1991. Neritic squid resources and cuttlefish resources in Japan. Marine Behaviour and Physiology, 18(3): 149-226 DOI:10.1080/10236249109378785 |
Sauer W H H, Smale M J, Lipinski M R, 1992. The location of spawning grounds, spawning and schooling behaviour of the squid Loligo vulgaris reynaudii (Cephalopoda: myopsida) off the eastern cape coast, South Africa. Marine Biology, 114(1): 97-107 DOI:10.1007/BF00350859 |
Shashar N, Hanlon R T, 2013. Spawning behavior dynamics at communal egg beds in the squid Doryteuthis (Loligo) pealeii. Journal of Experimental Marine Biology and Ecology, 447: 65-74 DOI:10.1016/j.jembe.2013.02.011 |
Vignon M, 2015. Extracting environmental histories from sclerochronological structures-recursive partitioning as a mean to explore multi-elemental composition of fish otolith. Ecological Informatics, 30: 159-169 DOI:10.1016/j.ecoinf.2015.10.002 |
Wang K Y, Chang K Y, Liao C H et al, 2013. Growth strategies of the swordtip squid, Uroteuthis edulis, in response to environmental changes in the southern East China Sea-a cohort analysis. Bulletin of Marine Science, 89(3): 677-698 DOI:10.5343/bms.2012.1044 |
Yamaguchi T, Kawakami Y, Matsuyama M, 2015. Migratory routes of the swordtip squid Uroteuthis edulis inferred from statolith analysis. Aquatic Biology, 24(1): 53-60 DOI:10.3354/ab00635 |
Yamaguchi T, Kawakami Y, Matsuyama M, 2018. Analysis of the hatching site and migratory behaviour of the swordtip squid (Uroteuthis edulis) caught in the Japan Sea and Tsushima strait in autumn estimated by statolith analysis. Marine Biology Research, 14(1): 105-112 DOI:10.1080/17451000.2017.1351616 |
Yatsu A, Mochioka N, Morishita K et al, 1998. Strontium/calcium ratios in statoliths of the neon flying squid, Ommastrephes bartrami (Cephalopoda), in the North Pacific Ocean. Marine Biology, 131(2): 275-282 DOI:10.1007/s002270050320 |
Zumholz K, Klügel A, Hansteen T et al, 2007. Statolith microchemistry traces the environmental history of the boreoatlantic armhook squid Gonatus fabricii. Marine Ecology Progress Series, 333: 195-204 DOI:10.3354/meps333195 |
 2021, Vol. 52
2021, Vol. 52


