中国海洋湖沼学会主办。
文章信息
- 陈佳怡, 龙进霞, 徐汉祥, 张涛, 史会来, 徐开达, 梁君. 2021.
- CHEN Jia-Yi, LONG Jin-Xia, XU Han-Xiang, ZHANG Tao, SHI Hui-Lai, XU Kai-Da, LIANG Jun. 2021.
- 曼氏无针乌贼(Sepiella japonica)繁殖期行为谱特征的研究
- STUDY ON THE CHARACTERISTICS OF BEHAVIOR ETHOGRAM IN REPRODUCTIVE PERIOD OF SEPIELLA JAPONICA
- 海洋与湖沼, 52(6): 1549-1556
- Oceanologia et Limnologia Sinica, 52(6): 1549-1556.
- http://dx.doi.org/10.11693/hyhz20210500119
文章历史
-
收稿日期:2021-05-19
收修改稿日期:2021-07-29
2. 浙江省海洋水产研究所 舟山 316021;
3. 农业农村部重点渔场渔业资源科学观测实验站 舟山 316021;
4. 浙江省海洋渔业资源可持续利用技术研究重点实验室 舟山 316021
2. Zhejiang Marine Fisheries Research Institute, Zhoushan 316021, China;
3. Scientific Observing and Experimental Station of Fishery Resources for Key Fishing Grounds, Ministry of Agriculture and Rural Affairs, Zhoushan 316021, China;
4. Key Laboratory of Sustainable Utilization of Technology Research for Fishery Resource of Zhejiang Province, Zhoushan 316021, China
曼氏无针乌贼(Sepiella japonica)隶属于软体动物门(Mollusca)、头足纲(Cephalopoda)、十腕目(Decapoda)、乌贼科(Sepiidae)、无针乌贼属(Sepiella), 是我国近海重要经济头足类之一, 曾与大黄鱼(Larimichthys crocea)、小黄鱼(Larimichthys polyactis)和带鱼(Trichiurus lepturus)并称为我国东海“四大海产”(陈治等, 2020; 肖燃等, 2021)。自20世纪50年代末以来, 曼氏无针乌贼捕捞资源量经历了高产(最高年产近7万t, 至20世纪70年代末)—下滑(至1989年)—基本绝迹(至2005年)—转折(育苗成功, 至2009年)—年产3000 t (至今)的“过山车”式变化, 根本原因是过度捕捞和对乌贼产卵场的破坏, 鱼汛已不再出现(吴常文等, 2010)。曼氏无针乌贼具有生长速度快、生命周期短、世代更新快等特点, 近年来自然海域曼氏无针乌贼资源量有所恢复得益于我国沿海实施的规模化增殖放流和产卵场修复工作, 尤其是浙江近海, 然而在依赖政府主导的全域增殖放流以维系可捕资源量的背景下, 代际传递能维系多久?而繁殖期是曼氏无针乌贼生命周期的重要阶段, 繁殖行为不仅决定其后代的数量以及质量, 对遗传多样性和种群代际传递也有重要意义, 是制约自然群体大小的重要因素(Moltschaniwskyj et al, 2007)。
行为谱(ethogram)是一种动物正常行为的全部记录或名录, 建立动物的行为谱是行为学研究中最基础的内容(Mcdonnell et al, 2002; 郝爱霞等, 2014)。每一种动物都有自己的行为谱, 但至今为止, 国内外学者对极少数陆生动物的行为谱有较全面的了解, 而关于水生动物的行为谱研究却有待加强。当前, 国外学者对金乌贼(Sepia esculenta) (Wada et al, 2005)、曼氏无针乌贼(Wada et al, 2006)和头足类的行为(Hanlon et al, 2018)方面进行了较为全面详细的描述。而国内学者相继对拟目乌贼(Sepia lycidas) (文菁等, 2012)、虎斑乌贼(Sepia pharaonis) (陈道海等, 2013)以及金乌贼(王亮等, 2017)等十腕目种类繁殖行为方面进行了报道, 而关于曼氏无针乌贼, 仅有张炯等(1965)对自然群体开展的交配、产卵等繁殖习性室内观察的研究。近年来, 自然海域中曼氏无针乌贼产卵亲体性成熟提前和小型化现象明显(吴常文等, 2012), 这可能是放流种群繁殖期行为的一种适应性进化。因此, 人工干预背景下曼氏无针乌贼的繁殖期行为动态变化值得研究。
本研究以曼氏无针乌贼为对象, 采用聚焦个体扫描法和定点连续记录法, 于2020年4—6月对曼氏无针乌贼繁殖期的行为活动进行了观察、记录和分析, 以期阐明其繁殖期的行为特征, 并初步构建较完整的曼氏无针乌贼繁殖期行为谱, 为进一步探讨其行为机制和基于全生活史的资源保护等方面的研究提供理论依据。
1 材料与方法 1.1 实验材料及环境实验随机挑选200只健康、有活力、体表无任何损伤的曼氏无针乌贼产卵亲体, 性腺发育处于Ⅴ期。其中雄性88只, 体质量(42.88±16.74) g, 胴背长(67.92±8.85) mm; 雌性112只, 体质量(37.09±10.85) g, 胴背长(63.88±6.60) mm, 饲养于浙江省舟山市西轩渔业科技岛养殖基地。实验水池为圆形, 直径3 m, 水深1 m, 池底放置网片、竹丝等作为产卵附着基, 且放置前于海水中浸泡1 d。水池上方屋顶框架式为彩钢瓦材料, 设置透光天窗, 配有遮光布以调节光照度, 光周期与自然光一致。实验用水为经砂滤池过滤的天然海水, 水体高度控制在0.9 m且保证进水量和排水量相当, 实现流水环境, 水池内采用气石充氧。每日换水至少一次, 温度为23—27 ℃, 盐度为28—30。实验期间每日7:00、12:00、17:00各投饵1次, 投喂饵料为4—6 cm活的脊尾白虾, 根据残饵情况及时进行吸污清理, 始终保持水质清洁, 方便观察。
1.2 行为观察方法与行为谱构建本研究采用聚焦个体扫描法和定点连续记录法观察和记录曼氏无针乌贼繁殖期的行为。聚焦个体扫描法即按照既定的时间间隔逐个扫描观察目标对象的各种行为(揭志良, 2016)。每日7:30、11:30、15:30、19:30间隔观察曼氏无针乌贼繁殖期的行为, 视水体能见度情况, 观察时间进行适当延长或缩短。采用便携式高清摄像机GoPro HERO 7 black进行水下拍摄, 记录所有行为数据, 包括行为动作、行为特征、行为偏好、行为持续时间等, 每次观察记录为1 h, 每10 min为一个行为记录时间单元, 2个时间单元间隔5 min。定点连续记录法即利用红外线防水摄像设备Canon 5D 3对固定区域内的曼氏无针乌贼进行24 h的监控录像, 持续记录时间总计为15 d, 反复观看录像确保行为数据的准确性。实验观察期间尽量避免人为走动, 以免惊扰曼氏无针乌贼。
行为谱构建如下述原则: 首先按照曼氏无针乌贼的生活习性及各行为的生物功能(王涛涛等, 2015), 对其繁殖期的所有行为进行系统化分类; 然后依据每种行为发生的形态或逻辑顺序对每一大类的行为再进一步细分(韩雪松等, 2018), 通过层层聚焦, 最终获得较完整的曼氏无针乌贼繁殖期行为谱, 见图 1。
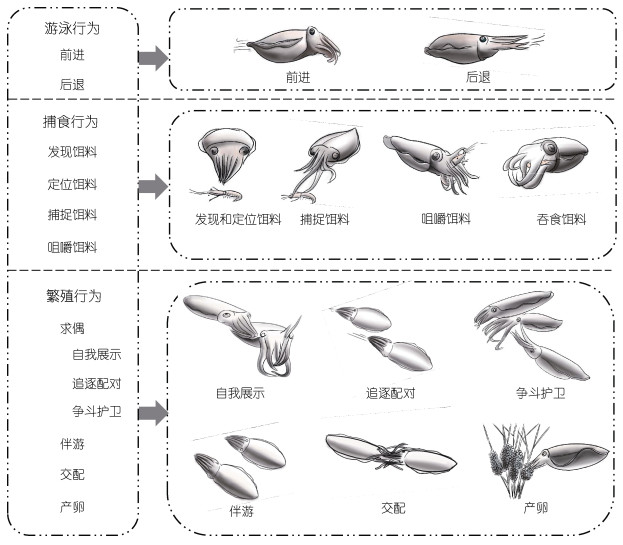 |
| 图 1 曼氏无针乌贼繁殖期行为谱 Fig. 1 The behavior ethogram in the reproductive period of S. japonica |
首先对聚焦个体扫描法和定点连续记录法获取的所有影像资料构建行为谱数据库, 采用Ulead Video Studio 15对录像视频进行编辑, 截取行为样本中的有效片段逐个分析, 再利用Excel 2016对曼氏无针乌贼的各行为数据进行分类统计。然后对实验过程中采集的行为照片手绘出行为简图, 利用Adobe Photoshop CC 2018和Adobe Illustrator 2019进行着色处理。采用SPSS 23.0软件对统计的捕食时间、争斗时间、交配时间、产卵时间等行为数据求取平均值和标准差。
2 结果 2.1 行为谱构建聚焦个体扫描观察15 d, 总时长3 600 min, 有效时长2 400 min; 定点连续记录15 d, 总时长21 600 min, 有效时长17 280 min。经观察和分析, 依据行为谱构建原则将曼氏无针乌贼繁殖期的行为活动分为三大类12种(图 2)。对观察到的所有行为进行级数划分, Ⅰ级行为按曼氏无针乌贼的生活习性及各行为的生物学功能分类, 分为游泳、捕食和繁殖等三大类行为; Ⅱ级行为按每种行为发生的形态或逻辑顺序进行细分, 游泳行为分为前进和后退2种, 捕食行为分为发现饵料、定位饵料、捕捉饵料、咀嚼和吞食饵料4种, 繁殖行为分为求偶、伴游、交配和产卵4种; Ⅲ级行为按具体情景斑块的衍生特征再进一步细分, 求偶行为可再细分为自我展示、追逐配对和争斗护卫3种。
 |
| 图 2 曼氏无针乌贼繁殖期的12种行为 Fig. 2 The twelve behaviour in the reproduction period of S. japonica 注: a—b: 游泳行为, a: 前进, b: 后退; c—f: 捕食行为, c: 发现和定位饵料, d: 捕捉饵料, e: 咀嚼饵料, f: 吞食饵料; g—l: 繁殖行为, g: 自我展示, h: 追逐配对, i: 争斗护卫, j: 伴游, k: 交配, l: 产卵 |
繁殖期间, 曼氏无针乌贼主要有前进和后退两种游泳方式。前进时(图 2a), 眼部瞳孔放大, 裙边快速波浪式摆动以辅助其游泳。四对腕紧紧靠拢, 腕末端自然弯曲下垂, 指向游动方向。从俯视视角看, 整个头部和腕部呈三角形状, 转换方向时头部转动。后退时(图 2b), 游泳速度较快, 裙边摆动幅度较小, 甚至无需其辅助, 主要依靠漏斗喷水的反作用力推动身体高速游泳, 四对腕紧紧靠拢且完全伸直, 腕末端上下轻微浮动, 并随游动方向而相应摆动。当曼氏无针乌贼受到惊吓或逃避危险时会出现紧急后退的情况, 并常伴有喷墨现象。观察发现, 繁殖期的雌性通常比较安定, 多处于静潜水底或静悬水中的状态, 而雄性却显得较活跃, 常在水中快速游动。
2.3 捕食行为曼氏无针乌贼繁殖期会继续进食, 其捕食行为可分为发现饵料(图 2c)、定位饵料(图 2c)、捕捉饵料(图 2d)、咀嚼(图 2e)和吞食饵料(图 2f)等4个行为动作。捕食行为迅速而敏捷, 从发现到捕捉整个过程大约持续2.0—10.0 s [(4.9±2.3) s, n=20], 且成功率较高, 但也存在因捕捉目标过大未被腕固定好或遭遇抢食而挣脱的现象。观察发现, 繁殖后期, 曼氏无针乌贼捕食行为的频率明显降低, 投饵后常有大量残余的现象。
2.3.1 发现饵料曼氏无针乌贼能够迅速感知其周围17.0—36.0 cm [(25.2±6.0) cm, n=20]范围内的饵料。一旦发现饵料后, 身体会出现一系列的行为反应, 眼睛随饵料位置转动, 头部、腕部以及身体的颜色由深变浅。头部和身体通过轻微摆动裙边而转向饵料, 腕部自然并拢, 时刻指向饵料。发现饵料的过程通常时间很短, 一般小于1.0 s。
2.3.2 定位饵料曼氏无针乌贼转向饵料后, 或原地不动, 或根据与饵料的距离相应调整位置。当与饵料相距较近时则向后游动, 当与饵料相距较远时则向前游动。在定位阶段, 曼氏无针乌贼游至距饵料8.0—22.0 cm [(14.4±4.5) cm, n=20]处, 保持与饵料的有效距离(捕获饵料的最适距离)。
2.3.3 捕捉饵料曼氏无针乌贼到达有效距离内, 整个腕部并拢呈三角形且向前伸展。然后迅速伸出一对触腕将饵料卷住收回, 再利用其他腕紧紧抱住饵料。环抱位置多集中在虾的头胸部和腹部交接处, 这不仅可避免虾的逃脱, 亦可防止虾的额角和尾肢对自身造成伤害。同时, 加快裙边的摆动速度, 头部、腕部以及身体的颜色变化迅速。伸出触腕时体色变浅, 捕捉饵料后体色呈鲜艳的斑点状花纹, 且裙边摆动频率恢复到原来的状态。
2.3.4 咀嚼饵料曼氏无针乌贼成功捕捉饵料后, 通常游至角落区域咀嚼饵料或漂浮在水中吞食饵料, 通常咀嚼时间持续在60.0 s以上, 所需时间与食物大小和饥饿程度有关, 咀嚼过程中常伴有体色变化。
2.4 繁殖行为曼氏无针乌贼繁殖期具有较高等复杂的繁殖行为, 主要包括求偶、伴游、交配、和产卵等行为。
2.4.1 求偶行为繁殖期间, 雄性曼氏无针乌贼表现相对活跃, 具有明显的求偶行为, 可分为自我展示(图 2g)、追逐配对(图 2h)、争斗护卫(图 2i)等3个行为动作。
自我展示 当雄性曼氏无针乌贼选定雌性后, 会通过伸展腕部、体色变化等进行自我展示, 以吸引雌性的注意力。雄性与雌性相比体色更鲜艳, 背部白色斑点更大, 腕部及身体边缘的白色条纹更宽, 且高举第一对腕, 并时不时用腕抚摸或拍打雌性的头部和身体。
追逐配对 雄性曼氏无针乌贼会主动靠近和追逐雌性, 在其周围5.0—50.0 cm [(24.3±13.9) cm, n=20]范围内进行伴游, 并向雌性发出“求偶信号”, 进行尝试交配。若雌性不愿与“追求者”配对, 会以急速游泳的方式逃脱, 此时雄性会继续追逐。若雌性继而选择逃避, 雄性则放弃追逐, 转向寻找下一个配对目标。若雌性“动情”且有意与其配对, 二者便共同游泳一段时间, 伺机进行交配。观察发现, 雌性曼氏无针乌贼倾向与比自身体型更大的雄性配对交配。
争斗护卫 当雌性身边已有护卫乌贼时, 其他未参与护卫的雄性不会就此放弃机会, 因而雄性之间常会为争夺雌性配偶发生争斗行为。雌雄二者配对成功后, 雄性扮演护卫的角色紧随雌性游动, 对其进行保护, 防止其他雄性接近。若其他雄性闯入保护领域内, 护卫乌贼则高举第一对腕, 伸开腕部向雌性倾斜遮拦以保护其不受侵犯。根据入侵乌贼体型规格的大小可将争斗护卫情形分为三类, 如表 1所示。
| 入侵乌贼体型规格 | 争斗护卫情形 | 结果 | |
| 较小且力量弱 | 入侵乌贼处于明显弱势 | 入侵乌贼主动游走 | |
| 较大且力量强 | 入侵乌贼从已配对雌雄乌贼之间强势靠近并将护卫雄性推开 | 护卫雄性被迫离开, 入侵乌贼取代护卫角色, 并与雌性伺机交配 | |
| 与护卫乌贼体型相当 | 争斗行为更激烈, 持续时间更久; 二者各腕张开, 头尾部相衔或头部相触在原地转动, 表现出对峙状态, 持续时间10.0—50.0 s [(41.2±16.2) s, n=20]不等 | 放弃相持, 示弱者选择离开 | 失败者离开雌性, 胜利者则守候在雌性身旁, 得到交配权 |
| 展开争斗, 用腕鞭打对方的身体, 常伴有喷墨现象, 甚至跃出水面发生身体碰撞 | |||
曼氏无针乌贼配对成功后, 雄性会以不同游泳姿态伴游于雌性周围(图 2j), 以防止其他雄性靠近, 伴游距离最远不超过50.0 cm。当雌性于附着基内部或旁侧伏底休息时, 常出现乌贼叠加现象(护卫乌贼将头部和腕部靠在雌性身体上), 向入侵者宣示主权。
2.4.3 交配行为曼氏无针乌贼交配采用“头对头”的方式(图 2k)。观察发现, 交配前雄性通常会用腕拍打雌性以示意, 然后从伴游位置游到雌性前方, 再迅速转体与其交配。若雌性有意交配, 则停止游动, 各腕主动张开, 与雄性顺利完成交配; 若无意交配, 则不会做出回应, 甚至后退适当距离以躲避与雄性的接触。但雄性十分强壮时, 会以强迫的方式与雌性进行交配。交配时, 雄性的第一对腕从背部、第二三对腕从侧面抱住雌性的头部, 右侧的第四对腕抱住其腹部, 左侧的第四对腕(茎化腕)向右伸遮住雌性的口部, 形成头部相接、腕部相抱的状态。此时雄性外套膜剧烈收缩, 裙边快速摆动, 将精荚排出并通过漏斗由交接腕粘附于雌性的纳精囊。最后通常由雌性主动挣脱结束交配。整个交配过程历时25.0—81.0 s [(42.9±15.5) s, n=30], 雄性表现更为主动, 雌性则相对被动。观察发现, 曼氏无针乌贼可能并非“一夫一妻”制, 存在“多雌多雄”的混合交配现象。曼氏无针乌贼交配过程并非每次顺利, 常会出现其他乌贼打断交配以争夺雌性的现象。当已配对的雌雄乌贼进行交配时, 其他雄性会游至附近导致其交配行为受到干扰甚至被打断。此时, 雄性迅速松开雌性与入侵者展开争斗。
2.4.4 产卵行为交配结束不久后雌性开始产卵(图 2l)。观察发现, 雌性在产卵前会对附着基进行甄选, 表现为向附着基不断喷水, 并用腕触碰附着基, 以判断其牢固性。雌性选好附着基后, 常会游至附着基附近静止不动。然后将腕部下垂收拢形成一个闭合腔, 同时漏斗从腕部中间伸入腔内, 外套膜剧烈收缩, 裙边快速摆动, 最后产出受精卵, 并由第二三对腕抱住, 在产出受精卵后漏斗有喷出少许墨汁的现象。曼氏无针乌贼的卵是逐个产出的, 每次产卵到附卵过程持续时间73.0—255.0 s [(108.6±43.7) s, n=30]。雌性产出受精卵后迅速游向附着基。附卵前, 它通常会用漏斗再次向附着基喷水。附卵时各腕紧紧并拢且向前伸展为锥子形, 然后从腕部中间分开缠绕附着基。此时第一对腕向上微翘, 第四对腕位于最下方紧靠拢第三对腕, 抱卵的第二三对腕缠绕附着基并将受精卵系于附着基上。附卵后, 雌性亲体游至附着基附近继续产卵, 整个产卵到附卵过程不断重复进行。期间雄性在雌性身旁伴游, 也会伺机与其再次交配。观察发现, 雌性曼氏无针乌贼偏好选择最初的附着基附卵, 若把卵群移走, 短时间内将不再产卵。此外, 已附着的卵群对其他亲体的交配和产卵行为起到一定的诱导和刺激作用。
3 讨论 3.1 游泳行为曼氏无针乌贼的游泳行为是多个器官综合作用的结果。“船型”海螵蛸具有浮力和承担水压的作用, 曼氏无针乌贼通过该器官调节体内的水容量以实现在水中的自由升降。裙边有辅助游泳和保持平衡的作用。漏斗由腕特化而成, 既可以喷水产生较快的运行速度而满足摄食和紧急逃脱的需要, 还可以任意转动控制运动方向, 从而使其具有高度的灵活性以应对各种敌害(许一兵, 1990)。陈新军等(2009)研究表明, 喷水推进是头足类最主要的运动方式, 其中柔鱼类和枪乌贼类喷水推进能力最强, 乌贼类次之, 蛸类最差。本研究显示繁殖期的雌性曼氏无针乌贼较安定, 多处于静止休息或静悬水中的状态, 而雄性表现较积极活跃, 常快速游动。分析认为可能是雌性为交配产卵储备能量而减少运动, 而雄性为了吸引雌性注意, 在主动游泳运动方面耗能相对更多。在“生物行为节能假说”中也提到繁殖与运动行为之间存在能量竞争关系, 动物通过减少自身运动时间, 将能量优先用于繁殖过程(Fossette et al, 2012; Chamberlain et al, 2016)。柏青青等(2020a)研究中也表明雌性金乌贼产卵后自发活动降低, 通过减少运动耗能来保障繁殖的高能量需求。
3.2 捕食行为曼氏无针乌贼在繁殖期会继续进食, 繁殖前期和中期有抢食现象, 繁殖后期摄食量逐渐减少。曼氏无针乌贼的捕食过程迅速敏捷, 捕食成功率普遍较高, 相似的结果在其他乌贼中也有报道。推测曼氏无针乌贼捕食成功率较高的原因可能是: 第一, 具有伸缩自如的触腕。曼氏无针乌贼有2个触腕, 能在猎物猝不及防下突然伸出将其捕获, 且触腕穗上的吸盘吸力强大, 钩爪锋利。第二, 具有快速发射触腕的能力。曼氏无针乌贼从触腕发射到捕捉用时不到1 s。研究表明迅速的捕捉速度与触腕上高度发达的横纹肌快速收缩有关(雷舒涵等, 2016)。曼氏无针乌贼繁殖后期摄食量减少, 分析原因可能是亲体储备能量需求降低, 或繁殖行为使能量消耗过大导致体力下降而难以快速伸出触腕捕捉饵料, 从而减少了摄食量。
3.3 繁殖行为繁殖期占据头足类生活史的大部分时间, 是其生命周期的重要阶段(郑小东等, 2009)。头足类为雌雄异体的软体动物, 繁殖过程中具有对抗、求爱及交配等复杂行为, 如四鳃类的鹦鹉螺有简单的交配及产卵行为, 而二鳃类则出现相当复杂的追偶、争偶、交配、产卵及护卵行为(陈新军等, 2009)。
3.3.1 求偶行为雄性曼氏无针乌贼具有明显的求偶行为, 会通过体色变化、腕部伸展等外在表现以吸引雌性。同时雄性间为争夺配偶常发生争斗行为, 这与史会来等(2016)研究结果一致。求偶争斗行为在其他头足类中也有出现, 如雄性枪乌贼在求偶过程中常发生争斗, 最初表现为体色变化的展示, 随后升级为身体接触; 然而蛸类中求偶行为较为少见, 但雄性会有更多的体色展示和喷墨行为(Arnold, 1965)。郑小东等(2009)研究表明争斗行为本质上是精子竞争, 体型较大的雄性占据明显优势, 易在竞争中取胜与雌性配对。体型相近的雄性间争斗程度远比体型差异大的个体激烈。
3.3.2 伴游行为雄性求偶成功后会有伴游行为并贯穿于整个繁殖过程, 防止雌性受到其他乌贼的侵犯。该行为在虎斑乌贼(陈道海等, 2013)、拟目乌贼(文菁等, 2012)、金乌贼(王亮等, 2017)均有表现。相关研究表明这是一种典型保证受精率和孵化率的交配策略(Hanlon et al, 2018)。雄性个体在繁殖过程中表现出较强的领域行为, 这有利于保证其精子的繁殖率。一旦入侵乌贼闯入护卫领域, 护卫乌贼则立即做出反应, 驱赶入侵乌贼离开(柏青青等, 2020b)。
3.3.3 交配行为曼氏无针乌贼采用“头对头”的交配方式, 与乌贼科的生物有很大相似性, 但不同于柔鱼的平行式和蛸类的距离式交配(Yan, 2006)。曼氏无针乌贼交配时雄性更为主动, 利用体型优势紧紧抱住雌性, 将排出的精荚通过漏斗经交接腕递送到雌性口部纳精囊处(张炯等, 1965)。实验观察显示曼氏无针乌贼存在“多雌多雄”的混合交配现象, 这与Wada等(2006)研究结果一致。Wada等(2010)认为乌贼“多夫多妻”制的交配策略可以提高精子的竞争力和卵的受精率, 即雌性与同一或不同雄性多次交配能够降低受精失败的风险。在交配前雄性乌贼有精子移除现象, 因此, 最后交配的雄性精子受精率较高(张秀梅等, 2016)。曼氏无针乌贼整个交配过程平均历时42.9 s, 并且在交配后雌雄乌贼表现更为亲密(张炯等, 1965)。拟目乌贼(文菁等, 2012)、虎斑乌贼(陈道海等, 2013)交配时间均超过60.0 s, 金乌贼(王亮等, 2017)交配所需时间为125.0—398.0 s, 推测交配持续时间长短可能与体型大小有关, 曼氏无针乌贼是其中体型较小的一种。
3.3.4 产卵行为雌性曼氏无针乌贼产卵前有用漏斗对附着基喷水现象, 这与金乌贼一致(郝振琳等, 2007), 而拟目乌贼没有喷水现象, 但在离开卵群前会喷沙(文菁等, 2012)。曼氏无针乌贼喜好在附着基上附卵(李星颉等, 1986), 不同雌性会在同一附着基上附卵。这一发现与拟目乌贼、虎斑乌贼相类似, 而金乌贼却有各自单独的产卵区域(王亮等, 2017)。曼氏无针乌贼每次产卵平均用时108.6 s, 与20世纪60年代研究(张炯等, 1965)相比, 一次产卵持续时间延长了约30.0 s, 推测可能与温度、盐度等外界水环境不同以及人工养殖条件下曼氏无针乌贼内部机能变化有关。实验中发现卵群对雌性产卵行为有诱导和刺激作用, 已有研究表明乌贼繁殖期的受精卵会释放信息素, 吸引其他性成熟的雌性到此共同产卵(Boal et al, 2010)。
4 结论曼氏无针乌贼作为高等的软体动物, 繁殖期占据其生活史的大部分时间, 繁殖期行为谱主要包括三大类12种行为, 每种行为都有不同的表现特征。本研究从构建行为谱的视角, 在20世纪60年代源于自然群体的曼氏无针乌贼繁殖行为观察结论的基础上, 新增了游泳和捕食等Ⅰ级行为、求偶和伴游等Ⅱ级行为以及因求偶而衍生的Ⅲ级行为; 人工干预的新背景下, 曼氏无针乌贼交配有多雌多雄的现象, 认为是繁殖期行为的一种适应性进化, 与自然海域亲体性成熟提前和小型化现象是否具有直接关联需要进一步研究; 卵群对曼氏无针乌贼的产卵行为有诱导和刺激作用, 曼氏无针乌贼对产卵附着基也有选择性, 而且每一次产卵持续时间有一定延长, 不利于种群代际传递。区别于其他头足类繁殖期的行为, 交配方式与交配持续时间不同, 且曼氏无针乌贼在争斗护卫和伴游行为过程中的护雌现象较为激烈, 伴游期间雌性伏底休息时常出现乌贼叠加现象, 雄性表现出宣示主权的意图。综上所述, 本文对所有观察到的行为进行了级数划分, 构建了曼氏无针乌贼繁殖期行为谱, 既是对曼氏无针乌贼各种行为的系统化完善, 也对后续曼氏无针乌贼行为机制和基于全生活史的资源保护等方面提供理论依据。
王亮, 张秀梅, 丁鹏伟, 等. 2017. 金乌贼繁殖行为与交配策略. 生态学报, 37(6): 1871-1880 |
王涛涛, 白玛次仁, 海淑珍, 等. 2015. 布氏田鼠行为谱的构建. 草地学报, 23(3): 646-652 |
文菁, 江星, 王雁, 等. 2012. 拟目乌贼繁殖行为学的初步研究. 水产科学, 31(1): 22-27 |
史会来, 平洪领, 张涛, 等. 2016. 养殖曼氏无针乌贼(Sepiella japonica)的两性异形及判别模式的建立. 海洋与湖沼, 47(4): 838-846 |
许一兵. 1990. 浅谈乌贼的结构与生态观察. 生物学通报, (12): 15-16 |
李星颉, 戴健寿, 马利青, 等. 1986. 不同形式的附卵器对曼氏无针乌贼附卵效果的试验. 浙江水产学院学报, 5(2): 109-113 |
肖燃, 宋长普, 朱阳, 等. 2021. 神经肽FF在小黄鱼(Larimichthys polyactis)性腺发育早期的表达与定位分析. 海洋与湖沼, 52(1): 213-221 |
吴常文, 周超, 郭宝英, 等. 2012. 浙江近海曼氏无针乌贼(Sepiella maindroni)繁殖生物学特性变化研究. 海洋与湖沼, 43(4): 689-694 |
吴常文, 董智勇, 迟长凤, 等. 2010. 曼氏无针乌贼(Sepiella maindroni)繁殖习性及其产卵场修复的研究. 海洋与湖沼, 41(1): 39-46 |
张炯, 卢伟成. 1965. 曼氏无针乌贼Sepiella maindroni de Rochebrune繁殖习性的初步观察. 水产学报, 2(2): 35-44 |
张秀梅, 张东雪, 王亮. 2016. 水生动物多次交配繁殖策略与多重父权研究进展. 中国海洋大学学报, 46(11): 22-31 |
陈治, 宋娜, 源利文, 等. 2020. 舟山近海水样环境DNA获取方法的建立. 水生生物学报, 44(1): 50-58 |
陈道海, 郑亚龙. 2013. 虎斑乌贼(Sepia pharaonis)繁殖行为谱分析. 海洋与湖沼, 44(4): 931-936 |
陈新军, 刘必林, 王尧耕. 2009. 世界头足类. 北京: 海洋出版社, 44, 60-64
|
郑小东, 韩松, 林祥志, 等. 2009. 头足类繁殖行为学研究现状与展望. 中国水产科学, 16(3): 459-465 |
郝振林, 张秀梅, 张沛东. 2007. 金乌贼的生物学特性及增殖技术. 生态学杂志, 26(4): 601-606 |
郝爱霞, 邓文洪. 2014. 笼养褐马鸡行为的PAE编码及行为谱特征. 北京师范大学学报(自然科学版), 50(6): 614-619 |
柏青青, 李江涛, 徐秀文, 等. 2020a. 社群等级对金乌贼行为表型及能量代谢的影响. 生态学报, 40(15): 5408-5417 |
柏青青, 张东雪, 王林龙, 等. 2020b. 金乌贼雄性规格和社群数量对求偶与交配行为的影响. 中国水产科学, 27(2): 147-157 |
揭志良, 2016. 蒙古野驴的繁殖行为学研究. 呼和浩特: 内蒙古师范大学硕士学位论文
|
韩雪松, 郭玉民. 2018. 基于野外观察的黑颈鹤个体行为谱构建. 野生动物学报, 39(1): 58-79 |
雷舒涵, 张秀梅, 张沛东, 等. 2016. 金乌贼幼体捕食行为及捕食能力的研究. 中国海洋大学学报, 46(4): 37-42 |
Arnold J M, 1965. Observations on the mating behavior of the squid Sepioteuthis sepioidea. Bulletin of Marine Science, 15(1): 216-222 |
Boal J G, Prosser K N, Holm J B et al, 2010. Sexually mature cuttlefish are attracted to the eggs of conspecifics. Journal of Chemical Ecology, 36(8): 834-836 |
Chamberlain J D, Gifford M E, 2016. Physical and physiological costs of reproduction in Watersnakes. Copeia, 104(3): 722-727 |
Fossette S, Schofield G, Lilley M K S et al, 2012. Acceleration data reveal the energy management strategy of a marine ectotherm during reproduction. Functional Ecology, 26(2): 324-333 |
Hanlon R T, Messenger J B, 2018. Cephalopod Behaviour. Cambridge: Cambridge University Press
|
McDonnell S M, Poulin A, 2002. Equid play ethogram. Applied Animal Behaviour Science, 78(2-4): 263-290 |
Moltschaniwskyj N A, Pecl G T, 2007. Spawning aggregations of squid (Sepioteuthis australis) populations: a continuum of 'microcohorts'. Reviews in Fish Biology and Fisheries, 17(2-3): 183-195 |
Wada T, Takegaki T, Mori T et al, 2005. Sperm displacement behavior of the cuttlefish Sepia esculenta (Cephalopoda: Sepiidae). Journal of ethology, 23(2): 85-92 |
Wada T, Takegaki T, Mori T et al, 2006. Reproductive behavior of the Japanese spineless cuttlefish Sepiella japonica. Venus: Journal of the Malacological Society of Japan, 65(3): 221-228 |
Wada T, Takegaki T, Mori T et al, 2010. Sperm removal, ejaculation and their behavioural interaction in male cuttlefish in response to female mating history. Animal Behaviour, 79(3): 613-619 |
Yan T R Z, 2006. Sperm competition in squid. Genetic Inheritance, 60(3): 53-56 |
 2021, Vol. 52
2021, Vol. 52


