中国海洋湖沼学会主办。
文章信息
- 林筱钧, 彭英林, 鄢庆枇, 江兴龙, 周建传, 汤学敏, 范云庭, 郑江. 2022.
- LIN Xiao-Jun, PENG Ying-Lin, YAN Qing-Pi, JIANG Xing-Long, ZHOU Jian-Chuan, TANG Xue-Min, FAN Yun-Ting, ZHENG Jiang. 2022.
- 利用核酸适配体的竞争置换作用检测溶藻弧菌(Vibrio alginolyticus)
- DETECTION OF VIBRIO ALGINOLYTICUS BASED ON COMPETITION AND SUBSTITUTION REACTIONS RELATED TO APTAMER
- 海洋与湖沼, 53(1): 215-223
- Oceanologia et Limnologia Sinica, 53(1): 215-223.
- http://dx.doi.org/10.11693/hyhz20210600149
文章历史
-
收稿日期:2021-06-27
收修改稿日期:2021-08-29
2. 鳗鲡现代产业技术教育部工程研究中心 福建厦门 361021;
3. 福建省水产生物育种与健康养殖工程研究中心 福建厦门 361021;
4. 福建省特种水产配合饲料重点实验室 福建福清 350308
2. Engineering Research Center of the Modern Technology for Eel Industry, Ministry of Education, Xiamen 361021, China;
3. Engineering Research Center of Aquaculture Breeding and Healthy of Fujian, Xiamen 361021, China;
4. Fujian Province Key Laboratory of Special Aquatic Formula Feed, Fuqing 350308, China
溶藻弧菌(Vibrio alginolyticus)隶属于弧菌科、弧菌属, 是嗜盐嗜温性的革兰氏阴性杆菌(Luo et al, 2016)。它广泛分布于海洋、河口、海水养殖池等水体环境中, 对鱼、虾、贝等水生生物都具有较强的致病性(张晓华等, 2018), 是水产养殖业中的重要条件致病菌(Liu et al, 2004; 余庆等, 2018)。对溶藻弧菌进行快速的检测是其病害防治的前提和基础。目前, 溶藻弧菌的检测方法主要有传统的基于生理生化反应的微生物培养法, 以及基于细菌16S rDNA等的分子生物学方法(张颖雪等, 2019)。传统的微生物培养法较为耗时, 当遇到表型较难分辨的类似菌时, 很容易出现判断错误, 降低了检测的准确性(Da-Silva et al, 2018)。16S rDNA等分子生物学方法则在区分同属细菌时的效果并不理想, 因为同属细菌的种间基因同源性很高, 不容易区分; 另外采用PCR进行检测扩增时, 还可能会由于错配而产生假阴性或假阳性现象(Li et al, 2018)。因此, 有必要寻找和开发更为理想、便捷的针对溶藻弧菌的检测方法。
核酸适配体是利用SELEX (systematic evolution of ligands by exponential enrichment)技术, 即指数富集配体的系统进化技术, 筛选出的能够以较高亲和力与靶目标结合的单链寡核苷酸分子及其衍生物(Välimaa et al, 2015; 李亚楠等, 2017)。核酸适配体具有亲和特异性高、分子量小、容易合成和修饰、可在体外筛选、免疫原性低、靶标范围广等多种优势(Blind et al, 2015; Futami et al, 2019; Yan et al, 2019; Muhammad et al, 2021), 已用于金属离子、小分子、蛋白质、细胞和细菌等靶目标的检测分析(Qi et al, 2020; Raducanu et al, 2020; Uemachi et al, 2020; Yu et al, 2021)。
本文在溶藻弧菌核酸适配体的基础上, 设计了一种荧光报告探针, 该探针能与溶藻弧菌核酸适配体的部分序列通过碱基互补配对结合, 形成核酸适配体-荧光报告探针复合物(AP复合物), 并且使该探针与核酸适配体间的碱基互补配对作用力要弱于溶藻弧菌与其核酸适配体间的亲和力。当该复合物遇到核酸适配体的靶目标菌溶藻弧菌时, 靶目标菌就会和荧光报告探针共同竞争核酸适配体, 由于靶目标菌对核酸适配体的亲和力更高, 竞争力更强, 核酸适配体就会转而与其靶目标菌结合, 在这个竞争结合过程中, 原来与核酸适配体结合的荧光报告探针会被置换出来, 释放到溶液中, 而且靶目标菌越多, 置换出来的荧光报告探针也越多, 因此通过检测溶液中的荧光强度就可间接测定靶目标菌的浓度。本文利用这种竞争置换作用, 通过构建的磁珠-核酸适配体-荧光报告探针的检测复合物(MAP检测复合物), 建立了一种检测溶藻弧菌的方法。相关研究对于溶藻弧菌等水产病害的防治及其核酸适配体的应用开发都具有重要价值。
1 材料与方法 1.1 材料 1.1.1 核酸适配体和磁珠核酸适配体为先前获得并验证的溶藻弧菌核酸适配体#37 (李玉宝, 2013), 其序列为5′-TCAGTCGCTTCGCCGTCTCCTTCAGC GGGATGAGGGAGTAGGAGGGCCACAGTGGACT GCACAAGAGGGAGACCCCAGAGGG-3′, 5′端标记有生物素, 荧光报告探针序列为5′-AAAAAAAAAGGCCCTCCT-3′, 5′端标记有FAM荧光基团, 荧光报告探针和核酸适配体可通过下划线处的碱基互补配对结合成核酸适配体-荧光报告探针复合物, 即AP复合物。核酸适配体和荧光报告探针的合成及标记均由上海生工生物工程有限公司完成。磁珠为链霉亲和素修饰的磁珠, 粒径为200 nm, 浓度5 mg/mL, 购自北京雷鸣生物公司。
1.1.2 实验用菌和培养基溶藻弧菌(Vibrio alginolyticus)、嗜水气单胞菌(Aeromonas hydrophila)、迟钝爱德华氏菌(Edwardsiella tarda)、大肠杆菌(Escherichia coli)和哈维氏弧菌(Vibrio harveyi)均由集美大学病原微生物实验室鉴定并提供。大肠杆菌用LB培养基培养, 其他菌用TSB培养基培养。
1.1.3 缓冲液20×结合缓冲液(pH 7.4, 100 mL)的配制: NaCl 5.844 g, KCl 3.725 g, Tris-HCl 6.06 g, MgCl2·6H2O 2.033 g, 以上物质全部溶于超纯水中, 并定容至100 mL, 调节pH至7.4, 使用时用超纯水稀释为2×和1×结合缓冲液。TE缓冲液的配制(pH 8.0, 100 mL): 取1 mol/L Tris-HCl 1 mL, 0.5 mol/L EDTA 0.2 mL, 用超纯水稀释并定容至100 mL。
1.2 MAP检测复合物的制备分别取2 μmol/L核酸适配体400 μL和2 μmol/L荧光报告探针400 μL, 95 ℃金属浴加热5 min, 再冰浴10 min。随后将二者混合, 在200 r/min摇床孵育结合30 min, 形成800 μL、1 μmol/L核酸适配体-荧光报告探针复合物(AP复合物); 然后取5 mg/mL已被链霉亲和素修饰过的磁珠, 用适量TE缓冲液洗涤3次后, 加入TE缓冲液稀释至0.5 mg/mL; 将0.5 mg/mL的磁珠溶液800 μL与1 μmol/L的AP复合物800 μL混合, 200 r/min摇床孵育1 h; 链霉亲和素和生物素的偶联作用将AP复合物固定在磁珠上, 从而形成了磁珠-核酸适配体-荧光报告探针的检测复合物(MAP检测复合物), 然后于磁力架上磁分离5 min, 去上清, 磁分离出的MAP检测复合物沉淀用适量TE缓冲液洗涤3次, 最后加入2×结合缓冲液1 600 μL重悬, 从而构建出基于磁珠和核酸适配体的MAP检测复合物。
1.3 可行性实验为了验证构建的MAP检测复合物是否能够对溶藻弧菌进行检测, 我们做了可行性验证实验。具体如下: 目标菌溶藻弧菌用2×结合缓冲液分别稀释至50和500 CFU/mL; 随后取40 μL的MAP检测复合物分别与上述不同浓度的溶藻弧菌各200 μL混合, 再分别加入160 μL 2×结合缓冲液至终体积为400 μL, 作为实验组; 另取40 μL MAP检测复合物与360 μL 2×结合缓冲液混合, 作为空白对照组。每组6个平行, 实验组和对照组一同在常温25 ℃下200 r/min摇床孵育1 h, 孵育结束后, 进行磁分离, 随后取上清用Qubit 3.0荧光定量仪分别测定实验组和对照组的荧光强度。最终菌的荧光值等于实验组荧光值减去对照组平均荧光值。
1.4 MAP检测复合物制备条件的优化 1.4.1 荧光报告探针与核酸适配体结合比例和结合时间的优化通过前期研究, 初步确定了MAP检测复合物的制备条件为: 25 μg/mL 200 μL的磁珠、50 nmol/L 100 μL的核酸适配体、结合时间60 min。在此条件下, 按1.2中的方法, 采用不同浓度的荧光报告探针来制备AP复合物, 进而再制备出MAP检测复合物, 然后磁分离, 检测上清液的荧光强度, 研究荧光报告探针的不同浓度对荧光强度的影响, 进而确定荧光报告探针与核酸适配体的结合比例。类似的, 在初步确定的MAP检测复合物的制备条件下(25 μg/mL 200 μL的磁珠、核酸适配体和荧光报告探针均为50 nmol/L 100 μL), 按1.2中的方法, 采用不同的结合时间来制备AP复合物, 进而再制备出MAP检测复合物, 然后磁分离, 检测上清液的荧光强度, 研究荧光报告探针与核酸适配体的结合时间对荧光强度的影响, 进而确定相应的结合时间。实验每组6个平行。
1.4.2 磁珠和AP复合物的结合比例和结合时间的优化按1.4.1中确定的优化方法制备50 nmol/L AP复合物, 然后取200 μL该AP复合物和200 μL浓度分别为1、5、10、15、20、25、30、35、40、45、50 μg/mL的磁珠结合, 按1.2的方法制备MAP检测复合物, 之后磁分离, 检测上清液的荧光强度, 研究不同磁珠浓度对荧光强度的影响, 进而确定磁珠和AP复合物的结合比例。类似的, 在确定了磁珠和AP复合物的结合比例后, 选择25 μg/mL 200 μL的磁珠和50 nmol/L 200 μL的AP复合物, 按1.2中的方法, 采用不同的结合时间来制备MAP检测复合物, 磁分离后, 检测上清液的荧光强度, 研究磁珠与AP复合物的结合时间对荧光强度的影响, 进而确定磁珠与AP复合物的结合时间。实验每组6个平行。
1.5 工作曲线的制作将目标菌溶藻弧菌用2×结合缓冲液分别稀释至下列15个浓度梯度: 1、2、5、10、15、20、40、60、80、100、200、400、600、800和1 000 CFU/mL, 然后分别取40 μL的MAP检测复合物与上述浓度的溶藻弧菌各200 μL混合, 再加入160 μL 2×结合缓冲液至终体积为400 μL, 作为实验组; 另取40 μL MAP检测复合物与360 μL 2×结合缓冲液混合, 作为空白对照组。每组6个平行, 实验组和对照组一同在常温25 ℃下200 r/min摇床孵育1 h, 孵育结束后, 进行磁分离, 随后取上清用Qubit 3.0荧光定量仪分别测定实验组和对照组的荧光强度。菌的荧光值等于实验组荧光值减去对照组平均荧光值, 通过Origin软件进行线性拟合, 可得到相应的工作曲线及其线性拟合方程。
1.6 特异性、稳定性和重现性研究 1.6.1 特异性研究将溶藻弧菌、嗜水气单胞菌、迟钝爱德华氏菌和哈维氏弧菌接种到TSB培养基, 将大肠杆菌接种至LB培养基, 所有的菌都在100 r/min、30 ℃的摇床培养8 h; 取培养好的各种菌, 根据菌的浓度曲线, 用2×结合缓冲液分别稀释至10、20、50、100和500 CFU/mL; 然后取40 μL的MAP检测复合物与各种菌液各200 μL结合, 再加入160 μL 2×结合缓冲液, 作为实验组; 另取40 μL MAP检测复合物与360 μL 2×结合缓冲液结合, 作为空白对照组。每组6个平行, 实验组和对照组一同在常温25 ℃下200 r/min摇床孵育1h, 孵育结束后, 进行磁分离, 随后取上清用Qubit 3.0荧光定量仪分别测定实验组和对照组的荧光强度。菌的荧光值等于实验组荧光值减去对照组平均荧光值。
1.6.2 稳定性研究按1.6.1的方法应用MAP检测复合物检测10和100 CFU/mL的溶藻弧菌, 然后将该复合物置于4 ℃冰箱避光保存5 d后, 再次用于10和100 CFU/mL溶藻弧菌的检测, 比较两次检测中菌的荧光值, 研究该复合物及其检测方法的稳定性。
1.6.3 重现性研究按1.6.1的方法应用MAP检测复合物检测10和100 CFU/mL的溶藻弧菌, 共进行6次重复性实验, 计算相对标准偏差(相对标准偏差=标准差/平均值×100%), 研究其重现性。
1.7 加标回收实验为了研究该方法在实际样品中对溶藻弧菌的检测适用性, 在厦门集美龙舟池养殖厂取海水样, 进行加标回收实验。用2×结合缓冲液将溶藻弧菌分别稀释为20、100和1 000 CFU/mL, 然后分别取菌液2 mL与2 mL上述海水样混合配制成加标水样, 此时加标水样中溶藻弧菌的浓度分别为10、50和500 CFU/mL。随后取200 μL加标水样与40 μL的MAP检测复合物混合, 再加入160 μL 2×结合缓冲液, 作为实验组; 另取100 μL海水、40 μL的MAP检测复合物和260 μL 2×结合缓冲液结合, 作为空白对照组。每组6个平行, 实验组和对照组一同在常温25 ℃下200 r/min摇床孵育1 h; 孵育结束后, 将实验组和对照组用磁力架进行磁分离, 待磁珠全部被吸至管底后, 取上清, 用Qubit 3.0荧光定量仪分别测定实验组和对照组的荧光强度。
每个加标水样的荧光值等于实验组荧光值减去对照组平均荧光值, 每个样品均进行6次以上重复实验, 然后计算每个加标水样的平均值和标准差, 以及相对标准偏差(相对标准偏差=标准差/平均值×100%); 分别将加标水样的荧光平均值带入1.5中获得的工作曲线回归方程中, 可计算出回收量, 相应的回收率=回收量/加入量×100%。
1.8 统计分析利用EXCEL软件中的t-检验函数对实验数据进行组间差异分析, P < 0.05为显著差异, P < 0.01为极显著差异。
2 结果与分析 2.1 核酸适配体竞争置换作用的检测原理选用溶藻弧菌的核酸适配体, 构建一种可用于检测溶藻弧菌的磁珠-核酸适配体-荧光报告探针的检测复合物(MAP检测复合物), 然后将该检测复合物与溶藻弧菌混合孵育, 利用溶藻弧菌对其核酸适配体的竞争作用置换出MAP检测复合物中的荧光报告探针, 从而实现对溶藻弧菌的检测。其基本原理如图 1所示, 首先将带有荧光标记的报告探针通过部分碱基的互补配对作用与生物素标记的核酸适配体结合形成具有部分双链DNA的AP复合物; 然后利用链霉亲和素和生物素的偶联作用将核酸适配体固定在链霉亲和素修饰的磁珠上, 从而构建出可用于溶藻弧菌检测的MAP检测复合物。当体系中不存在溶藻弧菌时, 通过磁分离可以将MAP检测复合物全部分离, 上清液的荧光强度极弱; 当检测体系中存在溶藻弧菌时, 溶藻弧菌与其核酸适配体也有很强的特异性亲和力, 就会和荧光报告探针竞争核酸适配体。在初始设计中, 我们通过增减互补碱基的数量来调节核酸适配体与荧光报告探针间的碱基互补配对作用, 使碱基互补配对的作用力弱于溶藻弧菌与其核酸适配体的亲和力, 这样在争夺核酸适配体的竞争中, 溶藻弧菌的竞争力就要强于荧光报告探针, 这就导致原本结合在MAP检测复合物上的荧光报告探针被溶藻弧菌置换出来进入上清液, 从而使得上清液荧光强度明显增加; 并且上清液的荧光强度与体系中存在的溶藻弧菌浓度成一定的线性关系, 因此, 通过分析检测体系中的荧光强度可以实现对溶藻弧菌的定量检测。
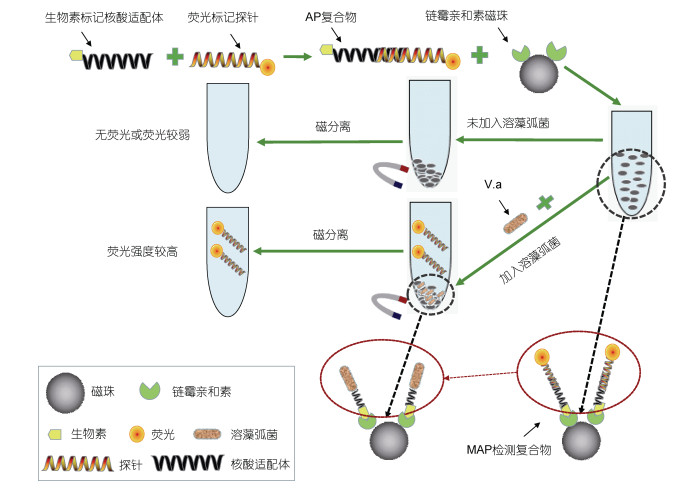 |
| 图 1 利用核酸适配体的竞争置换作用检测溶藻弧菌的示意图 Fig. 1 Schematic diagram of detection of V. alginolyticus based on its competition and substitution reactions related to aptamer |
如表 1所示, 溶藻弧菌浓度为零的空白对照, 荧光强度极低, 只有1.38; 溶藻弧菌浓度分别为50和500 CFU/mL时, 荧光强度分别为1 240.84和2 456.18, 表明不同浓度的溶藻弧菌, 荧光强度有很大差别, 说明荧光强度与菌浓度有很大的相关性; 而相同浓度的溶藻弧菌, 其标准差较小, 荧光强度波动不大, 有较好稳定性, 因此采用该方法来检测溶藻弧菌是可行的。
| 细菌浓度/(CFU/mL) | 样品数 | 荧光强度平均值 | 标准差 |
| 0 | 6 | 1.38 | 0.29 |
| 50 | 6 | 1 240.84 | 2.22 |
| 100 | 6 | 2 456.18 | 2.70 |
荧光报告探针浓度的影响如图 2a所示, 在1~50 nmol/L范围内, 荧光强度较低且稳定, 说明在50 nmol/L以下, 荧光报告探针全部与核酸适配体结合。当荧光报告探针的浓度超过50 nmol/L以后, 荧光强度随着探针的浓度增加而快速增加, 说明50 nmol/L就是探针的饱和浓度, 而这个浓度也正是核酸适配体的初始浓度, 这也表明荧光报告探针与核酸适配体的结合是按摩尔比1︰1进行结合的。荧光报告探针与核酸适配体结合时间对荧光强度的影响如图 2b所示, 荧光强度随着结合时间增加而减少, 但结合30 min以后, 荧光强度已较低且不发生明显变化, 说明30 min后荧光报告探针已几乎全部与核酸适配体结合完全。因此, 核酸适配体-荧光报告探针复合物(AP复合物)较为理想的制备条件是: 相同摩尔浓度的核酸适配体与荧光报告探针按体积比1︰1混合后孵育结合30 min。
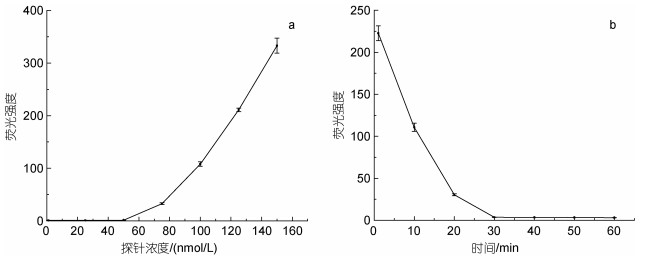 |
| 图 2 荧光报告探针浓度(a)及孵育时间(b)对荧光强度的影响 Fig. 2 Effects of the concentration of fluorescent reporter probe (a) and incubation time (b) on fluorescence intensities |
不同浓度的磁珠和50 nmol/L AP复合物结合制备MAP检测复合物, 磁珠浓度的影响如图 3a所示。随着磁珠浓度的升高, 荧光强度逐渐下降, 说明溶液中越来越多游离的AP复合物被固定在磁珠上, 当磁珠浓度超过25 μg/mL后, 荧光强度则变化不大, 趋近于零, 说明此时上清液中游离的AP复合物已几乎全部与磁珠结合了, 再增加磁珠浓度已没有效果。因此, 较为理想的结合比例应是25 μg/mL磁珠与50 nmol/L AP复合物按体积比1︰1进行混合结合。
 |
| 图 3 磁珠浓度(a)和结合时间(b)对荧光强度的影响 Fig. 3 Effects of the concentration of magnetic beads (a) and incubation time (b) on fluorescence intensities |
磁珠和AP复合物结合时间的影响如图 3b所示。荧光强度随着结合时间的增加而逐渐减弱, 当结合时间超过60 min以后, 荧光强度趋于一个稳定值, 再增加结合时间荧光强度下降幅度不明显。表明经过60 min的孵育, 磁珠上的链霉亲和素与AP复合物上生物素的偶联结合反应已经基本完成。因此, 磁珠和AP复合物的优化结合条件为: 25 μg/mL磁珠与50 nmol/L的AP复合物按体积比1︰1混合后孵育结合60 min。
综合2.3.1和2.3.2的结果, 最终确定MAP检测复合物的优化制备条件为: 100 nmol/L核酸适配体与100 nmol/L荧光报告探针按体积比1︰1混合后结合30 min, 制备出50 nmol/L的AP复合物, 然后50 nmol/L的AP复合物再与25 μg/mL的磁珠按体积比1︰1混合后结合60 min, 制备出相应的MAP检测复合物。
2.4 检测方法的工作曲线及其定量效果分析根据检测原理, 利用构建的MAP检测复合物对溶藻弧菌进行定量检测, 以评价该检测方法的定量效果。相应的工作曲线和线性拟合曲线如图 4所示, 随着溶藻弧菌浓度增加, 荧光强度也不断增大, 而且荧光强度(y)与溶藻弧菌浓度(x)在不同范围内, 表现出不同的线性关系。按照溶藻弧菌的浓度进行分段线性拟合, 拟合出线性回归方程如表 2所示。从表中可看出, 溶藻弧菌浓度分别在1~20、20~100和100~1 000 CFU/mL范围内, 荧光强度与菌浓度都呈现出较好的线性关系, 只是三个检测范围的线性方程不同而已。说明该检测方法有较好的定量检测效果, 其最低检测限可达到1 CFU/mL。
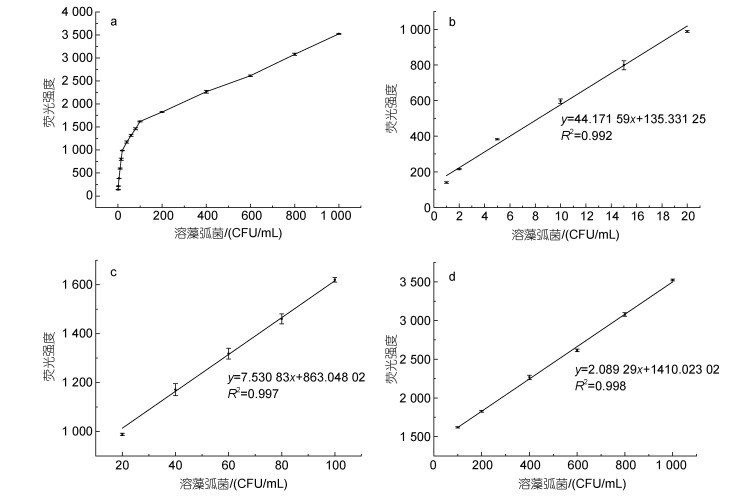 |
| 图 4 利用MAP检测复合物对溶藻弧菌进行检测的工作曲线及线性拟合曲线 Fig. 4 The working curve and linear fitting curves for detection of V. alginolyticus based on the MAP detection complex 注: a. 全浓度范围的工作曲线; b. 1~20 CFU/mL范围的线性拟合曲线; c. 20~100 CFU/mL范围的线性拟合曲线; d. 100~1 000 CFU/mL范围的线性拟合曲线 |
| 溶藻弧菌浓度范围/(CFU/mL) | 荧光强度(y)和菌浓度(x)的线性回归方程 | 拟合系数(R2) |
| 1~20 | y=44.171 59x+135.33 | 0.992 |
| 20~100 | y=7.530 83x+863.05 | 0.997 |
| 100~1 000 | y=2.089 29x+141 0.02 | 0.998 |
为考察该检测方法的特异性, 采用该方法, 利用MAP检测复合物对浓度相同的溶藻弧菌、哈维氏弧菌、嗜水气单胞菌、迟钝爱德华氏菌和大肠杆菌进行检测。结果如图 5所示, 在菌浓度分别为10、20、50、100和500 CFU/mL时, 目标菌溶藻弧菌检测出的荧光强度都极显著的高于其他细菌(P < 0.01), 约有8.6倍以上, 说明应用MAP检测复合物检测溶藻弧菌的方法有较好的特异性。
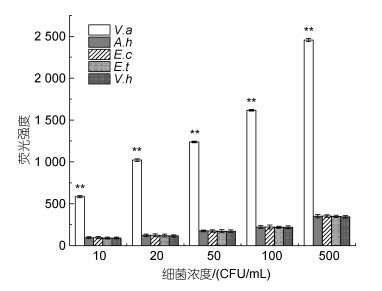 |
| 图 5 MAP检测复合物对溶藻弧菌的检测特异性 Fig. 5 Specificity of the detection of V. alginolyticus based on the MAP complex 注: A.h: 嗜水气单胞菌; E.c: 大肠杆菌; E.t: 迟钝爱德华氏菌; V.a: 溶藻弧菌; V.h: 哈维氏弧菌。图中**表示达到极显著水平(P < 0.01) |
在稳定性研究方面, 将MAP检测复合物置于4 ℃冰箱避光保存5 d后, 再分别用于10和100 CFU/mL溶藻弧菌的检测, 结果显示荧光强度分别可以保持在97.74%和99.75%。说明该方法或该检测复合物具有较好的稳定性。
在重现性研究方面, 对浓度分别为10和100 CFU/mL的溶藻弧菌进行了6次检测, 检测结果的相对标准偏差(RSD)分别为1.89%和0.47%。说明应用MAP检测复合物检测溶藻弧菌的方法具有较好的重现性。
2.6 加标回收实验加标回收实验的结果如表 3所示, 溶藻弧菌的加标回收率为95.47%~102.89%, 测定结果的相对标准偏差(RSD)为1.29%~3.49%, 均在合理范围, 说明本检测方法及构建的MAP检测复合物可以用于溶藻弧菌的检测。
| 样品 | 加入量/(CFU/mL) | 回收量/(CFU/mL) | 相对标准偏差/% | 回收率/% |
| 1 | 10 | 9.854 | 1.29 | 98.54 |
| 2 | 50 | 51.445 | 3.49 | 102.89 |
| 3 | 500 | 477.366 | 2.80 | 95.47 |
目前溶藻弧菌的检测方法主要有传统的基于微生物培养的方法、以抗体为基础的免疫检测法和以弧菌基因为靶点的分子生物学方法。微生物培养法, 由于需要进行微生物的培养, 检测周期较长, 灵敏度也不高, 目前市售的检测试剂盒基本都采用这一方法, 其对溶藻弧菌的检测限一般在103~104 CFU/mL左右(汤学敏等, 2019)。以抗体为基础的免疫检测法对溶藻弧菌的检测限则大多在104 CFU/mL左右(宋晓玲等, 2001; Su et al, 2016), 而对副溶血弧菌的检测限可达到10 CFU/mL (Wangman et al, 2017), 对霍乱弧菌的检测限可到102 CFU/mL (Chaivisuthangkura et al, 2013)。分子生物学法是目前研究报道最多的方法, 其中针对溶藻弧菌gyrB基因的环介导等温扩增法对溶藻弧菌的检测限为104 CFU/mL (陈昌国等, 2019); 选择溶藻弧菌的鞭毛基因fliC为目的基因, 通过Taqman探针和qPCR体系对溶藻弧菌的检测限可到102 CFU/mL (钟渊福等, 2016); 而针对mdh、vvhA、colH和toxR基因, 采用DPO引物建立的多重聚合酶链反应系统对溶藻弧菌的检测限可达到1.2 CFU/mL (Xu et al, 2017)。而我们采用的基于竞争置换作用的核酸适配体检测复合物(即MAP检测复合物)的方法, 可使最低检测限达到1 CFU/mL, 体现出了较好的检测灵敏度。目前我们应用该MAP检测复合物对淡水、海水以及养殖水体中的一些样品进行了检测, 都取得了较好的效果, 后续将进一步研究完善对血液、组织液、水产品等较为复杂样品的检测技术及前处理方法, 使其能有更广泛的应用价值。
利用核酸适配体来检测溶藻弧菌的方法也有一些报道。Yu等(2019)等利用核酸适配体VA2建立了酶联核酸适配体吸附技术(VA2-ELASA), 最低可以检测到5×104 CFU/mL的溶藻弧菌。Tang等(2013)等利用核酸适配体和PCR技术, 能检测到102 CFU/mL的灭活溶藻弧菌, 进一步改进方法后则可检测到10 CFU/mL (汤学敏等, 2019)。Zhao等(2016)等利用核酸适配体、纳米磁珠、敏感膜电极构建的电化学传感器, 最低可以检测到10 CFU/mL的溶藻弧菌。本文则通过构建磁珠-核酸适配体-荧光报告探针的MAP检测复合物, 利用核酸适配体的竞争置换作用实现了对溶藻弧菌的定量检测, 其最低检测限达到了1 CFU/mL。与其他检测方法相比, 本文的检测限有了明显的改进, 这应该与核酸适配体复合物具有较好的竞争置换作用相关, 当极微量的溶藻弧菌能置换出MAP检测复合物中较多的荧光报告探针时, 这个置换作用就相当于一个信号转换和放大作用, 将菌浓度信号放大转换成了荧光报告探针的荧光信号, 从而大大提高了检测的灵敏度。本文的竞争置换方法, 检测过程方便快捷, 有较好的特异性和稳定性, 体现出了较好的应用前景。
4 结论以磁珠-核酸适配体-荧光报告探针的MAP检测复合物为基础, 利用溶藻弧菌对其核酸适配体的竞争作用置换出荧光报告探针, 建立了一种检测溶藻弧菌的方法。该方法在1~20、20~100和100~1 000 CFU/mL范围内都呈现出较好的线性关系, 其最低检测限可达到1 CFU/mL, 并具有较好的特异性、稳定性和重现性。另外, 对MAP检测复合物的制备条件进行了优化, 确定了其较理想的制备条件为: 100 nmol/L核酸适配体与100 nmol/L荧光报告探针按体积比1︰1混合结合30 min, 制备出50 nmol/L的AP复合物, 然后该AP复合物再与25 μg/mL的磁珠按体积比1︰1混合结合60 min, 制备出相应的MAP检测复合物。
汤学敏, 林文燕, 鄢庆枇, 等. 2019. 基于核酸适配体的PCR法检测溶藻弧菌及其灭活菌. 中国水产科学, 26(2): 391-396 |
李玉宝, 2013. 基于适配子的弧菌PCR检测技术的研究[D]. 厦门: 集美大学: 14.
|
李亚楠, 赵洁, 张傲哲, 等. 2017. 核酸适配体的体外筛选方法的最新研究进展. 生物技术通报, 33(4): 78-82 |
余庆, 李菲, 覃仙玲, 等. 2018. 广西卵形鲳鲹小脑来源细胞系的建立及特征分析. 广西科学, 25(1): 74-79 |
宋晓玲, 黄倢, 史成银. 2001. 溶藻弧菌单克隆抗体的制备及应用. 水产学报, 25(6): 522-527 |
张晓华, 林禾雨, 孙浩, 等. 2018. 弧菌科分类学研究进展. 中国海洋大学学报, 48(8): 43-56 |
张颖雪, 苏洁, 叶仕根. 2019. 养殖贝类病原弧菌的耐药性及防治方法研究进展. 江西水产科技, (5): 53-56 DOI:10.3969/j.issn.1006-3188.2019.05.020 |
陈昌国, 陈秋圆, 侯兵兵, 等. 2019. 基于LAMP技术针对溶藻弧菌gyrB基因快速检测方法的建立. 现代检验医学杂志, 34(6): 6-9 DOI:10.3969/j.issn.1671-7414.2019.06.002 |
钟渊福, 郭以河, 胡永狮, 等. 2016. 荧光实时定量PCR检测溶藻弧菌方法的建立. 现代预防医学, 43(21): 3974-3977 |
BLIND M, BLANK M, 2015. Aptamer selection technology and recent advances. Molecular Therapy-Nucleic Acids, 4: e223 DOI:10.1038/mtna.2014.74 |
CHAIVISUTHANGKURA P, PENGSUK C, LONGYANT S et al, 2013. Evaluation of monoclonal antibody based immunochromatographic strip test for direct detection of Vibrio cholerae O1 contamination in seafood samples. Journal of Microbiological Methods, 95(2): 304-311 DOI:10.1016/j.mimet.2013.09.013 |
DA-SILVA E, BAUDART J, BARTHELMEBS L, 2018. Biosensing platforms for Vibrio bacteria detection based on whole cell and nucleic acid analysis: a review. Talanta, 190: 410-422 DOI:10.1016/j.talanta.2018.07.092 |
FUTAMI K, KIMOTO M, LIM Y W S et al, 2019. Genetic alphabet expansion provides versatile specificities and activities of unnatural-base DNA aptamers targeting cancer cells. Molecular Therapy-Nucleic Acids, 14: 158-170 DOI:10.1016/j.omtn.2018.11.011 |
LI L Y, LI Q J, LIAO Z Y et al, 2018. Magnetism-resolved separation and fluorescence quantification for near-simultaneous detection of multiple pathogens. Analytical Chemistry, 90(15): 9621-9628 DOI:10.1021/acs.analchem.8b02572 |
LIU C H, CHENG W, HSU J P et al, 2004. Vibrio alginolyticus infection in the white shrimp Litopenaeus vannamei confirmed by polymerase chain reaction and 16S rDNA sequencing. Diseases of Aquatic Organisms, 61(1/2): 169-174 |
LUO P, HE X Y, WANG Y H et al, 2016. Comparative genomic analysis of six new-found integrative conjugative elements (ICEs) in Vibrio alginolyticus. BMC Microbiology, 16(1): 79 DOI:10.1186/s12866-016-0692-9 |
MUHAMMAD M, HUANG Q, 2021. A review of aptamer-based SERS biosensors: design strategies and applications. Talanta, 227: 122188 DOI:10.1016/j.talanta.2021.122188 |
QI X Y, YAN X C, ZHAO Y L et al, 2020. Highly sensitive and specific detection of small molecules using advanced aptasensors based on split aptamers: a review. TrAC Trends in Analytical Chemistry, 133: 116069 DOI:10.1016/j.trac.2020.116069 |
RADUCANU V S, RASHID F, ZAHER M S et al, 2020. A direct fluorescent signal transducer embedded in a DNA aptamer paves the way for versatile metal-ion detection. Sensors and Actuators B: Chemical, 304: 127376 DOI:10.1016/j.snb.2019.127376 |
SU Z Z, LI Y, PAN L Q et al, 2016. An investigation on the immunoassays of an ammonia nitrogen-degrading bacterial strain in aquatic water. Aquaculture, 450: 17-22 DOI:10.1016/j.aquaculture.2015.07.001 |
TANG X M, ZHENG J, YAN Q P et al, 2013. Selection of aptamers against inactive Vibrio alginolyticus and application in a qualitative detection assay. Biotechnology Letters, 35(6): 909-914 DOI:10.1007/s10529-013-1154-1 |
UEMACHI H, KASAHARA Y, TANAKA K et al, 2020. Discovery of cell-internalizing artificial nucleic acid aptamers for lung fibroblasts and targeted drug delivery. Bioorganic Chemistry, 105: 104321 DOI:10.1016/j.bioorg.2020.104321 |
VÄLIMAA A L, TILSALA-TIMISJÄRVI A, VIRTANEN E, 2015. Rapid detection and identification methods for Listeria monocytogenes in the food chain - a review. Food Control, 55: 103-114 DOI:10.1016/j.foodcont.2015.02.037 |
WANGMAN P, CHAIVISUTHANGKURA P, SRITUNYALUCKSANA K et al, 2017. Development of monoclonal antibodies specific to ToxA and ToxB of Vibrio parahaemolyticus that cause acute hepatopancreatic necrosis disease (AHPND). Aquaculture, 474: 75-81 DOI:10.1016/j.aquaculture.2017.03.039 |
XU Y G, SUN L M, WANG Y S et al, 2017. Simultaneous detection of Vibrio cholerae, Vibrio alginolyticus, Vibrio parahaemolyticus and Vibrio vulnificus in seafood using dual priming oligonucleotide (DPO) system-based multiplex PCR assay. Food Control, 71: 64-70 DOI:10.1016/j.foodcont.2016.06.024 |
YAN J H, XIONG H J, CAI S D et al, 2019. Advances in aptamer screening technologies. Talanta, 200: 124-144 DOI:10.1016/j.talanta.2019.03.015 |
YU Q, LIU M Z, WEI S N et al, 2021. Research progress and prospects for the use of aptamers in aquaculture biosecurity. Aquaculture, 534: 736257 DOI:10.1016/j.aquaculture.2020.736257 |
YU Q, LIU M Z, XIAO H H et al, 2019. Development of novel aptamer-based enzyme-linked apta-sorbent assay (ELASA) for rapid detection of mariculture pathogen Vibrio alginolyticus. Journal of Fish Diseases, 42(11): 1523-1529 DOI:10.1111/jfd.13066 |
ZHAO G T, DING J W, YU H et al, 2016. Potentiometric aptasensing of Vibrio alginolyticus based on DNA nanostructure-modified magnetic beads. Sensors, 16(12): 2052 DOI:10.3390/s16122052 |
 2022, Vol. 53
2022, Vol. 53


