中国海洋湖沼学会主办。
文章信息
- 罗素雅, 虞新磊, 陈琼琳, 刘士霞, 徐年军, 孙雪. 2022.
- LUO Su-Ya, YU Xin-Lei, CHEN Qiong-Lin, LIU Shi-Xia, XU Nian-Jun, SUN Xue. 2022.
- 利用代谢组学揭示脱落酸对高温胁迫龙须菜(Gracilariopsis lemaneiformis)的作用机制
- METABOLOMICS REVEALED THE POTENTIAL MECHANISM OF ABSCISIC ACID IN GRACILARIOPSIS LEMANEIFORMIS UNDER HIGH TEMPERATURE STRESS
- 海洋与湖沼, 53(1): 224-234
- Oceanologia et Limnologia Sinica, 53(1): 224-234.
- http://dx.doi.org/10.11693/hyhz20210800173
文章历史
-
收稿日期:2021-08-02
收修改稿日期:2021-09-27
大型海藻龙须菜(Gracilariopsis lemaneiformis)隶属红藻门(Rhodophyta)、江蓠目(Gracilariales), 主要用来生产琼胶和用作鲍的饵料。野生型龙须菜主要分布在山东半岛海域, 其适宜生长温度为10~23 ℃。而耐高温龙须菜981的生长适温范围在12~26 ℃ (张学成等, 2008)。后来, 耐高温龙须菜2007和鲁龙1号也相继选育成功。目前, 龙须菜在山东、福建、广东等沿海地区大面积栽培, 形成了龙须菜产业。但南方海区的高温仍然会阻碍龙须菜的生长, 限制龙须菜的生长周期, 影响了其产量与效益。
脱落酸(ABA)是一种倍半萜结构的植物激素, 在植物芽休眠、落叶、种子发育、果实成熟等生长发育过程中具有调节作用(Barrero et al, 2005)。20世纪60年代, ABA首次在棉铃中被发现(Addicott et al, 1969)。后来ABA结合蛋白和合成相关基因在高等植物中也被检测出(Zhang et al, 2002; Du et al, 2010)。相比于高等植物, 藻类中ABA含量更低, 因此检测较困难。Yalçın等(2019)利用超高效液相色谱-质谱联用法(UPLC-MS/MS)在江蓠(Gracilaria bursa-pastoris)、珊瑚藻(Ellisolandia elongata)中检测到微量ABA, 分别为0.24和0.31 ng/g DW (干重)。Gupta等(2011)在5种石莼属绿藻中检测到ABA、赤霉素(GA3)、吲哚-3-乙酸(IAA)等6种植物激素, 其中ABA含量最高, 为19.68~68.28 nmol/g FW(鲜重)。作为植物生命活动过程中的重要调节因子, 除了参与植物的生长发育过程, 内源或外源ABA在抵抗外界非生物胁迫方面也发挥了重要作用(Cutler et al, 2010)。在盐胁迫条件下, 单细胞红藻Cyanidioschyzon merolae中ABA大量积累, 而其ABA缺失突变体对盐胁迫则很敏感(Kobayashi et al, 2016); 10 μmol/L ABA可提高盐胁迫下生菜(Lactuca sativa)的色素含量、光合作用参数, 从而增强对盐胁迫的抗性(Xie et al, 2018)。除了盐度和干旱胁迫(Zhou et al, 2016), ABA在响应温度胁迫中也发挥了作用。如喷施ABA可促进蔗糖转运和代谢来逆转高温引起的水稻小穗的花粉败育(Rezaul et al, 2019); 外源ABA可通过增强野生型水稻的碳水化合物含量和热休克蛋白活性来增强其耐热性(Li et al, 2020a)。在冷胁迫下, 条斑紫菜(Pyropia yezoensis)中ABA直接合成途径中的法尼基焦磷酸合成酶基因表达上调(Sun et al, 2015)。
代谢组学是继基因组学和蛋白质组学之后发展起来的一门学科, 它从整体角度对生物体内所有代谢物进行定量分析, 关注的多是分子量小于1 000的小分子代谢物。目前在代谢组学中使用较为广泛的是UPLC-MS/MS技术, 它具有特异性强、灵敏度高、稳定性高等特点, 已成为小分子物质定量分析常用的方法。利用代谢组学方法来研究ABA对植物代谢水平的影响已有报道。如Broekgaarden等(2018)利用代谢组学结合转录组学方法研究了甘蓝(Brassica rapa)对粉虱抗性的分子机制, 发现ABA在其中发挥了作用; Murcia等(2017)利用代谢组学方法发现外源添加ABA/GA3可以促进葡萄(Vitis vinifera)中脯氨酸、单萜和倍半萜的积累, 从而来抵御生物和非生物胁迫。
本课题组在前期研究中发现外源添加ABA可以促进高温胁迫下龙须菜的生长, 增加甘露醇、脯氨酸、海藻糖等含量。在此基础上, 本文利用基于UPLC-MS/MS的代谢组学方法探究了ABA对高温胁迫下龙须菜的整体代谢水平的影响, 为研究藻类植物激素的作用及后续利用植物激素提高龙须菜抗逆性提供理论参考。
1 材料与方法 1.1 材料培养与处理本实验所用龙须菜981于2020年6月采自福建霞浦龙须菜养殖场(26°65′N, 119°66′E)。将充分洗刷去除泥沙、附着生物后的新鲜藻体在0.7%碘化钾中浸泡10 min, 再用灭菌海水清洗2~3次。取3~5 cm藻体尖端在23 ℃、盐度25的人工海水、光照强度40 μmol/(m2⋅s)、光周期12L: 12D的条件下预培养2~3 d。然后在高温(33 ℃)下进行实验。实验共设置2组: 对照组(不加ABA)和ABA组(添加ABA至终浓度为50 μmol/L), 其他培养条件与预培养条件均相同。每组设置3个生物学重复。
1.2 UPLC-MS/MS样品制备在培养第3天, 称取3 g龙须菜置于冻干机(Scientz-IOOF)中真空冷冻干燥。利用研磨仪(MM400, Retsch)研磨(30 Hz) 1.5 min至粉末状。再称取100 mg藻粉, 溶解于1.2 mL 70%甲醇提取液中; 每30 min涡旋一次, 每次持续30 s, 共涡旋6次后置于4 ℃冰箱过夜。再以12 000 r/min转速离心10 min后, 吸取上清, 最后用0.22 μm微孔滤膜过滤样品后置于进样瓶中, 用于UPLC-MS/MS分析。
1.3 色谱质谱采集条件超高效液相色谱采用Agilent SB-C18色谱柱(2.1 mm×100 mm, 1.8 μm)。流动相A为超纯水(含0.1%的甲酸), B为乙腈(含0.1%的甲酸)。梯度洗脱程序为0 min, 5% B; 0~9 min, 5%~95% B; 9~10 min, 95% B; 10~11.10 min, 95%~5% B; 11.10~14 min, 5% B; 流速为0.35 mL/min。柱温40 ℃, 进样量为4 μL。质谱条件为电喷雾离子源温度550 ℃, 质谱电压5500 V (正离子模式)/–4500 V (负离子模式), 帘气为25 psi, 碰撞诱导电离参数设置为高。在三重四级杆中根据优化的去簇电压和碰撞扫描检测每个离子对(Chen et al, 2013)。
1.4 代谢物定性定量分析在三重四级杆质谱的多反应监测模式下筛选出每个物质的特征离子, 在检测器中获得特征离子的信号强度, 用Multia Quant软件打开样本下机质谱文件, 进行色谱峰的积分和校正工作, 每个色谱峰的峰面积代表对应物质的相对含量。
1.5 代谢组学数据分析对6个样品进行主成分分析(PCA)来判定各个样品的分离情况, 再使用正交偏最小二乘法判别分析(OPLS-DA)过滤不相关变量后筛选差异变量。本研究主要依据OPLS-DA模型分析的变量投影重要度(VIP)和差异倍数(fold change)筛选差异代谢物, 筛选条件为VIP≥0.8和fold change≥1.6 (或≤0.625)。对差异代谢物进行KEGG通路富集, 结果以气泡图表示, 其中rich factor为通路中的差异代谢物的个数与该通路注释到的代谢物总数的比值。再将ABA影响显著的几条代谢途径进行代谢通路分析。
1.6 相对生长速率测定在33 ℃培养的龙须菜中分别添加0、50、100、200和400 μmol/L的黄嘌呤, 培养3 d后进行藻生长的测定。准确称量龙须菜藻体初始鲜重(g)以及第3天的鲜重, 按照以下公式计算龙须菜的相对生长速率(RGR) (Abreu et al, 2009):
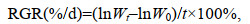 (1)
(1)式中, W0和Wt分别为开始培养和第t天时藻体鲜重, t为实验天数(3 d)。
1.7 活性氧(ROS)测定按照与1.6相同的浓度设置添加黄嘌呤, 在培养3 d后进行藻体ROS的测定。称取0.15 g龙须菜, 采用活性氧酶联免疫分析试剂盒(上海江莱)测定藻体ROS活性。
1.8 酶活性分析设置与1.1相同的对照组和ABA组进行龙须菜的培养, 分别取0、12、24、48和72 h培养的龙须菜0.1 g, 按照试剂盒的说明进行酶活性测定。使用磷脂酶A2 (PLA2)试剂盒(苏州科铭)测定磷脂酶A2酶活性; 分别使用溶血磷脂酰胆碱酰基转移酶1 (LPCAT1)酶联免疫分析试剂盒和植物精氨酰琥珀酸合成酶(ASS)酶联免疫分析试剂盒来测定LPCAT1和ASS活性, 以上两个试剂盒均购自上海科兴。
1.9 基因表达量分析设置与1.1相同的对照组和ABA组进行龙须菜的培养, 分别取0、12、24、48和72 h培养的龙须菜0.1 g在液氮中研磨成粉末用于总RNA提取。使用Plant RNA Kit (OMEGA)来提取总RNA, 使用iScript cDNA Synthesis Kit (BIO-RAD)来进行反转录合成cDNA。根据龙须菜基因组数据库中ass基因序列, 利用Primer Premier 5.0设计该基因的正反向引物(其序列分别为5′-ATGTCCAAAGGCAAAGTCGT-3′和5′-GTCTGCGATGTAGCAAATGA-3′)。使用actin基因作为内参, 在Eppendorf荧光定量PCR仪中进行实时荧光定量PCR, 内参引物序列、扩增程序等参考孙鹏等(2019)。采用2–ΔΔCt法计算基因的相对表达量(Livak et al, 2001)。
1.10 数据统计分析使用Excel 2013进行数据处理和作图, 实验数据均以平均值±标准偏差(mean±SD)表示。采用SPSS 21.0进行单因素方差(One-way ANOVA)和Tukey多重比较分析, 以P < 0.05为差异显著水平。
2 结果与分析 2.1 PCA和OPLS-DA结果本研究采用UPLC-MS/MS进行广泛靶向代谢组分析, 在龙须菜中共检测到419种代谢物, 包括114种脂质、65种氨基酸及其衍生物、52种核苷酸及其衍生物、45种有机酸等。对这些代谢物进行了主成分分析(图 1a), 第一主成分(PC1)占比44.8%, 第二主成分(PC2)占比18.6%。以上结果说明ABA组与对照组样本分离良好, 两个组存在显著差异。
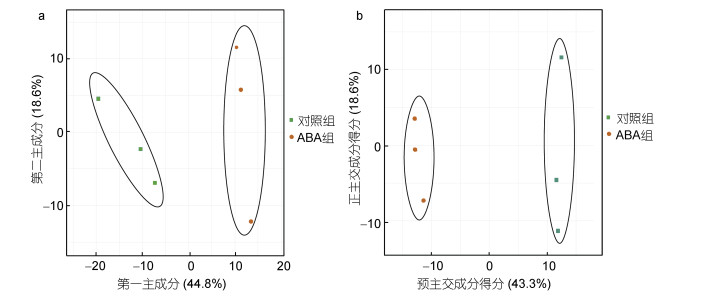 |
| 图 1 主成分分析(a)和正交偏最小二乘法判别分析(b) Fig. 1 Principal component analysis (a) and orthogonal partial least squares-discriminant analysis (b) |
在构建的OPLS-DA模型中(图 1b), Q2为0.952, R2X为0.65, R2Y为0.997。Q2 > 0.9说明我们构建的模型较好。从图中可以看出对照组和ABA组样品之间差异明显。
2.2 高温下龙须菜响应ABA的代谢物以VIP值以及差异倍数为条件, 我们共筛选到104种差异代谢物(部分差异代谢物见表 1), 其中26种物质含量上升, 78种物质含量下降。
| 物质分类 | 代谢物 | VIP | 差异倍数 |
| 核苷酸及其衍生物 | 9-(阿拉伯糖基)次黄嘌呤 | 1.20 | 2.39 |
| 别嘌呤醇 | 1.24 | 2.66 | |
| 次黄嘌呤 | 1.15 | 2.26 | |
| 黄嘌呤 | 1.35 | 2.10 | |
| 2′-脱氧肌苷-5′-单磷酸 | 1.30 | 2.08 | |
| 1-甲基腺嘌呤 | 1.27 | 1.64 | |
| 尿苷5′-单磷酸 | 1.25 | 1.64 | |
| 环-3′, 5′-腺嘌呤核苷酸 | 1.34 | 0.53 | |
| 腺苷 | 1.34 | 0.58 | |
| 2-氨基嘌呤 | 1.31 | 0.55 | |
| 黄酮 | 芦丁 | 1.24 | 11.36 |
| 槲皮素-3-O-洋槐糖苷 | 1.10 | 8.13 | |
| 槲皮素-7-O-芸香糖苷 | 1.06 | 8.12 | |
| 槲皮素-3-O-新橘皮糖苷 | 1.06 | 7.95 | |
| 表儿茶素 | 1.24 | 3.97 | |
| 异槲皮素 | 1.48 | 2.03 | |
| 有机酸 | 精氨酰琥珀酸 | 1.10 | 2.45 |
| β-脲基异丁酸 | 1.42 | 1.83 | |
| 2-氧庚二酸 | 1.19 | 1.72 | |
| 鞣质 | 原花青素B2 | 1.33 | 6.31 |
| 原花青素B3 | 1.28 | 5.54 | |
| 4β-8-儿茶素 | 1.21 | 3.52 | |
| 肉桂单宁D1 | 0.88 | 0.45 | |
| 酚酸类 | 1-O-水杨酰-D-葡萄糖 | 1.24 | 3.57 |
| 1, 7-双对羟基苯基-3-庚醇 | 1.22 | 1.79 | |
| 松柏醛 | 1.42 | 0.56 | |
| 生物碱 | 对羟基扁桃腈 | 1.42 | 1.67 |
| 双-2-乙酰氨基-1, 5-无水-2-脱氧-1-D-葡萄糖醇 | 1.41 | 0.26 | |
| 3-氧基-2-羟丙基棕榈酸酯 | 1.28 | 0.49 | |
| 氨基酸及其衍生物 | 甲硫氨酸 | 1.46 | 1.77 |
| 脂质 | 1-亚油酰甘油酯-3-O-葡萄糖苷 | 1.18 | 1.61 |
| 二十二碳四烯酸 | 1.52 | 0.01 | |
| 1-亚油酰甘油酯-2, 3-二-O-葡萄糖苷* | 1.50 | 0.43 | |
| 2-亚油酰甘油酯-1-O-葡萄糖苷* | 1.40 | 0.45 | |
| 1-亚油酸单甘油酯-二葡萄糖苷 | 1.46 | 0.46 | |
| 2-亚油酰甘油酯-1, 3-二-O-葡萄糖苷* | 1.50 | 0.49 | |
| α-亚麻酸 | 1.27 | 0.50 | |
| 单酰甘油酯(18:1) | 1.37 | 0.57 | |
| 戊烯酸 | 1.11 | 0.62 | |
| 其他类 | D-葡萄糖醛酸 | 1.25 | 1.78 |
| 维生素C (抗坏血酸) | 1.45 | 0.32 | |
| D-葡萄糖醛酸-6, 3-内酯 | 1.41 | 0.33 | |
| 磷酸丙二乙酯 | 1.28 | 0.44 | |
| 注: *表示该物质具有同分异构体 | |||
在26种上调差异代谢物中(图 2a), 核苷酸及其衍生物数量最多(7种), 包括9-次黄嘌呤、别嘌呤醇、次黄嘌呤、黄嘌呤等, 占总差异代谢物的26.92%; 其次为黄酮类化合物(6种, 23.08%), 包括芦丁、槲皮素-3-O-洋槐糖苷、槲皮素-7-O-芸香糖苷及异槲皮素等。除了以上两类代谢物之外, 还检测到精氨酰琥珀酸等3种有机酸、原花青素B2等3种鞣质以及2种酚酸和1种氨基酸(甲硫氨酸)上调。在上调的差异代谢物中, 芦丁上调幅度最大(11.36倍); 而在3种有机酸中, 精氨酰琥珀酸上调幅度最大(2.45倍)。
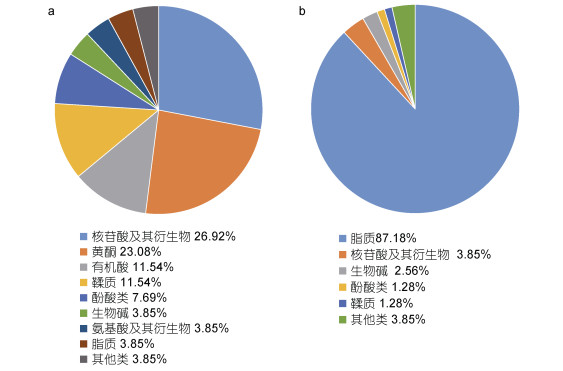 |
| 图 2 差异代谢物归类 Fig. 2 The classification of differential metabolites 注: a. 上调代谢物; b. 下调代谢物 |
在78种下调差异代谢物中(图 2b), 脂质数量最多, 共68种(87.18%), 其中有23种溶血磷脂酰乙醇胺(LPE), 包括溶血磷脂酰乙醇胺15:0、16:0、18:2等, 以及35种溶血磷脂酰胆碱(LPC), 包括溶血磷脂酰胆碱14:0、15:0、16:2等(表 1中未列出)。其次为3种核苷酸及其衍生物、2种生物碱(D-葡萄糖醇衍生物、3-氧基-2-羟丙基棕榈酸酯)、1种酚酸(松柏醛)及1种鞣质(肉桂单宁D1)。
2.3 高温下龙须菜响应ABA的代谢途径将龙须菜中差异代谢物映射至PubChem数据库获得匹配的代谢物信息, 并搜索拟南芥(Arabidopsis thaliana)代谢通路数据库进行分析(图 3)。KEGG富集结果表明, 代谢途径(metabolic pathways)和次级代谢物的合成(biosynthesis of secondary metabolites)这两个途径富集到的差异代谢物最多, 分别有16种和9种; 其次为嘌呤代谢(purine metabolism)和抗坏血酸和醛酸盐代谢(ascorbate and aldarate metabolism), 分别有5种和3种代谢物。从富集程度上来看, 嘌呤代谢、黄酮和黄酮醇合成(flavone and flavonol biosynthesis)、抗坏血酸和醛酸盐代谢通路富集程度较高。
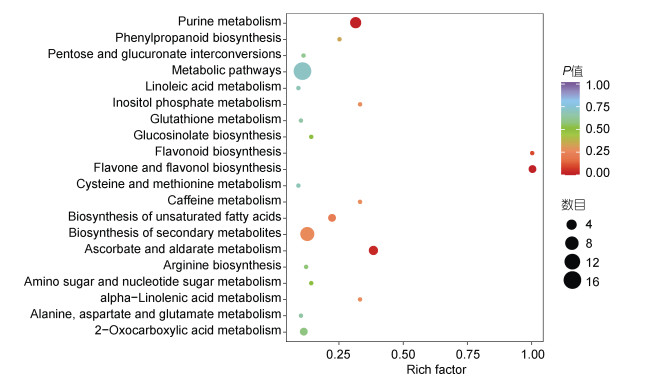 |
| 图 3 ABA影响的龙须菜中显著富集的代谢通路 Fig. 3 Metabolic pathways affected by ABA in G. lemaneiformis under high temperature stress 注: 横坐标表示每个通路对应的rich factor, 纵坐标为通路名称。气泡颜色表示富集程度; 气泡大小表示富集代谢物的数目 |
将受ABA影响显著富集的嘌呤代谢、黄酮和黄酮醇合成代谢途径用简单的通路图表示(图 4)。如图所示, ABA的添加显著促进了高温下龙须菜的嘌呤代谢, 其代谢途径中的部分代谢物含量显著上升, 如2′-脱氧肌苷-5′-单磷酸、次黄嘌呤和黄嘌呤, 分别是对照组的2.08倍、2.26倍、2.10倍。
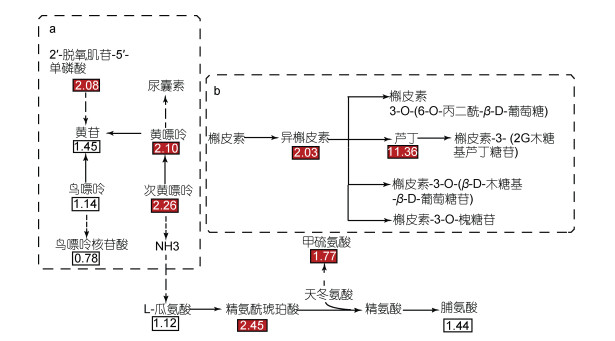 |
| 图 4 ABA影响的龙须菜中嘌呤代谢(a)和黄酮和黄酮醇合成(b)通路 Fig. 4 Purine metabolism (a) and flavone and flavonol biosynthesis (b) in G. lemaneiformis affected by ABA 注: 方框内数字表示代谢物的变化倍数, 红色表示上调倍数。实线箭头代表一步完成的反应, 虚线箭头代表需要多步反应 |
在黄酮和黄酮醇合成途径中, 其中间产物芦丁和异槲皮素分别上调至对照组的11.36倍、2.03倍, 表明ABA显著促进了高温下龙须菜中黄酮和黄酮醇的合成。
2.4 黄嘌呤对高温下龙须菜生长和ROS的影响在表 1中, ABA添加后龙须菜中黄嘌呤的含量显著上升(2.10倍)。为了探究黄嘌呤对高温胁迫下龙须菜的影响, 我们比较了不同浓度黄嘌呤对龙须菜生长和ROS的影响(图 5)。结果表明, 100和200 μmol/L黄嘌呤显著促进了高温下龙须菜的生长, 其RGR分别是对照组的1.35倍和2.13倍(P < 0.05)。同时, 100和200 μmol/L黄嘌呤也降低了ROS活性, 比对照组分别下降了22.32%、26.89% (P < 0.05)。这说明合适浓度的黄嘌呤能促进高温下龙须菜的生长, 并且有助于清除高温下产生的ROS。
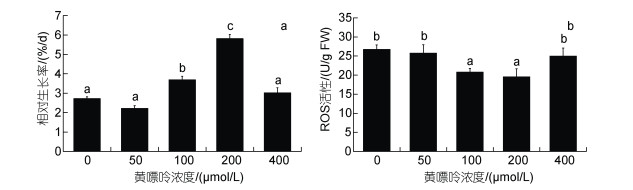 |
| 图 5 黄嘌呤对高温胁迫下龙须菜生长(a)和ROS (b)的影响 Fig. 5 The effect of xanthine on the growth (a) and ROS activity (b) in G. lemaneiformis under high temperature stress 注: 不同小写字母表示不同黄嘌呤浓度组之间差异显著(P < 0.05) |
在表 1中, 龙须菜中精氨酰琥珀酸含量受ABA影响显著上升(2.45倍), 因此我们对其合成酶ASS活性及其基因表达水平进行了分析(图 6)。在高温胁迫的72 h内, ABA组藻的ASS活性在12 h和72 h时分别较对照组提高了8.21%和11.60% (P < 0.05), 而其他时间点与对照组无显著差异。在高温胁迫的48 h内, ABA组藻的ass表达水平增加, 为对照组的1.36~2.73倍(P < 0.05)。以上结果表明高温胁迫下外源添加ABA可一定程度地促进龙须菜ASS活性及其基因表达量的升高。ASS活性及其转录水平的变化与代谢组结果中精氨酰琥珀酸含量上升的结果一致。
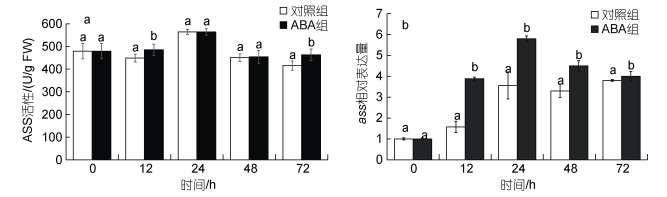 |
| 图 6 ABA对高温胁迫下龙须菜ASS活性(a)和ass基因表达(b)的影响 Fig. 6 The effects of ABA on ASS activity (a) and ass expression (b) in G. lemaneiformis under high temperature stress 注: 不同小写字母表示相同时间点对照组与ABA组差异显著(P < 0.05) |
在筛选到的差异代谢物中, 大量LPC受ABA影响下调, 因此我们对LPC的合成酶PLA2和降解酶LPCAT1进行了分析(图 7)。在高温胁迫12 h时, 对照组和ABA组藻中的PLA2活性无差别, 而在24、48、72 h时, ABA组中龙须菜PLA2活性降低, 分别比对照组下降13.39%、34.30%、21.03% (P < 0.05)。与PLA2不同, LPCAT1活性在12 h时显著下降, 但在24和48 h时ABA组藻的LPCAT1活性升高, 分别是对照组的1.62和1.38倍(P < 0.05), 而在72 h时没有显著差异。该结果表明外源ABA可通过抑制PLA2活性、激活LPCAT1活性来降低LPC含量。
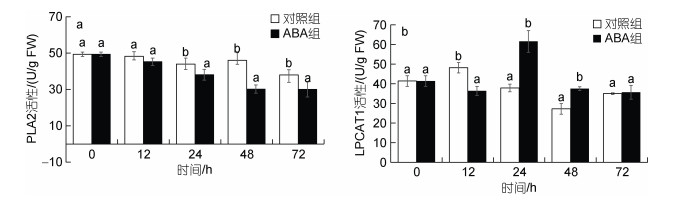 |
| 图 7 ABA对高温胁迫下龙须菜PLA2活性(a)和LPCAT1活性(b)的影响 Fig. 7 The effects of ABA on PLA2 activity (a) and LPCAT1 activity (b) in G. lemaneiformis under high temperature stress 注: 不同小写字母表示相同时间点对照组与ABA组差异显著(P < 0.05) |
随着温室效应的加剧, 海水温度逐年上升。在高温胁迫下, 高等植物和藻类的代谢活动如光合作用、呼吸代谢、营养元素转运, 以及代谢酶的活性和有机物的积累等都会受到影响。高温可使长心卡帕藻(Kappaphycus alvarezii)、异枝卡帕藻(K. striatum)的实际光合效率和相对光合电子传递效率显著下降(赵素芬等, 2011)。在长期进化过程中, 植物已形成一系列包括植物激素在内的应对外界不利环境的应激防御机制。如ABA可抑制高温下水稻丙二醛含量增加从而来降低热损害对膜脂的损伤(Li et al, 2014)。水杨酸可提高龙须菜抗氧化酶活性和脯氨酸含量来增强藻体对高温的抗性(王重彬等, 2015)。24-表油菜素内酯可显著增加黄瓜(Cucumis sativus)脯氨酸含量以降低盐胁迫对其产生的负面影响(Fariduddin et al, 2013)。
3.1 嘌呤代谢对逆境胁迫和激素的响应在高等植物中, 嘌呤参与了氮代谢、黄酮合成及植物激素合成等代谢过程(Aguey-Zinsou et al, 2003; Irani et al, 2018)。黄嘌呤脱氢酶(XDH)是嘌呤代谢过程的重要酶, 可以催化黄嘌呤和次黄嘌呤转化为尿囊素等酰脲类化合物(吴自明等, 2012), 它可通过调节氮代谢、活性氧代谢来帮助植物应对不良环境(Brychkova et al, 2008)。如在高温胁迫下拟南芥通过升高XDH1活性来清除叶绿体中过氧化氢(H2O2) (Ma et al, 2016)。XDH还参与了植物激素如ABA、IAA等代谢过程(Taylor et al, 2001; Watanabe et al, 2014a)。此外, 嘌呤代谢的中间产物尿囊素也参与了ABA代谢过程, 它在非生物胁迫下可以大量积累启动ABA合成, 从而提高对逆境胁迫的耐受性(Watanabe et al, 2014b)。在本研究中, ABA显著增强了龙须菜嘌呤代谢, 其中间代谢物2′-脱氧肌苷-5′-单磷酸、次黄嘌呤和黄嘌呤均为对照组的2倍以上。我们推测ABA添加促使嘌呤代谢向下游途径进行, 使其积累更多尿囊素等抗逆代谢物质。
在高温胁迫下, ABA能够提高植物的抗氧化能力和H2O2含量。H2O2作为信号分子可以调节热应激反应减少过量的ROS产生(Driedonks et al, 2015)。在本研究中, ABA可以促使黄嘌呤显著积累, 而外源添加黄嘌呤也能显著促进高温下龙须菜生长、降低ROS活性。因此推测ABA可能通过促进嘌呤代谢中间代谢物的积累来抑制ROS活性, 从而参与了抗高温的逆境应答。
3.2 黄酮类化合物对逆境胁迫和激素的响应黄酮类化合物广泛存在于植物的根、茎、叶、花、果实和种子中, 包括黄酮、黄酮醇、芦丁、花青素等。在植物生长发育过程中, 黄酮类化合物能调控生长素转运、影响花粉发育、调节叶片气孔开度等(Stracke et al, 2010; Silva-Navas et al, 2016)。此外, 黄酮类化合物具有增强植物抗逆性和化学防御功能。如在水分胁迫下, 高粱(Sorghum bicolor)中的黄酮含量从0.14 μg/g增加到157.2 μg/g (Pinheiro et al, 2021)。花青素的大量积累可以减缓干旱胁迫下拟南芥内ROS的积累(Nakabayashi et al, 2015)。芦丁和芦丁水解酶还参与了植物对抗紫外线、低温和干旱等抗逆防御反应(Suzuki et al, 2015)。
外源植物激素可以促进黄酮类化合物的积累及其合成相关基因的表达。如喷施ABA可以增加葡萄(Vitis vinifera)果皮中花青素的含量(Yamamoto et al, 2015)。100 μmol/L水杨酸的添加使贯叶连翘(Hypericum perforatum)总黄酮含量较对照组提高了2.7倍(Wang et al, 2015)。外源ABA诱导了苦荞麦(Fagopyrum tataricum)中大部分芦丁合成相关基因如查尔酮合酶(CHS)、黄烷酮-3-羟化酶(F3H)和黄酮醇合成酶(FLS)等的转录表达(Li et al, 2020b)。在本文中, ABA处理使高温下龙须菜中芦丁、异槲皮素含量显著积累, 尤其是前者积累量达到对照组的11.36倍。这表明ABA可能通过促进黄酮和黄酮醇合成代谢来保护高温胁迫下的龙须菜。
3.3 脂质对逆境胁迫和激素的响应细胞膜是植物维持正常生命活动的基本结构, 当植物受到非生物胁迫时, 体内的ROS含量上升导致脂膜质过氧化, 从而破坏细胞膜的完整性。在高温环境中, 坛紫菜(Pyropia haitanensis)中ROS显著积累, 对细胞造成损害甚至抑制藻的生长(Yang et al, 2013)。但植物可以通过膜脂质的重塑和膜脂不饱和度的降低来适应高温环境(Zheng et al, 2011)。拟南芥在17 ℃时脂肪酸的双键指数为2.39, 而在36 ℃时则下降了38.91% (Falcone et al, 2004); 烟草(Nicotiana tabacum)可以通过提高半乳糖脂含量和降低脂肪酸不饱和度来增强其耐热性(Murakami et al, 2000)。
溶血磷脂广泛存在于生物体的细胞膜中, 主要作用是参与各种磷脂的合成等(Simons et al, 2011)。按其底物来源不同, 溶血磷脂主要包括LPC、LPE、溶血磷脂酸(LPA)等。溶血磷脂有较强的表面活性, 过高浓度溶血磷脂会破坏细胞膜结构(李招等, 2018)。本研究利用代谢组方法检测到大量LPC和LPE含量降低, 这可能与ABA能够减缓细胞膜的损伤有关。LPC可以由磷脂酰胆碱(PC)通过PLA2等磷脂酶水解形成, 而LPC在LPCAT作用下得到一个脂酰基又可生成PC (Lands, 1960)。PC是一种甘油醇磷脂, 它不仅是细胞膜的组成成分, 还是脂质信号分子合成的前体物质。在对代谢组结果的验证实验中, 我们发现高温下龙须菜中PLA2活性下降, 而LPCAT1酶活性多上升, 两者的变化均使LPC含量降低。因此, 我们推测ABA添加后龙须菜中两种溶血磷脂代谢酶的活性变化使更多的LPC向累积PC的方向进行。而PC的增加有利于维持藻细胞膜的稳态, 减轻高温带来的不利影响。
4 结论在高温胁迫下, 50 μmol/L ABA添加后龙须菜中有104个代谢物发生变化, 其中黄嘌呤、次黄嘌呤、芦丁、槲皮素衍生物、精氨酰琥珀酸等物质含量升高, 而大量LPC和LPE含量降低, 这些差异代谢物直接或间接参与了龙须菜抵抗高温胁迫的应答。本文结果为植物激素在藻类抗高温中的作用研究提供了理论资料。
王重彬, 邹同雷, 孙雪, 等. 2015. 水杨酸和茉莉酸甲酯对高温龙须菜(Gracilariopsis lemaneiformis)理化及基因表达的影响. 海洋与湖沼, 46(5): 1132-1138 |
孙鹏, 杜宇, 吕燕, 等. 2019. 龙须菜卤代烷烃脱卤酶基因的转录及原核表达. 水产学报, 43(12): 2468-2475 |
李招, 谷克仁, 张海臣, 等. 2018. 溶血磷脂的制备、分离、检测及应用研究进展. 中国油脂, 43(6): 132-136, 143 DOI:10.3969/j.issn.1003-7969.2018.06.028 |
吴自明, 谭雪明, 韩瑞才, 等. 2012. 高等植物黄嘌呤脱氢酶的研究进展. 中国农学通报, 28(21): 159-163 |
张学成, 费修绠. 2008. 全国水产原良种审定委员会审定品种-981龙须菜及其栽培技术介绍. 科学养鱼, (6): 21-22 |
赵素芬, 何培民. 2011. 高温对两种卡帕藻的酶活性、色素含量与叶绿素荧光的影响. 生态学报, 31(22): 6845-6852 |
ABREU M H, VARELA D A, HENRÍQUEZ L et al, 2009. Traditional vs. integrated multi-trophic aquaculture of Gracilaria chilensis C. J. Bird, J. McLachlan & E. C. Oliveira: productivity and physiological performance. Aquaculture, 293(3/4): 211-220 |
ADDICOTT F T, LYON J L, 1969. Physiology of abscisic acid and related substances. Annual Review of Plant Physiology, 20: 139-164 DOI:10.1146/annurev.pp.20.060169.001035 |
AGUEY-ZINSOU K F, BERNHARDT P V, LEIMKÜHLER S, 2003. Protein film voltammetry of Rhodobacter capsulatus xanthine dehydrogenase. Journal of the American Chemical Society, 125(50): 15352-15358 DOI:10.1021/ja037940e |
BARRERO J M, PIQUERAS P, GONZÁLEZ-GUZMÁN M et al, 2005. A mutational analysis of the ABA1 gene of Arabidopsis thaliana highlights the involvement of ABA in vegetative development. Journal of Experimental Botany, 56(418): 2071-2083 DOI:10.1093/jxb/eri206 |
BROEKGAARDEN C, PELGROM K T B, BUCHER J et al, 2018. Combining QTL mapping with transcriptome and metabolome profiling reveals a possible role for ABA signaling in resistance against the cabbage whitefly in cabbage. PLoS One, 13(11): e0206103 DOI:10.1371/journal.pone.0206103 |
BRYCHKOVA G, ALIKULOV Z, FLUHR R et al, 2008. A critical role for ureides in dark and senescence-induced purine remobilization is unmasked in the Atxdh1 Arabidopsis mutant. The Plant Journal, 54(3): 496-509 DOI:10.1111/j.1365-313X.2008.03440.x |
CHEN W, GONG L, GUO Z et al, 2013. A novel integrated method for large-scale detection, identification, and quantification of widely targeted metabolites: application in the study of rice metabolomics. Molecular Plant, 6(6): 1769-1780 DOI:10.1093/mp/sst080 |
CUTLER S R, RODRIGUEZ P L, FINKELSTEIN R R et al, 2010. Abscisic acid: emergence of a core signaling network. Annual Review of Plant Biology, 61: 651-679 DOI:10.1146/annurev-arplant-042809-112122 |
DRIEDONKS N, XU J M, PETERS J L et al, 2015. Multi-level interactions between heat shock factors, heat shock proteins, and the redox system regulate acclimation to heat. Frontiers in Plant Science, 6: 999 |
DU H, WANG N L, CUI F et al, 2010. Characterization of the β-carotene hydroxylase gene DSM2 conferring drought and oxidative stress resistance by increasing xanthophylls and abscisic acid synthesis in rice. Plant Physiology, 154(3): 1304-1318 DOI:10.1104/pp.110.163741 |
FALCONE D L, OGAS J P, SOMERVILLE C R, 2004. Regulation of membrane fatty acid composition by temperature in mutants of Arabidopsis with alterations in membrane lipid composition. BMC Plant Biology, 4(4): 17 |
FARIDUDDIN Q, KHALIL R R A E, MIR B A et al, 2013. 24-Epibrassinolide regulates photosynthesis, antioxidant enzyme activities and proline content of Cucumis sativus under salt and/or copper stress. Environmental Monitoring and Assessment, 185(9): 7845-7856 DOI:10.1007/s10661-013-3139-x |
GUPTA V, KUMAR M, BRAHMBHATT H et al, 2011. Simultaneous determination of different endogenetic plant growth regulators in common green seaweeds using dispersive liquid-liquid microextraction method. Plant Physiology and Biochemistry, 49(11): 1259-1263 DOI:10.1016/j.plaphy.2011.08.004 |
IRANI S, TODD C D, 2018. Exogenous allantoin increases Arabidopsis seedlings tolerance to NaCl stress and regulates expression of oxidative stress response genes. Journal of Plant Physiology, 221: 43-50 DOI:10.1016/j.jplph.2017.11.011 |
KOBAYASHI Y, ANDO H, HANAOKA M et al, 2016. Abscisic acid participates in the control of cell cycle initiation through heme homeostasis in the unicellular red alga Cyanidioschyzon merolae. Plant and Cell Physiology, 57(5): 953-960 DOI:10.1093/pcp/pcw054 |
LANDS W E, 1960. Metabolism of glycerolipids. Ⅱ. The enzymatic acylation of lysolecithin. The Journal of Biological Chemistry, 235(8): 2233-2237 DOI:10.1016/S0021-9258(18)64604-6 |
LI G Y, ZHANG C X, ZHANG G H et al, 2020a. Abscisic acid negatively modulates heat tolerance in rolled leaf rice by increasing leaf temperature and regulating energy homeostasis. Rice, 13(1): 18 DOI:10.1186/s12284-020-00379-3 |
LI H, LIU S S, YI C Y et al, 2014. Hydrogen peroxide mediates abscisic acid-induced HSP70 accumulation and heat tolerance in grafted cucumber plants. Plant Cell & Environment, 37(12): 2768-2780 |
LI X, WU Z, XIAO S et al, 2020b. Characterization of abscisic acid (ABA) receptors and analysis of genes that regulate rutin biosynthesis in response to ABA in Fagopyrum tataricum. Plant Physiology and Biochemistry, 157: 432-440 DOI:10.1016/j.plaphy.2020.11.005 |
LIVAK K J, SCHMITTGEN T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods, 25(4): 402-408 DOI:10.1006/meth.2001.1262 |
MA X F, WANG W M, BITTNER F et al, 2016. Dual and opposing roles of xanthine dehydrogenase in defense-associated reactive oxygen species metabolism in Arabidopsis. The Plant Cell, 28(5): 1108-1126 DOI:10.1105/tpc.15.00880 |
MURAKAMI Y, TSUYAMA M, KOBAYASHI Y et al, 2000. Trienoic fatty acids and plant tolerance of high temperature. Science, 287(5452): 476-479 DOI:10.1126/science.287.5452.476 |
MURCIA G, FONTANA A, PONTIN M et al, 2017. ABA and GA3 regulate the synthesis of primary and secondary metabolites related to alleviation from biotic and abiotic stresses in grapevine. Phytochemistry, 135: 34-52 DOI:10.1016/j.phytochem.2016.12.007 |
NAKABAYASHI R, YONEKURA-SAKAKIBARA K, URANO K et al, 2015. Enhancement of oxidative and drought tolerance in Arabidopsis by overaccumulation of antioxidant flavonoids. The Plant Journal, 77(3): 367-379 |
PINHEIRO S S, DE MORAIS CARDOSO L, ANUNCIAÇÃO P C et al, 2021. Water stress increased the flavonoid content in tannin-free sorghum grains. Journal of Food Composition and Analysis, 100: 103892 DOI:10.1016/j.jfca.2021.103892 |
REZAUL I M, FENG B H, CHEN T T et al, 2019. Abscisic acid prevents pollen abortion under high-temperature stress by mediating sugar metabolism in rice spikelets. Physiologia Plantarum, 165(3): 644-663 DOI:10.1111/ppl.12759 |
SILVA-NAVAS J, MORENO-RISUENO M A, MANZANO C et al, 2016. Flavonols mediate root phototropism and growth through regulation of proliferation-to-differentiation transition. The Plant Cell, 28(6): 1372-1387 DOI:10.1105/tpc.15.00857 |
SIMONS K, SAMPAIO J L, 2011. Membrane organization and lipid rafts. Cold Spring Harbor Perspectives in Biology, 3(10): a004697 |
STRACKE R, FAVORY J J, GRUBER H et al, 2010. The Arabidopsis bZIP transcription factor HY5 regulates expression of the PFG1/MYB12 gene in response to light and ultraviolet-B radiation. Plant, Cell & Environment, 33(1): 88-103 |
SUN P P, MAO Y X, LI G Y et al, 2015. Comparative transcriptome profiling of Pyropia yezoensis (Ueda) M.S. Hwang & H.G. Choi in response to temperature stresses. BMC Genomics, 16(1): 463 DOI:10.1186/s12864-015-1586-1 |
SUZUKI T, MORISHITA T, KIM S J et al, 2015. Physiological roles of rutin in the buckwheat plant. Japan Agricultural Research Quarterly, 49(1): 37-43 DOI:10.6090/jarq.49.37 |
TAYLOR N, COWAN K, 2001. Plant hormone homeostasis and the control of avocado fruit size. Plant Growth Regulation, 35(3): 247-255 DOI:10.1023/A:1014463300850 |
WANG J, QIAN J, YAO L Y et al, 2015. Enhanced production of flavonoids by methyl jasmonate elicitation in cell suspension culture of Hypericum perforatum. Bioresources and Bioprocessing, 2(1): 5 DOI:10.1186/s40643-014-0033-5 |
WATANABE S, KOUNOSU Y, SHIMADA H et al, 2014a. Arabidopsis xanthine dehydrogenase mutants defective in purine degradation show a compromised protective response to drought and oxidative stress. Plant Biotechnology, 31(2): 173-178 DOI:10.5511/plantbiotechnology.14.0117a |
WATANABE S, MATSUMOTO M, HAKOMORI Y et al, 2014b. The purine metabolite allantoin enhances abiotic stress tolerance through synergistic activation of abscisic acid metabolism. Plant, Cell & Environment, 37(4): 1022-1036 |
XIE Y D, SUN G C, WANG L M et al, 2018. Effects of spraying abscisic acid on photosynthetic physiology of lettuce seedlings under salt stress. IOP Conference Series: Earth and Environmental Science, 199(5): 052011 DOI:10.1088/1755-1315/199/5/052011/pdf |
YALÇIN S, OKUDAN E Ş, KARAKAŞ Ö et al, 2019. Identification and quantification of some phytohormones in seaweeds using UPLC-MS/MS. Journal of Liquid Chromatography & Related Technologies, 42(15/16): 475-484 |
YAMAMOTO L Y, DE ASSIS A M, ROBERTO S R et al, 2015. Application of abscisic acid (S-ABA) to cv. Isabel grapes (Vitis vinifera × Vitis labrusca) for color improvement: effects on color, phenolic composition and antioxidant capacity of their grape juice. Food Research International, 77: 572-583 DOI:10.1016/j.foodres.2015.10.019 |
YANG R, LIU W, ZHANG X L et al, 2013. Sequences of Mn-sod gene from Pyropia haitanensis (Bangiales, Rhodophyta) and its expression under heat shock. Botanica Marina, 56(3): 249-259 |
ZHANG D P, WU Z Y, LI X Y et al, 2002. Purification and identification of a 42-kilodalton abscisic acid-specific-binding protein from epidermis of broad bean leaves. Plant Physiology, 128(2): 714-725 DOI:10.1104/pp.010531 |
ZHENG G W, TIAN B, ZHANG F J et al, 2011. Plant adaptation to frequent alterations between high and low temperatures: remodelling of membrane lipids and maintenance of unsaturation levels. Plant, Cell & Environment, 34(9): 1431-1442 |
ZHOU Y L, SUN X D, YANG Y Q et al, 2016. Expression of Stipa purpurea SpCIPK26 in Arabidopsis thaliana enhances salt and drought tolerance and regulates abscisic acid signaling. International Journal of Molecular Sciences, 17(6): 966 DOI:10.3390/ijms17060966 |
 2022, Vol. 53
2022, Vol. 53


