
中国海洋湖沼学会主办。
文章信息
- 陈鹭真. 2022.
- CHEN Lu-Zhen. 2022.
- 地表高程监测在滨海蓝碳碳收支评估中的应用
- APPLICATION OF SURFACE ELEVATION TABLE FOR CARBON BUDGET ASSESSMENTS IN COASTAL BLUE CARBON ECOSYSTEMS
- 海洋与湖沼, 53(2): 261-268
- Oceanologia et Limnologia Sinica, 53(2): 261-268.
- http://dx.doi.org/10.11693/hyhz20210800177
文章历史
-
收稿日期:2021-08-09
收修改稿日期:2021-10-11
红树林、盐沼和海草床等滨海湿地生态系统是地球上最密集的碳汇之一。它们能够捕获和储存大量有机碳, 并永久埋藏在沉积物中。这部分固定下来的碳被称为滨海湿地蓝碳或海岸带蓝碳, 即狭义的蓝碳(blue carbon)。虽然, 滨海湿地仅占地球表面积的0.1%, 但其储碳量达到海洋储碳量的50% (Nellemann et al, 2009)。由于强大的储碳和固碳能力, 滨海湿地对有效固定人为排放的二氧化碳(CO2)和减缓气候变暖具有重要作用。
除植物光合固碳外, 滨海湿地生态系统捕获和埋藏的碳远高于陆地生态系统。沉积物是滨海湿地碳储量的主要贡献者, 生态系统总碳的50%~90%存储于地下沉积物中, 且能长时间封存(Khan et al, 2007; Donato et al, 2011)。沉积物碳埋藏速率(carbon accumulation rate, CAR)可衡量沉积物碳库的变化, 是滨海湿地固碳能力评估的关键指标(Rogers et al, 2019)。在滨海湿地沉积物测定中, 通常可应用210Pb-137Cs同位素测年获得百年尺度的沉积速率、或应用水平标志层和地表高程-标志层监测(surface elevation table-marker horizon, 简称SET-MH或SET)等方法获得沉积速率的年际变化。将沉积速率乘以沉积物碳密度, 可获得沉积物CAR。目前, SET体系是红树林和盐沼CAR计量中广泛应用的连续监测方法, 在全球范围已建立SET监测网络。我国近海多为强潮海区, 河流沉积物入海通量大(Milliman et al, 1983), 沉积物的再悬浮和沉降频繁、沉积速率较高, 引起地貌的显著变化, 形成我国滨海湿地独特的沉积物碳储量快速增加的特征。滨海湿地植被加快了沉积速率(张乔民等, 1996; 陈一宁等, 2020)。我国海岸线存在淤涨和侵蚀两种地貌特征, 并受到人类活动的干扰, 导致了河流入海的沉积物增多(Chu et al, 2009)。因此, 亟需对CAR开展动态监测, 获得沉积物碳库的变量(增量或减量)。本文将着重介绍SET法在滨海湿地CAR监测中及其在蓝碳碳收支评估中的应用, 为我国滨海湿地蓝碳生态系统的固碳能力评估提供参考。
1 滨海蓝碳沉积物碳埋藏特征与陆地生态系统一样, 滨海湿地植被光合作用将CO2转换成有机碳, 并可在相对较短的时间内(几年到几十年)在植物活体中保存下来; 但是, 地表捕获和固定的碳可长时间封存(封存时间达几百到上千年)在沉积物中, 因此, 沉积物成为滨海湿地巨大的碳库(Duarte et al, 2005; Lo Iacono et al, 2008)。这与滨海湿地沉积物的低氧生境和有机质陆源输入丰富等两个特征有关。
1.1 低氧和高沉积环境减缓有机质分解与陆地生态系统相似, 滨海湿地沉积物的碳来源于凋落物分解或埋藏、细根周转及其埋藏。由于陆地土壤富含氧气, 好氧微生物将土壤中的有机质氧化并以CO2等形式返还到大气中(Schlesinger et al, 2001); 但滨海湿地过饱和的水环境使沉积物保持低氧状态(或几乎无氧), 沉积物中的有机质难以分解, 可保持垂直方向上的固碳。因此, 滨海湿地沉积物的低氧环境大大降低了有机质的分解速率, 使大量细根还未分解就被埋藏下来、形成泥炭或富碳的有机土(有机质含量超过20%), 其有机质保存率高、矿化速率低。在一些人为扰动小的地区, 滨海湿地甚至拥有10 cm至3 m深的有机土, 碳储量远高于陆地森林(Howard et al, 2014)。在伯利兹的一处红树林, 沉积物深度达10 m、历史可追溯至7 000 a前(McKee et al, 2007; Lo Iacono et al, 2008)。新英格兰北部的盐沼形成了具有4 000 a历史、3~5 m厚的沉积物(Johnson et al, 2007)。由于我国海岸带地区人为扰动严重, 滨海湿地沉积物保持较高的碳埋藏速率(Chen et al, 2021a)。
1.2 地表径流和潮汐的横向输入提供大量外源碳地表径流和潮汐作用带来外源碳的横向输入, 是滨海湿地有别于陆地生态系统的最显著特征。通过地表沉积等物理过程, 被固定和埋藏到沉积物中的有机碳是滨海湿地的碳来源之一。滨海湿地植被和气生根等地上结构通过衰减水动力而捕获细颗粒泥沙, 提高碳累积速率(Furukawa et al, 1996)。红树林的气生根具有潜在的降低水流速度、促进沉积的作用(Young et al, 1996); 有支柱根生长的区域, 沉积速率高达11.0 mm/a (Krauss et al, 2003)。热带地区的红树林凋落物量高达44.4~66.2 Mg/(ha·a); 由潮汐从周边区域带来的凋落物量超过系统内年均凋落物量(Sukardjo et al, 2013)。这些过程为红树林、盐沼和海草床的沉积物贡献了大量的有机碳。当然, 在侵蚀地貌中, 沉积物中的有机碳可随着沉积物侵蚀流失而被不断释放。
基于以上两个因素, 滨海湿地比陆地生态系统具备更强的固碳能力。CAR可衡量单位时间和单位面积内有机碳被捕获和埋藏到沉积物中的速率, 是评估滨海湿地固碳能力的关键参数。它还受到潮汐淹水周期、盐度、养分状况和沉积物输运等因素的共同影响。
2 沉积物碳埋藏速率测定方法受潮汐等潮间带恶劣环境的影响, 滨海湿地沉积物CAR的测定方法较为特殊。目前常用测定沉积速率的方法主要有210Pb-137Cs同位素测年法、水平标志层法和SET法等。用沉积速率乘以表层沉积物的碳密度, 可获得CAR。
2.1 210Pb-137Cs同位素测年法210Pb过剩法和137Cs法是百年时间尺度内被广泛应用的年代学测定和沉积速率测定的经典方法(Goldberg, 1963; Ritchie et al, 1990; Appleby et al, 1992)。其原理是: 地表中过剩210Pb主要来自大气沉降的210Pb, 强颗粒活性使过剩的210Pb进入沉积物后不再迁移; 若沉积环境稳定, 沉积物中210Pb随时间的延长(或深度变化)将按指数规律衰减, 基于此分布特征计算百年尺度的平均沉积速率, 获得沉积物沉积的年代(Sanchez-Cabeza et al, 2012)。210Pb测年可获得某一地层的相对年龄(相对于表层的年龄)。137Cs测年是基于人类活动释放到大气中的137Cs在1963年达到峰值, 由此特征确定137Cs最大值所在的地层为1963年。在一些地区也可观测到1986年切尔诺贝利事件导致的次级峰值。137Cs测年是绝对测年法, 可与210Pb测年结合, 获得比较可靠的年代学。在密西西比三角洲、墨西哥湾和长江三角洲等滨海湿地都有相关测定(DeLaune et al, 1989; Milan et al, 1995; 张乔民等, 1996; Comeaux et al, 2012; Sun et al, 2019)。该方法获得的沉积速率是过去百年尺度的均值; 若要获得更短时间尺度的速率, 则需要定位观测的手段。
2.2 水平标志层法水平标志层法是比较直观和准确的测定垂直淤积的方法。它是在沉积物表面铺一层细沙、砖屑、白土或者长石粉等人工标记物。随着时间推移, 人工标记层以上到地表的新沉积物厚度(精度为毫米, mm)为标记时间段内的垂直沉积(vertical accretion, VA)速率(Woodroffe, 1992; Callaway et al, 2013)。它用于计量短时间尺度(月和年的尺度)的沉积速率。在潮间带, 新淤积的沉积物会通过重力作用而发生紧实和体积压缩, 即浅部压实作用, 进而使地表高程的变化低于垂直淤积的变化。应用该方法获得的垂直沉积速率计算CAR, 其不足之处是未考虑到压实作用, 当它乘以表层沉积物碳密度(压实后的碳密度)后, 将高估沉积物的碳埋藏量。
2.3 地表高程-标志层监测体系(SET-MH或SET)自1993年起, 美国地质调查局(United States Geological Survey)建立了一种可监测年际间地表高程变化和垂直沉积速率的监测系统, 即地面高程-水平标志层监测系统(Lynch et al, 2015)。该系统分辨率高, 可测定地表高程变化(surface elevation change, SEC)和垂直沉积(vertical accretion, VA), 计算沉积物的浅层沉降(shallow subsidence, SS)或膨胀等浅层沉积物的变化, 测定精度达到±1.3 mm (Cahoon et al, 1995, 2003)。该系统可在多地布设固定标志桩。在一些研究中, 还可应用浅层SET监测根系生长所导致的根区膨胀, 分析导致高程变化的原因(林秋莲, 2019)。SET-MH系统主要包括两个部分, 其中SET用于监测高程的变化, MH用于监测表层垂直沉积速率, 其工作原理如图 1所示。
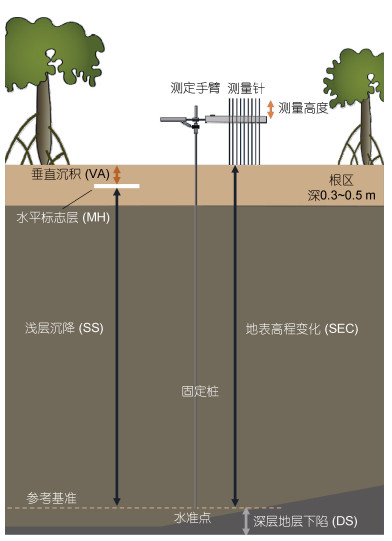 |
| 图 1 地表高程-水平标志层法示意图 Fig. 1 Methods of surface elevation table vs marker horizon (SET-MH) |
SET系统由固定桩和测量手臂组成。固定桩是一个连续到水准点的不锈钢杆, 在安装时需直达地下岩石层的水准点, 使之不能继续下推为宜。固定桩的顶部突出地表, 测定时连接测定手臂(即高程监测仪)。测定手臂上配有测量针。测定时测量针垂直向下接触沉积物表面。计量针顶端到测定手臂的高度, 即为测定时的地表高程。前后两次测定测量针的高度差值即为高程的变化值(surface elevation change, SEC), 由此计算出单位时间内地表高程变化速率(SEC rate)。测定手臂可以转换不同方向, 每个方向数据作为水平样, 计算该固定桩的SEC。垂直淤积的速率由水平标志层(marker horizon, MH)获得。在监测的区域内布设水平标志层的小样方, 在样方内添加一层约1 cm厚的人工标记层, 一般为沙子、砖屑或长石粉, 间隔一定时间后切取标记层的沉积物样品, 测定标记层以上的沉积物厚度, 即为该时间段中垂直沉积(vertical accretion, VA), 由此计算单位时间内的垂直沉积速率(VA rate)。将这两个方法结合起来, 可以同时测定地表高程变化速率(SEC rate)和表层垂直沉积速率; 两者的差值就是浅层沉降速率(shallow subsidence rate, SS rate)。
在滨海湿地生态系统中, 表层沉积物的垂直沉积与浅层沉降共同作用下引起地表高程变化。该监测体系可获得单位时间的SEC。在淤积型海岸, 通过单位时间的高程变量SEC和表层沉积物碳密度(一般为沉积物柱状样0~10 cm层的碳密度, 即容重和沉积物碳百分含量的乘积), 可获得年际尺度的沉积物碳埋藏速率CAR (Lovelock et al, 2014; Chen et al, 2021b; Cormier et al, 2021)。在侵蚀性海岸, 这一方法还可以确定每年沉积物的碳损失速率。通过对固定桩的长时间多次重复测定, 可准确计算特定区域沉积物碳库的增量或减量。
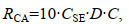 (1)
(1)公式(1)中, RCA为碳埋藏速率[单位: g/(m2·a)], D为柱状样表层沉积物(通常为0~10 cm)的容重(单位: g/cm3), C为沉积物碳的百分含量(单位: %), CSE为地表高程变化率(单位: mm/a)。
3 SET监测体系的全球应用滨海湿地在减缓全球气候变化中扮演着重要角色。但由于测定方法不同、SET监测站点稀疏和观测体系不完善等原因, 沉积速率的数据来源多样、存在较大的变异, 由此计算得到的碳埋藏率也存在很大的不确定性。我国滨海湿地现有的碳埋藏量和固碳速率估算多来源于历史数据整合。例如, 周晨昊等(2015)应用整合分析估算我国滨海湿地每年通过沉积物埋藏所固定的碳为0.349~0.835 Tg/a; 而Meng等(2019)整合已有数据, 获得我国红树林、盐沼和海草床三类滨海湿地的碳埋藏速率为0.84 Tg/a; 王法明等(2021)应用全球滨海湿地CAR均值估算了我国滨海湿地的碳埋藏速率为0.973 Tg/a。因此, 需要建立统一的、可计量的监测方式, 准确获得我国蓝碳碳收支年际变化的高精度数据。
由于SET体系在监测滨海湿地地表高程和沉积物碳埋藏速率的优势, 它已广泛应用于美国、澳大利亚、英国、法国、新加坡、马来西亚、印度尼西亚等国家的数百个红树林和盐沼生态系统中。2000年以来, 美国NOAA资助了其东部、西部和墨西哥湾等海区187个盐沼湿地SET监测站点(Cressman, 2020); 美国USGS在美洲大陆和太平洋地区建立了300多个SET站点(Krauss et al, 2014; Lovelock et al, 2015)。澳大利亚、新西兰和东南亚等地也陆续建立一系列SET站点(Rogers et al, 2019)。因此, SET监测站点已分布至全球热带至温带的滨海湿地。目前, SET监测体系已经广泛应用于滨海湿地应对海平面上升的脆弱性评估(Lovelock et al, 2015), 并应用在与滨海湿地海平面上升有关的碳汇评估中。近年来, 我国滨海湿地也逐步建立约30个SET监测站点共200多个监测桩, 形成监测网络(仇晴川等, 2009; 陈一宁等, 2020; Chen et al, 2021a); 监测范围北起辽河河口、南到海南文昌, 西达广西北仑河口, 覆盖红树林、盐沼和海草床等三大滨海湿地生态系统(图 2)。然而, 我国滨海湿地的SET站点数量仍然不足, 难以覆盖到所有滨海湿地分布的海岸线。未来, 在我国沿海布设更多、更为密集的SET监测体系, 有望构建滨海湿地CAR数据库, 为蓝碳生态系统的增汇能力评价提供统一的实测数据, 减少不同测定方法带来的误差。
 |
| 图 2 我国滨海湿地的SET监测站点 Fig. 2 Map of the SET-MH sites in the coastal wetlands of China |
2014年, 全球蓝碳倡议科学工作组(Blue Carbon Initiative, BCI)编著的符合IPCC (联合国政府间气候变化专门委员会)最高精度等级——等级3的滨海湿地蓝碳碳汇计量手册, 即《滨海蓝碳——红树林、盐沼和海草床碳储量和碳排放因子评估方法》(Howard et al, 2014; Howard, 2018), 已广泛应用于全球滨海湿地。该手册将储量差分法用于评估滨海蓝碳生态系统的碳库变化。储量差分法是通过测定两个不同时间点的各个碳库碳储量的差异, 来计量滨海湿地的增汇速率(Kauffman et al, 2014)。
储量差分法的原理是跟踪观测两个时间点生态系统各个碳库的碳储量变化值, 获得生态系统的碳库变量(增量或减量)。在第一次编制碳收支清单时, 需建立固定样方, 随后在固定样方中对地上的活生物量、死生物量、地下生物量以及沉积物等各个碳库的碳储量进行监测。沉积物的碳储量变化是监测技术的核心和难点, 在此专门阐述该方法。由于滨海湿地沉积物碳库的变化非常缓慢, 如果没有发生土地利用变化或生态系统类型的改变, 沉积物地表高程的变化速率将以毫米级的速率逐年变化(Krauss et al, 2014)。因此, 在沉积物碳库储量差分法的计算中, 可利用SET法获得高分辨率的SEC, 进而获得沉积物体积的变化率。如图 3所示, 在侵蚀海岸, 从T1到T2两个时间点之间发生地表侵蚀, 沉积物中的碳将以CO2的形式释放到大气中; T1和T2的地表高程变化量SEC与表层沉积物有机碳密度(soil organic carbon, SOC)相乘可计算出沉积物碳库中碳储量的减量。相反地, 在淤涨海岸, 从T1到T2发生沉积物淤积, 增加的沉积物碳可从地表高程增量和表层沉积物SOC计算得到, 即为沉积物的碳埋藏量。SET固定桩的水准点是该方法的稳定参考基准, 可保证在不同测定时间地表的稳定性。
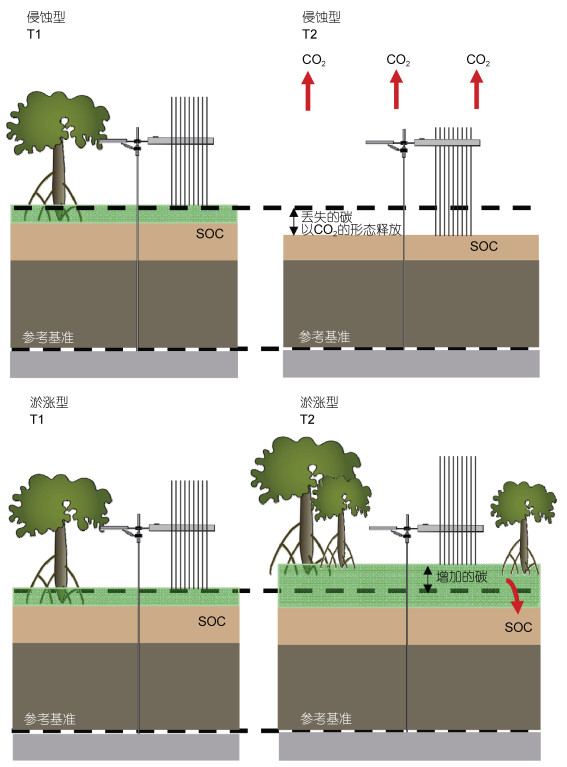 |
| 图 3 滨海湿地生态系统地表的侵蚀和淤涨对沉积物碳收支的影响 Fig. 3 The influence of erosion and accretion to sediment carbon budget in coastal wetland ecosystems 注: T1和T2分别表示2个时间点; SOC: soil organic carbon, 沉积物有机碳密度 |
储量差分法在红树林碳收支清单编制中, 特别是在计量沉积物碳库的增量时, 已得到许多应用(Kauffman et al, 2014; Chen et al, 2021b)。在应用时, 每个监测时间(一般为每年或者每半年)获得每个固定桩的平均测量针高度, 计算出测定时间段的地表高程变化SEC, 通过柱状样表层沉积物的容重, 计算得到随着淤积过程在这个时间段中额外增加的碳, 并通过面积上推到区域尺度, 获得区域的碳增量(表 1)。在我国, 该方法已应用在深圳福田红树林沉积物碳库增量的监测中(Chen et al, 2021b)。Chen等(2021b)监测了由于高大乔木疏伐、林下老鼠簕灌草丛爆发性生长后研究区域的地表高程变化, 并发现由于老鼠簕灌丛在疏伐区暴发后加速沉积物淤积、进而加剧沉积物碳库的增多; 在SET监测区内, 沉积物SEC由疏伐前的25.1 mm/a显著升高为疏伐后的46.5 mm/a, 应用储量差分法计量出每年疏伐区域沉积物碳埋藏速率提升至49.9 Mg/ha。
| 固定桩 | 每年平均测量针高度/mm | T0~T10时间段SEC /mm | T0~T10的时间/a | T10时沉积物柱状样表层10cm容重/(g/cm3) | 碳含量/% | T10时随淤积而额外增加的沉积物碳/(g/cm2) | 上推到区域尺度碳增量/(Mg/ha) | ||||
| T0 | T1 | T2 | …… | T10 | |||||||
| 1 | 10.0 | 17.1 | 25.4 | …… | 98.5 | 88.5 | 10 | 0.195 | 10 | 1.726 | 172.6 |
| 2 | … | ||||||||||
| 注: SEC: surface elevation change, 可测定地表高程变化 | |||||||||||
由于SET监测体系可克服潮间带的恶劣生境, 开展高密度站点的高精度反复测量, 并获得与测定时间相匹配的地表高程变化, 已经在全球滨海湿地的垂直沉积速率和地表高程变化的研究中得到广泛应用, 成为红树林和盐沼生态系统地表高程变化的标准方法; 也成为衡量滨海湿地地表高程变化速率、沉积物埋藏速率和碳库增量的科学方法。
5 展望近年来, 我国不断完善自然资源的调查和监测体系, 实施红树林、盐沼和海草床等典型蓝碳生态系统碳储量的调查评估。随着对蓝碳生态系统的固碳和减排功能认识的不断深入, 滨海湿地缓解气候变暖的作用得到广泛认可。因此, 亟需对滨海湿地生态系统的固碳能力进行精确计量。SET监测体系符合IPCC最高精度要求, 并已在全球许多滨海湿地沉积物碳埋藏和碳汇监测中广泛应用。我国的滨海湿地已初步建立SET监测体系, 建议未来进一步加密监测站点, 特别是在重要的河口湿地和地貌变化迅速的滨海湿地加密监测, 形成对我国滨海湿地类型的全面监测。通过重复测定, 有望获得翔实的长时序CAR实测数据, 计算准确的沉积物碳库增量, 编制滨海蓝碳的碳收支清单。
红树林、盐沼和海草床已纳入IPCC国家温室气体清单指南, 并被美国和澳大利亚等国家采用。红树林也成为联合国气候变化框架公约(United Nations Framework Convention on Climate Change, UNFCCC)认可的、在清洁发展机制框架下可进行碳证贸易的碳汇林。目前, 全球已经通过建立蓝碳碳汇交易平台、开展蓝碳交易。未来, 蓝碳还将作为经济杠杆, 推动海洋生态系统保护和修复, 成为自然保护的潜在融资机制。滨海蓝碳碳收支清单编制中, 对计量方法的需求也是建立全国蓝碳市场的共同需求。因此, SET监测体系将为科学家、自然保护工作者、社会团体和蓝碳市场提供标准化的计量方案, 为应对气候变化行动计划提供理论依据, 服务于我国碳中和战略。
致谢 自然资源部第二海洋研究所陈一宁研究员在本文撰写中提供了宝贵建议。厦门大学张家林、林秋莲和顾肖璇协助文字工作。特此感谢!
HOWARD J, 2018. 滨海蓝碳: 红树林、盐沼、海草床碳储量和碳排放因子评估方法[M]. 陈鹭真, 卢伟志, 林光辉, 译. 厦门: 厦门大学出版社.
|
王法明, 唐剑武, 叶思源, 等, 2021. 中国滨海湿地的蓝色碳汇功能及碳中和对策. 中国科学院院刊, 36(3): 241-251 |
仇晴川, 张乔民, 2009. 湿地地表高程变化的测量与研究. 海洋地质动态, 25(11): 15-20 DOI:10.3969/j.issn.1009-2722.2009.11.003 |
陈一宁, 陈鹭真, 蔡廷禄, 等, 2020. 滨海湿地生物地貌学进展及在生态修复中的应用展望. 海洋与湖沼, 51(5): 1055-1065 |
张乔民, 温孝胜, 宋朝景, 等, 1996. 红树林潮滩沉积速率测量与研究. 热带海洋, 15(4): 57-62 |
林秋莲, 2019. 红树植物地上/地下根系对滩面高程的影响[J]. 厦门: 厦门大学硕士学位论文: 1-86.
|
周晨昊, 毛覃愉, 徐晓, 等, 2016. 中国海岸带蓝碳生态系统碳汇潜力的初步分析. 中国科学: 生命科学, 46(4): 475-486 |
APPLEBY P G, OLDFIELD F, 1992. Application of lead-210 to sedimentation studies [M] // Ivanovich M, Harmon R S eds. Uranium Series Disequilibrium: Application to Earth, Marine and Environmental Sciences. Oxford: Clarendon Press: 731-778.
|
CAHOON D R, HENSEL P, RYBCZYK J, et al, 2003. Mass tree mortality leads to mangrove peat collapse at Bay Islands, Honduras after hurricane mitch. Journal of Ecology, 91(6): 1093-1105 DOI:10.1046/j.1365-2745.2003.00841.x |
CAHOON D R, REED D J, DAY J W, 1995. Estimating shallow subsidence in microtidal salt marshes of the southeastern United States: Kaye and Barghoorn revisited. Marine Geology, 128(1-2): 1-9 DOI:10.1016/0025-3227(95)00087-F |
CALLAWAY J C, CAHOON D R, LYNCH J C, 2013. The surface elevation table-marker horizon method for measuring wetland accretion and elevation dynamics [M] // DELAUNE R D, REDDY K R, RICHARDSON C J, et al. Methods in Biogeochemistry of Wetlands. Madison: Soil Science Society of America: 901-918.
|
CHEN L Z, CHEN Y N, ZHANG Y H, et al, 2021a. Mangrove carbon sequestration and sediment deposition changes under cordgrass invasion [M] // Sidik F, Friess D A eds. Dynamic Sedimentary Environments of Mangrove Coasts. Amsterdam: Elsevier: 473-509.
|
CHEN L Z, LIN Q L, KRAUSS K W, et al, 2021b. Forest thinning in the seaward fringe speeds up surface elevation increment and carbon accumulation in managed mangrove forests. Journal of Applied Ecology, 58(9): 1899-1909 DOI:10.1111/1365-2664.13939 |
CHU Z X, ZHAI S K, LU X X, et al, 2009. A quantitative assessment of human impacts on decrease in sediment flux from major Chinese rivers entering the western Pacific Ocean. Geophysical Research Letters, 36(19): L19603 DOI:10.1029/2009GL039513 |
COMEAUX R S, ALLISON M A, BIANCHI T S, 2012. Mangrove expansion in the gulf of Mexico with climate change: implications for wetland health and resistance to rising sea levels. Estuarine, Coastal and Shelf Science, 96: 81-95 DOI:10.1016/j.ecss.2011.10.003 |
CORMIER N, KRAUSS K W, DEMOPOULOS A W J, et al, 2021. Potential for carbon and nitrogen sequestration by restoring tidal connectivity and enhancing surface elevations in denuded and degraded south Florida mangrove ecosystems [M] // KRAUSS K W, ZHU Z Z, STAGG C L. Wetland Carbon and Environmental Management (in press). Washington: American Geophysical Union.
|
CRESSMAN K, 2020. National synthesis of NERR surface elevation table data. National Estuarine Research Reserve System Science Collaborative [EB/OL]. https://nerrssciencecollaborative.org/resource/national-synthesis-nerr-surface-elevation-table-data.
|
DELAUNE R D, WHITCOMB J H, PATRICK W H, et al, 1989. Accretion and canal impacts in a rapidly subsiding wetland. I. 137Cs and 210Pb techniques. Estuaries, 12(4): 247-259 DOI:10.2307/1351904 |
DONATO D C, KAUFFMAN J B, MURDIYARSO D, et al, 2011. Mangroves among the most carbon-rich forests in the tropics. Nature Geoscience, 4(5): 293-297 DOI:10.1038/ngeo1123 |
DUARTE C M, MIDDELBURG J J, Caraco N, 2005. Major role of marine vegetation on the oceanic carbon cycle. Biogeosciences, 2(1): 1-8 DOI:10.5194/bg-2-1-2005 |
FURUKAWA K, WOLANSKI E, 1996. Sedimentation in mangrove forests. Mangroves and Salt Marshes, 1(1): 3-10 DOI:10.1023/A:1025973426404 |
GOLDBERG E D, 1963. Radioactive Dating. Vienna, Austria: International Atomic Energy Agency, 121-131
|
HOWARD J, HOYT S, ISENSEE K, et al, 2014. Coastal blue carbon: methods for assessing carbon stocks and emissions factors in mangroves, tidal salt marshes, and seagrass meadows. Arlington: International Union for Conservation of Nature
|
JOHNSON B J, MOORE K A, LEHMANN C, et al, 2007. Middle to late Holocene fluctuations of C3 and C4 vegetation in a Northern New England Salt Marsh, Sprague Marsh, Phippsburg Maine. Organic Geochemistry, 38(3): 394-403 DOI:10.1016/j.orggeochem.2006.06.006 |
KAUFFMAN J B, HEIDER C, NORFOLK J, et al, 2014. Carbon stocks of intact mangroves and carbon emissions arising from their conversion in the Dominican Republic. Ecological Applications, 24(3): 518-527 DOI:10.1890/13-0640.1 |
KHAN M N I, SUWA R, HAGIHARA A, 2007. Carbon and nitrogen pools in a mangrove stand of Kandelia obovata (S., L.) Yong: vertical distribution in the soil–vegetation system. Wetlands Ecology and Management, 15(2): 141-153 DOI:10.1007/s11273-006-9020-8 |
KRAUSS K W, ALLEN J A, CAHOON D R, 2003. Differential rates of vertical accretion and elevation change among aerial root types in Micronesian mangrove forests. Estuarine, Coastal and Shelf Science, 56(2): 251-259 DOI:10.1016/S0272-7714(02)00184-1 |
KRAUSS K W, MCKEE K L, Lovelock C E, et al, 2014. How mangrove forests adjust to rising sea level. New Phytologist, 202(1): 19-34 DOI:10.1111/nph.12605 |
LO IACONO C, MATEO M A, GRÀCIA E, et al, 2008. Very high-resolution seismo-acoustic imaging of seagrass meadows (Mediterranean Sea): implications for carbon sink estimates. Geophysical Research Letters, 35(18): L18601 DOI:10.1029/2008GL034773 |
LOVELOCK C E, ADAME M F, BENNION V, et al, 2014. Contemporary rates of carbon sequestration through vertical accretion of sediments in mangrove forests and saltmarshes of south east Queensland, Australia. Estuaries and Coasts, 37(3): 763-771 DOI:10.1007/s12237-013-9702-4 |
LOVELOCK C E, CAHOON D R, FRIESS D A, et al, 2015. The vulnerability of Indo-Pacific mangrove forests to sea-level rise. Nature, 526(7574): 559-563 DOI:10.1038/nature15538 |
LYNCH J C, HENSEL P, CAHOON D R, 2015. The surface elevation table and marker horizon technique: a protocol for monitoring wetland elevation dynamics. Fort Collins: National Park Service |
MCKEE K L, CAHOON D R, FELLER I C, 2007. Caribbean mangroves adjust to rising sea level through biotic controls on change in soil elevation. Global Ecology and Biogeography, 16(5): 545-556 DOI:10.1111/j.1466-8238.2007.00317.x |
MENG W Q, FEAGIN R A, HU B B, et al, 2019. The spatial distribution of blue carbon in the coastal wetlands of China. Estuarine, Coastal and Shelf Science, 222: 13-20 DOI:10.1016/j.ecss.2019.03.010 |
MILAN C S, SWENSON E M, TURNER R E, et al, 1995. Assessment of the 137Cs method for estimating sediment accumulation rates: Louisiana salt marshes. Journal of Coastal Research, 11(2): 296-307 |
MILLIMAN J D, MEADE R H, 1983. World-wide delivery of river sediment to the oceans. Journal of Geology, 91(1): 1-21 DOI:10.1086/628741 |
NELLEMANN C, CORCORAN E, DUARTE C M, et al, 2009. Blue carbon: a rapid response assessment. Arendal: United Nations Environmental Programme |
RITCHIE J C, MCHENRY J R, 1990. Application of radioactive fallout cesium-137 for measuring soil erosion and sediment accumulation rates and patterns: a review. Journal of Environmental Quality, 19(2): 215-233 |
ROGERS K, KELLEWAY J J, SAINTILAN N, et al, 2019. Wetland carbon storage controlled by millennial-scale variation in relative sea-level rise. Nature, 567(7746): 91-95 DOI:10.1038/s41586-019-0951-7 |
SANCHEZ-CABEZA J A, RUIZ-FERNÁNDEZ A C, 2012. 210Pb sediment radiochronology: an integrated formulation and classification of dating models. Geochimica et Cosmochimica Acta, 82: 183-200 DOI:10.1016/j.gca.2010.12.024 |
SCHLESINGER W H, LICHTER J, 2001. Limited carbon storage in soil and litter of experimental forest plots under increased atmospheric CO2. Nature, 411(6836): 466-469 DOI:10.1038/35078060 |
SUKARDJO S, ALONGI D M, KUSMANA C, 2013. Rapid litter production and accumulation in Bornean mangrove forests. Ecosphere, 4(7): 1-7 |
SUN X S, FAN D J, LIU M, et al, 2019. Persistent impact of human activities on trace metals in the Yangtze River Estuary and the East China Sea: evidence from sedimentary records of the last 60 years. Science of the Total Environment, 654: 878-889 DOI:10.1016/j.scitotenv.2018.10.439 |
WOODROFFE C, 1992. Mangrove sediments and geomorphology [M] // ROBERTSON A I, ALONGI D M. Tropical Mangrove Ecosystems. Washington: American Geophysical Union: 7-41.
|
YOUNG B M, HARVEY E L, 1996. A spatial analysis of the relationship between mangrove (Avicennia marina varr. australasica) physiognomy and sediment accretion in the Hauraki Plains, New Zealand. Estuarine, Coastal and Shelf Science, 42(2): 231-246 DOI:10.1006/ecss.1996.0017 |
 2022, Vol. 53
2022, Vol. 53

