中国海洋湖沼学会主办。
文章信息
- 罗畅, 宋国栋, 刘素美. 2022.
- LUO Chang, SONG Guo-Dong, LIU Su-Mei. 2022.
- 基于双还原体系与膜进样质谱快速测定15N加富水样中15NO3-的方法
- DETERMINATION OF 15NO3- IN 15N-ENRICHED WATER SAMPLES BASED ON DOUBLE REDUCTION SYSTEM IN MEMBRANE INJECTION MASS SPECTROMETRY
- 海洋与湖沼, 53(2): 320-329
- Oceanologia et Limnologia Sinica, 53(2): 320-329.
- http://dx.doi.org/10.11693/hyhz20211000237
文章历史
-
收稿日期:2021-10-09
收修改稿日期:2021-12-02
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 山东青岛 266237;
3. 中国海洋大学化学化工学院 山东青岛 266100
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China
氮是影响海洋初级生产乃至引起生态系统改变的关键生源要素(Gruber et al, 2008; Zhang et al, 2020), 具有多种价态和存在形式, 而各种氮形态之间的转化构成了复杂的氮循环(Casciotti, 2016)。硝酸盐(NO3-)是海水溶解无机氮(NH4+, NO2-, NO3-)中含量最丰富的形态, 其参与的海洋氮循环过程主要包括同化吸收(Glibert et al, 1984)、异化硝酸盐还原(包括反硝化、厌氧铵氧化和异化硝酸盐还原为铵, 即DNRA)和硝化过程(Song et al, 2013; Devol, 2015)。硝酸盐主要通过硝化作用产生, 一般分为两个步骤: 第一步NH4+被氧化成NO2-, 第二步NO2-被氧化成NH4+, 每一步都由不同的微生物群落所控制, 但由NH3直接到NO3-完全的硝化途径目前也已经被证实(Daims et al, 2015; van Kessel et al, 2015)。NO3-作为氮循环过程中氧化途径的终点和还原途径的起点, 厘清硝化作用对硝酸盐的供给作用对于研究氮的转化十分重要(Jenkins et al, 1984; Jäntti et al, 2011)。目前测定硝化速率最常用和可靠的方法为15N标记方法, 即采用15NH4+或者15NO2-作为底物进行培养实验, 以产物15NO2-和15NO3-的产率来衡量硝化速率(Jensen et al, 1996; Jäntti et al, 2012; Lin et al, 2021)。因此准确测定15NO2-和15NO3-的含量就成为研究硝化过程的关键。
测定15NO3-的主要方法涵盖早期的蒸馏法和扩散法, 以及目前常用的反硝化细菌法等, 根据操作流程、测试设备等具有不同的方法特点(表 1)。比如, 蒸馏法(Hoering, 1957; Moore, 1974)或扩散法(Brooks et al, 1989)等预处理实验操作繁琐; 硝酸银法(Silva et al, 2000)和反硝化细菌法(Sigman et al, 2001)等测试时间较长; 基于传统的扇区磁质谱同位素比值质谱法(IRMS)尽管测试精度较高, 但测试成本也较高。测定硝化速率的15N加富培养实验一般会产生大量样品, 目前的一些15NO3-分析方法难以在此研究领域普遍推广。
| 方法 | 原理 | 特点 | 参考文献 |
| 蒸馏法 | 锌铜将NO3-还原成NH4+蒸馏收集, 用次溴酸钠转化为N2O或N2 | 操作繁琐, 预处理时间至少1天, 需样品体积至少几十毫升 | Hoering, 1957; Moore, 1974 |
| 扩散法 | 锌铜合金将NO3-还原成NH4+进行扩散分离, 用次溴酸钠转化为N2O或N2 | 氨扩散样品处理需6天时间以上, 所需样品体积 > 40 mL | Brooks et al, 1989 |
| 硝酸银法 | 盐酸洗脱阴离子交换柱硝酸盐, 用Ag2O中和、过滤、冷冻干燥产生无水硝酸银, 燃烧转换成N2 | 前处理复杂至少1天, 试剂消耗大, 分析超30 min/样品, 适用于离子强度低的淡水样品 | Silva et al, 2000 |
| 硝酸银改进法 | 用特定的阴离子交换树脂柱, 减少Ag2O中和剂用量 | 相对节约时间简化操作, 成本高耗时, 适于淡水样品 | Xing et al, 2011 |
| 反硝化细菌法 | 反硝化细菌(N2O还原基因缺陷)将NO3-转化成N2O | 细菌培养至少1周; NO3- < 1 μmol/L时精密度达0.2‰; 主要测定天然水体15NO3- | Sigman et al, 2001 |
| 叠氮法 | 用海绵镉将NO3-还原成NO2-, 再利用叠氮酸醋酸缓冲液将NO2-还原成N2O; 改进法将缓冲液稀释 | 叠氮酸(HN3)有毒性和挥发性, 前处理麻烦, 样品分析时间长(1 000 s/样品), 适用于天然同位素测定 | McIlvin et al, 2005; Tu et al, 2016 |
| 高效阳离子交换法 | 锌将NO3-还原为NH4+, 分析NH4+的15N/14N比值 | 样品体积需15 mL, 但成本高, 测试10 min/样品, 检测限较高, 至少NO3- > 1 μmol/L | Gardner et al, 1995 |
| 反应连续流四极杆质谱技术(RCFQMS) | 利用碘化钾试剂将NO2-还原为N2, 再由质谱仪测定 | 灵敏, 快速地测定15N-NO2-和NO3-, 检测限较高NO2- > 2.17 μmol/L | Russow et al, 1996 |
| 无机氮制备单元与四极质谱仪耦合(SPINMAS) | 用三氯化钒试剂将NO3-转化成NO, 再由质谱仪测定 | 简单省时, 自动化反应装置成本高, 检测限较高NO3- > 0.97 μmol/L | Stange et al, 2007 |
| 基于膜进样质谱的化学还原方法(REOX/MIMS) | 用锌粉将NO3-还原成NH4+, 然后用次溴酸碘溶液将NH4+氧化成N2, 再由膜进样质谱测定 | NO3-检测限低至0.1 μmol/L, 快速简便, 样品体积15~20 mL | Lin et al, 2021 |
| 硝酸盐还原酶与MIMS结合 | 利用沉积物微生物将NO3-还原成N2, 再由膜进样质谱仪测定 | 沉积物微生物培养操作复杂, 培养时间超20 h | Moraes et al, 2019 |
膜进样质谱仪(MIMS)是一种成本较低的用来分析气体同位素的仪器, 目前在氮循环研究中应用越来越广泛。如Groffman等(2006)把MIMS用于沉积物-水体系反硝化速率的直接测定。Yin等(2014)利用KBrO氧化法将15NH4+转化为29N2和30N2, 利用MIMS测定, 并获得15NH4+浓度。Moraes等(2019)结合硝酸盐还原酶和MIMS来研究沉积物中的硝化作用。MIMS可直接测定水中溶解气体和15N加富样品的同位素, 具有快速简便、用样量小、不需要脱气等优点(Kana et al, 1994; 谢成军等, 2020)。虽然MIMS的精密度比IRMS低, 但可以应用于15N加富样品的测定。若用合适的方法将15NO3-转化为MIMS可测定的气体, 将有望实现15N加富水样中15NO3-的快速测定。
氨基磺酸(sulfamic acid, SA)作为一种有效的还原剂, 在酸性条件下可以快速将NO2-转化为N2, 以前常被用于硝酸盐同位素分析前亚硝酸盐干扰的消除(Granger et al, 2009), 反应式为HNO2+(H2N)HSO3 = H2SO4 +N2 + H2O。顺此思路, 只要预先将15NO3-还原为15NO2-, 然后再加入SA发生反应, 由15NO2-提供一个15N, 然后与SA中未经标记的14N反应结合成质量数为29的29N2, 即可实现将15NO3-转化为MIMS可检测的29N2。而利用镉柱将NO3-还原为NO2-是目前国际上测定硝酸盐时最为常用的方法。由此, 建立镉柱与氨基磺酸双还原体系, 将15NO3-转化为29N2, 并结合低成本的膜进样质谱测定29N2, 即可实现15NO3-的快速分析。
本研究基于现有的膜进样质谱仪(MIMS)对29N2和30N2的成功测定(谢成军等, 2020)以及间接测定15NH4+的方法开发(徐颢铭等, 2022), 拟开发基于镉柱与氨基磺酸双还原体系测定15N加富样品中15NO3-含量的方法, 包括优化方法条件(如镉柱的还原效率、SA的浓度、反应体系的酸度和反应时间等), 并实现此方法在石老人沙滩硝化过程研究的初步应用, 可为海洋沉积物硝化等过程研究提供有效的技术支持。
1 材料和方法 1.1 测定15N加富样品中15NO3-的分析步骤测定15NO3-样品的方法基于镉柱与氨基磺酸双还原体系并结合膜进样质谱, 分析测试流程如下(图 1): 取5mL 15N加富培养产生的15NO3-样品, 加入0.1 mL SA试剂混匀并利用高纯He吹扫去除样品中原有的15NO2-, 再加入0.1 mL 1 mol/L的NaOH溶液调节pH; 然后加入等体积的NH4Cl缓冲溶液(pH=8.5), 混匀, 以10 mL/min的流速经镉柱还原为15NO2-, 将流出液接入6 mL Exetainer瓶中装满, 加入0.1 mL SA试剂, 加盖旋紧混匀, 常温反应10 min后用MIMS测定28N2, 29N2和30N2的信号值。15NO3-工作曲线按照上述同样流程操作, 工作曲线可用高纯水或者盐度相近的具有低含量NO3-的陈化海水配制。以Δ29N2/ΣN2为纵轴, 以15NO3-浓度为横轴绘制工作曲线, 然后根据样品的Δ29N2/ΣN2值计算样品中15NO3-浓度。Δ29N2/ΣN2为29N2与总的N2信号值的比值与15NO3-零添加浓度时所测定的29N2与总的N2信号值的比值的差值。样品中15NO2-的含量则通过直接与SA试剂反应转化成29N2利用MIMS进行测定。
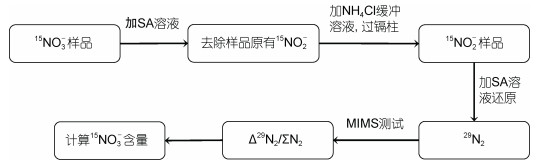 |
| 图 1 基于镉柱与氨基磺酸双还原体系并结合膜进样质谱测定15N加富样品中15NO3-的简单流程 Fig. 1 A simple process for the determination of 15NO3- in 15N-enriched samples based on the double reduction system of cadmium column and aminosulfonic acid combined with membrane injection mass spectrometry |
整个方法涉及多项因素的条件测试, 影响因素和条件设定如表 2, 方法的条件测试具体步骤见1.2~1.5, 方法对样品的应用测试见1.6。
| 影响因素 | 条件设定 |
| 镉柱还原率 | 配制NO3-和NO2-标准溶液0、1、2、5、8、10 μmol/L |
| 试剂SA浓度 | 0.5、1、2、4、8、16、20 mmol/L |
| 试剂SA加入HCl浓度 | 0、0.1、0.2、0.3、0.5、0.6、1 mol/L |
| 试剂SA反应时间 | 10 min、20 min、30 min、1 h、2 h、4 h、6 h、8 h |
| 线性范围 | 配制15NO3-标准溶液0、0.5、1、2、5、10、20、40、60、80、100、150、200 μmol/L |
| 精密度 | 配制15NO3-标准溶液1和10 μmol/L分别取4个平行样 |
| 盐效应 | 盐度为0、5、10、15、20、25、30、35的海水配制10 μmol/L15NO3-标准溶液 |
按照标准方法制备镉还原柱(中华人民共和国国家质量监督检验检疫总局等, 2008)。将处理好的镉粒灌装于长度10 cm内径3 mm的聚四氟乙烯管中, 管上端连接5 mL移液管枪头, 下端连接蠕动泵。配制NO3-和NO2-标准溶液浓度分别为0、1、2、5、8和10 μmol/L, 以10 mL/min流速进行过柱, 过柱后接收至10 mL离心管, 而另一组0、1、2、5、8和10 μmol/L的NO2-标准溶液无需过柱。配制0、0.5、1、2、5、10、20、40、60、80、100、150和200 μmol/L NO3-标准溶液, 均由镉柱还原为NO2-后, 将浓度高于10 μmol/L的溶液按理论稀释为10 μmol/L。配制15NO3-和14NO3-标准溶液浓度分别为0、1、2、5、8和10 μmol/L进行过柱。利用磺胺-萘乙二胺分光光度法测定每条工作曲线的斜率。通过计算NO3-和NO2-工作曲线的斜率的比值来评估镉柱的还原效率。14NO2-过柱的目的在于监测镉柱是否存在过度还原。15NO3-过柱目的为检验其与14NO3-的工作曲线斜率是否存在显著性差异。
1.3 氨基磺酸浓度、试剂酸度及反应时间15NO3-由镉柱还原为15NO2-后需要在酸性条件下再被SA还原为29N2, 为了探究适宜的SA试剂浓度和酸度, 配制SA试剂浓度梯度为0.5、1、2、4、8、16和20 mmol/L, HCl浓度梯度为0、0.1、0.2、0.3、0.5、0.6和1 mol/L的混合溶液, 共计49个全因子组合实验。将10 μmol/L 15NO3-使用液, 以10 mL/min的流速进行过柱, 过柱之后接收至6 mL Exetainer瓶装满。分别加入0.1 mL上述不同酸度和不同浓度的SA溶液, 利用膜进样质谱上机测试28N2、29N2和30N2的信号值, 并转化为Δ29N2/ΣN2。并用分光光度法检测剩余样品中NO3-含量, 来验证15NO2-的转化率。从SA浓度和酸度实验选择优化条件, 确定适宜的SA试剂。
利用10 μmol/L 15NO3-标准溶液, 经镉柱还原后, 再加入SA试剂, 设置时间梯度为10 min、20 min、30 min、1 h、2 h、4 h、6 h、8 h, 然后上机测试Δ29N2/ΣN2, 验证此反应随反应时间变化的关系。
1.4 线性范围、精密度及检测限线性范围: 配制15NO3-浓度为0、0.5、1、2、5、10、20、40、60、80、100、150和200 μmol/L的标准系列, 经镉柱还原后, 将流出液接入6 mL Exetainer瓶中装满, 分别向瓶中加入0.1 mL 1 mol/L HCl和15 mmol/L SA溶液, 加盖旋紧, 用膜进样质谱仪测定29N2。以Δ29N2/ΣN2为纵坐标, 15NO3-标准系列浓度为横坐标绘制工作曲线, 通过线性拟合寻求线性范围。
精密度: 配制1和10 μmol/L 15NO3-标准溶液由镉柱还原后, 收集装满至6 mL Exetainer瓶, 每个浓度的样品取4个平行样; 加入SA试剂0.1 mL上机测定, 计算相对标准偏差。
检测限: 以工作曲线线性回归方程截距标准偏差的3倍除以斜率即检测限。
1.5 盐效应使用陈化海水配制盐度梯度为0、5、10、15、20、25、30、35的海水, 再与NH4Cl缓冲溶液1︰1配制10 μmol/L 15NO3-标准溶液, 经镉柱和SA试剂还原, 上机测试并计算Δ29N2/ΣN2, 计算相对偏差, 验证本方法在已优化的条件下是否存在盐效应。实验所用陈化海水于2016年5月采自南海开阔海域, 盐度为34.5, 经过0.4 μm醋酸纤维滤膜过滤后避光陈化保存待用, NOx-(NO2-+NO3-)的本底小于0.1 μmol/L, NH4+的本底小于0.2 μmol/L, 对于本实验中的工作曲线的配制无显著影响。
1.6 石老人沙滩沉积物中铵氧化与亚硝酸盐氧化速率的测定于2019年5月15日早上08:30 (低潮位时刻)在青岛石老人沙滩(36°5′48″N, 120°28′25″E)获取沉积物柱状样, 将表层10 cm沉积物以2 cm的垂向分辨率现场进行分割装入密封袋中; 获取沉积物的同时获取5 L海水, 与分割好的沉积物一同保存在装有冰盒的保温箱带回实验室进行后续实验。
NH4+潜在氧化速率测定实验: 对每个层次取30 mL沉积物加入气密性培养袋中, 加入280 mL海水, 排尽培养袋中气泡, 加入0.3 mL 100 mmol/L的15NH4Cl溶液, 混匀, 15NH4+最终浓度为100 μmol/L左右, 然后利用10 mL注射器分别在0, 1, 2, 4和7 h抽取培养袋中的样品10 mL, 经0.22 μm聚醚砜滤头过滤后, 冷冻保存。按照1.1中的步骤进行测定。NO2-潜在氧化速率测定实验: 类似NH4+潜在氧化速率测定实验, 将Na15NO2作为所添加的15N标记物进行培养, 然后按照同样的过程进行分析测试。
样品中15NH4+氧化速率以v(15NH4+)表示, 15NO2-氧化速率以v(15NO2-)表示, 计算公式如下:
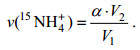 (1)
(1)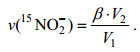 (2)
(2)加富15NH4+的样品, 以产生的15NO2-(或15NO3-)质谱信号值(Δ29N2/ΣN2)带入15NO2-(或15NO3-)工作曲线计算样品中15NO2-(或15NO3-)的浓度, 以15NO2-(或15NO3-)浓度对培养时间进行线性回归, 其斜率即为15NO2-(或15NO3-)产生速率, 记为α; 加富15NO2-的样品, 以产生的15NO3-质谱信号值(Δ29N2/ΣN2)带入15NO3-工作曲线计算样品中15NO3-的浓度, 以15NO3-浓度对培养时间进行线性回归, 其斜率即为15NO3-产生速率, 记为β; 其中培养实验中加入沉积物的体积记为V1, 培养袋中沉积物与海水的混合体积为V2。
2 结果与讨论 2.1 镉柱还原率整个方法基于镉柱-氨基磺酸(SA)双还原体系, 实现由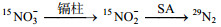
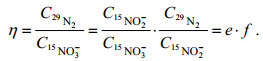 (3)
(3)镉柱还原率e≤1, SA还原效率f≤1, 为实现转化率η越大, 则需e和f越接近1。
镉柱还原效率结果如图 2所示。由图 2b和2c可知, NO2-已过柱和NO2-不过柱的工作曲线斜率之比为0.114/0.115=99%, 可知制备的镉柱不会过度还原; 由图 2a和2b可知, NO3-过柱与NO2-过柱的工作曲线斜率之比为0.108/0.114=95%, 即e=95%, 可知还原效率较好, 满足实验要求; 而浓度高于10 μmol/L的NO3-溶液, 先由镉柱还原后并按理论稀释为10 μmol/L后测定吸光度, 经检验符合工作曲线, 镉柱至少可还原200 μmol/L的NO3-溶液。由图 2 d可知, 14NO3-和15NO3-过柱的斜率均为0.109, 斜率相对偏差 < 0.1%, 可知14NO3-和15NO3-过柱的结果没有显著性差异。
 |
| 图 2 NO3-过柱(a), NO2-过柱(b), NO2-不过柱(c), 14NO3-过柱与15NO3-过柱(d)工作曲线 Fig. 2 Working curves of NO3- passed through the column (a); NO2- passed through the column (b); NO2- not passed through the column (c); 14NO3- and 15NO3- passed through the column (d) |
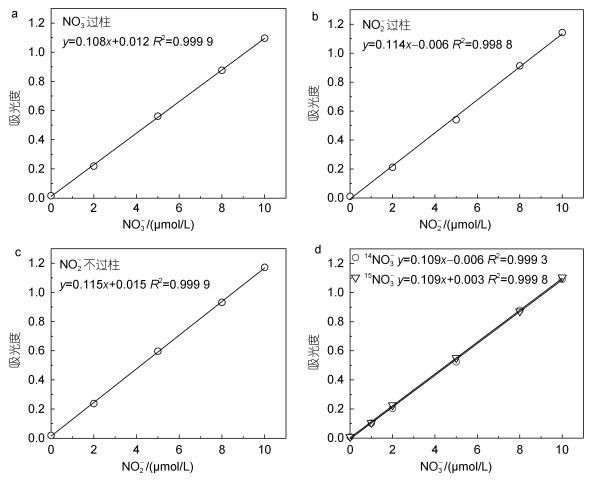
实验控制SA试剂浓度和酸度的影响结果如图 3所示。当HCl浓度低于0.3 mol/L, SA浓度从0 mmol/L逐渐增加至20 mmol/L, Δ29N2/ΣN2数值与本底无明显差异(图 3a), 可知此范围条件下15NO2-基本未被还原; 当HCl浓度高于0.5 mol/L, Δ29N2/ΣN2明显增大, 并随着SA浓度增加而升高(图 3a); HCl浓度为0.6 mol/L和1 mol/L且SA浓度大于8 mmol/L, Δ29N2/ΣN2数值最大且保持不变(图 3a), 说明此条件下15NO2-被稳定地还原为29N2。通过光度法测定样品加入SA试剂后剩余15NO2-, 验证了15NO2-转化率(图 3b), 可知15NO2-转化率与图 3a中Δ29N2/ΣN2基本对应, 证明HCl浓度大于0.6 mol/L且SA浓度大于8 mmol/L, 可实现15NO2-完全转化为29N2, 此条件下氨基磺酸还原效率f=100%, 整个方法的还原效率η=95%。因此, 为保证反应可靠进行, 选择SA浓度为15 mmol/L且HCl浓度为1 mol/L为SA试剂优化条件。
 |
| 图 3 不同氨基磺酸(SA)浓度(0.5~20 mmol/L)和酸度(HCl浓度0~1 mol/L)条件下, 15NO2-转化为29N2的信号比值Δ29N2/ΣN2变化(a)和15NO2-转化率(b) Fig. 3 The signal ratio Δ29N2/ΣN2 variation from 15NO2- to 29N2 (a) and 15NO2- conversion (b) under different sulfamic acid (SA) concentration (0.5~20 mmol/L) and acidity (expressed as HCl concentration 0~1 mol/L) |
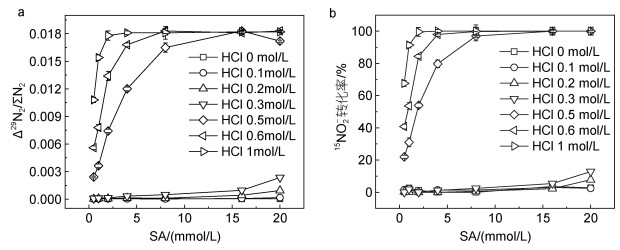
15NO2-被SA还原时反应时间影响如图 4所示。可知10 μmol/L 15NO3-溶液在试剂条件为15 mmol/L SA (1 mol/L HCl)下, 经镉柱和SA试剂还原, Δ29N2/ΣN2数值随时间梯度基本不变化, 测定结果的相对标准偏差为2%, 可知在选择的条件下测定时15NO2-和SA试剂反应非常迅速, 加入SA试剂后即可进行测定。
 |
| 图 4 10 μmol/L 15NO3-经镉和15 mmol/L SA (1 mol/L HCl)试剂还原后测试信号随时间的变化 Fig. 4 The change of test signal with time on the reduction test of 10 μmol/L 15NO3- by cadmium and 15 mmol/L SA (1 mol/L HCl) reagent |
本研究中镉柱还原硝酸盐的线性范围完全满足需要, 利用镉柱还原-SA反应测定0~200 μmol/L 15NO3-线性范围(图 5)。通过线性拟合, 当15NO3-浓度处于0~40 μmol/L范围, 测定29N2的信号值Δ29N2/ΣN2与15NO3-浓度成明显线性关系; 当15NO3-浓度高于40 μmol/L, Δ29N2/ΣN2偏离拟合线, 因此本方法的线性范围为0~40 μmol/L。
 |
| 图 5 镉柱还原-SA反应测定15NO3-的线性范围测试 Fig. 5 Determination of linear range of 15NO3- by cadmium column reduction-SA reaction |
根据15NO3-0~10 μmol/L的工作曲线(图 6), 计算出该方法的检测限为0.05 μmol/L。
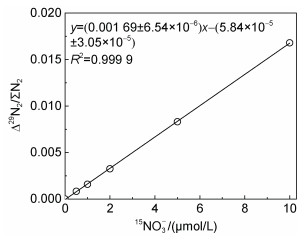 |
| 图 6 镉柱还原-SA反应测定15NO3-的工作曲线(0~10 μmol/L) Fig. 6 Working curve of determination of 15NO3- by cadmium column reduction-SA reaction (0~10 μmol/L) |
分别进行了1 μmol/L和10 μmol/L 15NO3-溶液平行测试(n=4), 其Δ29N2/ΣN2相对标准偏差分别为1.1%和0.3%(表 3)。
| 15NO3-/(μmol/L) | Δ29N2/ΣN2平均值 | Δ29N2/ΣN2标准偏差 | Δ29N2/ΣN2相对标准偏差 |
| 1 | 1.81×10–3 | 1.94×10–5 | 1.1% |
| 10 | 1.73×10–2 | 5.66×10–5 | 0.3% |
通过测定盐度范围为0~35的Δ29N2/ΣN2与盐度为0时Δ29N2/ΣN2信号比值计算相对误差(图 7), 表明当盐度为5、30和35, Δ29N2/ΣN2相对误差明显低于1%, Δ29N2/ΣN2基本未发生变化; 当盐度为10~25, Δ29N2/ΣN2相对误差约为2%, Δ29N2/ΣN2受到的影响也较小。因此, 整个反应过程可视为无显著的盐效应。
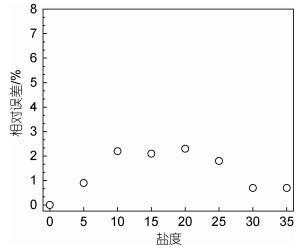 |
| 图 7 盐度为0~35时Δ29N2/ΣN2相对误差变化 Fig. 7 The relative error of Δ29N2/ΣN2 change at salinity with 0~35 |
15NH4+加富样品中生成的15NO2-经测定浓度过低, 均 < 0.1 μmol/L, 与背景值之间并无显著差异。15NH4+加富样品中15NO3-生成与培养时间的关系、15NO2-加富样品中15NO3-生成与培养时间的关系如图 8a, 8b所示。可知, 沉积物15NH4+加富在0~10 cm随着培养时间增加, 除最表层沉积物0~2 cm外, 15NO3-整体上均有升高, 发现NH4+氧化为NO3-的硝化过程。沉积物15NO2-加富在0~10 cm随着培养时间增加, 15NO3-均有升高, 明显发生了NO2-氧化为NO3-的硝化过程; 并且随着深度增加, 15NO3-升高更明显, 氧化速率更高。
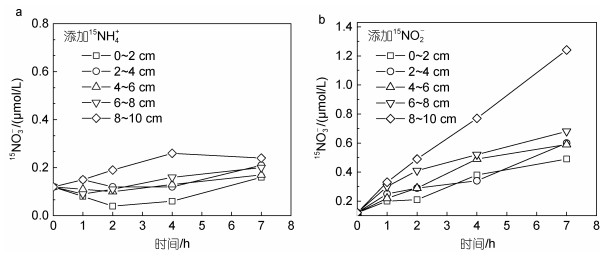 |
| 图 8 15NH4+加富样品(a)和15NO2-加富样品(b)中15NO3-生成与培养时间的关系 Fig. 8 Relationship between 15NO3- production and incubation time in 15NH4+-enriched samples (a) and 15NO2--enriched samples (b) |
铵氧化及亚硝酸盐氧化速率与沉积物深度的关系结果如图 9所示。石老人沙滩沉积物中存在明显的硝化过程。沉积物15NH4+氧化为15NO2-的速率难以检测; 而沉积物15NH4+氧化为15NO3-的速率变化范围为0.08~0.17 nmol N/(cm3·h), 随着深度增加而增加, 8~10 cm 15NH4+氧化为15NO3-的速率最高; 沉积物15NO2-氧化为15NO3-的速率也有明显变化, 变化范围为0.53~1.56 nmol N/(cm3·h), 随着深度增加, 速率变化小, 但在8~10 cm速率明显高。由石老人沙滩沉积物测得的硝化速率大小结果与一些研究相似(杜佳鑫等, 2015; 常永凯, 2016; Chang et al, 2021)。石老人沙滩沉积物是砂质的潮间带沉积物, 在表面难以发现明显的由铵被氧化为亚硝或硝酸盐的硝化过程, 而沉积物2~10 cm则有明显的硝化过程, 将15NH4+氧化为15NO3-的速率与深度做相关性分析, 结果P=0.022 < 0.05, 由15NH4+氧化为15NO3-的速率与深度显著相关; 而将15NO2-氧化为15NO3-的速率与深度做相关性分析, 结果P=0.085 > 0.05, 与深度无明显相关性。
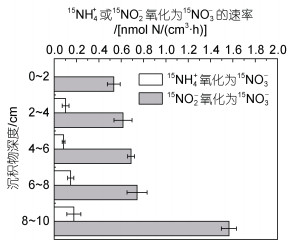 |
| 图 9 15NH4+氧化为15NO3-及15NO2-氧化为15NO3-的速率与沉积物深度的关系 Fig. 9 Relationship between the oxidation rate from 15NH4+ to 15NO3- and 15NO2- to 15NO3- and sediment depth |
本研究优化了基于双还原体系与膜进样质谱测定15N加富水样中15NO3-的方法。通过实验优化, 15NO3-还原为29N2的最佳条件为: 先用SA除去样品原有的15NO2-, 然后利用镉柱将15NO3-还原为15NO2-, 再加入0.1 mL 15 mmol/L SA(HCl浓度为1 mol/L)将15NO2-还原为29N2, 最后由膜进样质谱测定29N2, 并通过工作曲线得出15NO2-的浓度。此方法测量样品快速简便、成本低、效率高, 可测15NO3-浓度上限至少可以到达40 μmol/L, 对15N加富产生的大量样品测定优势显著。石老人沙滩沉积物中存在明显的硝化过程, 沉积物0~10 cm 15NH4+氧化为15NO3-及15NO2-氧化为15NO3-的速率变化明显, 在整体上, 随着深度增加氧化速率增加, 由15NH4+氧化为15NO3-的速率与深度显著相关。
致谢 感谢谢成军同学对本研究实验过程与仪器操作所提供的协助; 感谢广西大学海洋学院宁志铭老师对本文的修改指正。
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008. 海洋监测规范第4部分: 海水分析: GB 17378.4—2007[S]. 北京: 中国标准出版社: 115-117.
|
杜佳鑫, 杜华超, 王连峰, 2015. 辽东湾河口潮间带沉积物及附近土壤硝化和反硝化强度研究. 环境保护科学, 41(5): 123-127 DOI:10.3969/j.issn.1004-6216.2015.05.023 |
徐颢铭, 宋国栋, 刘素美, 等, 2022. 基于次溴酸钠氧化-氨基磺酸还原测定沉积物15N加富培养样品中的15NH4+的方法探索. 海洋学报, 44(01): 147-156 |
常永凯, 2016. 辽河口沉积物中氨氧化微生物多样性和硝化作用研究[D]. 大连: 大连海洋大学: 9-12.
|
谢成军, 宋国栋, 刘素美, 等, 2020. 自组装膜进样质谱系统及其在砂质沉积物异化硝酸盐还原研究中的应用. 海洋学报, 42(2): 22-29 DOI:10.3969/j.issn.0253-4193.2020.02.003 |
BROOKS P D, STARK J M, MCINTEER B B, et al, 1989. Diffusion method to prepare soil extracts for automated nitrogen-15 analysis. Soil Science Society of America Journal, 53(6): 1707-1711 DOI:10.2136/sssaj1989.03615995005300060016x |
CASCIOTTI K L, 2016. Nitrogen and oxygen isotopic studies of the marine nitrogen cycle. Annual Review of Marine Science, 8: 379-407 DOI:10.1146/annurev-marine-010213-135052 |
CHANG Y K, YIN G Y, HOU L J, et al, 2021. Nitrogen removal processes coupled with nitrification in coastal sediments off the North East China Sea. Journal of Soils and Sediments, 21(10): 3289-3299 DOI:10.1007/s11368-021-02964-5 |
DAIMS H, LEBEDEVA E V, PJEVAC P, et al, 2015. Complete nitrification by Nitrospira bacteria. Nature, 528(7583): 504-509 DOI:10.1038/nature16461 |
DEVOL A H, 2015. Denitrification, anammox, and N2 production in marine sediments. Annual Review of Marine Science, 7: 403-423 DOI:10.1146/annurev-marine-010213-135040 |
GARDNER W S, BOOTSMA H A, EVANS C, et al, 1995. Improved chromatographic analysis of 15N: 14N ratios in ammonium or nitrate for isotope addition experiments. Marine Chemistry, 48(3/4): 271-282 |
GLIBERT P M, MCCARTHY J J, 1984. Uptake and assimilation of ammonium and nitrate by phytoplankton: indices of nutritional status for natural assemblages. Journal of Plankton Research, 6(4): 677-697 DOI:10.1093/plankt/6.4.677 |
GRANGER J, SIGMAN D M, 2009. Removal of nitrite with sulfamic acid for nitrate N and O isotope analysis with the denitrifier method. Rapid Communications in Mass Spectrometry, 23(23): 3753-3762 DOI:10.1002/rcm.4307 |
GROFFMAN P M, ALTABET M A, BÖHLKE J K, et al, 2006. Methods for measuring denitrification: diverse approaches to a difficult problem. Ecological Applications, 16(6): 2091-2122 DOI:10.1890/1051-0761(2006)016[2091:MFMDDA]2.0.CO;2 |
GRUBER N, GALLOWAY J N, 2008. An Earth-system perspective of the global nitrogen cycle. Nature, 451(7176): 293-296 DOI:10.1038/nature06592 |
HOERING T, 1957. The isotopic composition of the ammonia and the nitrate ion in rain. Geochimica et Cosmochimica Acta, 12(1/2): 97-102 |
JÄNTTI H, LESKINEN E, STANGE C F, et al, 2012. Measuring nitrification in sediments-comparison of two techniques and three 15NO3- measurement methods. Isotopes in Environmental and Health Studies, 48(2): 313-326 DOI:10.1080/10256016.2012.641543 |
JÄNTTI H, STANGE F, LESKINEN E, et al, 2011. Seasonal variation in nitrification and nitrate-reduction pathways in coastal sediments in the Gulf of Finland, Baltic Sea. Aquatic Microbial Ecology, 63(2): 171-181 DOI:10.3354/ame01492 |
JENKINS M C, KEMP M W, 1984. The coupling of nitrification and denitrification in two estuarine sediments. Limnology and Oceanography, 29(3): 609-619 DOI:10.4319/lo.1984.29.3.0609 |
JENSEN K M, JENSEN M H, KRISTENSEN E, 1996. Nitrification and denitrification in Wadden Sea sediments (Königshafen, Island of Sylt, Germany) as measured by nitrogen isotope pairing and isotope dilution. Aquatic Microbial Ecology, 11(2): 181-191 |
KANA T M, DARKANGELO C, HUNT M D, et al, 1994. Membrane inlet mass spectrometer for rapid high-precision determination of N2, O2, and Ar in environmental water samples. Analytical Chemistry, 66(23): 4166-4170 DOI:10.1021/ac00095a009 |
LIN X B, LU K J, HARDISON A K, et al, 2021. Membrane inlet mass spectrometry method (REOX/MIMS) to measure 15N-nitrate in isotope-enrichment experiments. Ecological Indicators, 126(15): 107639 |
MCILVIN M R, ALTABET M A, 2005. Chemical conversion of nitrate and nitrite to nitrous oxide for nitrogen and oxygen isotopic analysis in freshwater and seawater. Analytical Chemistry, 77(17): 5589-5595 DOI:10.1021/ac050528s |
MOORE H, 1974. Isotopic measurement of atmospheric nitrogen compounds. Tellus, 26(1/2): 169-174 |
MORAES P C, GÒMEZ D M A, VINCENZI F, et al, 2019. Analysis of 15N-NO3- via anoxic slurries coupled to MIMS analysis: an application to estimate nitrification by Burrowing Macrofauna. Water, 11(11): 2310 DOI:10.3390/w11112310 |
RUSSOW R, SICH I, STEVENS R J, 1996. Rapid, sensitive and highly selective 15N analysis of 15N enriched nitrite in water samples and soil extracts by nitric oxide production and CF-QMS measurement. Isotopes in Environmental and Health Studies, 32(4): 323-328 DOI:10.1080/10256019608234024 |
SIGMAN D M, CASCIOTTI K L, ANDREANI M, et al, 2001. A bacterial method for the nitrogen isotopic analysis of nitrate in seawater and freshwater. Analytical Chemistry, 73(17): 4145-4153 DOI:10.1021/ac010088e |
SILVA S R, KENDALL C, WILKISON D H, et al, 2000. A new method for collection of nitrate from fresh water and the analysis of nitrogen and oxygen isotope ratios. Journal of Hydrology, 228(1/2): 22-36 |
SONG G D, LIU S M, MARCHANT H, et al, 2013. Anammox, denitrification and dissimilatory nitrate reduction to ammonium in the East China Sea sediment. Biogeosciences, 10(11): 6851-6864 DOI:10.5194/bg-10-6851-2013 |
STANGE C F, SPOTT O, APELT B, et al, 2007. Automated and rapid online determination of 15N abundance and concentration of ammonium, nitrite, or nitrate in aqueous samples by the SPINMAS technique. Isotopes in Environmental and Health Studies, 43(3): 227-236 DOI:10.1080/10256010701550658 |
TU Y, FANG Y T, LIU D W, et al, 2016. Modifications to the azide method for nitrate isotope analysis. Rapid Communications in Mass Spectrometry, 30(10): 1213-1222 DOI:10.1002/rcm.7551 |
VAN KESSEL M A H J, SPETH D R, ALBERTSEN M, et al, 2015. Complete nitrification by a single microorganism. Nature, 528(7583): 555-559 DOI:10.1038/nature16459 |
XING M, LIU W G, 2011. An improved method of ion exchange for nitrogen isotope analysis of water nitrate. Analytica Chimica Acta, 686(1/2): 107-114 |
YIN G Y, HOU L J, LIU M, et al, 2014. A novel membrane inlet mass spectrometer method to measure 15NH4+ for isotope-enrichment experiments in aquatic ecosystems. Environmental Science & Technology, 48(16): 9555-9562 |
ZHANG X N, WARD B B, SIGMAN D M, 2020. Global nitrogen cycle: critical enzymes, organisms, and processes for nitrogen budgets and dynamics. Chemical Reviews, 120(12): 5308-5351 DOI:10.1021/acs.chemrev.9b00613 |
 2022, Vol. 53
2022, Vol. 53


