
中国海洋湖沼学会主办。
文章信息
- 胡晓坤, 赵越, 孔凡洲, 张清春, 严冰, 于仁成. 2022.
- HU Xiao-Kun, ZHAO Yue, KONG Fan-Zhou, ZHANG Qing-Chun, YAN Bing, YU Ren-Cheng. 2022.
- 流式影像仪在东海海域甲藻藻华研究中的应用
- APPLICATION OF FLOWCAM IN THE STUDY OF A DINOFLAGELLATE BLOOM IN THE EAST CHINA SEA
- 海洋与湖沼, 53(2): 330-339
- Oceanologia et Limnologia Sinica, 53(2): 330-339.
- http://dx.doi.org/10.11693/hyhz20210700171
文章历史
-
收稿日期:2021-07-31
收修改稿日期:2021-10-26
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 山东青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 山东青岛 266071;
5. 山东科技大学 海洋科学与工程学院 山东青岛 266590;
6. 暨南大学 生命科学技术学院 广东广州 510632
2. Key Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. College of Ocean Science and Engineering, Shandong University of Science and Technology, Qingdao 266590, China;
6. College of Life Science and Technology, Jinan University, Guangzhou 510632, China
浮游植物是海洋生态系统的基础。部分有毒或有害的浮游植物在短时间内大量增殖, 会形成有害藻华(harmful algal blooms, HABs) (GlobalHAB, 2017), 对海水养殖、人类健康和生态安全产生负面影响(Anderson et al, 2012)。进入21世纪以来, 我国长江口及其邻近海域连年暴发甲藻形成的大规模有害藻华(亦称赤潮), 米氏凯伦藻(Karenia mikimotoi)、东海原甲藻(Prorocentrum donghaiense)和亚历山大藻(Alexandrium spp.)等是主要的原因种(于仁成等, 2017)1179。其中, 米氏凯伦藻藻华对养殖动物具有强烈的急性毒性效应(Li et al, 2019), 2005年东海海域暴发的米氏凯伦藻藻华造成养殖鱼类大量死亡, 经济损失超过3 000万元; 2012年福建近岸海域暴发的大规模米氏凯伦藻藻华导致养殖鲍大量死亡, 经济损失超过20亿元(Lu et al, 2014; Li et al, 2017; Chen et al, 2021)。东海原甲藻藻华会抑制中华哲水蚤繁殖, 影响浮游动物群落结构和动态, 对渔业资源有潜在威胁(Lin et al, 2014, 2015), 是一种生态系统破坏型有害藻华(ecosystem disruptive algal bloom, EDAB)。亚历山大藻则会通过产生麻痹性贝类毒素, 危害海产品等食品安全, 甚至造成人类中毒(周名江等, 2003; 李冬融等, 2014; 高岩等, 2016)。此外, 剧毒卡尔藻(Karlodinium veneficum)、锥状斯氏藻(Scrippsiella trochoidea)等也是东海海域常见的有害藻华原因种(王红霞等, 2011; 田媛等, 2020)。
东海的有害藻华受到水温、环流及营养盐等多类环境因子的调控(周名江等, 2006; Zhou et al, 2008)675, 形成机理复杂, 预测预警困难。目前, 对原因种的检测仍是有害藻华监测和防控的主要途径。藻种检测可以通过显微观察、流式分析、色素检测、DNA序列测定等途径进行(Scanlan et al, 2009; Al-Kandari et al, 2011; Zamor et al, 2012; Faria et al, 2014)。其中, 通过显微镜进行藻种鉴定和计数的方法直观、方便, 是藻华原因种检测的传统方法(孙军等, 2002)。但是, 显微观察对实验人员的专业能力要求高, 且样品处理和观察耗时费力; 样品固定过程容易造成藻细胞形态的改变, 影响藻种的鉴定和计数结果准确性。流式分析也是藻类检测的重要手段(Biegala et al, 2003), 流式细胞仪能够通过细胞粒径和光学特性, 对原绿球藻(Prochlorococcus spp.)和聚球藻(Synechococcus spp.)等进行检测(Chisholm et al, 1988; Jiao et al, 2002; 赵越等, 2019)。近年来, 随着流式成像技术快速发展, 流式影像仪(如FlowCam)开始逐渐应用于微藻的识别和计数。FlowCam设备可以通过高速摄影拍照捕捉样品中的微粒, 获取每个颗粒物的粒径、体积、荧光参数等40多种信息(Otálora et al, 2021)4, 其研发的图像分析软件VisualSpreadsheet能够对信息进行分类识别和特征筛选, 并与藻种库中的目标藻种信息进行相似度分析(Buskey et al, 2006)690, 实现藻类的自动识别(王雨等, 2010)。FlowCam可在一定程度上弥补传统显微观察方法的不足, 实现样品的高通量分析, 且样品无需固定, 能够最大程度保留细胞的原始形态特征(Trask et al, 1982; Olson et al, 1983; Yentsch et al, 1983), 可用于浮游生物种类鉴定和定量分析(Simon et al, 1994; Becker et al, 2002; Karnan et al, 2020), 在浮游生物功能群和有害藻华监测研究中得到广泛应用(Crosbie et al, 2003; Dubelaar et al, 2004; Wong et al, 2017)。但对于形态特征不明显的藻种, 应用FlowCam进行藻种检测时还需要进行图像人工判读并结合分子生物学手段进行分析(Hansen et al, 2003; Bergholtz et al, 2006)。
近年来, 应用FlowCam开展生态学研究逐渐受到关注(Camoying et al, 2016)305, 但是, 在中国近岸海域应用FlowCam开展的实际研究工作仍相对较少。本研究针对东海海域常见的甲藻藻华原因种米氏凯伦藻和东海原甲藻, 通过室内实验测试了FlowCam对微藻计数结果的准确性, 并尝试应用FlowCam对福建三沙海域的甲藻藻华过程进行了现场观测。
1 材料与方法 1.1 仪器设备显微镜(Leica, 德国); FlowCam-8400 (Fluid Imaging Technologies, 美国)。
1.2 实验藻种实验所用的米氏凯伦藻、东海原甲藻、亚历山大藻、剧毒卡尔藻和锥状斯氏藻等藻种(表 1), 以f/2-Si培养基培养, 培养条件温度为20 ℃, 光照强度约100 μmol/(m2·s): 光暗为14 h: 10 h。
| 藻种 | 分离海域 | 藻株 | 分离时间/年 |
| 米氏凯伦藻 | 东海 | MEL22 | 2013 |
| 东海原甲藻 | 东海 | MEL14 | 2018 |
| 亚历山大藻 | 黄海 | MEL1 | 2006 |
| 锥状斯氏藻 | 南海 | MEL30 | 不明 |
| 剧毒卡尔藻 | 东海 | MEL23 | 2016 |
以实验室培养的米氏凯伦藻为对象, 通过与显微镜计数结果对比, 分析FlowCam对颗粒计数结果的准确性。选择生长状态良好的米氏凯伦藻(对数生长期), 通过稀释获得一系列不同密度的藻细胞样品(10~30 000 000 cells/L), 每一样品设置3个平行, 分别通过显微镜镜检(Utermöhl, 1958)和FlowCam (Sieracki et al, 1998)分析获得各样品中的米氏凯伦藻细胞密度。其中显微镜定量检测体积为0.1 mL, FlowCam检测体积1 mL。根据目标藻种细胞粒径(15~20 μm), 在FlowCam检测中采用了10倍物镜, 流速设置为0.15 mL/min。应用SPSS 19软件, 对两种方法的检测结果进行线性相关性分析, 并以配对样品t检验方法分析两种方法的测试结果是否存在显著差异(任琳琳, 2013; Camoying et al, 2016)309。
1.4 FlowCam识别准确性实验为测试FlowCam对目标藻种识别的准确性, 以实验室培养的米氏凯伦藻和东海原甲藻为对象, 评价了FlowCam对目标藻种的准确率和召回率。其中, 准确率衡量检索的精度(正确识别的目标藻细胞数/识别的总细胞数×100%), 召回率衡量检索的查全比例(正确识别的目标藻细胞数/样品中目标藻细胞数×100%) (牟琪, 2014)。
选择不同数量的米氏凯伦藻和东海原甲藻细胞(10、50、100、1 000和5 000个), 分别建立两种微藻的影像库。采用室内培养的米氏凯伦藻、东海原甲藻、亚历山大藻、剧毒卡尔藻和锥状斯氏藻, 分别针对米氏凯伦藻和东海原甲藻制备了两个不同优势度的混合藻种样品(表 2)。基于构建的米氏凯伦藻和东海原甲藻影像库, 对混合藻种样品中两种目标藻种进行识别, 评估其识别的准确性, 并探讨影像库建库细胞数对藻种识别结果的影响。
| 目标藻种 | 样品类型 | 细胞数 | 优势度/% | |
| 目标藻细胞数 | 其他藻细胞数 | |||
| 米氏凯伦藻 | 高优势度样品 | 1 272 | 788 | 61.2 |
| 低优势度样品 | 936 | 17 846 | 4.98 | |
| 东海原甲藻 | 高优势度样品 | 765 | 1 505 | 33.7 |
| 低优势度样品 | 1 028 | 20 366 | 4.81 | |
为进一步验证FlowCam对目标藻种识别的准确性, 选择2018年福建近海一次东海原甲藻藻华期间采集的两个样品, 对比分析了不同来源、不同数目的东海原甲藻细胞影像库(表 3)对FlowCam识别准确性的影响。
| 建库目标藻种来源 | 建库细胞数/个 |
| 室内培养 | 10 |
| 50 | |
| 100 | |
| 1 000 | |
| 5 000 | |
| 野外样品 | 10 |
| 50 |
2018年4月25日至5月28日期间, 应用FlowCam对福建三沙近岸海域的甲藻藻华进行了跟踪研究。现场共设置15个站位(图 1), 每间隔2~6天进行一次采样调查。在每个站位取10 L表层海水, 以孔径10 μm的筛绢浓缩至50 mL, 用FlowCam分别检测凯伦藻和东海原甲藻细胞密度, 每个样品的检测体积为1 mL。在每个站位取1 L表层海水, 用鲁格试剂固定, 鲁格试剂最终浓度为1.0%~1.5%, 用显微镜定量检测凯伦藻和东海原甲藻密度。分析研究期间2种藻的丰度变化状况, 用SPSS软件分析两种方法检测结果的差异显著性和线性相关性, 分析方法同1.3。
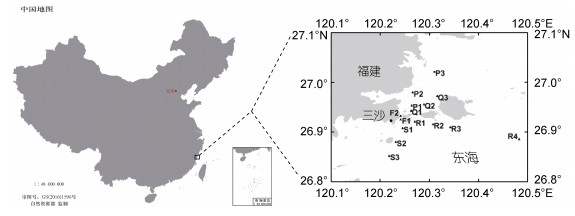 |
| 图 1 2018年福建三沙海域藻华跟踪研究中采样站位示意图 Fig. 1 Illustration of sampling sites in the coastal waters of Fujian Province during a bloom of dinoflagellates in 2018 |
以米氏凯伦藻为对象, 参照显微镜定量检测结果, 对FlowCam计数结果的准确性进行了分析和评估。结果表明, FlowCam计数结果与显微镜计数结果无显著差异(P > 0.05), 且两者之间具有极显著的线性相关性(P < 0.01), R2达到0.98(图 2)。当采用的检测体积为1 mL时, FlowCam的检出限理论上可以达到1 000 cells/L。当野外样品中藻细胞密度低时, 可以通过加大检测体积或浓缩样品进一步降低检出限水平。
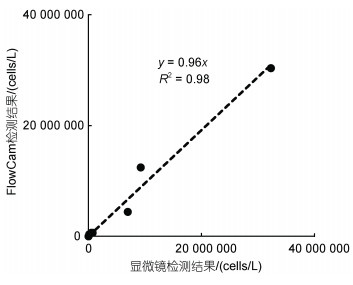 |
| 图 2 显微镜和FlowCam对室内培养的米氏凯伦藻计数结果对比 Fig. 2 Comparison of cell counting results of cultured Karenia mikimotoi cells using microscope and FlowCam |
应用室内模拟的混合藻类样品和野外采集的藻华区现场样品, 分别以米氏凯伦藻和东海原甲藻建库, 评估了建库细胞数目和来源对FlowCam目标藻识别准确性的影响。结果表明, 随着建库藻细胞数量的增加, FlowCam对样品中两种微藻的召回率升高, 而准确率则有所下降(图 3, 4)。当目标藻种在浮游植物样品中的优势度较低时, 对目标藻种的识别准确率也会相应下降。FlowCam对东海原甲藻的识别准确率和召回率结果明显好于米氏凯伦藻, 当东海原甲藻的建库细胞数目为100藻细胞时, 对样品中东海原甲藻的识别召回率即可达到最大值, 识别准确率也基本保持稳定; 而米氏凯伦藻建库细胞数目达到5 000藻细胞时, 对样品中米氏凯伦藻的召回率才达到最大值, 而识别准确率也相对较低。
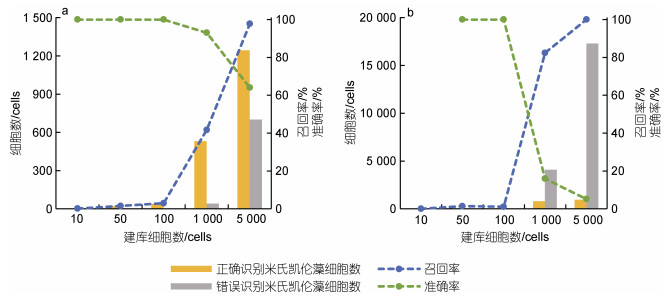 |
| 图 3 FlowCam对两个混合样品中米氏凯伦藻识别的准确率与召回率 Fig. 3 Recall and accuracy rates of FlowCam in identification of dinoflagellate Karenia mikimotoi in two mixed-algal samples 注: a. 高优势度米氏凯伦藻样品; b. 低优势度米氏凯伦藻样品 |
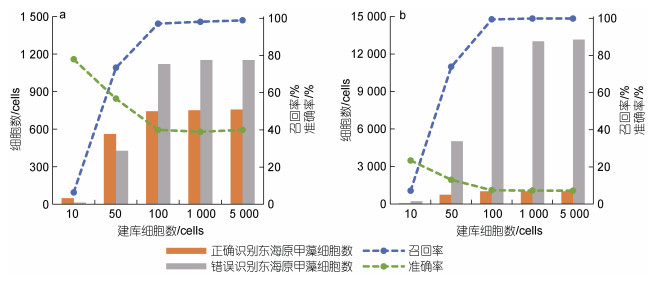 |
| 图 4 FlowCam对两个混合样品中东海原甲藻识别的召回率与准确率 Fig. 4 Recall and accuracy rates of FlowCam in identification of dinoflagellate Prorocentrum donghaiense in two mixed-algal samples 注: a. 高优势度东海原甲藻样品; b. 低优势度东海原甲藻样品 |
应用2018年福建三沙海域甲藻藻华过程中采集的两个样品, 对FlowCam自动识别东海原甲藻的准确性进行了分析。结果表明, 当建库细胞数达到50个时, 对东海原甲藻的识别召回率即可达到90%以上。相比于以室内培养的东海原甲藻建立的影像库, 应用野外样品中东海原甲藻细胞建立藻种库时, 以10个藻细胞建立的影像库即可达到较高的召回率(图 5)。
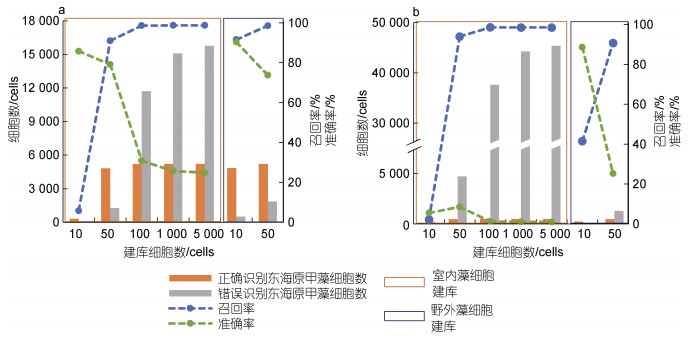 |
| 图 5 FlowCam对2018年福建三沙海域甲藻藻华期间两个样品中东海原甲藻的识别召回率与准确率 Fig. 5 Recall and accuracy rates of FlowCam in identification of dinoflagellate Prorocentrum donghaiense in two phytoplankton samples collected from Sansha, Fujian province, during a dinoflagellate red tide in 2018 注: a. 高优势度东海原甲藻样品; b. 低优势度东海原甲藻样品 |
在航次调查期间, 采取自动识别辅以人工判读方式, 用FlowCam对2018年4~5月期间福建三沙近岸海域一次甲藻藻华过程进行了跟踪研究, 获得了海水中东海原甲藻和凯伦藻的影像数据(图 6)。由于无法通过藻种形态对米氏凯伦藻进行准确鉴定, 野外样品中获得与米氏凯伦藻形态相似的藻种均笼统称为凯伦藻。两种藻华藻种的检测结果如图 7、图 8所示。可以看出, 东海原甲藻丰度远高于凯伦藻, 藻细胞最高丰度超过106 cells/L。FlowCam与显微镜对东海原甲藻的检测结果无显著差异(P > 0.5), 两种检测结果具有极显著的线性相关性(P < 0.01), R2为0.92(图 8)。凯伦藻密度一直处于较低水平, 仅在部分站位检出, 最高丰度为120 cells/L(图 7)。
 |
| 图 6 2018年福建三沙海域甲藻藻华期间获取的凯伦藻和东海原甲藻FlowCam影像图 Fig. 6 FlowCam images of Kareniacean and Prorocentrum donghaiense cells in the coastal water of Sansha, Fujian Province, during a dinoflagellate red tide in 2018 |
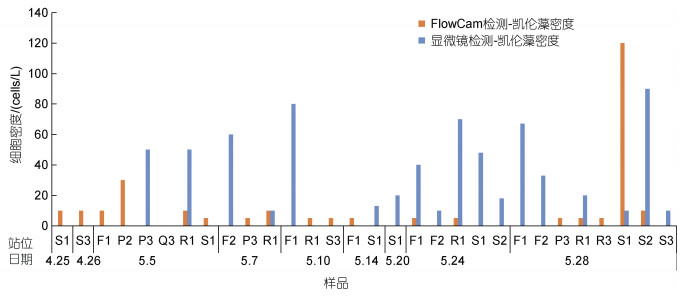 |
| 图 7 2018年福建三沙海域甲藻藻华过程中凯伦藻丰度变化状况 Fig. 7 Variation of Kareniacean cell abundance in the coastal water of Sansha, Fujian Province, during a dinoflagellate red tide in 2018 |
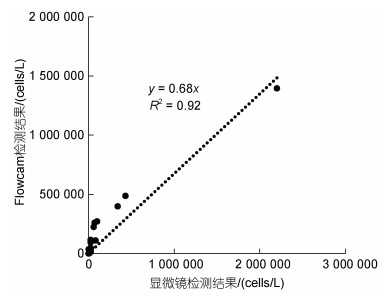 |
| 图 8 2018年福建三沙海域甲藻藻华过程中FlowCam和显微镜检测东海原甲藻细胞丰度对比 Fig. 8 Comparison of Prorocentrum donghaiense cell abundance in the coastal water of Sansha, Fujian Province, during a dinoflagellate red tide in 2018 |
流式影像技术是在显微镜和流式细胞术基础上发展起来的新型浮游植物检测方法, 目前已发展成较为成熟的技术。传统上, 浮游植物细胞主要由分类学家在显微镜下进行鉴定和计数(Andersen et al, 2003), 一个样品通常需要2~10 h, 甚至更长时间(Karlson et al, 2010)14。FlowCam仪器采用流式影像技术, 能够快速检测、处理更大体积的样品。Steele等(2020)用配备4倍物镜的FlowCam分析样品时, 检测速度为1.7 mL/min, 本研究中使用10倍物镜、流速0.15 mL/min, 检测1 mL样品需6 min左右。FlowCam不仅提高了浮游植物的检测效率, 也具有较好的准确性(侯建军等, 2004; Hrycik et al, 2019)。此外, 用显微镜检测方法分析浮游植物样品时, 常用甲醛、鲁格试剂等对样品进行固定(方晓琪等, 2019), 存在破坏细胞形态的风险(Karlson et al, 2010)15。应用FlowCam对浮游植物样品进行检测时, 无需对样品进行固定处理, 能够更好地满足浮游植物检测时效性和准确性的需求。获取的图像信息可以通过计算机长期保存, 具有再现性优势(Hrycik et al, 2019)。
本研究尝试应用FlowCam, 对东海海域两种甲藻藻华原因种米氏凯伦藻和东海原甲藻进行了检测。结果表明, 通过显微镜和FlowCam对室内培养的目标藻种(米氏凯伦藻)进行计数, 两者结果呈线性相关, 且没有显著差异。应用FlowCam和显微镜对野外样品中的目标藻种(东海原甲藻)计数结果同样具有线性相关性, 但FlowCam计数结果相对偏低, 推测主要原因在于野外样品中目标藻种的不均匀分布, 以及样品浓缩过程中的损失。与显微镜计数相比, FlowCam可以通过VisualSpreadsheet软件自动识别目标藻种(Camoying et al, 2016)306, 大大提高了样品的计数效率, 但识别准确性仍然存在欠缺。实验结果表明, FlowCam对藻种识别的召回率和准确率与建库策略有关, 建库细胞数增加会提高对目标藻细胞的召回率, 但会降低识别的准确率。由于FlowCam对样品的计数效率很高, 而识别准确性相对较差, 因此, 在实际样品分析过程中, 可优先选择高召回率以减少对样本中目标藻细胞的遗漏, 再辅以人工判读提高藻种识别的准确性, 实现对目标藻种快速、准确地识别和计数。从实验结果中可以看出, FlowCam对藻种的识别结果还与藻种形态特征有关(任琳琳, 2013)。与米氏凯伦藻相比, 东海原甲藻的形态特征更为明显。因此, 当东海原甲藻的建库细胞数达到50个时, FlowCam对东海原甲藻的召回率即可达到90%以上; 而米氏凯伦藻建库细胞数在1 000个以上, 才能达到较高的召回率。当采用野外样品中的东海原甲藻建库时, 采用10个藻细胞即可达到较高的召回率。综上, 为保障对目标藻种的高召回率, 在具体工作中应针对不同形态、不同状态的藻种, 考虑构建不同细胞数的影像库。
目前, FlowCam自带的图像分析软件VisualSpreadsheet可以区分具有不同形态特征的浮游植物种类。但是, 受到图像分辨率和数据分析方法等因素的限制, 对形态特征相似的浮游植物识别能力仍然有限(余肖翰等, 2013), 制约了对浮游植物的准确分类和识别。利用FlowCam获取的图像, 可以通过针对性地研发图像提取和处理方法, 进一步提高浮游生物分类的准确性(Kerr et al, 2020)。如Promdaen等(2014)提出了一种将藻类从图像背景中分离出来的图像分割方法, 可以解决藻类边界不清晰、藻类鞭毛外观透明、接触污染物体等分割难点, 用序列最小优化算法(SMO)进行分类, 准确率可达97.22%。Otálora等(2021)3用FlowCam获取了小球藻(Chlorella vulgaris)和一种栅藻(Scenedesmus almeriensis)的细胞图像信息, 基于人工神经网络(ANN)进行图像分析, 可以实现对藻细胞的自动识别。Sosik等(2007)开发了一种基于图像特征提取的方法, 通过组合大小、形状、对称性和纹理等图像信息, 结合机器学习算法对浮游植样品进行分类。通过改进的卷积神经网络模型(CNN)进行藻类图像分析和深度学习后, 对藻细胞分类准确率达98%~99% (Pant et al, 2020; Yadav et al, 2020)。将FlowCam图像获取与先进的图像分类算法相结合, 有望进一步提高对藻种的分类识别能力(孙晓霞等, 2014)。
FlowCam目前已在浮游植物和有害藻华研究中得到较为广泛的应用(See et al, 2005; Patil et al, 2015; Amadei Martínez et al, 2020)。依据国际海事组织(IMO)颁布的《国际船舶压载水和沉积物控制与管理公约》标准, Romero-Martínez等(2017)将FlowCam应用于船舶压载水中的浮游植物检测。在美国弗罗里达近海, FlowCam也被成功应用于短凯伦藻的监测, 提高了对藻华原因种的监测效率(Buskey et al, 2006)685。我国东海海域是有害藻华高发区, 针对东海浮游植物已开展了大量的现场调查和研究工作(陈楠生等, 2021)。东海原甲藻和米氏凯伦藻是该海域主要的有害藻华原因种, 两类有害藻华的形成与海域营养盐、水温等环境因素密切相关(周名江等, 2006; 丁光茂等, 2018; 邹双燕, 2018; 吕颂辉等, 2019; 文世勇等, 2019)676, 此外也受到黑潮分支等物理海洋学过程的调控(于仁成等, 2017)1181。春季是东海有害藻华的高发季, 东海原甲藻几乎每年都会形成大规模藻华, 而米氏凯伦藻仅在个别年份形成。但是, 米氏凯伦藻藻华一旦形成, 就会造成巨大的危害。2003年5月底在福建连江海域发生米氏凯伦藻藻华(龙华等, 2005); 2012年5~6月, 福建近海多次发生米氏凯伦藻藻华, 累计面积超过323 km2, 经济损失20.11亿元(邓华等, 2016)。因此, 需要针对米氏凯伦藻和东海原甲藻等藻华原因种开展针对性的监测和预警(黄海燕等, 2016; 赵聪蛟等, 2020)。本研究利用FlowCam结合人工判读方式, 在福建三沙海域航次调查过程中监测到东海原甲藻藻华, 并对海水中东海原甲藻的细胞密度进行了检测, 其结果与显微镜计数结果较为一致, 同时还检测到低密度的米氏凯伦藻细胞。现场实验结果表明, FlowCam可以提高样品处理效率, 有望在今后的米氏凯伦藻和东海原甲藻藻华监测和预警中发挥更大作用。
4 结论本研究以米氏凯伦藻和东海原甲藻为目标藻种, 通过室内实验测试了FlowCam的计数和识别准确性, 并在福建三沙海域甲藻藻华过程中进行了现场测试和应用。研究结果表明, FlowCam计数结果准确, 应用其自动识别功能, 可以实现对目标藻种的自动识别和计数, 能够显著提高对浮游植物样品的检测效率; 但目前FlowCam对藻种的识别准确率低, 仍需结合人工判读辅助, 需要研发新的图像提取和分析方法, 进一步提高检测效率。目前在应用FlowCam进行目标藻种识别时, 其召回率和准确率与建库细胞的形态特征、数量、来源密切相关, 需要针对不同的目标藻种构建不同大小的藻种库, 以提高召回率, 减少分析过程中对目标藻细胞的遗漏。对2018年福建近海甲藻藻华的现场实验结果表明, FlowCam样品处理效率高, 可有效应用于有害藻华的现场监测, 可望在今后监测和预警中发挥更大作用。
致谢 本实验中所用的米氏凯伦藻和剧毒卡尔藻系由厦门大学王大志教授和自然资源部第二研究所陆斗定研究员提供, 谨致谢忱。感谢审稿人对本论文提出的建设性修改意见和建议。
丁光茂, 张树峰, 2018. 2012年三沙湾米氏凯伦藻赤潮的生态特征及成因分析. 海洋学报, 40(6): 104-112 DOI:10.3969/j.issn.0253-4193.2018.06.010 |
于仁成, 张清春, 孔凡洲, 等, 2017. 长江口及其邻近海域有害藻华的发生情况、危害效应与演变趋势. 海洋与湖沼, 48(6): 1178-1186 |
王红霞, 陆斗定, 黄海燕, 等, 2011. 东海剧毒卡尔藻的形态特征及其系统进化分析. 植物学报, 46(2): 179-188 |
王雨, 林茂, 林更铭, 等, 2010. 流式影像术在海洋浮游植物分类研究中的应用. 海洋科学进展, 28(2): 266-274 DOI:10.3969/j.issn.1671-6647.2010.02.019 |
文世勇, 林雨霏, 王紫竹, 等, 2019. 米氏凯伦藻和东海原甲藻生长的光照强度生态幅研究. 海洋与湖沼, 50(3): 664-671 |
方晓琪, 仇建标, 余海滨, 等, 2019. 海洋浮游植物调查中常见的固定和保存方法及其影响. 海洋湖沼通报, (6): 106-111 |
邓华, 管卫兵, 曹振轶, 等, 2016. 2012年福建沿海大规模米氏凯伦藻赤潮暴发的水文气象原因探讨. 海洋学研究, 34(4): 28-38 DOI:10.3969/j.issn.1001-909X.2016.04.004 |
龙华, 杜琦, 2005. 福建沿海米氏凯伦藻赤潮的初步研究. 福建水产, 4: 22-26 DOI:10.3969/j.issn.1006-5601.2005.04.006 |
田媛, 李涛, 胡思敏, 等, 2020. 广东省沿岸海域藻华发生的时空特征. 海洋环境科学, 39(1): 1-8 |
吕颂辉, 岑竞仪, 王建艳, 等, 2019. 我国近海米氏凯伦藻(Karenia mikimotoi)藻华发生概况、危害及其生态学机制. 海洋与湖沼, 50(3): 487-494 |
任琳琳, 2013. 流式影像术在黄东海浮游植物群落结构研究中的应用[D]. 青岛: 中国科学院研究生院(海洋研究所): 27-29.
|
孙军, 刘东艳, 钱数本, 2002. 一种海洋浮游植物定量研究分析方法——Utermöhl方法的介绍及其改进. 黄渤海海洋, 20(2): 105-112 |
孙晓霞, 孙松, 2014. 海洋浮游生物图像观测技术及其应用. 地球科学进展, 29(6): 748-755 |
牟琪, 2014. 基于机器视觉的硅藻门藻类鉴定方法研究[D]. 杭州: 浙江理工大学: 49-50.
|
李冬融, 陆斗定, 戴鑫烽, 等, 2014. 东海藻华高发区塔玛亚历山大藻(Alexandrium tamarense)的形态、分子及分布特征. 海洋与湖沼, 45(6): 1241-1250 |
余肖翰, 曾松福, 曹宇峰, 等, 2013. 基于流式细胞摄像技术(FlowCAM)的赤潮藻类识别分析初探. 海洋科学进展, 31(4): 515-526 DOI:10.3969/j.issn.1671-6647.2013.04.010 |
邹双燕, 2018. 福建海域东海原甲藻赤潮初探. 江西水产科技, (1): 47-48 DOI:10.3969/j.issn.1006-3188.2018.01.019 |
陈楠生, 陈阳, 2021. 中国海洋浮游植物和赤潮物种的生物多样性研究进展(二): 东海. 海洋与湖沼, 52(2): 363-384 |
周名江, 朱明远, 2006. "我国近海有害赤潮发生的生态学、海洋学机制及预测防治"研究进展. 地球科学进展, 21(7): 673-679 DOI:10.3321/j.issn:1001-8166.2006.07.003 |
周名江, 颜天, 邹景忠, 2003. 长江口邻近海域赤潮发生区基本特征初探. 应用生态学报, 14(7): 1031-1038 DOI:10.3321/j.issn:1001-9332.2003.07.001 |
赵越, 于仁成, 张清春, 等, 2019. 北部湾海域微型、微微型浮游植物类群季节变化及其与棕囊藻赤潮的关系初探. 海洋与湖沼, 50(3): 590-600 |
赵聪蛟, 刘希真, 付声景, 等, 2020. 基于水质浮标在线监测的米氏凯伦藻赤潮过程及环境因子变化特征分析. 热带海洋学报, 39(2): 88-97 |
侯建军, 黄邦钦, 戴相辉, 2004. 赤潮藻细胞计数方法比较研究. 中国公共卫生, 20(8): 907-908 DOI:10.3321/j.issn:1001-0580.2004.08.004 |
高岩, 于仁成, 柳阳, 等, 2016. 基于产毒基因sxtA的qPCR方法在长江口邻近海域有毒藻类检测中的应用初探. 海洋环境科学, 35(2): 279-287 |
黄海燕, 康林冲, 杨翼, 等, 2016. 2013年我国近海赤潮引发种种类和分布研究. 海洋科学, 40(11): 17-27 DOI:10.11759/hykx20160227001 |
AL-KANDARI M A, HIGHFIELD A C, HALL M J, et al, 2011. Molecular tools separate harmful algal bloom species, Karenia mikimotoi, from different geographical regions into distinct sub-groups. Harmful Algae, 10(6): 636-643 DOI:10.1016/j.hal.2011.04.017 |
AMADEI MARTÍNEZ L, MORTELMANS J, DILLEN N, et al, 2020. LifeWatch observatory data: phytoplankton observations in the Belgian Part of the North Sea. Biodiversity Data Journal, 8: e57236 DOI:10.3897/BDJ.8.e57236 |
ANDERSEN P, THRONDSEN J, 2003. Estimating cell numbers[M] // HALLEGRAEFF G M, ANDERSON D M, CEMBELLA A D. Manual on Harmful Marine Microalgae. Paris, France: UNESCO.
|
ANDERSON D M, CEMBELLA A D, HALLEGRAEFF G M, 2012. Progress in understanding harmful algal blooms: paradigm shifts and new technologies for research, monitoring, and management. Annual Review of Marine Science, 4: 143-176 DOI:10.1146/annurev-marine-120308-081121 |
BECKER A, MEISTER A, WILHELM C, 2002. Flow cytometric discrimination of various phycobilin-containing phytoplankton groups in a hypertrophic reservoir. Cytometry, 48(1): 45-57 DOI:10.1002/cyto.10104 |
BERGHOLTZ T, DAUGBJERG N, MOESTRUP Ø, et al, 2006. On the identity of Karlodinium Veneficum and description of Karlodinium Armiger sp. nov. (Dinophyceae), based on light and electron microscopy, nuclear-encoded LSU rDNA, and pigment composition. Journal of Phycology, 42(1): 170-193 DOI:10.1111/j.1529-8817.2006.00172.x |
BIEGALA I C, NOT F, VAULOT D, et al, 2003. Quantitative assessment of picoeukaryotes in the natural environment by using taxon-specific oligonucleotide probes in association with tyramide signal amplification-fluorescence in situ hybridization and flow cytometry. Applied and Environmental Microbiology, 69(9): 5519-5529 DOI:10.1128/AEM.69.9.5519-5529.2003 |
BUSKEY E J, HYATT C J, 2006. Use of the FlowCAM for semi-automated recognition and enumeration of red tide cells (Karenia brevis) in natural plankton samples. Harmful Algae, 5(6): 685-692 DOI:10.1016/j.hal.2006.02.003 |
CAMOYING M G, YÑIGUEZ A T, 2016. FlowCAM optimization: attaining good quality images for higher taxonomic classification resolution of natural phytoplankton samples. Limnology and Oceanography: Methods, 14(5): 305-314 DOI:10.1002/lom3.10090 |
CHEN B H, WANG K, GUO H G, et al, 2021. Karenia mikimotoi blooms in coastal waters of China from 1998 to 2017. Estuarine, Coastal and Shelf Science, 249: 107034 DOI:10.1016/j.ecss.2020.107034 |
CHISHOLM S W, OLSON R J, ZETTLER E R, et al, 1988. A novel free-living prochlorophyte abundant in the oceanic euphotic zone. Nature, 334(6180): 340-343 DOI:10.1038/334340a0 |
CROSBIE N D, TEUBNER K, WEISSE T, 2003. Flow-cytometric mapping provides novel insights into the seasonal and vertical distributions of freshwater autotrophic picoplankton. Aquatic Microbial Ecology, 33(1): 53-66 |
DUBELAAR G B J, GEERDERS P J F, JONKER R R, 2004. High frequency monitoring reveals phytoplankton dynamics. Journal of Environmental Monitoring, 6(12): 946-952 DOI:10.1039/b409350j |
FARIA D G, LEE M D, LEE J B, et al, 2014. Molecular diversity of phytoplankton in the East China Sea around Jeju Island (Korea), unraveled by pyrosequencing. Journal of Oceanography, 70(1): 11-23 DOI:10.1007/s10872-013-0208-2 |
GlobalHAB, 2017. GlobalHAB: Global Harmful Algal Blooms: Science and Implementation Plan. Paris, France: SCOR, Intergovernmental Oceanographic Commission (IOC) of UNESCO
|
HANSEN G, DAUGBJERG N, HENRIKSEN P, 2003. Comparative study of Gymnodinium mikimotoi and Gymnodinium aureolum, comb. nov. (= Gyrodinium aureolum) based on morphology, pigment composition, and molecular data. Journal of Phycology, 36(2): 394-410 DOI:10.1046/j.1529-8817.2000.99172.x |
HRYCIK A R, SHAMBAUGH A, STOCKWELL J D, 2019. Comparison of FlowCAM and microscope biovolume measurements for a diverse freshwater phytoplankton community. Journal of Plankton Research, 41(6): 849-864 DOI:10.1093/plankt/fbz056 |
JIAO N Z, YANG Y H, 2002. Ecological studies on Prochlorococcus in China seas. Chinese Science Bulletin, 47(15): 1243-1250 DOI:10.1360/02tb9276 |
KARLSON B, CUSACK C, BRESNAN E, 2010. Microscopic and Molecular Methods for Quantitative Phytoplankton Analysis. Paris, France: UNESCO
|
KARNAN C, JYOTHIBABU R, ARUNPANDI N, et al, 2020. Response of microplankton size structure to summer stratification, freshwater influx and coastal upwelling in the Southeastern Arabian Sea. Continental Shelf Research, 193: 104038 DOI:10.1016/j.csr.2019.104038 |
KERR T, CLARK J R, FILEMAN E S, et al, 2020. Collaborative deep learning models to handle class imbalance in FlowCam plankton imagery. IEEE Access, 8: 170013-170032 DOI:10.1109/ACCESS.2020.3022242 |
LI X D, YAN T, LIN J N, et al, 2017. Detrimental impacts of the dinoflagellate Karenia mikimotoi in Fujian coastal waters on typical marine organisms. Harmful Algae, 61: 1-12 DOI:10.1016/j.hal.2016.11.011 |
LI X D, YAN T, YU R C, et al, 2019. A review of karenia mikimotoi: Bloom events, physiology, toxicity and toxic mechanism. Harmful Algae, 90: 101702 DOI:10.1016/j.hal.2019.101702 |
LIN J N, SONG J J, YAN T, et al, 2015. Large-scale dinoflagellate bloom species Prorocentrum donghaiense and Karenia mikimotoi reduce the survival and reproduction of copepod Calanus sinicus. Journal of the Marine Biological Association of the United Kingdom, 95(6): 1071-1079 DOI:10.1017/S0025315415000533 |
LIN J N, YAN T, ZHANG Q C, et al, 2014. In situ detrimental impacts of Prorocentrum donghaiense blooms on zooplankton in the East China Sea. Marine Pollution Bulletin, 88(1/2): 302-310 |
LU D D, QI Y Z, GU H F, et al, 2014. Causative species of harmful algal blooms in Chinese coastal waters. Algological Studies, 145/146: 145-168 DOI:10.1127/1864-1318/2014/0161 |
OLSON R J, FRANKEL S L, CHISHOLM S W, et al, 1983. An inexpensive flow cytometer for the analysis of fluorescence signals in phytoplankton: chlorophyll and DNA distributions. Journal of Experimental Marine Biology and Ecology, 68(2): 129-144 DOI:10.1016/0022-0981(83)90155-7 |
OTÁLORA P, GUZMÁN J L, ACIÉN F G, et al, 2021. Microalgae classification based on machine learning techniques. Algal Research, 55: 102256 DOI:10.1016/j.algal.2021.102256 |
PANT G, YADAV D P, GAUR A, 2020. ResNeXt convolution neural network topology-based deep learning model for identification and classification of Pediastrum. Algal Research, 48: 101932 DOI:10.1016/j.algal.2020.101932 |
PATIL J S, ANIL A C, 2015. Effect of monsoonal perturbations on the occurrence of phytoplankton blooms in a tropical bay. Marine Ecology Progress Series, 530: 77-92 DOI:10.3354/meps11289 |
PROMDAEN S, WATTUYA P, SANEVAS N, 2014. Automated microalgae image classification. Procedia Computer Science, 29: 1981-1992 DOI:10.1016/j.procs.2014.05.182 |
ROMERO-MARTÍNEZ L, VAN SLOOTEN C, NEBOT E, et al, 2017. Assessment of imaging-in-flow system (FlowCAM) for systematic ballast water management. Science of the Total Environment, 603/604: 550-561 DOI:10.1016/j.scitotenv.2017.06.070 |
SCANLAN D J, OSTROWSKI M, MAZARD S, et al, 2009. Ecological genomics of marine picocyanobacteria. Microbiology and Molecular Biology Reviews, 73(2): 249-299 DOI:10.1128/MMBR.00035-08 |
SEE J H, CAMPBELL L, RICHARDSON T L, et al, 2005. Combining new technologies for determination of phytoplankton community structure in the Northern Gulf of Mexico. Journal of Phycology, 41(2): 305-310 DOI:10.1111/j.1529-8817.2005.04132.x |
SIERACKI C K, SIERACKI M E, YENTSCH C S, 1998. An imaging-in-flow system for automated analysis of marine microplankton. Marine Ecology Progress Series, 168: 285-296 DOI:10.3354/meps168285 |
SIMON N, BARLOW R G, MARIE D, et al, 1994. Characterization of oceanic photosynthetic picoeukaryotes by flow cytometry. Journal of Phycology, 30(6): 922-935 DOI:10.1111/j.0022-3646.1994.00922.x |
SOSIK H M, OLSON R J, 2007. Automated taxonomic classification of phytoplankton sampled with imaging-in-flow cytometry. Limnology and Oceanography: Methods, 5(6): 204-216 DOI:10.4319/lom.2007.5.204 |
STEELE R E, PATTERSON R T, HAMILTON P B, et al, 2020. Assessment of FlowCam technology as a potential tool for rapid semi-automatic analysis of lacustrine Arcellinida (testate lobose amoebae). Environmental Technology & Innovation, 17: 100580 |
TRASK B J, VAN DEN ENGH G J, ELGERSHUIZEN J H B W, 1982. Analysis of phytoplankton by flow cytometry. Cytometry, 2(4): 258-264 |
UTERMÖHL H, 1958. Zur vervollkommung der quantitativen phytoplankton-methodik. Mitteilungen internationale Vereinigung für Theoretische und Angewandte Limnologie, 9: 1-38 |
WONG E, SASTRI A R, LIN F S, et al, 2017. Modified FlowCAM procedure for quantifying size distribution of zooplankton with sample recycling capacity. PLoS One, 12(4): e0175235 DOI:10.1371/journal.pone.0175235 |
YADAV D P, JALAL A S, GARLAPATI D, et al, 2020. Deep learning-based ResNeXt model in phycological studies for future. Algal Research, 50: 102018 DOI:10.1016/j.algal.2020.102018 |
YENTSCH C M, HORAN P K, MUIRHEAD K, et al, 1983. Flow cytometry and cell sorting: a technique for analysis and sorting of aquatic particles. Limnology and Oceanography: Methods, 28(6): 1275-1280 DOI:10.4319/lo.1983.28.6.1275 |
ZAMOR R M, GLENN K L, HAMBRIGHT K D, 2012. Incorporating molecular tools into routine HAB monitoring programs: using qPCR to track invasive Prymnesium. Harmful Algae, 15: 1-7 DOI:10.1016/j.hal.2011.10.028 |
ZHOU M J, SHEN Z L, YU R C, 2008. Responses of a coastal phytoplankton community to increased nutrient input from the Changjiang (Yangtze) River. Continental Shelf Research, 28(12): 1483-1489 DOI:10.1016/j.csr.2007.02.009 |
 2022, Vol. 53
2022, Vol. 53


