中国海洋湖沼学会主办。
文章信息
- 李静, 逄少军, 苏丽, 李晓东. 2022.
- LI Jing, PANG Shao-Jun, SU Li, LI Xiao-Dong. 2022.
- 海带褐藻多酚对绿烂海带表面分离的一株细菌的抑菌效果研究
- THE ANTIBACTERIAL ACTIVITY OF PHLOROTANNINS AGAINST A BACTERIA ISOLATE FROM BROWN ALGA SACCHARINA JAPONICA SUFFERED WITH GREEN-ROTTEN DISEASE
- 海洋与湖沼, 53(2): 346-351
- Oceanologia et Limnologia Sinica, 53(2): 346-351.
- http://dx.doi.org/10.11693/hyhz20210800193
文章历史
-
收稿日期:2021-08-31
收修改稿日期:2021-12-13
2. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室 山东青岛 266071;
3. 中国科学院海洋大科学研究中心 山东青岛 266071
2. Marine Biology and Biotechnology Laboratory, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
海带是我国重要的栽培经济海藻。随着养殖规模持续增加以及海洋环境的持续变化, 海带病害有逐年增加的趋势。其中, 绿烂病危害最为严重, 它具有暴发频繁、发病时间短、蔓延快以及短时间可造成大批幼苗死亡的特点, 从而给海带养殖企业造成巨大经济损失, 也严重威胁着海带养殖生产任务的完成。
海带绿烂病的产生伴随着褐藻酸降解菌的大量增殖, 研究表明患病藻体上的褐藻酸降解菌数量比正常藻体上的数量高100~500倍(林伟等, 2004)。褐藻酸降解菌作为一类能够降解褐藻酸的细菌, 广泛分布于海带养殖区及藻体表面, 并且对褐藻酸钠具有明显的选择性和趋化性。一定浓度的褐藻酸钠是褐藻酸降解菌生长所必需, 因此可以通过褐藻酸钠培养基特异性地选择该类菌种(王艳玲等, 2003)。经证实, 褐藻酸降解菌是海带绿烂病的条件致病菌(Wang et al, 2008), 当海带处于不良环境因子胁迫下, 例如光照不足, 密度过大及营养不良时, 褐藻酸降解菌可以成功侵染藻体细胞, 造成细胞结构变化甚至死亡(Wang et al, 2004)。
褐藻多酚是海洋褐藻特有的化学防御物质, 是褐藻次级代谢产生的以间苯三酚为结构单元的聚合物(Shrestha et al, 2021), 具有抗氧化、抗菌、抗炎症及抗肿瘤等多种生物学活性(Cotas et al, 2020)。褐藻多酚具有广谱抑菌活性, 主要是通过影响细菌细胞膜的结构和功能, 裂解细菌细胞壁, 破坏细菌细胞膜的完整性, 从而达到抑菌效果(Nagayama et al, 2002; 董玲丽等, 2018)。曲词等(2016)发现在海黍子中提取的褐藻多酚对枯草芽孢杆菌、产气杆菌、变形杆菌和金黄色葡萄球菌均具有明显的抑制效果, 且多酚溶液经过萃取提纯之后, 抑菌效果有所提高。吴越(2014)以羊栖菜为研究对象, 采用不同抽提物抽提羊栖菜藻体内的褐藻多酚, 得到的褐藻多酚含量和抗菌活性显著不同。Jaswir (2014)分析了4种马尾藻属海藻(Sargassum plagyophillum, Sargassum flavellum, Padina australis, Sargassum binderi)的褐藻多酚的抑菌活性, 发现4种海藻对革兰氏阳性菌具有抑菌效果, 但对革兰氏阴性菌无抑菌效果(Jaswir et al, 2014)。海带褐藻多酚的抑菌活性也有相关报道, 如杨会成(2008)发现海带褐藻多酚对受试的2种革兰氏阳性菌和5种革兰氏阴性菌均有抑菌效果; 符晓杰等(2013)分析海带多酚得到9种组分, 其中5种组分对4种受试菌株均有一定的抑菌作用, 但是对枯草芽孢杆菌无抑菌效应。
海带褐藻多酚占海带干重的0.3% (严小军, 1996), 曾呈奎等(1985)认为海带中的多酚化合物是海带病害初期防御病原体侵入的主要手段与物质基础; 另有研究表明, 褐藻多酚与抗褐藻酸降解菌密切相关, 是海带绿烂病过程中最早启动的化学防御应答反应之一(王丽丽等, 2004)。本研究开展海带褐藻多酚对绿烂海带表面分离的细菌抑菌效果的研究, 对于了解海带病害暴发及开展海带病害防治具有重要意义。
1 材料与方法 1.1 材料绿烂海带苗: 采用雌性和雄性配子体克隆杂交培育获得长度为6~8 cm的海带苗, 培养在中科院海洋所海藻种质库循环制冷水系统中, 出现绿烂病症(图 1)。
 |
| 图 1 绿烂海带苗 Fig. 1 Seedling of Saccharina japonica suffered from green-rotten disease. |
褐藻酸钠固体培养基: 海藻酸钠5 g, 硫酸铵5 g, 硫酸镁1 g, 磷酸氢二钾2 g, 硫酸亚铁0.01 g, 琼脂20 g, 氯化钠30 g, 蒸馏水1 000 mL, pH值7.2~7.4, 121 ℃灭菌20 min。
2216E固体培养基: 称取52.4 g培养基样品加热溶解于1 000 mL蒸馏水中, 121 ℃灭菌20 min。
2216E液体培养基: 称取37.4 g培养基样品加热溶解于1 000 mL蒸馏水中, 121 ℃灭菌20 min。
1.2 细菌的分离和鉴定采用无菌海水对绿烂海带苗进行冲洗, 以去除表面附着的杂质及其他污染物; 随后加入适量无菌海水, 用灭菌的研磨棒研磨海带苗, 用无菌移液器取200 µL上清液均匀涂布到褐藻酸钠固体培养基上, 在28 ℃倒置培养5~7 d后, 挑取培养基上较大的菌落, 采用平板划线的方式, 进行菌种的纯化和分离。
挑取获得的纯的单菌落, 采用索莱宝生物科技有限公司生产的细菌基因组提取试剂盒提取菌株的基因组DNA, 以其为模板, 采用16S rRNA基因通用引物7F(CAGAGTTTGATCCTGGCT)和1540R(AGG AGGTGATCCAGCCGCA)(Di Cello et al, 1997)对菌株进行序列扩增, 将扩增后的序列送至北京擎科生物科技有限公司进行测序, 测序结果提交GenBank进行BLAST序列比对, 选取同源性较高的菌株的16S rRNA基因序列, 利用MEGA7.0软件中的邻接法构建系统发育树。
1.3 褐藻多酚粗提液的提取及浓度测定 1.3.1 制备褐藻多酚粗提液准确称取来源于荣成养殖海域的健康海带匀浆50 g, 放入具塞三角瓶中加入乙醇, 玻璃棒搅拌均匀, 超声处理30 min, 随后放入70 ℃水浴摇床中, 转速100 r/min, 避光浸提4 h。最后用布氏漏斗抽滤, 滤渣重复浸提一次, 合并两次提取液减压旋蒸除去乙醇, 用蒸馏水定容至50 mL, 即得海带多酚粗提液。
1.3.2 确定褐藻多酚粗提液浓度采用福林酚测定方法, 具体操作步骤参考文献(Koivikko et al, 2005), 以间苯三酚作为标准反应物, 制作标准曲线, 依据标准曲线对褐藻多酚粗提液进行浓度的确定。
1.4 褐藻多酚粗提液抑菌效果测定将褐藻多酚粗提液15 mL冷冻干燥, 得到粉末状物质, 随后加入3 mL无菌蒸馏水, 制备浓缩的褐藻多酚粗提液。将褐藻多酚粗提液最高浓缩5倍后, 采用2倍稀释法, 用无菌蒸馏水进行倍比稀释, 制备系列浓度稀释液, 获得5个浓度梯度的褐藻多酚粗提液。以无菌蒸馏水作为对照。
选取分离得到的一株细菌以及前期在海水中分离鉴定到的两株褐藻酸降解菌株哈维氏弧菌(Vibrio harveyi)和溶藻弧菌(Vibrio alginolyticus)作为对照。上述菌株分别采用2216E液体培养基制备菌悬液, 使菌悬液浓度大约在105~106 CFU/mL, 用移液枪吸取200 µL菌悬液, 加入无菌培养皿中, 立即倒入融化后冷却至45~50 ℃的2216E固体培养基约15 mL, 随即在平面上快速而轻巧的晃动培养皿, 使菌悬液和培养基混合均匀后平置, 待其冷却。在洁净工作台内, 将经过紫外线照射杀菌20 min后的移液枪装上特制枪头, 在已冷却的营养琼脂平板上均匀地打上5个直径为3 mm的光滑小孔, 其中1个小孔加10 µL无菌蒸馏水作为对照, 其余4个小孔分别加10 µL过滤除菌后的待测液, 每个浓度的待测液平行做4组。加完样液后平板静置放置10 min, 以保证待测液分散均匀。将已经加样的含菌平板倒置放入28 ℃的恒温培养箱中, 培养12~24 h后观察抑菌结果, 测量抑菌圈直径(杨会成, 2008)。
2 结果与分析 2.1 细菌鉴定通过采用16S rRNA基因通用引物7F和1540R对菌株进行序列扩增及序列测定, 将所的序列信息提交到GenBank (SUB10527418), 选取同源性较高的几个物种的16SrRNA基因序列, 利用邻接法构建系统发育树(图 2), 该菌株与Bacillus foraminis strain FV1 (JQ867498.1)聚合为一支, 初步判断该菌株为小孔芽孢杆菌(Bacillus foraminis)。
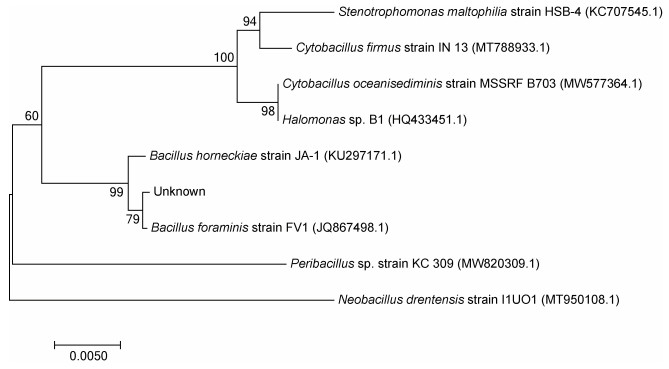 |
| 图 2 基于16s rRNA基因序列构建的系统发育树 Fig. 2 Phylogenetic tree based on 16s rRNA genes sequence |
间苯三酚标准曲线见图 3, 以间苯三酚标准溶液浓度为横坐标, 吸光度为纵坐标, 制作标准曲线, 如图所示, 间苯三酚的浓度在0~10 µg/mL范围内线性关系良好。
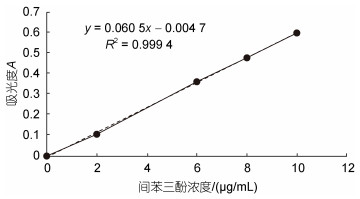 |
| 图 3 间苯三酚标准曲线 Fig. 3 Standard curve of phloroglucine |
在不能确定褐藻多酚粗提液浓度的前提下, 将其稀释了5个浓度梯度, 分别进行溶液吸光度的测定, 以便得到准确的结果。当稀释倍数为8倍和16倍时测得的吸光度所对应的间苯三酚的浓度在0~ 10 µg/mL区间范围内。因此, 选取这两组稀释液计算褐藻多酚粗提液原液的浓度。根据标准曲线方程式y=0.0605x−0.0047 (y为吸光值, x为褐藻多酚浓度)进行计算, 测定所提取的褐藻多酚粗提液原液浓度为59 µg/mL。
2.3 褐藻多酚粗提液抑菌效果5个浓度的褐藻多酚粗提液对三种菌株的抑菌活性结果如表 1所示。褐藻多酚溶液设置了5个浓度梯度, 当褐藻多酚浓度为73.75、147.50和295.00 µg/mL时, 会在接种有哈维氏弧菌和溶藻弧菌的培养基上产生抑菌圈, 表明褐藻多酚为73.75~295.00 µg/mL的浓度区间, 可以对两种细菌产生抑菌效果。而5种浓度的褐藻多酚溶液在接种有小孔芽孢杆菌的培养基上均无抑菌圈的产生。这表明褐藻多酚最高浓度达到295.00 µg/mL时, 对小孔芽孢杆菌亦无抑制效果。
| 褐藻多酚浓度/(µg/mL) | 哈维氏弧菌(Vibrio harveyi)抑菌圈直径/mm | 溶藻弧菌(Vibrio alginolyticus)抑菌圈直径/mm | 小孔芽孢杆菌(Bacillus foraminis)抑菌圈直径/mm |
| 295.00 | 23.50±2.52 | 20.00±1.63 | - |
| 147.50 | 19.50±1.00 | 17.00±1.15 | - |
| 73.75 | 12.00±2.31 | 16.00±1.63 | - |
| 36.88 | - | - | - |
| 18.44 | - | - | - |
| 注: -代表无抑菌圈产生 | |||
本研究在发生绿烂的海带幼苗藻体上筛选到了一株芽孢杆菌属菌株, 芽孢杆菌属细菌普遍存在于陆地、水环境(Ivanova et al, 1999)等多种条件中, 甚至在水稻和玉米的内部组织中也有分布(Rijavec et al, 2007; Liu et al, 2009)。目前, 芽孢杆菌属已鉴定得到200多种菌种(Kämpfer et al, 2017)。本研究中分离到的芽孢杆菌属菌种为小孔芽孢杆菌(B, foraminis), 该菌株也被报道存在于褐藻墨角藻(Fucus vesiculosus)藻体表面(Nasrolahi et al, 2012)。王明鹏等(2018)在铜藻表面也筛选到了具有褐藻酸降解能力的芽孢杆菌属菌株, 分别为特基拉芽孢杆菌(Bacillus tequilensis)、甲基营养型芽孢杆菌(Bacillus methylotrophicus)和地衣芽孢杆菌(Bacillus licheniformis)。由此可见, 芽孢杆菌属细菌广泛存在于海带、墨角藻及铜藻等多种褐藻藻体表面。
研究表明, 藻体表面的附生细菌既包含有益菌也包含有害菌, 当藻体发生病害时, 藻体表面的菌群结构将会发生变化(Li et al, 2020), 甚至在不同温度、光照等培养条件下, 藻体表面附生菌的菌群结构亦会产生显著变化(Li et al, 2021)。但是, 存在于藻体表面的附生细菌, 有些可以通过配置不同的培养基进行富集培养, 而另外一些菌种无法通过培养而获得。本文在绿烂海带苗藻体表面, 采用褐藻酸钠选择性培养基筛选获得了小孔芽孢杆菌, 褐藻酸钠为该培养基中的唯一碳源, 小孔芽孢杆菌能够在此培养基存活、生长, 反映了该菌株能够利用褐藻酸钠, 具备褐藻酸降解的能力, 而有关该菌株褐藻酸降解能力的强弱需在后期实验中进一步验证。
哈维氏弧菌(V. harveyi)及溶藻弧菌(V. alginolyticus)已被证实能够分泌褐藻酸降解酶, 为褐藻酸降解菌(Wong et al, 2000)。前期研究中, 在鼠尾藻中提取的多酚组分对两种菌株均具有抑菌活性(郭奇等, 2010), 在此次研究中, 海带多酚粗提液对两种细菌亦表现出抑菌活性, 但是在多酚对细菌的抑菌浓度方面却存在明显差异。提取的鼠尾藻多酚经超滤分级, 得到5种组分, 其中抑菌活性最高的组分1对哈维氏弧菌和溶藻弧菌的最小抑菌浓度分别为900和1 200 µg/mL。而在本研究中, 从海带中提取的多酚粗提液浓度为73.75 µg/mL时, 仍旧对哈维氏弧菌和溶藻弧菌具有抑制性。造成这一差异的原因, 一方面可能是海带多酚组分与鼠尾藻多酚组分不同, 且海带多酚组分对两种细菌的抑菌活性更高; 另一方面可能是多酚各组分分级后的抑菌活性低于多酚各组分混合液的抑菌活性, 因此需要提高分级后的组分浓度才能对细菌产生抑菌效果。
在本次研究中, 当海带多酚粗提液浓度达到295.00 µg/mL时, 对小孔芽孢杆菌仍然不存在抑菌活性, 虽然在前期研究中并未见有关多酚对小孔芽胞杆菌抑菌效果的报道, 但是, 已有研究表明海带多酚及鼠尾藻多酚各组分分级后对芽孢杆菌属的枯草芽孢杆菌(Bacillus subtilis)无抑菌效果, 而海带多酚粗提液却对枯草芽孢杆菌存在抑菌效果(符晓杰等, 2013)。造成该抑菌效果差异的原因, 一方面, 可能是由于采用的实验方法不同, 造成了结果的差异; 另一方面, 我们推测可能是褐藻多酚粗提液对芽孢杆菌属细菌的抑菌性较弱, 是否可以通过提高粗提液多酚浓度才能表现出抑菌效果还有待进一步研究。
本研究开展的海带多酚粗提液的抑菌实验表明, 具有广谱抗菌效果的褐藻多酚对绿烂海带表面分离得到的小孔芽胞杆菌无抑菌效果。而小孔芽孢杆菌是否具有致病性, 还有待进一步复染海带苗进行验证。
4 结论本研究在发生绿烂病的海带苗上分离获得了小孔芽孢杆菌, 初步探究了海带褐藻多酚对小孔芽孢杆菌的抑菌效果, 发现具有广谱抑菌效果的海带化学防御物质褐藻多酚对该菌株无抑菌活性, 说明海带化学防御物质褐藻多酚并非对海带表面所有的附生菌都有明显的抑制效果, 该研究结果对于了解海带病害暴发及开展海带病害防治具有重要意义。
王丽丽, 唐学玺, 王蒙, 等, 2004. 海带病烂发生过程中的生理生化变化研究(Ⅱ)——PAL, PPO和多酚的变化. 海洋科学进展, 22(1): 73-76 DOI:10.3969/j.issn.1671-6647.2004.01.011 |
王明鹏, 王学江, 陈蕾, 2018. 褐藻表面可培养褐藻酸降解菌的原位筛选. 微生物学通报, 45(9): 1853-1860 |
王艳玲, 唐学玺, 杨震, 2003. 褐藻酸降解菌的筛选及其生长条件. 中国水产科学, 10(1): 51-54 DOI:10.3321/j.issn:1005-8737.2003.01.011 |
曲词, 任丹丹, 任先见, 等, 2016. 海黍子多酚提取工艺的优化及抑菌活性研究. 食品工业, 37(11): 169-172 |
严小军, 1996. 中国常见褐藻的多酚含量测定. 海洋科学集刊, (37): 61-65 |
杨会成, 2008. 海带(Laminaria japonica Aresch)多酚的提取、分离及其抗肿瘤、抗菌活性研究[D]. 青岛: 中国海洋大学.
|
吴越, 2014. 羊栖菜生物活性成分研究[D]. 哈尔滨: 东北林业大学.
|
林伟, 张伟伟, 严小军, 等, 2004. 褐藻酸降解菌在海带(Laminaria japonica)幼苗藻体表面数量分布特点及其对海带回染的初步研究. 海洋与湖沼, 35(6): 562-567 DOI:10.3321/j.issn:0029-814X.2004.06.013 |
郭奇, 魏玉西, 殷邦忠, 等, 2010. 鼠尾藻多酚分级组分的抑菌活性研究. 渔业科学进展, 31(1): 117-121 DOI:10.3969/j.issn.1000-7075.2010.01.019 |
符晓杰, 徐年军, 廖智, 等, 2013. 海带多酚的提取和抑菌研究. 安徽农业科学, 41(9): 4099-4100, 4196 DOI:10.3969/j.issn.0517-6611.2013.09.122 |
董玲丽, 姜翠丽, 柴怡, 等, 2018. 羊栖菜生物活性成分研究综述. 现代农业科技, (16): 230-233 DOI:10.3969/j.issn.1007-5739.2018.16.141 |
曾呈奎, 王素娟, 刘思俭, 等, 1985. 海藻栽培学. 上海: 上海科学技术出版社
|
COTAS J, LEANDRO A, MONTEIRO P, et al, 2020. Seaweed phenolics: from extraction to applications. Marine Drugs, 18(18): 384 |
DI CELLO F, BEVIVINO A, CHIARINI L, et al, 1997. Biodiversity of a Burkholderia cepacia population isolated from the maize rhizosphere at different plant growth stages. Applied and Environmental Microbiology, 63(11): 4485-4493 DOI:10.1128/aem.63.11.4485-4493.1997 |
IVANOVA E P, VYSOTSKⅡ M V, SVETASHEV V I, et al, 1999. Characterization of Bacillus strains of marine origin. International Microbiology, 2(4): 267-271 |
JASWIR I, TOPE A H T, RAUS R A, et al, 2014. Study on anti-bacterial potentials of some Malaysian brown seaweeds. Food Hydrocolloids, 42: 275-279 DOI:10.1016/j.foodhyd.2014.03.008 |
KÄMPFER P, BUSSE H J, MCINROY J A, et al, 2017. Bacillus zeae sp. nov., isolated from the rhizosphere of Zea mays. International Journal of Systematic and Evolutionary Microbiology, 67(5): 1241-1246 DOI:10.1099/ijsem.0.001791 |
KOIVIKKO R, LOPONEN J, HONKANEN T, et al, 2005. Contents of soluble, cell-wall-bound and exuded phlorotannins in the brown alga Fucus vesiculosus, with implications on their ecological functions. Journal of Chemical Ecology, 31(1): 195-212 DOI:10.1007/s10886-005-0984-2 |
LI J, LI Q X, SU L, et al, 2021. Effects of light intensity on the epiphytic bacterial community of sporelings of Saccharina japonica. Journal of Applied Phycology, 33(3): 1759-1764 DOI:10.1007/s10811-021-02406-2 |
LI J, PANG S J, SHAN T F, et al, 2020. Changes of microbial community structures associated with seedlings of Saccharina japonica at early stage of outbreak of green rotten disease. Journal of Applied Phycology, 32(2): 1323-1327 DOI:10.1007/s10811-019-01975-7 |
LIU B, QIAO H P, HUANG L L, et al, 2009. Biological control of take-all in wheat by endophytic Bacillus subtilis E1R-j and potential mode of action. Biological Control, 49(3): 277-285 DOI:10.1016/j.biocontrol.2009.02.007 |
NAGAYAMA K, IWAMURA Y, SHIBATA T, et al, 2002. Bactericidal activity of phlorotannins from the brown alga Ecklonia kurome. Journal of Antimicrobial Chemotherapy, 50(6): 889-893 DOI:10.1093/jac/dkf222 |
NASROLAHI A, STRATIL S B, JACOB K J, et al, 2012. A protective coat of microorganisms on macroalgae: inhibitory effects of bacterial biofilms and epibiotic microbial assemblages on barnacle attachment. FEMS Microbiology Ecology, 81(3): 583-595 DOI:10.1111/j.1574-6941.2012.01384.x |
RIJAVEC T, LAPANJE A, DERMASTIA M, et al, 2007. Isolation of bacterial endophytes from germinated maize kernels. Canadian Journal of Microbiology, 53(6): 802-808 DOI:10.1139/W07-048 |
SHRESTHA S, ZHANG W, SMID S D, 2021. Phlorotannins: a review on biosynthesis, chemistry and bioactivity. Food Bioscience, 39: 100832 DOI:10.1016/j.fbio.2020.100832 |
WANG G G, LIN W, ZHANG L J, et al, 2004. Programmed cell death in Laminaria japonica (Phaeophyta) tissues infected with alginic acid decomposing bacterium. Progress in Natural Science, 14(12): 1064-1068 DOI:10.1080/10020070412331344811 |
WANG G G, SHUAI L, LI Y, et al, 2008. Phylogenetic analysis of epiphytic marine bacteria on Hole-Rotten diseased sporophytes of Laminaria japonica. Journal of Applied Phycology, 20(4): 403-409 DOI:10.1007/s10811-007-9274-4 |
WONG T Y, PRESTON L A, SCHILLER N L, 2000. Alginate lyase: review of major sources and enzyme characteristics, structure-function analysis, biological roles, and applications. Annual Review of Microbiology, 54: 289-340 DOI:10.1146/annurev.micro.54.1.289 |
 2022, Vol. 53
2022, Vol. 53


