中国海洋湖沼学会主办。
文章信息
- 谢林青, 曹为, 蒋凤华, 李景喜, 孙承君. 2022.
- XIE Lin-Qing, CAO Wei, JIANG Feng-Hua, LI Jing-Xi, SUN Cheng-Jun. 2022.
- 印度洋深海热液区贻贝足丝结构和性能特征研究
- THE STRUCTURE AND PERFORMANCE OF MUSSEL BYSSUS IN THE DEEP-SEA HYDROTHERMAL AREA OF THE INDIAN OCEAN
- 海洋与湖沼, 53(2): 364-374
- Oceanologia et Limnologia Sinica, 53(2): 364-374.
- http://dx.doi.org/10.11693/hyhz20210900213
文章历史
-
收稿日期:2021-09-16
收修改稿日期:2021-10-25
2. 青岛海洋科学与技术试点国家实验室 海洋药物与生物制品功能实验室 山东青岛 266200
2. Laboratory of Marine Drugs and Biological Products, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266200, China
贻贝是一种营半固着生活的软体动物, 主要生活在近海的潮间带和潮下带等地。近些年来研究发现, 在深海冷泉(Cosel et al, 1998)、大洋热液区(Duperron et al, 2019)也有贻贝生活的痕迹。为了对抗海洋恶劣的生存环境, 贻贝在漫长的进化历程中形成了一种特殊的固定器——足丝, 成为研究海洋环境中生物黏附和梯度功能材料的模式生物(Waite et al, 2005)。目前对于足丝的研究主要集中在足丝的生物黏附机制和仿生材料(刚性与韧性兼顾的梯度材料)的开发方面。近海贻贝的足丝主要分为两部分: 丝和黏附盘, 而丝又可分为远端刚性区和近端弹性区, 贻贝通过足丝在潮湿或水下环境中能够牢固地黏附在多种底物上(图 1a)(Aldred et al, 2006; Harrington et al, 2018)。足丝主要由蛋白质组成(大约97%), 目前从贻贝足丝中已经鉴定出至少十一种主要的黏附蛋白: 胶原蛋白(precollagen, preCOL)、足丝基质蛋白和贻贝足蛋白(Mussel foot protein, Mfp)等(Ravindranath et al, 1972; Sun et al, 2002)。三种胶原蛋白(preCOL-D, -P和-NG)构成了足丝内部的主体, 其中preCOL-D和-P胶原蛋白呈梯度分布, 两者具有不同的力学特征。这种不同的力学特征主要来自于preCOL-D和-P的侧翼结构域, 它们分别类似于刚性蜘蛛丝和弹性蚕丝蛋白(Waite et al, 2002; Hassenkam et al, 2004)。这种具有不同力学特征蛋白的梯度分布使得足丝具有极好的韧性, 在遭遇外力作用时足丝能够在短时间内吸收大量能量来实现力量缓冲(Waite et al, 2002)。贻贝足蛋白主要分布在足丝的表层和黏附盘中, 对贻贝足蛋白(Mfp)的表征分析发现Mfp-1、-3和-5中含有大量的3, 4-二羟基-L-苯丙氨酸(dihydroxyphenylalani, DOPA)(Hassenkam et al, 2004)。研究发现贻贝足丝的强黏附能力与DOPA有关, 足蛋白中的DOPA通过参与金属螯合(Zeng et al, 2010)、共价结合(Yu et al, 2013)以及氢键结合(Kim et al, 2017)等方式来增强足丝的黏附能力。但是由于我们对分子层面和多维结构材料了解不够深入, 且贻贝足蛋白DOPA中邻苯二酚本身不稳定, 容易氧化, 因此仿足丝蛋白黏附材料的应用受到很大限制。近海贻贝足丝表层覆盖着4~5 μm厚的保护性角质层, 其中Mfp-1是主要成分, 由Mfp-1组成的角质层既能保护足丝内部又能承受内部所表现的近70%的应变(Harrington et al, 2018)。这种角质层结构使得具梯度力学性能的足丝有优异的抗接触形变和损坏的能力, 同时在海洋环境中也能够帮助足丝抵抗海水侵蚀和细菌感染(Kim et al, 2016)。因此近海贻贝足丝的结构和功能对其适应环境具有重要作用。
 |
| 图 1 贻贝和足丝图 Fig. 1 Mussels and byssus images 注: a. 贻贝足丝结构示意图; b. 近海贻贝(Mytilus galloprovincialis); c. 深海贻贝(Bathymodiolus marisindicus) |
随着对海洋特殊生境研究的深入, 研究发现深海贻贝通常在大洋深海热液区生物中占主体地位。Distel等(2000)提出近海贻贝可能通过木头、鲸落等途径转移到深海定居, 成为深海贻贝的祖先。Sun等(2017)通过基因系统发育研究发现近海菲律宾偏顶蛤(Modiolus philippinarum)是深海偏顶蛤(Bathymodiolus platifrons)的祖先, 深海贻贝(B. platifrons)是近海贻贝(M. philippinarum)在一亿多年前移居到深海进化而来的。到目前为止, 科学家已经在印度洋、大西洋以及太平洋多个深海热液区都发现了深海贻贝, 对这些深海贻贝的研究主要集中在深海贻贝共生菌(Duperron et al, 2016)、基因组和系统发育(Sun et al, 2017)等方面。最近Zhou等(2020)、李景喜等(2017)和Bebianno等(2018)分别对西太平洋、西南印度洋和大西洋中脊等地的热液区贻贝体内的重金属及指示物进行分析, 研究热液区贻贝在深海热液环境下的重金属适应, 还有一些学者从生物节律(Mat et al, 2020)、种群调节因素(Metaxas, 2015)等方向对深海热液区贻贝展开研究分析, 从进化、种群等方面探索热液区贻贝对深海热液环境的适应性。由于热液区熔岩喷口中心温度极高, 能达到350~400 ℃, 以喷口为中心向外围温度逐渐降低, 生物也随着喷口温度向四周辐射分布(魏曼曼等, 2012)。这种奇特的极端生存环境(高温、高压、低营养、高盐等)也造就了热液区独特的贝类群落和生态习性等。但是目前对于热液区深海贻贝足丝的结构和功能研究非常少。
贻贝足丝结构和功能是探索深海贻贝适应热液区极端环境的重要方面, 因此为探索热液区深海贻贝足丝的结构和功能特点, 本文采集了西南印度洋热液区深海贻贝足丝, 利用光学显微镜和扫描电镜对印度洋热液区深海贻贝足丝进行形貌表征, 通过力学性能测试发现深海热液区贻贝足丝不同于近海贻贝足丝的力学性能表现。然后采用氨基酸分析和傅里叶变换红外光谱(Fourier Transform infrared spectrometer, FT-IR)对足丝组分进行分析。结果显示印度洋热液区深海贻贝足丝在结构、组成和力学性能方面与近海贻贝足丝存在明显差异。这为深海贻贝足丝结构和功能的探索以及研究印度洋热液区深海贻贝的生物适应性提供了一定的理论支持。
1 材料与方法 1.1 材料准备热液区深海贻贝Bathymodiolus marisindicus, 深海偏顶蛤属, 于2019年4月利用无人潜器海龙II ROV采集于西南印度洋中脊龙旂热液区(37°82′S, 49°58′E), 采集水深2 700 m。将ROV采集的热液区深海贻贝放到解剖盘内, 将贻贝剖开, 将足丝从根部取出后马上置于50 mL一次性离心管中, 密封保存在4 ℃冰箱内。去除所有足丝的深海贻贝则马上转移至−80 ℃超低温冰箱中冷冻保存。近海贻贝Mytilus galloprovincialis, 又称紫贻贝, 采集自青岛近海(36°10′N, 120°54′E), 采集后马上将M. galloprovincialis转移至实验室天然海水槽中, 利用橡皮筋将贻贝松弛地简单固定到缠有鱼线的塑料底板上, 通气培养, 采集足丝, 通常一星期内可反复多次采集其足丝, 采集后的足丝用过滤海水冲洗去除表面杂质后密封, 置于4 ℃冰箱保存。本研究所采用的深、近海贻贝足丝分别取自至少10只热液区深海贻贝和近海贻贝, 每只贻贝取用3~5条足丝。贻贝图片如图 1b和图 1c所示。
1.2 力学检测利用配备测量功能的体式显微镜(SMZ1270, Nikon)观察热液区贻贝和近海贻贝的足丝外观形貌, 并测量其直径以及长度, 然后再对足丝的力学性能进行测量表征。本研究采用电子拉力试验机(Criterion C42, MTS)对足丝力学性能进行测试, 采用微量拉伸夹具和模板。在测试前先将足丝的两端通过双面胶和小块A4纸配合固定在气压式夹具上, 夹具的运行气压保证在0.4 MPa左右, 防止测试过程中足丝打滑和夹具夹坏足丝。拉伸试验过程中通过微淋雾方式对足丝进行保湿, 足丝测试长度保持在5~10 mm之间, 以便使夹具两端保留足够长的固定长度, 减少实验误差, 所有测试速度均设为5 mm/min。断裂拉伸测试进行至足丝断裂(Vaccaro et al, 2001)。进行应力-应变循环测试足丝缓冲能力时, 先将足丝拉伸至20%伸长后再按实验速度返回初始状态, 即0~20%~0为一次拉伸循环, 反复循环3次。为保证足丝的恢复时间, 每两个循环间隔30 min以上。通过弹性模量对足丝力学性能进行分析, 弹性模量是足丝拉伸过程中弹性变形阶段应力-应变曲线的直线段的斜率, 用应力差值/应变差值的形式进行计算。应力为单位面积上的所受的力, 应变为形变量与原来的长度的比值。对所有数据进行单因素方差分析(α = 0.05), 以评估统计学意义。
1.3 FT-IR分析红外光谱是蛋白结构分析的重要的方法之一(丁静等, 2020), 它能够提供许多关于官能团的信息, 可以帮助确定部分乃至全部分子类型及结构。为了检测B. marisindicus和M. galloprovincialis足丝的基本组成, 本研究采用FT-IR (Spotlight 400, PerkinElmer)进行结构检测分析(Hagenau et al, 2009)。为检测足丝内部成分, 在实验前先对保存的贻贝足丝近端和远端进行纵切面处理, 暴露出足丝内部后, 冷冻干燥12 h保持其原状备用。在足丝红外检测前, 先进行4 000~1 000 cm–1波数红外光谱扫描扣除环境水气背景, 校准仪器背景值。然后将干燥后的足丝放置在FT-IR载物台上, 设置好仪器参数, 分辨率: 8 cm–1; 每像素扫描: 16; 像素尺寸: 6.25 μm; 干涉仪速度: 1.0 cm/s; 样品尺寸: 300×300 μm, 进行4 000~2 500 cm–1和1 800~1 000 cm–1波数红外光谱扫描。
1.4 扫描电镜(scanning electron microscope, SEM)和元素分布利用SEM (Regulus 8100, Hitachi)对B. marisindicus和M. galloprovincialis足丝的内外微观形貌进行分析表征。首先将之前冷冻干燥后的样品放入喷金装置(ION SPUTTER MC 1000, Hitachi)中, 10 mA下喷金30 s, 通过喷金增加足丝的导电性从而增强电镜观察效果。然后将喷金样品用双面碳导电胶带固定于扫描电镜的样品台上, 进行电镜观察, 同时对足丝成像区表面和内部进行能谱(Energy Dispersive Spectrometer, EDS)分析, 分析选择区域的元素组成。
1.5 氨基酸组成通过传统的酸水解后用色谱法分析B. marisindicus足丝氨基酸含量组成(吴怡等, 2021)。本研究采用异硫氰酸苯酯柱前衍生法进行分析。首先准确称取干燥后B. marisindicus足丝20 mg放于安培瓶中, 加入10 mL 6 mol/L的盐酸, 充入氮气后密封。在110 ℃烘箱水解24 h后减压蒸干, 再用0.02 mol/L盐酸定容至10 mL。量取制备好的足丝水解样品200 μL, 置于1 mL离心管中, 加入100 μL三乙胺溶液, 100 μL异硫氰酸苯酯, 混匀后室温放置1 h。然后加入400 mL正己烷振摇后放置10 min, 取下层溶液, 用0.45 μm滤膜过滤后利用HPLC进行分离分析。仪器采用Agilent1100液相色谱仪, 色谱柱: 4.6×250 mm, 5μ Venusil-AA氨基酸分析柱; 柱温: 40 ℃, 检测波长: 254 nm, 流动相A: 0.1 mol/L醋酸钠(含7%乙腈), 流动相B: 80%乙腈, 流速1 mL/min梯度洗脱。通过计算机系统获取洗脱数据后分析处理得到足丝中氨基酸含量组成。
2 结果与讨论 2.1 基础参数测量B. marisindicus外表呈钝纺锤状, 壳色多呈红棕色、深黄色, 选用的成体壳长约7~8 cm、壳高约4 cm (图 1c); 近海M. galloprovincialis多呈黑褐色、半叶状, 成体壳长约长5~6 cm、壳高约3 cm (图 1b), 比热液区贻贝体型略小。B. marisindicus足丝长度平均为14~24 mm, 直径为200~450 μm; M. galloprovincialis足丝长度一般在40~50 mm, 直径在50~100 μm之间(李希涓等, 2014), 其他近海贻贝Mytilus edulis、Mytilus californianus足丝均表现为细长状(Bouhlel et al, 2017)。通过图 2在体式显微镜下观测的贻贝足丝形貌, 可以发现B. marisindicus足丝相较于近海M. galloprovincialis足丝明显较为粗短, 黏附盘也相对较厚。
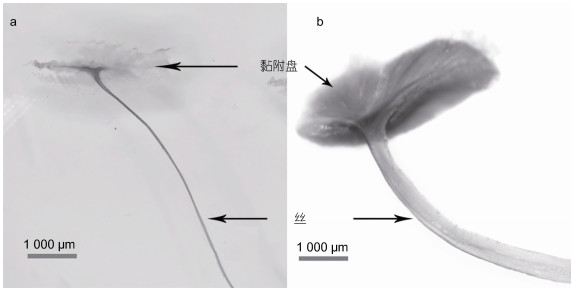 |
| 图 2 贻贝足丝光学显微图片 Fig. 2 Optical microscope images of mussel byssus 注: a. M. galloprovincialis足丝; b. B. marisindicus足丝; 比例尺: 1 000 μm |
力学测试结果显示B. marisindicus足丝的弹性模量平均为5~50 MPa, 伸长率平均约70% (图 3a)。作为对比的M. galloprovincialis足丝弹性模量大约10~200 Mpa, 伸长率约150%。有文献研究表明M. galloprovincialis足丝弹性模量大约200 Mpa左右, 伸长率高达200% (Waite et al, 2002), 其他几种近海贻贝如M. californianus、M. edulis足丝弹性模量分别大约为400、300 Mpa (Lucas et al, 2002; Pearce et al, 2009)。通过对比, 可以发现B. marisindicus足丝弹性模量明显小于近海M. galloprovincialis, 伸长率不足M. galloprovincialis足丝的一半, 并且没有明显的屈服点。贻贝足丝属于一类软而韧的生物有机材料, 这类材料的力学性能特点是模量小、伸长大。弹性模量越小, 说明材料刚度越小, 柔性越好, 越容易发生变形。由于弹性模量主要受材料的组成键合方式、晶体结构、化学成分、微观组织、温度等影响, 因此深海贻贝足丝模量和伸长率明显小于近海贻贝足丝的现象说明热液区特殊的环境可能对热液区贻贝足丝的组成结构产生了影响, 从而造成热液区贻贝足丝性能与近海贻贝足丝性质的不同。
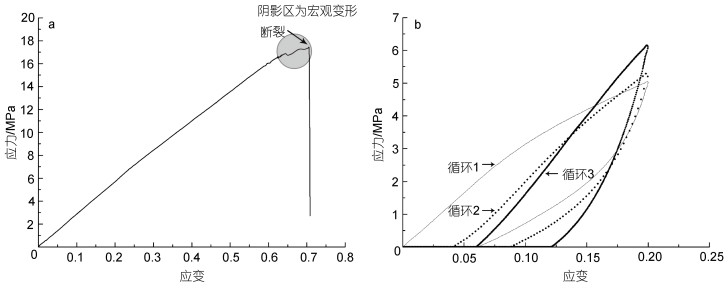 |
| 图 3 深海贻贝足丝拉伸和循环曲线 Fig. 3 Deep-sea mussel byssus stretch and cycle curve 注: a. B. marisindicus足丝拉伸曲线; b. 应力-应变循环曲线 |
通过应力-应变循环测量结果(表 1), 我们发现B. marisindicus足丝在3次应力-应变循环过程中, 足丝弹性模量逐渐变大。而M. galloprovincialis足丝在第二次循环时弹性模量从600 Mpa急剧下降到100 Mpa并表现出屈服点消失, 当应变超过其屈服点时表现出显著的应力软化, 即第二次循环的初始模量明显降低。足丝迟滞缓冲也随之变小(Waite et al, 2002), 保留了17%的初始刚度, 第三次循环仅恢复到原来刚度的30%, 说明近海贻贝足丝经过一定的时间可以恢复和保持弹性, Vaccaro等(2001)发现近海贻贝足丝的屈服点在24 h后可以恢复。B. marisindicus足丝第一次循环的弹性模量约40 Mpa, 模量在接下来的循环2和循环3呈现增大趋势, 没有表现出明显的弹性恢复。考虑到B. marisindicus足丝伸长率较低, 所以将足丝应变循环设置为0~20%~0的应变, 由于B. marisindicus足丝并没有明显的屈服点, 也没有出现M. galloprovincialis足丝循环过程中的应力软化以及刚度恢复, 因此B. marisindicus足丝在拉伸过程中产生了一定的塑性变形, 这部分变形是不可恢复的。B. marisindicus足丝在第二、三次循环过程中前期并不需要明显的外力即可拉伸, 这与形变有关, 中后段其拉伸应力变大, 弹性模量也随之变大, 足丝的刚度则越来越强(图 3b), 这与其断裂前只有少量宏观变形发生形成断裂相对应(图 3a阴影区), 这也能说明热液区贻贝足丝组成结构与近海贻贝足丝存在差异。贻贝足丝的结构组分是和它的力学性能、生活环境相适应的。深海贻贝足丝这种独特力学性能是热液区贻贝长期适应深海环境的结果。深海热液环境具有高压、高温、高盐、以及受重金属影响较大等特点, 贻贝所处区域深海环境流场又相对稳定, 海流较弱, 也不受风浪影响, 这与近海贻贝需要适应频繁的近海潮汐外力作用和泥沙摩擦作用非常不同, 因此深海贻贝足丝对抗频繁的周期性外力作用的压力可能会相对减小。所以适应条件相对温和的深海环境, 深海贻贝的足丝变得比较粗短且变形能力弱, 在力学性能方面则表现为模量小, 伸长率小。
| 样品 | 循环1 | 循环2 | 循环3 | 来源 |
| M. galloprovincialis | 572.0±90.8 | 102.1±11.6 | 168.3±20.3 | Vaccaro等(2001) |
| B. marisindicus | 40.5±16.64 | 98.1±41.58 | 116.2±55.89 | 本研究 |
贻贝足丝SEM结果显示(图 4a, 4b), B. marisindicus足丝表面相对光滑整洁, 而M. galloprovincialis足丝表面呈现出崎岖不平的凹凸状垄沟形貌, 存在大大小小的颗粒状结构, 这些颗粒状结构既可以保护足丝免受海水中细菌侵蚀以及外力磨损也可以承受足丝内部大部分应变(Harrington et al, 2018)。而从图 4e和4f足丝远、近端内部SEM图像来看, B. marisindicus足丝内部为整齐排列的纤维状结构, M. galloprovincialis足丝远端也呈现出紧密的纤维状结构, 近端则呈现出一些交错相连的结构。M. galloprovincialis足丝表面颗粒状使得其足丝表层的硬度和刚度比内部高, 但是二者的弹性模量相差无几, 这种独特的颗粒状结构可以作为微球增强复合材料来平衡足丝受力(Harrington et al, 2018)。而B. marisindicus足丝表面光滑, 并没有高刚度、硬度的颗粒状结构, 足丝近端和远端内部无明显梯度结构, 内部结构排列较为稳定。深海贻贝足丝光滑的表面以及内部不明显的梯度结构与力学特点一样, 也是其适应深海环境的表现。由于深海贻贝无需像近海贻贝一样对抗频繁的潮汐作用, 深海环境又相对温和, 因此深海贻贝受到外力和磨损(如泥沙冲刷、潮汐拖曳)明显减小, 不需要足丝表面的颗粒状增强复合结构来帮助其抵抗摩擦。EDS对足丝内部元素的分析结果(图 5)显示, 除了溴没有在近海贻贝足丝的近端检测出外, 其他几种元素在两种贻贝的足丝近端里组成相近。而在足丝远端, 两种贻贝足丝内部除了硫, 其他元素相差较少, 但总体来看两种贻贝足丝内部的主要元素含量接近。
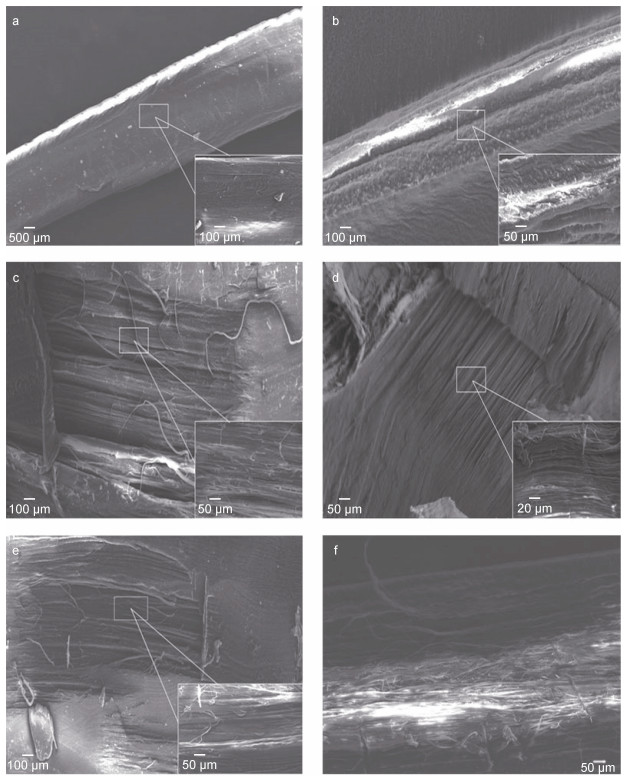 |
| 图 4 贻贝足丝SEM图像 Fig. 4 SEM image of the mussel byssus 注: a. B. marisindicus足丝表面; b. M. galloprovincialis足丝表面; c. B. marisindicus足丝远端内部; d. M. galloprovincialis足丝远端内部; e. B. marisindicus足丝近端内部; f. M. galloprovincialis足丝近端内部 |
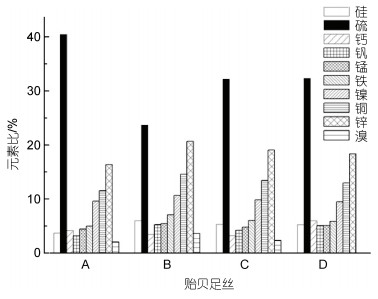 |
| 图 5 贻贝足丝内部EDS元素分析 Fig. 5 EDS element analysis inside the mussel byssus 注: A. B. marisindicus足丝远端; B. M. galloprovincialis足丝远端; C. B. marisindicus足丝近端; D. M. galloprovincialis足丝近端 |
为进一步研究两种贻贝足丝内部的结构组成差异, 本文进行了FI-IR检测分析。根据FT-IR谱图(图 6), B. marisindicus足丝两端内部在酰胺A带(3 250~3 300 cm–1)、酰胺I带(1 700~1 600 cm–1)以及酰胺III带(1 220~1 330 cm–1)都有较为明显的吸收峰, 而酰胺A、酰胺I和酰胺III是天然胶原蛋白所具有的特征吸收峰(陈静涛等, 2008), 除了胶原蛋白中明显的3种酰胺吸收峰外, 在B. marisindicus足丝内部还发现有酰胺B带(3 000~3 100 cm–1)以及酰胺II带(1 600~1 500 cm–1), 所以深海贻贝足丝内部和近海贻贝足丝一样含有胶原蛋白结构。但是在氢键区(4 000~2 500 cm–1), B. marisindicus两端在2 975~2 845 cm–1波数(图 6长方形阴影区)存在两个明显的亚甲基(—CH2—)基团, 即2 916 cm–1峰位的(—CH2—)对称伸缩振动和2 848 cm–1峰位的(—CH2—)反对称伸缩振动。这两种亚甲基信号在近海M. galloprovincialis足丝两端红外光谱中并没有明显发现。除此之外, 在单键区(1 500~1 000 cm–1), B. marisindicus足丝还有1 120 cm–1左右峰位的σC-O吸收(图 6b椭圆阴影区域), 在近海M. galloprovincialis足丝两端红外光谱中也缺少此吸收的信号, 因此深海热液区贻贝足丝与近海贻贝足丝在组成成分上有明显差异。由于醇、酸、酯、内酯的σC-O吸收在此吸收峰区域, 因此热液区贻贝足丝可能含有更多此类物质, 但σC-O吸收信号具体归属于何种物质还有待进一步研究。
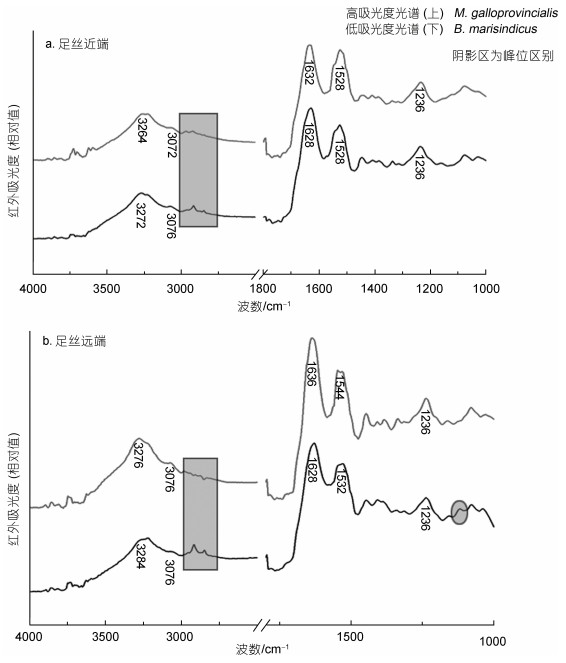 |
| 图 6 贻贝足丝远端和近端内部FI-IR图谱 Fig. 6 FI-IR spectra of the distal and proximal internal parts of the mussel byssus |
本文通过分析酰胺I和II带的最大值, 对足丝内部的二级结构进行预测。酰胺I峰位的波数表示三螺旋结构和β-结构, 对于足丝远端, 酰胺II信号在1 528 cm–1处的最大值表明存在β折叠结构。对于近端部分, 近海贻贝足丝在酰胺II信号最大值为1 543 cm–1, 表明α螺旋结构明显(Hagenau et al, 2009)。B. marisindicus贻贝足丝在酰胺II信号最大值为1 532 cm–1则表明β折叠结构明显。Hagenau等(2009)通过对酰胺I带反卷积后洛伦兹拟合, 发现近海贻贝足丝远端主要是β-折叠结构, 近端则由α-螺旋、超螺旋、β结构组成。对B. marisindicus足丝二级结构的分析预测, 发现其足丝远端和近海贻贝足丝相近, 可能有大量的β-折叠结构, 而足丝近端则主要是由超螺旋和α-螺旋结构组成。B. marisindicus足丝近端的超螺旋和α-螺旋可以使足丝变得更佳稳定、不易破坏, 从而能够更有效地适应热液环境可能带来的接触形变和破坏。
2.5 氨基酸组成分析结果贻贝足丝氨基酸检测过程中由于检测前先对样品进行酸水解, 导致色氨酸被盐酸水解破坏无法检测出, 天冬酰胺和谷氨酰胺侧链的酰胺基被水解成了羧基, 因此氨基酸分析结果中并没有列出色氨酸、天冬酰胺和谷氨酰胺的含量。根据足丝氨基酸分析结果(图 7), 可以发现B. marisindicus足丝中脯氨酸和甘氨酸含量高于近海贻贝足丝, 其中甘氨酸含量大约29%, 脯氨酸大约9%。贻贝足丝主体结构是由类似于胶原蛋白的preCOL组成的, 而胶原蛋白是由3条左螺旋结构多肽链通过链间氢键相互咬合形成牢固的右手超螺旋结构。胶原蛋白复合螺旋区中其氨基酸通常呈现(甘氨酸-X-羟脯氨酸)n周期性排列(Engel et al, 2005), 甘氨酸侧链的单个氢原子大空间使得胶原蛋白纤维非常紧密地缔合, 从而促进氢键和分子间交联的形成, 所以胶原蛋白的高甘氨酸含量对于胶原蛋白螺旋的稳定性是非常重要的(Reiser et al, 2012)。而脯氨酸由于其亚氨基酸结构往往使得肽链中形成“结节”, 在胶原蛋白结构中能够促进链内螺旋(Shoulders et al, 2009)。同样脯氨酸在X-a-a位置的环折叠对三螺旋稳定性也很重要(Bella, 2016), 同时Pro的吡咯环所施加的构象限制对于胶原三螺旋结构的完整性是至关重要的(Kersteen et al, 2001; Egli et al, 2020)。B. marisindicus足丝中的高甘氨酸和脯氨酸可以使三螺旋结构之间匹配的氢键更多, 从而有利于稳定类胶原蛋白的三螺旋结构。通过这种更稳定的胶原三螺旋结构, B. marisindicus足丝可以更有效地在深海热液特殊环境中发挥其功能。
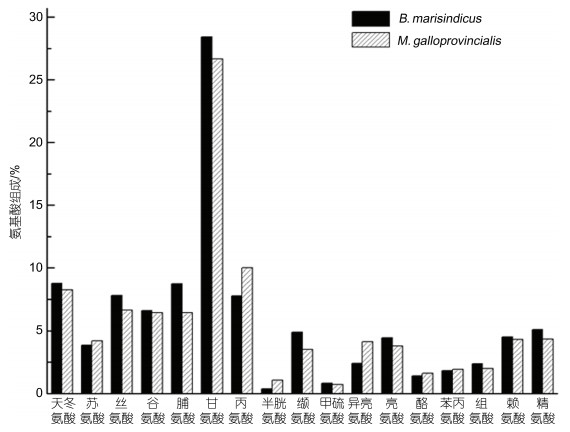 |
| 图 7 M. galloprovincialis和B. marisindicus的足丝氨基酸组成分析 Fig. 7 Amino acid composition analysis of the byssus of M. galloprovincialis and B. marisindicus 注: M. galloprovincialis足丝贻氨基酸组成贝源自Benedict等(1986) |
脯氨酸能够促进胶原蛋白中肽链螺旋结构的稳定, 同时也会导致肽链中β折叠、转角二级结构的出现, B. marisindicus足丝中脯氨酸量比近海贻贝足丝中高, 这也与我们对热液区贻贝足丝FT-IR谱图酰胺位拟合后的二级结构分析相符合, 热液区贻贝足丝近端主要是超螺旋和α-螺旋, 远端则存在有大量β折叠、β转角结构。另外B. marisindicus足丝中谷氨酸、赖氨酸、精氨酸、组氨酸含量也比近海M. galloprovincialis足丝略高一点, 这几个氨基酸侧链都有双亚甲基的存在, 这也与红外图谱中热液区贻贝足丝远端特有的亚甲基峰相对应。热液区贻贝足丝中高脯氨酸通过与高甘氨酸链间氢键结合可增强螺旋稳定性, 促进三螺旋结构稳定, 从而使得热液区贻贝足丝结构更加稳定。氨基酸以及红外光谱分析表明B. marisindicus足丝内部化学结构和组分可能比近海贻贝足丝更为稳定。这种稳定的结构会让深海贻贝足丝的化学性能更为稳定, 从而使得深海贻贝能够更好地适应深海极端环境。
3 结论通过分析发现, 热液区贻贝足丝表面光滑无高刚度、硬度耐磨的颗粒状结构, 而内部蛋白结构和组分更偏于稳定结构。深海热液区贻贝足丝的弹性模量较小, 伸长率也比较小, 弹性模量、伸长率小说明深海贻贝足丝刚度小、柔性好、变形能力较差, 相反地是其弹性缓冲较差。热液区贻贝足丝这种独特的低弹性模量、低伸长、高稳定性结构可能更有利于其适应外力相对较弱的深海热液区环境。近海贻贝由于身处近岸潮间带, 受到潮汐和海沙等外力作用, 为了对抗这种反复性外界作用力, 其足丝具有良好的力学性能, 即高延伸、低模量、弹性恢复、耐磨损。移居到深海热液区后, 热液区贻贝受周期性外力影响相对较小, 也无需频繁对抗外界磨损破坏, 表层耐磨颗粒在长期适应深海热液区环境过程中消失。而为了应对深海热液区的极端条件的影响, 贻贝进化出高稳定性的足丝蛋白结构, 同时热液区贻贝足丝也变得粗短、柔软。对深海贻贝足丝这种独特的力学性能和内部稳定、高强度结构的研究有助于我们研究热液区贻贝对环境的适应性, 对开发和利用深海生物材料也提供了基础。
丁静, 钱俊青, 2020. 蛋白质二级与三级结构的表征方法. 浙江化工, 51(11): 49-54 DOI:10.3969/j.issn.1006-4184.2020.11.012 |
李希涓, 王明召, 2014. 揭秘细小贻贝足丝的超强黏附作用. 化学教育, 35(18): 1-4 |
李景喜, 孙承君, 蒋凤华, 等, 2017. 印度洋热液区贻贝及栖息沉积物中金属元素的特征分析. 分析化学, 45(9): 1316-1322 |
吴怡, 徐蕊, 王云健, 2021. 采用柱前衍生化高效液相色谱法测定氨基酸的方法研究. 科技经济导刊, 29(17): 1-3 |
陈静涛, 赵玉萍, 徐政, 等, 2008. 重组胶原蛋白与牛源Ⅰ型胶原蛋白红外光谱研究. 材料导报, 22(3): 119-121 DOI:10.3321/j.issn:1005-023X.2008.03.029 |
魏曼曼, 陈新华, 周洪波, 2012. 深海热液喷口微生物群落研究进展. 海洋科学, 36(6): 113-121 |
ALDRED N, ISTA L K, CALLOW M E, et al, 2006. Mussel (Mytilus edulis) byssus deposition in response to variations in surface wettability. Journal of the Royal Society, Interface, 3(6): 37-43 DOI:10.1098/rsif.2005.0074 |
BEBIANNO M J, CARDOSO C, GOMES T, et al, 2018. Metal interactions between the polychaete Branchipolynoe seepensis and the mussel Bathymodiolus azoricus from Mid-Atlantic-Ridge hydrothermal vent fields. Marine Environmental Research, 135: 70-81 DOI:10.1016/j.marenvres.2018.01.017 |
BELLA J, 2016. Collagen structure: new tricks from a very old dog. Biochemical Journal, 473(8): 1001-1025 DOI:10.1042/BJ20151169 |
BENEDICT C V, WAITE J H, 1986. Composition and ultrastructure of the byssus of Mytilus edulis. Journal of Morphology, 189(3): 261-270 DOI:10.1002/jmor.1051890305 |
BOUHLEL Z, GENARD B, IBRAHIM N, et al, 2017. Interspecies comparison of the mechanical properties and biochemical composition of byssal threads. Journal of Experimental Biology, 220(6): 984-994 |
DISTEL D L, BACO A R, CHUANG E, et al, 2000. Do mussels take wooden steps to deep-sea vents?. Nature, 403(6771): 725-726 DOI:10.1038/35001667 |
DUPERRON S, GAUDRON S M, LAMING S R, 2019. A mussel's life around deep-sea hydrothermal vents. Frontiers for Young Minds, 7: 76 DOI:10.3389/frym.2019.00076 |
DUPERRON S, GROS O, 2016. Colwellia and sulfur-oxidizing bacteria: an unusual dual symbiosis in a Terua mussel (Mytilidae: Bathymodiolinae) from whale falls in the Antilles arc. Deep Sea Research Part I: Oceanographic Research Papers, 115: 112-122 DOI:10.1016/j.dsr.2016.05.012 |
EGLI J, SCHNITZER T, DIETSCHREIT J C B, et al, 2020. Why proline? influence of ring-size on the collagen triple helix. Organic Letters, 22(2): 348-351 DOI:10.1021/acs.orglett.9b03528 |
ENGEL J, BÄCHINGER H P, 2005. Structure, stability and folding of the collagen triple helix[M] // BRINCKMANN J, NOTBOHM H, MÜLLER P K. Collagen. Berlin, Heidelberg, Germany: Springer: 7-33.
|
HAGENAU A, SCHEIDT H A, SERPELL L, et al, 2009. Structural analysis of proteinaceous components in Byssal threads of the mussel Mytilus galloprovincialis. Macromolecular Bioscience, 9(2): 162-168 DOI:10.1002/mabi.200800271 |
HARRINGTON M J, JEHLE F, PRIEMEL T, 2018. Mussel byssus structure-function and fabrication as inspiration for biotechnological production of advanced materials. Biotechnology Journal, 13(12): 1800133 DOI:10.1002/biot.201800133 |
HASSENKAM T, GUTSMANN T, HANSMA P, et al, 2004. Giant bent-core mesogens in the thread forming process of marine mussels. Biomacromolecules, 5(4): 1351-1355 DOI:10.1021/bm049899t |
KERSTEEN E A, RAINES R T, 2001. Contribution of tertiary amides to the conformational stability of collagen triple helices. Biopolymers, 59(1): 24-28 DOI:10.1002/1097-0282(200107)59:1<24::AID-BIP1002>3.0.CO;2-N |
KIM S, MOON J M, CHOI J S, et al, 2016. Mussel inspired approach to constructing robust multilayered alginate films for antibacterial applications. Advanced Functional Materials, 26(23): 4099-4105 DOI:10.1002/adfm.201600613 |
KIM S, YOO H Y, HUANG J, et al, 2017. Salt triggers the simple coacervation of an underwater adhesive when cations meet aromatic π electrons in seawater. ACS Nano, 11(7): 6764-6772 DOI:10.1021/acsnano.7b01370 |
LUCAS J M, VACCARO E, WAITE J H, 2002. A molecular, morphometric and mechanical comparison of the structural elements of byssus from Mytilus edulis and Mytilus galloprovincialis. Journal of Experimental Biology, 205(12): 1807-1817 DOI:10.1242/jeb.205.12.1807 |
MAT A M, SARRAZIN J, MARKOV G V, et al, 2020. Biological rhythms in the deep-sea hydrothermal mussel Bathymodiolus azoricus. Nature Communications, 11(1): 3454 DOI:10.1038/s41467-020-17284-4 |
METAXAS A, 2015. Bivalve populations inhabiting hydrothermal vents on submarine volcanoes: using size frequency distributions to infer potential regulatory factors. Marine Ecology, 36(S1): 62-70 |
PEARCE T, LABARBERA M, 2009. A comparative study of the mechanical properties of Mytilid byssal threads. Journal of Experimental Biology, 212(10): 1442-1448 DOI:10.1242/jeb.025544 |
RAVINDRANATH M H, RAMALINGAM K, 1972. Histochemical identification of dopa, dopamine and catechol in the phenol gland and the mode of tanning of byssus threads of Mytilus edulis. Acta Histochemica, 42(1): 87-94 |
REISER K M, MCCOURT A B, YANKELEVICH D R, et al, 2012. Structural origins of chiral second-order optical nonlinearity in collagen: amide I band. Biophysical Journal, 103(10): 2177-2186 DOI:10.1016/j.bpj.2012.10.017 |
SHOULDERS M D, RAINES R T, 2009. Collagen structure and stability. Annual Review of Biochemistry, 78: 929-958 DOI:10.1146/annurev.biochem.77.032207.120833 |
SUN C J, LUCAS J M, WAITE J H, 2002. Collagen-binding matrix proteins from elastomeric extraorganismic byssal fibers. Biomacromolecules, 3(6): 1240-1248 DOI:10.1021/bm0255903 |
SUN J, ZHANG Y, XU T, et al, 2017. Adaptation to deep-sea chemosynthetic environments as revealed by mussel genomes. Nature Ecology & Evolution, 1(5): 0121 |
VACCARO E, WAITE J H, 2001. Yield and post-yield behavior of mussel byssal thread: a self-healing biomolecular material. Biomacromolecules, 2(3): 906-911 DOI:10.1021/bm0100514 |
VON COSEL R, OLU K, 1998. Gigantism in Mytilidae. A new Bathymodiolus from cold seep areas on the Barbados accretionary Prism. Comptes Rendus de l'Académie des Sciences - Series Ⅲ - Sciences de la Vie, 321(8): 655-663 |
WAITE J H, ANDERSEN N H, JEWHURST S, et al, 2005. Mussel adhesion: finding the tricks worth mimicking. The Journal of Adhesion, 81(3/4): 297-317 |
WAITE J H, VACCARO E, SUN C, et al, 2002. Elastomeric gradients: a hedge against stress concentration in marine holdfasts?. Philosophical Transactions of the Royal Society B: Biological Sciences, 357(1418): 143-153 DOI:10.1098/rstb.2001.1025 |
YU J, KAN Y J, RAPP M, et al, 2013. Adaptive hydrophobic and hydrophilic interactions of mussel foot proteins with organic thin films. Proceedings of the National Academy of Sciences of the United States of America, 110(39): 15680-15685 DOI:10.1073/pnas.1315015110 |
ZENG H B, HWANG D S, ISRAELACHVILI J N, et al, 2010. Strong reversible Fe3+-mediated bridging between dopa-containing protein films in water. Proceedings of the National Academy of Sciences of the United States of America, 107(29): 12850-12853 DOI:10.1073/pnas.1007416107 |
ZHOU L, CAO L, WANG X C, et al, 2020. Metal adaptation strategies of deep-sea Bathymodiolus mussels from a cold seep and three hydrothermal vents in the West Pacific. Science of the Total Environment, 707: 136046 |
 2022, Vol. 53
2022, Vol. 53


