中国海洋湖沼学会主办。
文章信息
- 李有志, 牟恩镟, 申屠琰, 朱卫东, 赵蓓蓓, 王志铮. 2022.
- LI You-Zhi, MU En-Xuan, SHENTU Yan, ZHU Wei-Dong, ZHAO Bei-Bei, WANG Zhi-Zheng. 2022.
- 越冬对池塘专养模式下中华鳖(Trionyx sinensis)机体形态、血清生化、脏器相关功能酶活力及肌肉和裙边物性的影响
- EFFECTS OF OVERWINTERING ON BODY MORPHOLOGY, SERUM BIOCHEMISTRY, ACTIVITY OF FUNCTIONAL ENZYMES RELATED TO VISCERA, AND PHYSICAL PROPERTIES OF MUSCLE AND SKIRT OF TRIONYX SINENSIS IN POND CULTURE MODE
- 海洋与湖沼, 53(2): 421-429
- Oceanologia et Limnologia Sinica, 53(2): 421-429.
- http://dx.doi.org/10.11693/hyhz20210900231
文章历史
-
收稿日期:2021-09-30
收修改稿日期:2021-10-27
2. 余姚市水产技术推广中心 浙江余姚 315400
2. Yuyao Aquatic Technology extension Center, Yuyao 315400, China
冬眠是动物在长期自然进化过程中形成的应对低温和饥饿双重胁迫的固有生存方式。水生动物为响应并顺利完成冬眠过程, 往往会通过调整脏器消化酶活力、血清生化、心肺生理等一系列生理生化特征以切换生命代谢机制, 进而改变机体形态和生化组成, 发展并形成了各自固有的以节能降耗为目的的越冬生存适应对策(王金星等, 1995; 刘云, 1999; 刘云等, 2002; 郑荣泉等, 2005; 刘庄鹏等, 2015; 孙燃等, 2019; 牟恩镟等, 2021)。因此, 深入探究具冬眠习性目标水产养殖动物冬眠前后间生理生化、能源物质利用和生命代谢特征的差异, 揭示越冬对机体生理状况的影响过程与机制, 并据此科学分析周年生活节律, 无疑对于指导其安全养殖具重要参考价值。中华鳖(Trionyx sinensis)隶属于爬行纲(Reptilia)、龟鳖目(Chelonia)、鳖科(Trionychidae)、鳖属(Trionyx), 是浙江省重要的水产养殖对象, 最近二十余年间产量和产值均居全国首位。中华鳖系具冬眠习性的爬行动物, 冬眠对于延续其正常生命活动至关重要, 但迄今国内有关越冬对养殖中华鳖的影响研究仅涉及体温、呼吸频率、耗氧量、心率、血清GLU含量、血红蛋白含量、肥满度、肝系数和LDH同工酶活性等指标(王金星等, 1995; 刘云, 1999; 刘云等, 2002)。为进一步了解并掌握越冬对中华鳖生理生化的影响特征, 本文以2+龄余姚本地品系中华鳖同生群个体为研究对象, 拟从机体形态、血清生化、脏器相关功能酶活力以及肌肉和裙边物性四个维度聚焦并解读中华鳖越冬前后的生理适应性改变以及机体能源物质利用差异, 旨为中华鳖越冬生理生态学研究和池养中华鳖越冬管理技术体系构建提供基础资料。
1 材料与方法 1.1 实验用中华鳖系2015年8月孵化后在宁波市明凤渔业有限公司余姚黄家埠养殖基地阳光大棚池塘内同池专养的中华鳖(Trionyx sinensis), 分别于2017年9月30日和2018年4月30日采用地笼网采集后, 各随机选取肢体完整、反应灵敏、活力强、无病灶的35只雄性健康个体分别记为A实验群体和B实验群体, 均于常温条件下运至浙江海洋大学水产安全养殖实验室, 并各任选其中的30只用于生物学性状测定, 余下的5只用于血清生化指标、脏器相关功能酶活力以及肌肉和裙边物性指标的测定。
1.2 方法 1.2.1 生物学性状的测定按孙燃等(2019)和牟恩镟等(2021)的方法, 借助精度0.01 mm的电子数显游标卡尺(桂林广陆数字测控股份有限公司)和精度0.1 g的HZ1201A电子天平(慈溪红钻衡器设备有限公司)逐只测定体长、体宽、体高、躯干长、头长、头宽、头高、眼径、眼间距、鼻间距、上颌长、下颌长、颈长、颈直径、尾长、尾宽、裙边宽、裙边厚、背甲长、背甲宽、腹甲长、腹甲宽、左前肢长、左前肢上臂长、左前肢下臂长、左前肢掌长、左后肢长、左后肢上臂长、左后肢下臂长和左后肢掌长等30项体尺性状和体质量、净体质量(去除内脏后的体质量)、内脏质量、裙边质量、背甲骨质量和腹甲骨质量等6项质量性状。逐只分离心、肝、胃、肠、肺、脾并去除附于其上的脂肪和结缔组织并用滤纸吸干表面水分后, 用Sartorius BS223S电子天平[精度1 mg, 赛多利斯科学仪器(北京)有限公司]称量上述7项脏器质量性状。
1.2.2 血清生化指标测定75%酒精消毒实验鳖颈部和解剖刀后, 逐只采颈动脉血, 并分别注入含1%肝素钠的刻度为2 mL的离心管内制成抗凝血样, 血样于3 000 r/min离心10 min后, 将分离获得的血清置于4 ℃冰箱内保存备测。测定指标为总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、白球比(A/G)、甘油三酯(TG)、葡萄糖(GLU)、肌酐(CREA)、尿素(UREA)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、二氧化碳(CO2)、钾离子(K+)、钠离子(Na+)和磷(P)。测定用试剂盒均购自宁波美康生物工程有限公司, 测定仪器为日立7020型全自动生化分析仪。
1.2.3 脏器功能酶活力测定采血后, 将实验鳖即刻置于冰盘上解剖, 逐只摘取肝、胃、肠, 去除其内容物及附于其上的脂肪和结缔组织, 4 ℃双蒸水冲净并用滤纸吸干其表面水分后, 分别用Sartorius BSA223S型电子天平称量并逐一放入已标好的离心管内, 于–80 ℃超低温冰箱中保存备测。测定脏器消化酶(胃蛋白酶pepsin, 肠淀粉酶intestinal amylase, 肝脂肪酶)、肝ATPase酶(Na+/K+-ATPase酶, Ca2+/Mg2+-ATPase酶)和肝抗氧化酶(SOD, 超氧化物歧化酶; CAT, 过氧化氢酶; POD, 过氧化物酶)活力的试剂盒均购自南京建成生物工程研究所, 测定步骤及计算方法均按所附说明书。
1.2.4 物性测定取脏器后, 用手术刀和手术剪逐只取实验鳖左后腿上臂肌肉和尾根部上侧的裙边组织, 并均制成规格为10 mm×7 mm×4 mm的鲜样后, 即刻用TA.XTplus型质构分析仪逐只测定硬度、黏性、弹性、凝聚性、胶黏性、咀嚼性、恢复性等7项物性指标。质构仪采用TPA模式, 测量探头为P/36R, 测量速度分3步, 分别是测前速率1 mm/s、测中速率0.5 mm/s和测后速率1 mm/s, 测距为2 mm, 停留间隔时间为5 s。
1.3 数据处理整理所测结果, 借助Excel(2019)软件分别计算两实验对象的生物学性状、血清生化指标、脏器功能酶活力以及肌肉与裙边物性指标的均值与标准差, 借助SPSS23.0软件检验组间差异显著性(视P < 0.05为显著水平)。
2 结果 2.1 生物学性状测定值间的差异整理生物学性状测定结果分别得表 1和表 2。由表 1可见, A、B实验群体间在表观体尺性状上的差异主要表现为: (1) 从体态特征看, 所涉4项测定性状均呈B实验群体显著大于A实验群体(P < 0.05), 即两者在身材体征上的相似性为0; (2) 从头部形态看, 两实验群体在所涉8项测定性状中除头长、头宽和眼间距均无显著差异(P > 0.05)外, 其余性状均呈B实验群体显著大于A实验群体(P < 0.05), 即两者在头部形态上的相似性为37.5%; (3) 从颈部形态看, A实验群体的颈直径显著小于B实验群体, 而颈长则与B实验群体无显著差异(P > 0.05), 即两者在颈部形态上的相似性为50%; (4) 从尾部和裙边形态看, A、B实验群体在所涉4项测定性状间均无显著差异(P > 0.05), 即两者在尾部和裙边形态上的相似性均为100%; (5) 从体甲形态看, A、B实验群体间在所涉4项测定性状中均呈B实验群体显著大于A实验群体(P < 0.05), 即两者在体甲形态上的相似性为0; (6) 从四肢形态看, A、B实验群体间在所涉8项测定性状中除左后肢上、下臂长均呈B实验群体显著大于A实验群体(P < 0.05)外, 其余性状则均无显著差异(P > 0.05), 即两者在四肢形态上的相似性为75%。无疑, 越冬可显著扩大实验鳖的形态几何空间, 其对实验鳖表观体尺性状的改变呈体态=体甲 > 头部 > 颈部 > 四肢 > 尾部和裙边的顺序, 表现出较明显的不均衡性。
| 类别 | 性状 | 单位 | A实验群体/n=30 | B实验群体/n=30 | |||
| M±SE | CV/% | M±SE | CV/% | ||||
| 体态 | 体长 | mm | 246.83±23.82a | 9.65 | 269.03±37.49b | 13.94 | |
| 体宽 | mm | 104.8±11.91a | 11.36 | 112.92±14.35b | 12.71 | ||
| 体高 | mm | 41.14±4.67a | 11.35 | 44.72±6.22b | 13.91 | ||
| 躯干长 | mm | 128.91±14.44a | 11.20 | 150.62±19.74b | 13.11 | ||
| 头部 | 头长 | mm | 38.1±5.06a | 13.28 | 38.94±5.67a | 14.56 | |
| 头宽 | mm | 21.44±2.2a | 10.26 | 22.69±2.93a | 12.91 | ||
| 头高 | mm | 17.54±1.9a | 10.83 | 19.53±2.62b | 13.42 | ||
| 眼径 | mm | 4.14±0.74a | 17.87 | 6.1±0.86b | 14.10 | ||
| 眼间距 | mm | 3.84±0.62a | 16.15 | 3.92±0.59a | 15.05 | ||
| 鼻间距 | mm | 3.84±0.75a | 19.53 | 4.67±0.63b | 13.49 | ||
| 上颌长 | mm | 15.06±1.78a | 11.82 | 20.35±3.17b | 15.58 | ||
| 下颌长 | mm | 11.25±1.33a | 11.82 | 18.57±2.71b | 14.59 | ||
| 颈部 | 颈长 | mm | 65.59±19.78a | 30.16 | 65.64±12.6a | 19.20 | |
| 颈直径 | mm | 14.23±1.79a | 12.58 | 17.64±2.63b | 14.91 | ||
| 尾部 | 尾长 | mm | 40.64±5.36a | 13.19 | 42.45±6.45a | 15.19 | |
| 尾宽 | mm | 22.91±3.23a | 14.10 | 24.61±4.12a | 16.74 | ||
| 裙边 | 裙边宽 | mm | 36.95±5.03a | 13.61 | 37.94±6.97a | 18.37 | |
| 裙边厚 | mm | 4.74±0.78a | 16.46 | 4.73±0.9a | 19.03 | ||
| 体甲 | 背甲长 | mm | 85.93±11.45a | 13.32 | 107.48±15.57b | 14.49 | |
| 背甲宽 | mm | 82.8±9.05a | 10.93 | 95.96±12.36b | 12.88 | ||
| 腹甲长 | mm | 96.3±9.74a | 10.11 | 110.31±15.44b | 14.00 | ||
| 腹甲宽 | mm | 93.28±9.06a | 9.71 | 104.41±14.08b | 13.49 | ||
| 四肢 | 左前肢长 | mm | 54.55±7.65a | 14.02 | 57.25±7.88a | 13.76 | |
| 左前肢上臂长 | mm | 23.73±2.95a | 12.43 | 24.6±3.68a | 14.96 | ||
| 左前肢下臂长 | mm | 19±3.38a | 17.79 | 20.42±3.28a | 16.06 | ||
| 左前肢掌长 | mm | 22.73±4.14a | 18.21 | 23.19±3.22a | 13.89 | ||
| 左后肢长 | mm | 59.25±10.15a | 17.13 | 64.07±8.2a | 12.80 | ||
| 左后肢上臂长 | mm | 21.53±2.78a | 12.91 | 25.29±3.99b | 15.78 | ||
| 左后肢下臂长 | mm | 20.2±2.6a | 12.87 | 22.02±4.02b | 18.26 | ||
| 左后肢掌长 | mm | 23.85±3.36a | 14.09 | 23.52±3.5a | 14.88 | ||
| 注: (1) A实验群体: 取样测定时间为2017年9月30日; (2) B实验群体: 取样测定时间为2018年4月30日; (3) 上标a、b标注组间差异(P < 0.05), 字母相同表示无差异组间差异。下同 | |||||||
| 类别 | 性状 | 单位 | A实验群体(n=30) | B实验群体(n=30) | ||
| M±SE | CV/% | M±SE | CV/% | |||
| 身体 | 体质量 | g | 363.7±56.2a | 15.44 | 423.1±60.9b | 14.38 |
| 净体质量 | g | 267.3±54.6a | 20.43 | 311.8±46.7b | 14.97 | |
| 脏器 | 内脏质量 | g | 66.423±9.803a | 14.76 | 76.174±14.309b | 18.78 |
| 肠质量 | g | 3.818±0.417a | 10.92 | 5.237±0.926b | 17.68 | |
| 肝质量 | g | 9.685±1.466a | 15.14 | 12.914±2.531b | 19.60 | |
| 胃质量 | g | 2.484±0.406a | 16.34 | 3.324±0.576b | 17.33 | |
| 肺质量 | g | 3.956±0.611a | 15.44 | 5.049±0.905b | 17.92 | |
| 心质量 | g | 1.114±0.172a | 15.44 | 1.320±0.283b | 21.44 | |
| 脾质量 | g | 0.466±0.116a | 24.89 | 0.608±0.108b | 17.76 | |
| 附属物 | 裙边质量 | g | 43.215±7.048a | 16.31 | 50.007±7.344b | 14.69 |
| 背甲骨质量 | g | 25.475±4.029a | 15.82 | 28.046±6.150a | 21.93 | |
| 腹甲骨质量 | g | 12.063±2.24a | 18.57 | 14.901±2.669b | 17.91 | |
由表 2可见, A、B实验群体间在质量性状上的差异主要表现为: (1) 从身体质量和脏器质量看, 所涉9项测定性状均呈B实验群体显著大于A实验群体(P < 0.05), 即两者在身体质量和脏器质量上的相似性均为0; (2) 从附属物质量看, A、B实验群体间在所涉3项测定性状中除背甲质量无显著差异(P > 0.05)外, 其余性状均呈B实验群体显著大于A实验群体(P < 0.05), 即两者在附属物质量上的相似性为33.3%。综上可知, 本研究所涉30项体尺性状和12项质量性状测定值间的总体差异相似性分别为46.7%和8.3%, 表明越冬期间实验鳖总体上仍处于较旺盛的生长状态。
2.2 血清生化指标值的差异由表 3可见, 越冬对实验鳖血清生化指标值的影响主要表现为: (1) 从代谢底物水平看, TP和ALB均呈B实验群体显著大于A实验群体(P < 0.05), TG呈A实验群体显著大于B实验群体(P < 0.05), 两者间无显著差异的为A/G、GLB和GLU (P > 0.05); (2) 从代谢产物水平看, CREA呈B实验群体显著大于A实验群体(P < 0.05), 而UREA和CO2则均呈A实验群体显著大于B实验群体(P < 0.05); (3) 从血清酶活力水平看, LDH、CK均呈A实验群体显著大于B实验群体(P < 0.05), 而ALT、AST则均无组间差异(P > 0.05); (4) 从离子水平看, K+呈B实验群体显著大于A实验群体(P < 0.05), 而Na+和P则均无组间差异(P > 0.05)。综上可知, A、B实验群体间以代谢产物含量的差异为最大, 以离子含量的差异为最小, 介于两者之间的为代谢底物含量和血清酶活力。
| 指标 | 单位 | 群体类别 | |
| A实验群体(n=5) | B实验群体(n=5) | ||
| 总蛋白TP | g/L | 37.37±3.95a | 51.23±4.91b |
| 白蛋白ALB | g/L | 12.43±1.03a | 16.00±1.15b |
| 球蛋白GLB | g/L | 24.93±4.31a | 35.23±5.40a |
| 白球比A/G | 0.52±0.12a | 0.47±0.08a | |
| 甘油三酯TG | mmol/L | 2.83±0.7a | 0.59±0.02b |
| 葡萄糖GLU | mmol/L | 9.41±1.06a | 10.44±0.16a |
| 肌酐CREA | μmol/L | 10.67±1.70a | 15.67±1.70b |
| 尿素UREA | mmol/L | 3.07±0.40a | 1.70±0.29b |
| 二氧化碳CO2 | mmol/L | 48.13±2.16a | 24.77±1.99b |
| 谷丙转氨酶ALT | U/L | 8.67±3.40a | 18.33±6.55a |
| 谷草转氨酶AST | U/L | 96.67±6.55a | 117.33±13.91a |
| 乳酸脱氢酶LDH | U/L | 721.67±271.14a | 260.67±13.52b |
| 肌酸激酶CK | U/L | 8698.33±194.53a | 5831.00±1448.38b |
| 钾离子K+ | mmol/L | 4.31±0.03a | 13.15±2.70b |
| 钠离子Na+ | mmol/L | 128.00±1.41a | 129.67±1.70a |
| 磷P | mmol/L | 1.25±0.02a | 1.26±0.07a |
| 注: A示越冬前群体, 取样时间为2017年9月30日; B示越冬后群体, 取样时间为2018年4月30日。下同 | |||
由表 4、图 1和图 2可见, 越冬对脏器相关功能酶活力的影响主要表现为: (1) 从脏器消化酶活力看, B实验群体的胃蛋白酶和肠淀粉酶活力均显著大于A实验群体(P < 0.05), 而A实验群体的肝脂肪酶活力则
| 指标 | 单位 | 群体类别 | |
| A实验群体(n=5) | B实验群体(n=5) | ||
| 胃蛋白酶活力 | U/mg prot | 0.587±0.257a | 2.45±0.808b |
| 肠淀粉酶活力 | U/mg prot | 0.035±0.008a | 0.293±0.055b |
| 肝脂肪酶活力 | U/g prot | 23.389±4.99a | 4.028±1.986b |
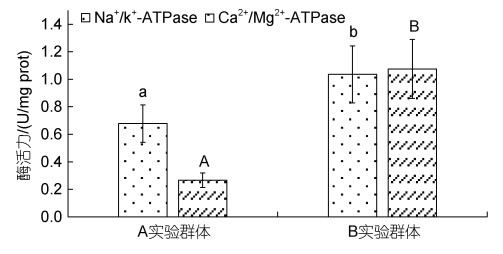 |
| 图 1 越冬前后实验鳖肝脏ATP酶活力的影响 Fig. 1 Differences of ATP activities in liver of T. sinensis before and after overwintering 注: 图内柱上方不同字母表示组间差异, 字母相同的表示无差异 |
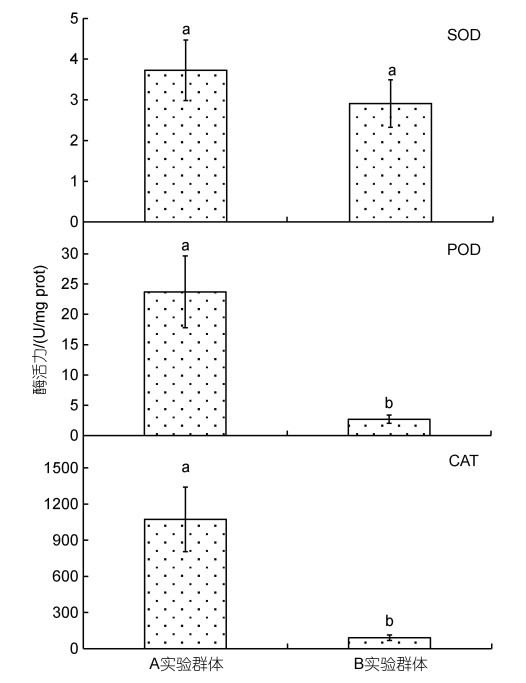 |
| 图 2 越冬前后实验鳖肝脏抗氧化酶活力的差异 Fig. 2 Differences of antioxidant enzyme activities in liver of T. sinensis before and after overwintering 注: a、b标注组间差异, 字母相同的表示无差异 |
显著大于B实验群体(P < 0.05); (2) 从肝ATP酶活力看, Na+/K+-ATPase酶和Ca2+/Mg2+-ATPase酶活力均呈B实验群体显著大于A实验群体(P < 0.05); (3) 从肝抗氧化酶活力看, 除SOD酶活力无显著差异(P > 0.05)外, CAT、POD酶活力均呈A实验群体显著大于B实验群体(P < 0.05)。综上可知, 越冬已引起实验鳖肝、肠、胃三大主要消化脏器生理功能的显著改变。
2.4 肌肉与裙边物性由表 5可见, A、B实验群体间在裙边物性上的差异主要表现为黏性、弹性和咀嚼性, 三者依次呈A > B (P < 0.05)、A < B (P < 0.05)和A < B (P < 0.05), 在肌肉物性上的差异则仅为黏性, 呈A > B (P < 0.05)。综上可知, 越冬对裙边物性的改变明显甚于肌肉。
| 测定指标 | 裙边 | 肌肉 | ||
| A实验群体(n=5) | B实验群体(n=5) | A实验群体(n=5) | B实验群体(n=5) | |
| 硬度 | 23 001.435±636.487a | 24 306.148±1 051.157a | 1 325.754±38.381a | 1 394.430±31.629a |
| 黏性 | –9.302±1.407a | –39.536±14.116b | –13.129±5.526a | –52.046±2.934b |
| 弹性 | 0.674±0.026a | 0.809±0.072b | 0.754±0.127a | 0.851±0.034a |
| 凝聚力 | 0.804±0.040a | 0.813±0.023a | 0.593±0.069a | 0.566±0.063a |
| 胶黏性 | 18 506.887±1 387.079a | 19 759.526±1 238.402a | 667.301±25.858a | 698.439±71.308a |
| 咀嚼性 | 12 513.783±1 345.418a | 15 890.599±488.89b | 581.042±23.305a | 632.000±56.966a |
| 恢复性 | 0.770±0.048a | 0.800±0.020a | 0.434±0.069a | 0.329±0.099a |
中华鳖属具典型冬眠习性的水生变温动物。刘云等(2002)研究发现, 中华鳖的体温与其所处环境相近, 是一种具一定温控能力的水生爬行动物。因此, 水温是诱导中华鳖入眠和出眠的重要外源信号。观察发现, 池养中华鳖的活动量、摄食强度均与所处区域环境的周年水温变化节律密切相关。即, 当水温回落至20 ℃时摄食活动明显减弱, 低于15 ℃时停止摄食, 12 ℃时入泥冬眠。为此, 刘云等(2002)将中华鳖的周年生活节律分为活动期和冬眠期, 而王金星等(1995)则将其分为休眠期和非休眠期。鉴于上述划分方法不够精细之考量, 本文作者根据池养中华鳖活动量和摄食强度的周年变化特征, 将其按序依次划分为捕食活跃期(水温稳定在25 ℃以上, 捕食活动频繁)、越冬准备期(水温波动于15~25 ℃之间, 捕食活动频次明显低于捕食活跃期)、越冬休眠期(水温降至15 ℃以下, 处于完全饥饿状态)和活动复苏期(水温回升并稳定于15~25 ℃之间, 捕食频次随水温上升而有所增加)。其中, 余姚地区池养中华鳖的捕食活跃期、越冬准备期、越冬休眠期和活动复苏期依次为5月下旬至9月下旬、10月上旬至11月下旬、12月上旬至次年3月下旬、4月上旬至5月下旬。故, 本研究涉及的A、B实验群体实质上分别为处于捕食活跃期和活动复苏期的2+龄中华鳖。无疑, 本研究表 1所示30项体尺性状中B实验群体显著大于A实验群体的为16项, 无显著差异的为14项, 以及表 2所示12项质量性状中B实验群体显著大于A实验群体的为11项, 而无显著差异的仅为1项的结果, 结合中华鳖越冬休眠期间体质量呈负增长的常识, 既印证了上述有关中华鳖由捕食活跃期进入越冬休眠期前存在越冬准备期这一过渡阶段的分期合理性, 也真实反映了中华鳖在越冬准备期储备的能量足以满足其越冬休眠期所需能耗的客观事实。
3.2 越冬对中华鳖机体能源物质利用对策的影响特征肝脏是糖原的主要存储器官(美国科学院国家研究委员会, 2015), GLU是机体可直接利用的能源物质(陈永祥等, 2009)。刘云等(2002)报道的中华鳖冬眠初、中期(12月~次年2月) GLU含量显著高于活动期(7~9月) (P < 0.05), 冬眠后期(3月) GLU含量与活动期无显著差异(P > 0.05)的情形, 既与冬眠期间大蟾蜍(Bufo gararizans)肝糖原含量一直保持大幅下降趋势致使其GLU含量显著下降(P < 0.05) (嵇庆等, 1995), 以及黄鳝(Monopterus albus)越冬后肝糖原含量极显著下降(P < 0.01) (李昭林等, 2017)的结果一致, 表明通过大量消耗GLU以维持机体代谢所需是冬眠期动物的共性, 也与本研究表 3所示实验鳖越冬前后GLU含量无显著差异(P > 0.05)的结果相吻, 表明保持GLU相对稳定对于启动并维系出眠后中华鳖的正常生命活动具极端重要性。由此可认定, 中华鳖为适应越冬生活在长期自然进化过程中形成并固化了“稳定~上升~下降~稳定”的GLU周年变动节律, 故可将GLU的稳定性视为甄别冬眠期与非冬眠期中华鳖的重要血清生化指标。
脂肪系动物体内的主要储能物质, 肝脏为储藏和消化脂肪的主要场所。本研究表 3和表 4所示实验鳖越冬后血清TG含量和肝脏脂肪酶活力均显著下降(P < 0.05), 而血清TP和ALB含量以及胃蛋白酶和肠淀粉酶活力均显著升高(P < 0.05)的结果, 既与黄鳝冬眠后血清TG含量和鱼体含脂量均显著降低(P < 0.05), TP含量极显著升高(P < 0.01)的结果相吻(李昭林等, 2017), 也与鲤鱼和鳕鱼饥饿时首先动用肝脏脂肪作为能源(麦康森, 2011), 卵形鲳鲹(Trachinotus ovatus)饥饿早期主要利用脂肪, 后期主要利用蛋白质(苏慧等, 2012), 以及饥饿状态下水生动物对蛋白质的利用一般是在脂肪被大量消耗之后(Stirling, 1976; Kutty, 1978)的情形类似, 由此可判定脂肪是实验鳖冬眠期间首先被大量利用的储能物质, 通过显著提高碳水化合物和蛋白质利用占比以弥补脂肪已被大量消耗导致的供能不足, 是出眠后实验鳖保持机体GLU相对稳定的重要途径。血清CREA可分为外源性和内源性2种, 其中外源性是肉类食物在体内代谢后的产物, 内源性是体内肌肉组织代谢的产物。生物组织的物性与其脂肪和蛋白质占比密切相关。一般而言, 生物组织含脂量越高其黏性也就越大, 蛋白质含量越高则弹性和咀嚼性就越大, 反之亦然。与越冬和饥饿分别致黄鳝(刘庄鹏等, 2015)和黑鲷(Sparus macrocephalus) (邓利等, 2003)鱼体含脂量显著下降(P < 0.05)的情形类似, 本研究表 3所示实验鳖越冬后肌肉和裙边黏性均显著下降(P < 0.05)的结果, 进一步印证了上述有关实验鳖体内脂肪已于冬眠期被大量消耗的客观事实, 至于裙边弹性和咀嚼性均显著上扬(P < 0.05), 而肌肉则均无显著差异(P > 0.05)的结果, 则既客观反映了肌肉组织因运动强度明显大于裙边, 致使其含脂量占比明显低于裙边而蛋白质含量占比明显高于裙边的实情, 故越冬期间肌肉的脂肪流失并未能显著改变其弹性和咀嚼性, 也同时互证了越冬后实验鳖通过增加肌肉蛋白消耗而导致表 1中血清CREA含量显著上扬(P < 0.05)的可靠性。综上, 可基本判定实验鳖为适应越冬生活在长期自然进化过程中形成并固化了越冬前通过大量动员脂肪异生为肝糖原使GLU含量大幅高企以利安全越冬、冬眠期间通过大量消耗越冬前已储备的GLU以维持基本生命体征、以及出眠后复苏期间为弥补机体脂肪供能不足采取显著提高碳水化合物和蛋白质利用占比以维系GLU相对稳定的能源物质利用对策。
3.3 越冬对中华鳖心脏和肝脏生理机能的影响分析血清生化指标作为评价机体生理功能正常与否的重要依据, 对于指示受检动物的健康状况具重要参考价值。CK、LDH、AST因主要存在于心肌中, 故常被作为诊断心脏或心肌组织是否受损的重要血清酶学指标(王志铮等, 2013)。ALT主要存在于肝脏中, 系表征肝组织健康完整的重要指示酶(何福林等, 2007; Srivastava et al, 2007; 刘伟等, 2010)。当ALT和AST大量溢入血液中时, 表明肝脏和心肌功能均已受损(何福林等, 2007; 蔡林婷等, 2013)。本研究实验鳖越冬前后血清中ALT和AST酶活力均未发生显著改变的结果(表 3) (P > 0.05), 与冬眠对黄鳝血清中ALT和AST酶活力的影响情形(刘庄鹏等, 2015)完全相同, 而与大黄鱼处于低温饥饿胁迫时血清中ALT和AST酶活力均显著升高(P < 0.05)的结论(冀德伟等, 2009; 徐浩等, 2015)相悖, 结合血清中分别用于指示机体免疫功能和肝脏合成功能的GLB含量和A/G值均无显著变化(P > 0.05)的结果(表 1), 表明越冬并不会致具冬眠习性的中华鳖的心肝功能产生实质性改变。水生变温生物的运动生理代谢和营养生理代谢是两个相互关联的方面, 它们均受水温的影响, 且往往与水温均有着较为密切的关系。类比刘云等(2002)等报道的中华鳖活动期体温、呼吸频率、心率和耗氧率均显著大于休眠期(P < 0.05), 而红细胞数和血红蛋白与休眠后期均无显著差异(P > 0.05)的结果, 可基本判定致本研究越冬后实验鳖血清中CK、LDH、UREA、CO2含量均显著下降(表 3) (P < 0.05)的原因, 系实验鳖越冬前、后体温间的明显差异引起与其捕食运动相关联的肌肉活动量、机体代谢强度和糖酵解代谢途径占比的连锁变化所致, 表明血清中CK、LDH、UREA、CO2含量均系受体温诱导的可逆性关联指标。由此, 也进一步印证了前述有关本研究所涉越冬前、后实验鳖分别处于捕食活跃期和活动复苏期这一野外观察结果的可靠性。
SOD、CAT和POD作为保护酶系统的重要组成部分, 在保持体内自由基代谢平衡和维系细胞正常代谢中具重要作用(王志铮等, 2013)。一般而言, 当抗氧化酶活力随体内自由基增加而升高时, 表明水产动物机体处在抗氧化正常生理状态, 而当酶活力随体内自由基继续增加而显著下降时, 则表明水产动物机体已出现氧化受损。Na+/K+-ATPase酶和Ca2+/Mg2+-ATPase酶均属跨膜ATP酶, 借助Na+/K+-ATPase酶能逆浓度梯度将Na+、K+分别由胞内转至胞外和由胞外转入胞内以调控细胞内外液的渗透压。故, 本研究实验鳖越冬后肝脏Na+/K+-ATPase、Ca2+/Mg2+-ATPase酶活力均显著升高(P < 0.05)而其CAT、POD和脂肪酶活力均显著下降(P < 0.05) (图 1, 图 2), 和血清中TP、ALB、K+含量均显著升高(P < 0.05) 而TG含量显著下降(P < 0.05) (表 3)的结果, 既反映了越冬后肝脏消化脂肪压力的骤降是导致其CAT、POD酶抗氧化压力显著下降的主因, 也揭示了肝脏抗氧化压力显著下降对其血清蛋白合成与转运效率获得显著提升所起的重要助力。SOD在清除活性氧过程中最早发挥作用(张克烽等, 2007), 是最能代表机体抗氧化防御变化特征的指标酶(Filho et al, 1993)。由此, 本研究图 2所示越冬后实验鳖肝脏SOD酶活力未出现显著变化(P > 0.05)的原因, 应和肝脏血清蛋白合成与转运效率显著增加导致流经的自由基数量增多有关。综上可知, 肝脏系调控实验鳖越冬前后机体能源物质利用的重要脏器, 而越冬则是引起肝脏功能发生正常切换的重要窗口期。
4 结论(1) 根据池养中华鳖活动量和摄食强度的周年变化特征, 可按序依次划分为捕食活跃期、越冬准备期、越冬休眠期和活动复苏期, 池塘专养模式下中华鳖在越冬准备期储备的能量足以满足其越冬休眠期所需能耗。
(2) 中华鳖为适应越冬生活在长期自然进化过程中形成并固化了“稳定~上升~下降~稳定”的GLU周年变动节律, 和越冬前通过大量动员脂肪异生为肝糖原使GLU含量大幅高企以利安全越冬、冬眠期间通过大量消耗越冬前已储备的GLU以维持基本生命体征、以及出眠后复苏期间为弥补机体脂肪供能不足采取显著提高碳水化合物和蛋白质利用占比以维系GLU相对稳定的能源物质利用对策, 故可将GLU的稳定性视为甄别冬眠期与非冬眠期中华鳖的重要血清生化指标。
(3) 中华鳖血清CK、LDH、UREA、CO2含量均系受体温诱导的可逆性关联指标。肝脏系调控中华鳖越冬前、后机体能源物质利用的重要脏器, 越冬后肝脏消化脂肪压力的骤降既可导致其抗氧化压力的显著下降, 也可为其血清蛋白合成与转运效率的显著提升提供重要助力。越冬是引起肝脏功能发生正常切换的重要窗口期, 但并不会致其心肝功能发生实质性改变。
王志铮, 赵晶, 杨磊, 等, 2013. 三种养殖模式下日本鳗鲡(Anguilla japonica)养成品血清生化指标和脏器消化酶、抗氧化酶活力的差异. 海洋与湖沼, 44(2): 403-408 |
王金星, 赵小凡, 廖正根, 1995. 休眠与非休眠期中华鳖乳酸脱氢酶同工酶的比较分析. 海洋湖沼通报, (2): 43-47 |
邓利, 张为民, 林浩然, 2003. 饥饿对黑鲷血清生长激素、甲状腺激素以及白肌和肝脏脂肪、蛋白质含量的影响. 动物学研究, 24(2): 94-98 DOI:10.3321/j.issn:0254-5853.2003.02.003 |
刘云, 1999. 中华大蟾蜍、黑斑蛙、中华鳖及山蝠冬眠期与活动期肝系数与肥满度的比较[C] // 中国动物科学研究——中国动物学会第十四届会员代表大会及中国动物学会65周年年会论文集. 北京: 中国林业出版社: 1213-1214.
|
刘云, 杨小林, 王朝莉, 2002. 中华鳖冬眠期与活动期部分生理生化性质的比较研究. 四川大学学报(自然科学版), 39(S1): 82-84 |
刘伟, 支兵杰, 战培荣, 等, 2010. 盐度对大麻哈鱼幼鱼血液生化指标及肝组织的影响. 应用生态学报, 21(9): 2411-2417 |
刘庄鹏, 胡毅, 吕富, 等, 2015. 越冬对黄鳝形体、肠道消化酶及免疫指标的影响. 水生态学杂志, 36(3): 72-76 |
孙燃, 朱卫东, 赵蓓蓓, 等, 2019. 池塘专养模式中华鳖幼鳖形态性状对体质量和净体质量的影响效果分析. 浙江海洋大学学报(自然科学版), 38(2): 113-120 DOI:10.3969/j.issn.1008-830X.2019.02.004 |
牟恩镟, 申屠琰, 熊玉凤, 等, 2021. 池塘专养模式下中华鳖养成品形态性状对体质量和净体质量的影响效应. 浙江海洋大学学报(自然科学版), 40(1): 22-28, 79 |
麦康森, 2011. 水产动物营养与饲料学. 2版. 北京: 中国农业出版社, 10-53
|
苏慧, 区又君, 李加儿, 等, 2012. 饥饿对卵形鲳鲹幼鱼不同组织抗氧化能力、Na+/K+-ATP酶活力和鱼体生化组成的影响. 南方水产科学, 8(6): 28-36 DOI:10.3969/j.issn.2095-0780.2012.06.005 |
李昭林, 刘庄鹏, 何志刚, 等, 2017. 越冬对黄鳝(Monopterus albus)机体生化组成及部分血清生化指标的影响. 渔业科学进展, 38(6): 41-47 |
何福林, 向建国, 李常健, 等, 2007. 水温对虹鳟血液学指标影响的初步研究. 水生生物学报, 31(3): 363-369 DOI:10.3321/j.issn:1000-3207.2007.03.010 |
张克烽, 张子平, 陈芸, 等, 2007. 动物抗氧化系统中主要抗氧化酶基因的研究进展. 动物学杂志, 42(2): 153-160 DOI:10.3969/j.issn.0250-3263.2007.02.031 |
陈永祥, 肖玲远, 严太明, 等, 2009. 野生和养殖裂腹鱼血液学指标的比较研究. 水生生物学报, 33(5): 905-910 |
郑荣泉, 姜科声, 叶挺梅, 等, 2005. 冬眠期及冬眠后棘胸蛙血清5种离子浓度及CO2结合力的变化. 浙江师范大学学报(自然科学版), 28(4): 429-431 DOI:10.3969/j.issn.1001-5051.2005.04.015 |
徐浩, 张东玲, 陈庆凯, 等, 2015. 低温下饥饿胁迫对大黄鱼血清生化指标的影响. 生物技术通报, 31(6): 195-199 |
嵇庆, 李宗芸, 杨影, 等, 1995. 大蟾蜍冬眠前后血清中某些激素含量变化及其与糖代谢的关系. 动物学杂志, 30(2): 19-22 |
蔡林婷, 李思源, 葛明峰, 等, 2013. 3种致病弧菌感染对大黄鱼血液生化指标的影响. 渔业科学进展, 34(2): 65-72 DOI:10.3969/j.issn.1000-7075.2013.02.009 |
冀德伟, 李明云, 王天柱, 等, 2009. 不同低温胁迫时间对大黄鱼血清生化指标的影响. 水产科学, 28(1): 1-4 |
美国科学院国家研究委员会编著, 麦康森, 李鹏, 赵建明译, 2015. 鱼类与甲壳类营养需要[M]. 北京: 科学出版社: 167.
|
FILHO D W, GIULIVI C, BOVERIS A, 1993. Antioxidant defences in marine fish1-I.Teleosts. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 106(2): 409-413 DOI:10.1016/0742-8413(93)90154-D |
KUTTY M N, 1978. Ammonia quotient in Sockeye salmon (Oncorhynchus nerka). Journal of the Fisheries Research Board of Canada, 35(7): 1003-1005 DOI:10.1139/f78-162 |
SRIVASTAVA A R, KUMAR S, AGARWAL G G, et al, 2007. Blunt abdominal injury: serum ALT-A marker of liver injury and a guide to assessment of its severity. Injury, 38(9): 1069-1074 DOI:10.1016/j.injury.2007.04.019 |
STIRLING H P, 1976. Effects of experimental feeding and starvation on the proximate composition of the European bass Dicentrarchus labrax. Marine Biology, 34: 85-91 DOI:10.1007/BF00390791 |
 2022, Vol. 53
2022, Vol. 53


