
中国海洋湖沼学会主办。
文章信息
- 马本贺, 王海华, 马爱军, 黄智慧, 李燕华, 王梦杰, 孙志宾. 2022.
- MA Ben-He, WANG Hai-Hua, MA Ai-Jun, HUANG Zhi-Hui, LI Yan-Hua, WANG Meng-Jie, SUN Zhi-Bin. 2022.
- 温度对金红色大鳞副泥鳅(Paramisgurnus dabryanus)孵化、仔鱼活力和性别分化的影响
- EFFECTS OF TEMPERATURE ON HATCHING, LARVAL VITALITY AND SEXUAL DIFFERENTIATION OF GOLDEN RED BIGSCALE LOACH PARAMISGURNUS DABRYANUS
- 海洋与湖沼, 53(2): 448-456
- Oceanologia et Limnologia Sinica, 53(2): 448-456.
- http://dx.doi.org/10.11693/hyhz20210900223
文章历史
-
收稿日期:2021-09-26
收修改稿日期:2021-10-24
2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛市海水鱼类种子工程与生物技术重点实验室 山东青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Qingdao Key Laboratory for Marine Fish Breeding and Biotechnology, Qingdao 266071, China
大鳞副泥鳅(Paramisgurnus dabryanus)隶属于鳅科(Cobitidae)、副泥鳅属(Paramisgurnus), 是我国重要的特种经济鱼类之一。本研究团队2014年引进大鳞副泥鳅台湾种群亲本, 在养殖子代中发现极少量体色为金红色的个体, 将其从养殖群体中选出单独培育为育种亲本, 以金红色体色为主要目标形状, 经多年系统选育, 获得了金红色体色稳定遗传的大鳞副泥鳅新品系, 暂命名为大鳞副泥鳅新品系“赣红1号”(以下简称“赣红1号”), 其体色金红、形态优美、营养丰富, 兼具食用和观赏价值, 深受市场青睐(Huang et al, 2021)。
温度是影响鱼类生长发育和繁殖的主要环境因素, 可以直接影响鱼体的代谢、免疫、能量收支等生理生化活动(王润萍等, 2019)。在适宜的温度范围内, 鱼体拥有较高的生理代谢水平和较强的生理机能, 此时生长速度和免疫活力均保持在较好的水平; 高温和低温会使鱼体出现代谢紊乱和多种生理应激反应, 阻碍正常的生长发育, 甚至造成永久性损伤和死亡(Nurdiani et al, 2007; 李伟业等, 2021)。温度还会影响部分鱼类的性别分化, 大多数温度敏感性鱼类在高温下可使群体中雄性率升高, 利用温度控制养殖群体的性别比例具有重要的实用经济价值(Hayashi et al, 2010; 喻杰等, 2020)。
温度也是鱼类早期发育的关键控制因子之一。鱼类早期发育阶段各组织器官发育不完全, 游泳、摄食、消化等生理机能和运动能力较差, 对外界环境极为敏感(蔡瑞钰, 2019)。由于温度不适造成受精卵孵化率降低、苗种死亡率升高的现象时有发生, 鱼体在早期发育阶段受到的温度胁迫还会持续影响整个生长周期, 导致养殖产量降低, 给渔业生产带来一定的经济损失。因此, 鱼类早期发育适宜温度的探索确定对研究鱼类繁育生产至关重要。研究表明温度对大鳞副泥鳅和泥鳅(Misgurnus anguillicaudatus)的胚胎发育、性腺分化、生长发育等具有重要影响(陈玉红等, 2007; 李潜洲, 2015; 刘自然等, 2018), 然而温度对金红色品系大鳞副泥鳅的影响研究鲜见报道。本试验对“赣红1号”在不同温度条件下受精卵孵化、仔鱼活力及性别分化的情况开展探究, 以期掌握其早期培育的最适温度范围以及早期阶段环境温度对性别分化的影响, 从而为“赣红1号”的实际生产示范提供理论参考, 促进金红色大鳞副泥鳅的生产应用和养殖推广。
1 材料与方法 1.1 试验材料金红色大鳞副泥鳅(Paramisgurnus dabryanus)取自江西省水产科学研究所科研试验基地, “赣红1号”亲本雌鳅平均体重(69.46±5.74) g, 体长(20.61±0.77) cm; 雄鳅平均体重(62.39±9.78) g, 体长(20.88±0.93) cm。亲鱼经催产后人工授精。受精卵置于孵化桶中孵化, 水温(26±1) ℃, 溶氧≥5.0 mg/L, pH为7.2~8.2。
1.2 试验方法 1.2.1 不同温度下受精卵的孵化试验设置5个温度梯度组(20, 23, 26, 29, 32 ℃), 每组3个平行。分别将盛有1 000 mL水的烧杯置于调好温度的恒温水浴槽中提前控温, 控温误差范围为±0.5 ℃。每个烧杯中分别随机放入100粒同一批次人工授精, 外观正常、无破损的受精卵。观察不同温度下“赣红1号”胚胎的发育情况, 记录各组的培育周期(cultivation periods)、孵化周期(hatching periods)、孵化率(hatching rate)和初孵仔鱼的畸形率(malformation rate)。
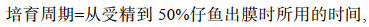 (1)
(1) (2)
(2)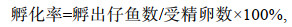 (3)
(3)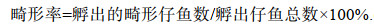 (4)
(4)设置5个温度组(20, 23, 26, 29, 32 ℃), 每组3个平行。将盛有1 000 mL水的烧杯置于调好温度的恒温水浴槽中提前控温, 待孵化桶中的仔鱼出膜时, 分别随机挑选100尾发育正常、无畸形的初孵仔鱼放入各烧杯中, 期间不投饵, 发现死亡个体及时捞出并计数, 直至仔鱼全部死亡。计算仔鱼不投饵存活系数(survival activity index, SAI)和存活率(survival rate)。以仔鱼存活率和不投饵存活系数来评价仔鱼活力(张海发等, 2006)。
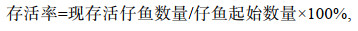 (5)
(5) (6)
(6)式中, N为试验初始时仔鱼数量, hi为第i天仔鱼累计死亡数, k为仔鱼全部死亡所需的天数。
1.2.3 早期不同温度下性别分化的试验选取1 000粒同一批次人工授精, 外观正常、无破损的受精卵随机分为5组, 分别放入空调房中5个养殖箱(80 cm×60 cm×50 cm)内, 设置5个温度组(20, 23, 26, 29, 32 ℃), 用加热棒控制每个养殖箱的温度, 控温误差范围为±1.0 ℃。试验鱼分别在各温度组中培育至15日龄, 然后将各组温度逐渐调至自然水温(23~25 ℃), 养殖至90日龄。养殖前期投喂轮虫、桡足类等浮游动物, 后期每天投喂2次人工配合饲料, 各组养殖条件保持一致, 定时换水, 发现死鱼及时捞出。各试验组在90日龄时分别观察统计雄性率。
1.3 数据处理试验数值用“Means±SD”表示, 数据统计使用SPSS 17.0和Excel 2010, 采用单因素方差分析法进行显著性分析(P < 0.05)。
2 结果 2.1 不同温度对受精卵孵化的影响“赣红1号”受精卵在试验温度范围内均能孵化出仔鱼, 培育周期随着温度的升高而显著缩短, 见表 1。20 ℃时培育周期(76.09 h)是32 ℃ (21.65 h)时的3.51倍, 各试验组之间差异显著(P < 0.05)。培育周期与温度呈负相关关系, 其拟合曲线(回归方程)表达式为:
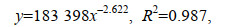 (7)
(7)| 孵化指标 | 温度/℃ | ||||
| 20 | 23 | 26 | 29 | 32 | |
| 培育周期(h) | 76.09±3.24e | 45.83±2.24d | 34.68±1.44c | 26.80±0.80b | 21.65±0.56a |
| 孵化周期(h) | 27.22±2.14d | 17.42±1.52c | 11.86±1.14b | 5.75±0.66a | 4.63±0.35a |
| 孵化率(%) | 63.00±5.29ab | 75.33±2.73bc | 81.67±4.04c | 72.67±5.13abc | 60.33±5.51a |
| 畸形率(%) | 36.92±2.92c | 15.41±2.67ab | 9.32±2.06a | 19.65±1.53b | 38.48±3.41c |
| 注: 表中数据均为平均值±标准差; 同一行中上标字母不同表示差异显著(P < 0.05)。下同 | |||||
式中, y为培育周期, x为水温, 见图 1。
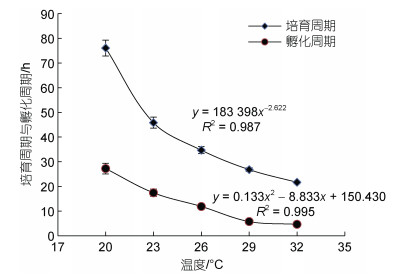 |
| 图 1 温度对“赣红1号”受精卵培育周期和孵化周期的影响 Fig. 1 Effect of temperature on cultivation periods and hatching periods of fertilized eggs of "Ganhong 1" |
20~32 ℃范围内, 孵化周期与培育周期的变化趋势一致, 随着温度的升高而缩短。29 ℃ (5.75 h)和32 ℃ (4.63 h)组间差异不显著, 其余各组间均达到显著差异(P < 0.05)。对孵化周期进行多项式回归分析, 其回归方程为:
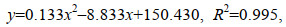 (8)
(8)式中, y为孵化周期, x为水温, 见图 1。
试验温度范围内, 在20~26 ℃, 孵化率随温度的升高而升高; 在26~32 ℃, 孵化率随温度的升高而降低。26 ℃时具有最高的孵化率(81.67%), 其次是23 ℃ (75.33%), 在32 ℃孵化率最低(60.33%), 26 ℃和23 ℃的孵化率均显著高于20 ℃和32 ℃, 孵化率与相应温度间呈二次曲线函数关系, 其表达式为:
 (9)
(9)式中, y为孵化率, x为水温, 见图 2。
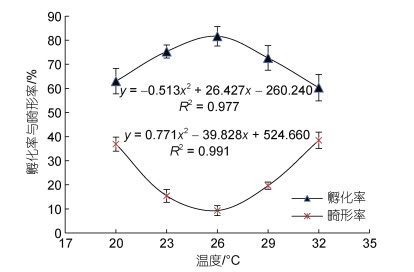 |
| 图 2 温度对“赣红1号”受精卵孵化率与畸形率的影响 Fig. 2 Effect of temperature on hatching rate and malformation rate of fertilized eggs of "Ganhong 1" |
各温度组胚胎和初孵仔鱼均出现畸形现象, 初孵仔鱼畸形率随着温度的升高呈现先降低后升高的趋势, 两个端值温度20和32 ℃组畸形率最高, 分别达到36.92%和38.48%, 在26 ℃畸形率最低(9.32%), 显著低于20、29和32 ℃组, 畸形率与相应温度间同样呈二次曲线函数关系:
 (10)
(10)式中, y为畸形率, x为水温, 见图 2。
部分畸形胚胎在未出膜前即停止发育, 少部分畸形胚胎在胚体出膜期或出膜后短时间内死亡。初孵仔鱼的畸形类型主要有骨骼畸形(脊柱弯曲, 尾部弯曲)、卵黄囊异形、围心腔水肿、尾部缺失四种, 且骨骼畸形的数量占比最高(图 3)。
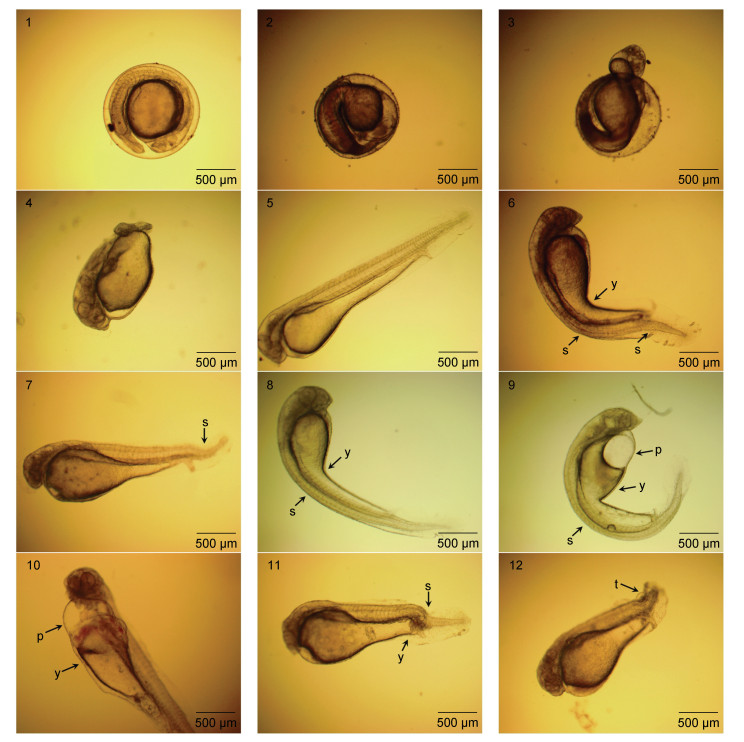 |
| 图 3 正常发育及畸形发育的胚胎和初孵仔鱼 Fig. 3 The embryos and newly-hatched larvae of "Ganhong 1" with normal and malformed development 注: 1. 正常胚胎; 2. 畸形胚胎停止发育; 3. 畸形胚体在出膜期死亡; 4. 畸形胚体出膜后短时间内死亡; 5. 正常初孵仔鱼; 6~12. 畸形初孵仔鱼。s: 骨骼畸形; y: 卵黄囊异形; p: 围心腔水肿; t: 尾部缺失 |
20~32 ℃范围内, 随着温度的升高, 仔鱼的SAI值逐渐降低, 各组间数据差异显著(P < 0.05) (表 2, 图 4)。20~26 ℃范围内各组仔鱼的SAI值都在35以上, 29和32 ℃组的SAI值分别为22.11和14.75 (图 4)。各组仔鱼的存活率均在前期缓慢下降, 到达某个时间点后开始骤降, 并在较短时间内降至0; 温度越高, 存活率骤降的时间越早, 最长可存活时间越短(图 5)。20 ℃时, 仔鱼SAI值最高, 此温度下仔鱼在9日龄的存活率可达91.00%, 但在12~14日龄时存活数目骤降, 半数死亡时间发生在13日龄, 不投饵最长存活时间可达16日龄。23 ℃下仔鱼的SAI值为59.77, 9日龄存活率达到82.67%, 11日龄后存活率急剧下降, 半数死亡时间较20 ℃组提前1 d, 最大可存活时间为15 d。26 ℃下仔鱼6日龄平均存活率为91.33%, 7日龄后存活率开始急剧下降, 半数死亡时间发生在9日龄, 并在11日龄时存活率降至0。29 ℃下仔鱼存活率在6日龄开始快速降低, 7日龄存活率即由83.00%降低到38.00%, 并在3d后全部死亡。32 ℃下仔鱼在5日龄后开始大量死亡, 半数死亡时间发生在6日龄, 并在7日龄时死亡率达到100%。
| 时间 | 初孵仔鱼不同温度下的存活率/% | ||||||||||||||
| 20 | 23 | 26 | 29 | 32 | |||||||||||
| 1 d | 100 | 100 | 100 | 100 | 99 | 99 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| 2 d | 99 | 99 | 99 | 99 | 98 | 99 | 99 | 99 | 99 | 100 | 99 | 99 | 99 | 100 | 99 |
| 3 d | 97 | 99 | 97 | 99 | 98 | 97 | 97 | 97 | 97 | 98 | 96 | 97 | 99 | 100 | 98 |
| 4 d | 97 | 97 | 97 | 97 | 97 | 96 | 97 | 97 | 95 | 93 | 94 | 92 | 98 | 97 | 96 |
| 5 d | 97 | 96 | 95 | 97 | 95 | 90 | 96 | 93 | 94 | 89 | 90 | 88 | 94 | 89 | 90 |
| 6 d | 96 | 96 | 94 | 93 | 94 | 83 | 93 | 90 | 91 | 84 | 89 | 76 | 3 | 0 | 15 |
| 7 d | 94 | 95 | 91 | 92 | 90 | 79 | 90 | 85 | 85 | 48 | 53 | 13 | 0 | — | 0 |
| 8 d | 93 | 95 | 89 | 92 | 88 | 79 | 76 | 78 | 67 | 5 | 7 | 1 | — | — | — |
| 9 d | 93 | 94 | 86 | 89 | 84 | 75 | 46 | 55 | 47 | 0 | 2 | 0 | — | — | — |
| 10 d | 89 | 92 | 84 | 85 | 81 | 71 | 0 | 2 | 6 | — | 0 | — | — | — | — |
| 11 d | 85 | 83 | 77 | 68 | 73 | 61 | — | 0 | 0 | — | — | — | — | — | — |
| 12 d | 62 | 77 | 62 | 19 | 62 | 21 | — | — | — | — | — | — | — | — | — |
| 13 d | 22 | 31 | 14 | 0 | 25 | 0 | — | — | — | — | — | — | — | — | — |
| 14 d | 0 | 3 | 4 | — | 4 | — | — | — | — | — | — | — | — | — | — |
| 15 d | — | 1 | 0 | — | 0 | — | — | — | — | — | — | — | — | — | — |
| 16 d | — | 0 | — | — | — | — | — | — | — | — | — | — | — | — | — |
| SAI | 71.56±3.60e | 59.77±5.38d | 36.61±0.59c | 22.11±2.30b | 14.75±0.42a | ||||||||||
 |
| 图 4 不同温度下“赣红1号”初孵仔鱼的SAI值 Fig. 4 SAI of "Ganhong 1" newly-hatched larvae at different temperatures |
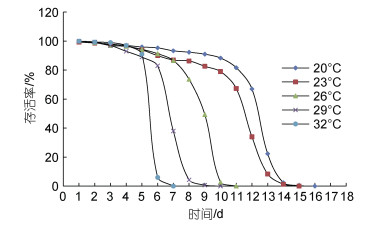 |
| 图 5 不同温度下“赣红1号”初孵仔鱼的存活率 Fig. 5 Survival rate of "Ganhong 1" newly-hatched larvae at different temperatures |
试验结束时解剖所有试验鱼, 通过组织学结构鉴定生理性别, 并统计各组性别比例。在试验温度范围内, “赣红1号”雄性率随温度的升高而升高(图 6)。26 ℃处理组雌雄比例接近1︰1 (雄性率51.72%), 20和23 ℃处理组雄性率轻微降低, 雄性率分别为47.30%和48.75%; 26 ℃时雄性率有所提升(56.63%), 32 ℃处理组雄性率明显提升(65.82%)。
 |
| 图 6 不同温度下“赣红1号”幼鱼的雄性率 Fig. 6 The male ratio of "Ganhong 1"larva at different temperatures |
不同鱼种受精卵孵化要求的温度条件不同, 并且对温度的适应范围也有明显的差异, 当温度高于或低于该鱼种的适宜区间, 均会对其正常的孵化和生长发育造成胁迫, 造成较高的畸形率和死亡率(张廷廷等, 2016)。“赣红1号”的胚胎发育需历经7个阶段29个发育时期(马本贺等, 2020), 受精卵在20~32 ℃均可孵化出膜。本试验采用静水孵化, 胚胎的培育周期与程玮玮(2015)所做大鳞副泥鳅孵化用时基本一致, 但与孵化桶循环水孵化相比时间较长, 原因可能是孵化方式的不同, 循环水孵化能带来更充足、适宜的溶解氧, 加快了胚胎发育进程。以培育周期、孵化周期、孵化率和畸形率作为评价指标, 来衡量温度对“赣红1号”受精卵孵化的影响, 一般而言, 从受精卵到仔鱼出膜期, 胚胎的耐热性呈现先升高后降低的趋势(桂建芳等, 2021)。20 ℃处理组胚胎的孵化周期和培育周期分别为76.09 h和27.22 h, 孵化率为63.00%, 畸形率达到了36.92%, 刘自然等(2018)发现在低温(17 ℃)条件下泥鳅受精卵第一次卵裂时间和卵裂间隔时间明显延长, 低温会抑制胚胎内孵化酶的活力, 降低胚胎细胞代谢和分裂速度, 进而减缓或阻止发育进程, 李文豪等(2018)对斑马鱼(Danio rerio)胚胎进行温度胁迫, 结果显示低温可造成细胞凋亡和肌肉发育的阻滞以及各器官发育速率不一致, 造成畸形率升高。另外, 培育周期和孵化周期越长, 胚胎受外界环境的影响越大, 更容易遭受霉菌感染或其他生物侵袭, 进一步导致了其较低的孵化率和较高的畸形率。20~26 ℃范围内, 随着温度的升高, 受精卵呈现出培育周期、孵化周期缩短, 孵化率升高、畸形率下降的趋势。26~32 ℃范围内, 受精卵的培育周期、孵化周期进一步缩短, 而孵化率和畸形率分别表现出降低和升高的趋势。这是因为在适宜的温度范围内, 温度升高可以提高胚胎孵化酶活性, 促进相关代谢活动, 加快胚胎发育速度, 但温度过高则可能使胚胎中的孵化酶失活、胚胎的代谢发生紊乱, 导致畸形甚至死亡(舒琥等, 2008)。每种鱼类胚胎发育对温度的最适条件不同, 但其在适宜温度范围内的孵化趋势基本一致。
正常胚体一般是尾部率先破膜而出, 依靠尾部摆动完成整个鱼体的出膜。本试验发现部分畸形胚体存在头部先出膜的现象, 且在出膜期即停止心跳, 无法完成整个出膜过程, 或出膜后短时间内即陆续死亡。不适宜的环境均会导致胚胎与初孵仔鱼出现畸形现象, 不同环境因子造成畸形的类型基本一致, 以骨骼畸形、围心腔水肿、卵黄囊异形、器官缺失等为主, 本试验畸形初孵仔鱼中以骨骼畸形占比最高, 且骨骼畸形往往导致卵黄囊异形伴随出现。
孵化周期越短, 说明该批次受精卵越整齐、越健康, 在实际育苗中可以提高整体的成活率, 有助于繁殖孵化的规模化生产。本试验中26 ℃时具有最高的孵化率和最低的畸形率, 以及较短的培育和孵化周期, 在实际生产中孵化水温最低不宜低于23 ℃, 最高不宜超过29 ℃。
3.2 温度对仔鱼生存活力的影响鱼类生长是一个新陈代谢的过程, 在饥饿期间用身体的储备能量来维持生命活动和个体生长, 对于初孵仔鱼来说, 其新陈代谢所需要的能量来自卵黄囊。仔鱼在无外源营养摄入条件下的生存活力可用仔鱼不投饵存活系数(SAI)和存活率评价, 理论上来说SAI值越高, 仔鱼的培育成活率就越高(Jaworski et al, 2002)。本次试验中初孵仔鱼各温度下的SAI值明显高于泥鳅, 可能与卵黄囊营养物质含量、环境因子以及亲鱼的性腺发育情况密切相关(刘阳等, 2017)。温度对水生动物渗透压的调节和氧气消耗, 以及一系列的酶促反应均有影响(杨斯琪等, 2019), 在20~32 ℃范围内, 随着温度的升高, 初孵仔鱼的最长可存活时间和半数死亡时间(LT50)显著缩短。20 ℃下的最长可存活时间(16 d)和半数死亡时间(13 d)分别是32 ℃时的2.29倍和2.17倍, 这是因为低温条件下, 鱼体的酶活降低, 酶促反应减缓, 新陈代谢速率下降(王兰梅等, 2018), 卵黄囊中的营养物质消耗缓慢, 其可存活时间越长; 温度越高, 仔鱼的新陈代谢越旺盛, 消耗营养物质越快, 越早发育进入外源性营养阶段, 在无外源性能量摄入的情况下, 越容易耗尽体内营养物质而死亡, 其死亡高峰期来的越快(柳敏海等, 2006)。高温还会破坏鱼体的免疫系统和抗氧化系统, 使机体产生应激反应和器官损伤, 这也是高温导致死亡时间提前和死亡率升高的原因之一。王涵生等(2002)认为仔鱼的半数死亡时间几乎相当于其忍受饥饿的时间临界点, 超过此时间, 仔鱼在恢复投饵后也无法恢复完全的摄食能力, 初孵仔鱼半数死亡时间越长, 其培育成活率越高。
温度不仅影响仔鱼的存活, 还影响其正常的生长发育, 李潜洲(2015)发现泥鳅幼鱼[(2.61±1.75) g]成活率在23 ℃时最高, 特定生长率在25 ℃达到最高水平。仔鱼SAI值的测定必须在适宜的环境条件下进行, 否则所测定的SAI值就不能体现真实的仔鱼活力(张海发等, 2006)。在实际养殖中, 发现仔鱼在20 ℃下虽然拥有最高的SAI值和最长可存活时间, 但苗种培育阶段新陈代谢水平低、营养物质消耗慢, 整体生长缓慢, 且规格差异较大, 表明此温度不适宜仔稚鱼的生长发育。23 ℃时SAI值为59.77, 最长可存活时间和半数死亡保持在较高的水平, 仔鱼在此温度下可保持较高的SAI值和存活率, 其生理活动及生长发育变得正常。在结合SAI值和存活率的基础上考虑早期生长发育情况, 综合判断仔鱼活力的适宜温度范围为23~26 ℃。
3.3 温度对性别分化的影响鱼类的性别决定及分化机制具有多样性和可塑性, 其性别决定可分为遗传决定模式(genetic sex determination, GSD)、环境决定模式(environmental sex determination, ESD)和遗传-环境协同决定模式(GSD+ESD) (Bachtrog et al, 2014; Wang et al, 2014; Capel, 2017)。温度性别决定(temperature sex determination, TSD)是环境决定模式中的主要类型之一(Baroiller et al, 2009), 温度一方面可以调控性别决定相关基因表达和促性腺激素分泌, 另一方面可作用于性腺、生殖细胞和类固醇激素代谢(Tong et al, 2003; Shen et al, 2014)。本次试验“赣红1号”在高温条件下(29 ℃, 32 ℃)具有雄性率升高的趋势, 与泥鳅(Nomura et al, 1998)、尼罗罗非鱼(Oreochromis niloticus) (Baroiller et al, 1995)等研究结果一致。
不同鱼类对温度的敏感期有所差异, 温度性别决定模式的敏感期通常发生在性腺形成前期或起始阶段(Baroiller et al, 2001; Goto-Kazeto et al, 2006)。南平等(2005)将受精卵置于特定温度下孵化直至体长达到6 cm以上, 发现在25~30 ℃范围内, 随着温度的升高, 泥鳅和大鳞副泥鳅的雄性个体比例均明显增加; 陈玉红等(2007)认为泥鳅的性别分化主要集中在仔鱼出膜后的25~30 d, 将5日龄的仔鱼置于各温度组中培育30 d后转回自然水温(23~25 ℃), 继续养殖至70日龄, 结果显示27 ℃和32 ℃温度中幼鱼的雄性率分别高达82.0%和90.0%。本研究中温度控制时间为从受精卵至仔鱼出膜15日龄, 温控时间较短且此时期尚未产生卵巢和精巢的分化, 15日龄后转回自然水温培育至90日龄, 高温组(29 ℃, 32 ℃)中幼鱼也表现出雄性率升高的趋势, 但雄性率低于南平等(2005)和陈玉红等(2007)的结果, 这说明温度对泥鳅和大鳞副泥鳅性别分化的影响是持续性的过程, 在性腺形成前期或性腺分化起始阶段均能有效诱导性别分化。
多种鱼类存在雌雄性别二态性, 或某种性别具有特定的价值特征, 这就导致了人们对其性别控制的需求(周贺等, 2015)。大鳞副泥鳅养殖产业中, 不同场景对雌雄数量的需求不尽相同, 如相同规格雄鳅含肉率高; 人工繁殖中雌鳅使用量更大等现象, 通过温度诱导控制其性别比例, 可以满足特定的市场需求, 提高养殖经济效益。
4 结论综上所述, 水温对大鳞副泥鳅“赣红1号”的孵化和性别分化有着重要影响。在“赣红1号”生产中, 孵化水温和仔鱼培育的适宜温度应保持在23~26 ℃, 在适宜温度下可以降低苗种畸形率, 保持较高的孵化率和仔鱼成活率, 以及较为平衡的雌雄比例。此结果可为金红色大鳞副泥鳅的养殖产业提供一定的理论和实践指导。
马本贺, 陶志英, 吴早保, 等, 2020. 大鳞副泥鳅新品系的人工繁殖及胚胎发育. 水产科学, 39(6): 863-870 |
王兰梅, 宋飞彪, 朱文彬, 等, 2018. 温度对马来西亚红罗非鱼越冬期体色的影响. 水产学报, 42(1): 72-79 |
王润萍, 戴铃灵, 陈雅飞, 等, 2019. 短期温度、盐度胁迫对海洋青鳉鱼(Oryzias melastigma)摄食行为及抗氧化的影响. 海洋与湖沼, 50(2): 378-387 |
王涵生, 方琼珊, 郑乐云, 2002. 盐度对赤点石斑鱼受精卵发育的影响及仔鱼活力的判断. 水产学报, 26(4): 344-350 |
刘自然, 潘淦, 2018. 温度对泥鳅胚胎卵裂间隔时间影响研究. 河南师范大学学报(自然科学版), 46(4): 74-80 |
刘阳, 温海深, 李吉方, 等, 2017. 盐度与pH对花鲈孵化、初孵仔鱼成活及早期幼鱼生长性能的影响. 水产学报, 41(12): 1867-1877 |
李文豪, 冉皓宇, 陈良标, 2018. 低温胁迫导致斑马鱼尾部发育畸形的分子机制. 基因组学与应用生物学, 37(6): 2383-2388 |
李伟业, 徐志进, 殷小龙, 等, 2021. 温度对美洲黑石斑(Centropristis striata)幼鱼生长和免疫因子活力与相关基因表达的影响. 海洋与湖沼, 52(3): 708-717 |
李潜洲, 2015. 泥鳅生长和繁殖的环境条件研究[D]. 福州: 福州大学: 12-18.
|
杨斯琪, 郑洪武, 孙颖, 等, 2019. 氨氮、温度和体重对大口黑鲈(Micropterus salmoides)幼鱼耗氧率和窒息点的影响. 海洋与湖沼, 50(6): 1328-1333 |
张廷廷, 陈超, 施兆鸿, 等, 2016. 温度对云纹石斑鱼(Epinephelus moara)胚胎发育和仔鱼活力的影响. 渔业科学进展, 37(3): 28-33 |
张海发, 刘晓春, 王云新, 等, 2006. 温度、盐度及pH对斜带石斑鱼受精卵孵化和仔鱼活力的影响. 热带海洋学报, 25(2): 31-36 |
陈玉红, 林丹军, 尤永隆, 2007. 泥鳅的性腺分化及温度对性腺分化的影响. 中国水产科学, 14(1): 74-82 |
周贺, 李佳奇, 马海艳, 等, 2015. 低温诱导红鳍东方鲀雄性化及性腺分化的组织学观察. 大连海洋大学学报, 30(1): 41-47 |
南平, 杜启艳, 燕帅国, 等, 2005. 温度对泥鳅和大鳞副泥鳅性腺分化的影响和CYP19a基因的克隆与时空表达. 中国水产科学, 12(4): 407-413 |
柳敏海, 施兆鸿, 陈波, 等, 2006. 饥饿对点带石斑鱼饵料转换期仔鱼生长和发育的影响. 海洋渔业, 28(4): 292-298 |
桂建芳, 周莉, 殷战, 等, 2021. 水产遗传育种学.
|
喻杰, 杨弘, 2020. 鱼类性别决定的遗传基础及性别控制技术在水产养殖中的应用. 大连海洋大学学报, 35(2): 161-168 |
程玮玮, 2015. 温度对大鳞副泥鳅和真泥鳅胚胎发育的影响. 安徽农学通报, 21(24): 128-129 |
舒琥, 樊景新, 张海发, 等, 2008. 温度对黄鳍东方鲀胚胎发育和仔鱼存活的影响. 水产科学, 27(5): 217-220 |
蔡瑞钰, 2019. 云南盘鮈仔稚鱼发育及温度的影响[D]. 重庆: 西南大学: 32-34.
|
BACHTROG D, MANK J E, PEICHEL C L, et al, 2014. Sex determination: why so many ways of doing it. PLoS Biology, 12(7): e1001899 |
BAROILLER J F, CHOURROUT D, FOSTIER A, et al, 1995. Temperature and sex chromosomes govern sex ratios of the mouthbrooding Cichlid fish Oreochromis niloticus. Journal of Experimental Zoology, 273(3): 216-223 |
BAROILLER J F, D'COTTA H, 2001. Environment and sex determination in farmed fish. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 130(4): 399-409 |
BAROILLER J F, D'COTTA H, SAILLANT E, 2009. Environmental effects on fish sex determination and differentiation. Sexual Development, 3(2/3): 118-135 |
CAPEL B, 2017. Vertebrate sex determination: evolutionary plasticity of a fundamental switch. Nature Reviews Genetics, 18(11): 675-689 |
GOTO-KAZETO R, ABE Y, MASAI K, et al, 2006. Temperature-dependent sex differentiation in goldfish: establishing the temperature-sensitive period and effect of constant and fluctuating water temperatures. Aquaculture, 254(1/4): 617-624 |
HAYASHI Y, KOBIRA H, YAMAGUCHI T, et al, 2010. High temperature causes masculinization of genetically female medaka by elevation of cortisol. Molecular Reproduction and Development, 77(8): 679-686 |
HUANG Z H, MA B H, GUO X L, et al, 2021. Comparative transcriptome analysis of the molecular mechanism underlying the golden red colour in mutant Taiwanese loach. Aquaculture, 543: 736979 |
JAWORSKI A, KAMLER E, 2002. Development of a bioenergetics model for fish embryos and larvae during the yolk feeding period. Journal of Fish Biology, 60(4): 785-809 |
NOMURA T, ARAI K, HAYASHI T, et al, 1998. Effect of temperature on sex rations of normal and gynogenetic diploid loach. Fisheries Science, 64(5): 753-758 |
NURDIANI R, ZENG C S, 2007. Effects of temperature and salinity on the survival and development of mud crab, Scylla serrata (Forsskål), larvae. Aquaculture Research, 38(14): 1529-1538 |
SHEN Z G, WANG H P, 2014. Molecular players involved in temperature-dependent sex determination and sex differentiation in teleost fish. Genetics Selection Evolution, 46(1): 26 |
TONG S K, CHUNG B C, 2003. Analysis of zebrafish Cyp19 promoters. The Journal of Steroid Biochemistry and Molecular Biology, 86(3/5): 381-386 |
WANG H P, GAO Z X, RAPP D, et al, 2014. Effects of temperature and genotype on sex determination and sexual size dimorphism of bluegill sunfish Lepomis macrochirus. Aquaculture, 420 Suppl 1-421 Suppl 1: S64-S71 |
 2022, Vol. 53
2022, Vol. 53


