
中国海洋湖沼学会主办。
文章信息
- 李忠琴, 邹文政, 张光明, 杨求华, 庄若飞, 乔欣君, 江兴龙. 2022.
- LI Zhong-Qin, ZOU Wen-Zheng, ZHANG Guang-Ming, YANG Qiu-Hua, ZHUANG Ruo-Fei, QIAO Xin-Jun, JIANG Xing-Long. 2022.
- 植物乳杆菌(Lactobacillus plantarum)对云龙石斑鱼生长、抗氧化性能及血清生化水平的影响
- EFFECTS OF LACTOBACILLUS PLANTARUM-ENRICHED DIET ON GROWTH PERFORMANCE, ANTIOXIDANT ABILITY, AND SERUM BIOCHEMICAL LEVEL OF EPINEPHELUS YUNLONG GROUPER
- 海洋与湖沼, 53(2): 457-465
- Oceanologia et Limnologia Sinica, 53(2): 457-465.
- http://dx.doi.org/10.11693/hyhz20210900215
文章历史
-
收稿日期:2021-09-21
收修改稿日期:2021-10-24
2. 福建省水产研究所 福建厦门 361012;
3. 厦门惠盈动物科技有限公司 福建厦门 361021
2. Fujian Fisheries Research Institute, Xiamen 361012, China;
3. Xiamen Huiying Animal Technology Co. Ltd., Xiamen 361021, China
乳酸菌(lactic acid bacteria)是一类人和动物消化道的有益微生物(杨红玲等, 2010), 主要包括乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、双歧杆菌属(Bifidobacterium)、链球菌属(Streptococcus)和肠球菌属(Enterococcus)等, 具有调节肠道微生态平衡、促进宿主生长、增强宿主免疫力、净化水质等多功能性(曲木等, 2021)。目前已成功应用于食品、医药、保健、畜禽和水产养殖等领域, 作为最主要的饲用益生菌之一而广泛用于动物养殖(李瑞等, 2021)。植物乳杆菌(Lactobacillus plantarum)属于乳杆菌科、乳杆菌属, 是鱼类肠道中常见乳酸菌, 常作为饲料添加剂, 通过定殖于动物体胃肠道等部位后大量增殖, 可抑制病原菌的生长, 产生维生素和促进生长因子等物质, 增加机体对饲料的消化和吸收, 提高生长与成活(胡爱心等, 2021)。
我国2019年、2020年石斑鱼养殖产量分别为18.3万t和19.2万t, 居海水养殖鱼类第三位, 石斑鱼养殖主产区为海南、广东、福建、广西(农业农村部渔业渔政管理局等, 2021)。石斑鱼常见疫病主要是病毒性神经坏死病、虹彩病毒病、弧菌病、刺激隐核虫病等, 传统防治以化学药物为主, 存在残留风险和耐药性问题。养殖中益生菌制剂的应用可以提高鱼体免疫力和抗病力, 有效降低疾病发生, 促进鱼类健康生长。目前关于植物乳杆菌在多种水产动物养殖中的应用研究已有相关报道(齐欣等, 2007; 郑晓婷等, 2016; 郑玉等, 2017; 刘长军, 2018; 张洪玉, 2019; 胡宗福等, 2020; 孔雨昕等, 2021), 均证明了植物乳杆菌可以改善水产养殖动物的肠道健康, 促进生长; 但有关石斑鱼投喂植物乳杆菌的研究及不同添加量的饲喂效果都尚未见报道。本文通过研究石斑鱼摄食不同添加量植物乳杆菌后肠道、肝脏、血清等各项生理生化指标的变化, 分析植物乳杆菌对石斑鱼生长、抗氧化性能、机体代谢等的影响, 探究植物乳杆菌影响石斑鱼健康和生长的作用机制, 确定养殖中合适的添加量, 以期为开发适用于石斑鱼养殖的益生菌制剂奠定理论基础, 促进石斑鱼养殖业的健康发展。
1 材料与方法 1.1 试验设计与饲养管理云龙石斑鱼(Epinephelus moara♀×E. lanceolatus♂)购自福建漳州石斑鱼养殖场。试验于2021年5~7月在集美大学水产学院的室内循环水养殖池中进行(养殖密度约36尾/m3), 暂养2周后挑选均重为(66.37±0.75) g石斑鱼240尾, 随机分成4组, 分别添加植物乳杆菌(L. plantarum), 即低剂量组F1 (1×105 CFU/g)、中剂量组F2 (1×107 CFU/g)、高剂量组F3 (1×109 CFU/g), 以及对照组F0 (0 CFU/g)。每组3个重复, 每个重复20尾, 试验周期40 d。每天定时定量投喂(初始投喂量为体重的1.5%, 此后根据摄食情况进行相应的调整), 日投喂2次(08:00和18:00), 并在投食1 h后吸出剩余饲料, 记录每次摄食量。暂养及投喂试验期间24 h保持养殖池连续充气, 用溶氧仪测量每日溶氧、pH、水温, 控制水温为(28±1) ℃, 溶氧为(6.8±0.9) mg/L, pH为7.9±0.3, 盐度为33.5。
1.2 样品制备投喂至40 d, 停喂1 d后, 称量每池鱼称量总重, 并随机捞取3尾, 每组共9尾, 丁香酚浸泡麻醉后, 无菌注射器尾静脉抽血, 全血样品于4 ℃静置析出血清, 3 000 r/min离心10 min, 收集血清于1.5 mL离心管, –80 ℃保存备用; 解剖取出内脏团称重, 立即用生理盐水清洗, 分离出肝脏和肠道, 放入收集管中, 立即放入液氮, 速冻2 h后, 将液氮中的样品转移至–80 ℃保存备用。
1.3 指标测定 1.3.1 生长性能指标以投喂40 d前后石斑鱼的总重量和总尾数, 计算初均重(initial average weight, IAW)、末均重(final average weight, FAW)、增重率(weight gain rate, WGR)、特定生长率(specific growth rate, SGR)和饲料系数(feed conversion rate, FCR), 相关公式如下:
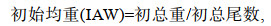 (1)
(1)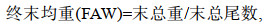 (2)
(2) (3)
(3) (4)
(4) (5)
(5)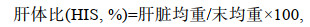 (6)
(6) (7)
(7)肠道和肝脏组织分别取1 g, 置于2 mL生理盐水中, 经匀浆仪研磨后, 离心去除沉淀, 制备匀浆液, 再利用试剂盒进行酶活检测。
消化酶活性测定: α-淀粉酶(amylase, AMS)、脂肪酶(lipase, LPS)、糜蛋白酶(chymotrypsin, CHY)活性采用酶标仪进行测定, 试验使用的试剂盒均购于南京建成生物工程研究所。
抗氧化指标测定: 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、还原型谷胱甘肽(GSH)、总抗氧化能力(T-AOC)和丙二醛(MDA)含量均采用南京建成生物工程研究所生产的相关试剂盒进行测定, 具体操作均参照说明书。
1.3.3 血清生化指标测定血清中总蛋白(TP)、白蛋白(Alb)、胆固醇(TC)、甘油三酯(TG)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)的含量均采用南京建成生物工程研究所生产的相关试剂盒进行测定, 具体操作均参照说明书。
1.4 数据统计与分析试验数据用平均值±标准差(mean±SD)表示, 采用SPSS 25.0软件进行单因素方差分析(one-way ANOVA), 若组间差异显著, 则采用Duncan氏法进行多重比较, 显著性水平设置为P < 0.05, 并用Graphpad Prism 8.0软件作图。
2 结果 2.1 植物乳杆菌对石斑鱼生长性能的影响各试验组石斑鱼的生长情况见表 1。与对照组F0相比, 添加组F1、F2、F3各组的终末均重、增重率、特定生长率均有所升高, 随植物乳杆菌的添加量增加先升后降, 而脏体比和肝体比均无明显差异。其中, 中剂量F2添加组的终末均重、增重率、特定生长率显著高于对照组和F1、F3添加组(P < 0.05); F2饵料系数显著低于对照组(P < 0.05)。低剂量F1添加组的各指标均优于对照组, 但除了增重率显著高于对照组(P < 0.05)之外, 其余指标均无明显差异(P > 0.05)。高剂量F3添加组与对照组无显著性差别(P > 0.05)。与对照组相比, 各添加组的肝体比和脏体比略有变化, 但是无显著性差异(P > 0.05); 各添加组的存活率均略有升高, 但无显著性差异(P > 0.05)。
| 项目 | 组别 | |||
| F0 | F1 | F2 | F3 | |
| 初始均重(IAW) /g | 67.43±0.72 | 66.38±0.85 | 66.38±0.59 | 65.30±0.67 |
| 终末均重(FAW) /g | 102.60±6.75a | 107.85±4.45a | 117.00±3.71b | 102.05±5.75a |
| 增重率(WGR) /% | 52.16±4.78a | 62.47±2.59b | 76.36±5.59c | 56.28±4.65a |
| 特定生长率(SGR) /% | 1.04±0.16a | 1.21±0.19a | 1.42±0.08b | 1.11±0.24a |
| 饲料系数(FCR) | 0.89±0.16a | 0.77±0.15a | 0.58±0.04b | 0.91±0.24a |
| 存活率(SR) /% | 95.83±1.18 | 97.50±2.04 | 96.67±2.36 | 96.67±1.18 |
| 肝体比(HSI) /% | 3.20±0.45 | 2.98±0.27 | 3.08±0.76 | 2.91±0.85 |
| 脏体比(VSI) /% | 6.57±0.57 | 6.57±0.13 | 6.90±0.71 | 5.68±0.69 |
各试验组石斑鱼肠道的消化酶活性见图 1。石斑鱼肠道中淀粉酶、脂肪酶和糜蛋白酶活性, 随植物乳杆菌的添加量增加, 均呈现先升高后降低趋势。与对照组F0相比, F1添加组的淀粉酶、脂肪酶和糜蛋白酶活性, 无明显差异(P > 0.05); F2添加组的淀粉酶、脂肪酶和糜蛋白酶活性均高于对照组, 尤其糜蛋白酶和脂肪酶显著升高(P < 0.05); F3添加组的淀粉酶活性略有降低, 脂肪酶活性无明显差异, 糜蛋白酶活性显著高于对照组(P < 0.05)。
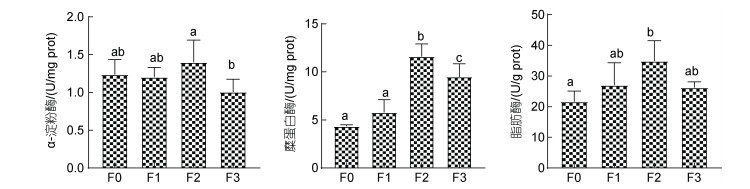 |
| 图 1 植物乳杆菌对石斑鱼肠道消化酶活性的影响 Fig. 1 Effects of L. plantarum on the activity of intestinal digestive enzyme in Epinephelus Yunlong grouper |
各试验组石斑鱼肠道的抗氧化水平见图 2。石斑鱼肠道中T-AOC、CAT、GSH、SOD的变化, 随植物乳杆菌的添加量增加, 均呈现先升高后降低趋势; MDA含量变化, 则呈现降低趋势。与对照组F0相比, F1添加组的T-AOC、SOD显著高于对照组(P < 0.05), CAT、GSH略高于对照组, MDA含量略低于对照组, 但差异不显著(P > 0.05); F2添加组的T-AOC、CAT、GSH、SOD、MDA均与对照组没有显著差异(P > 0.05); F3添加组除了MDA显著低于对照组(P < 0.05), 其余指标无明显变化。
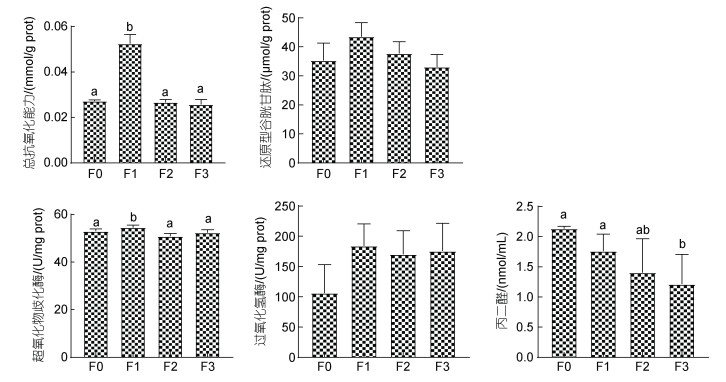 |
| 图 2 植物乳杆菌对石斑鱼肠道抗氧化水平的影响 Fig. 2 Effects of L. plantarum on the antioxidant of intestine of Epinephelus Yunlong grouper |
各试验组石斑鱼肝脏的抗氧化水平见图 3。与对照组F0比较, F1添加组T-AOC、CAT、GSH、SOD的变化没有显著差异, 仅MDA显著降低了32.7% (P < 0.05); F2添加组的T-AOC、MDA分别显著降低了7.7%、23.9% (P < 0.05), 其余指标无明显变化; F3添加组的T-AOC、GSH、SOD均显著高于对照组(P < 0.05), 分别提高了3.5%、10.1%、24.6%, MDA含量显著降低了23.2% (P < 0.05), CAT酶活也提高了30.7% (P > 0.05), 但没有显著高于对照组。
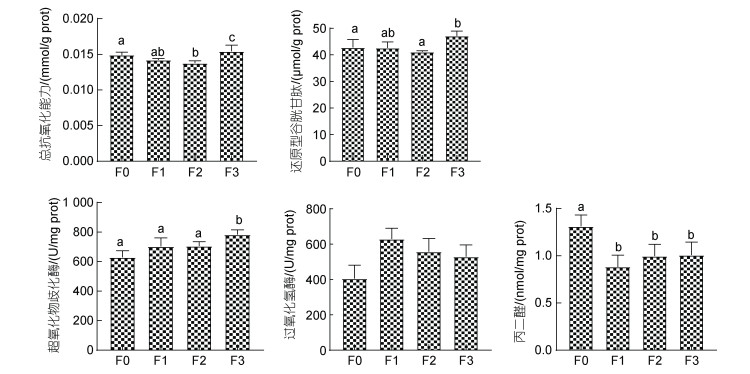 |
| 图 3 植物乳杆菌对石斑鱼肝脏抗氧化水平的影响 Fig. 3 Effects of L. plantarum on the antioxidant of liver of Epinephelus Yunlong grouper |
各试验组石斑鱼血清的生化水平见图 4。石斑鱼血清中总蛋白(TP)、白蛋白(Alb)、胆固醇(TC)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)、丙二醛(MDA), 均出现不同程度降低, 仅甘油三酯(TG)略有升高, 但总体变化不明显(P > 0.05)。
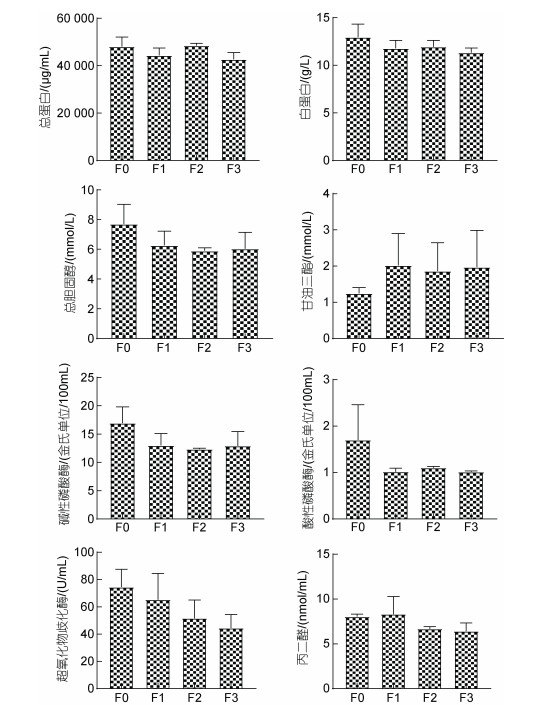 |
| 图 4 植物乳杆菌对石斑鱼血清免疫水平的影响 Fig. 4 Effects of L. plantarum-enriched diet on antioxidant level in serum of Epinephelus Yunlong grouper |
植物乳杆菌是鱼类肠道中的正常菌群, 属于革兰氏阳性、无芽孢、兼性厌氧、异型发酵的乳酸菌, 可在鱼类肠道中定植, 产生乳酸和乳酸杆菌素, 抑制肠道病原菌的生长、繁殖(王洋, 2015)。本试验结果表明, 饲料中添加植物乳杆菌促进了石斑鱼的生长, 但其作用与添加量有关。添加量过高反而对促生长作用影响不显著。当饲料中添加1.0×105 CFU/g植物乳杆菌时, 石斑鱼的终末均重、增重率、特定生长率分别提高了5%、19%、15%; 饲料系数降低了13%; 但与对照组差异不显著。当添加量为1.0×107 CFU/g植物乳杆菌时, 可以显著提高了石斑鱼的终末均重、增重率、特定生长率, 分别增加了14%、46%、35%; 饲料系数降低了34%。而添加量增加到1.0×109 CFU/g植物乳杆菌时, 石斑鱼的终末均重几乎没有变化, 而增重率、特定生长率仅分别提高了8%、6%; 饲料系数反而升高了1%。由此表明, 植物乳杆菌的添加量是影响其作用效果的重要因素, 只有在饲料中添加适当的菌量, 才能促进石斑鱼的健康生长。这与斑点叉尾鮰、凡纳滨对虾、细鳞鲑、彭泽鲫等(齐欣等, 2007; 郑晓婷等, 2016; 郑玉等, 2017; 刘长军, 2018; 张洪玉, 2019; 胡宗福等, 2020)的研究结果相似, 说明饲喂一定量的植物乳杆菌可以促进水产养殖动物的生长。
张洪玉(2019)在饲料中添加3.0×108 CFU/g植物乳杆菌对斑点叉尾鮰生长性能的改善无统计学差异; 郑玉等(2017)拌料投喂1.0×108 CFU/g植物乳杆菌(LAB1036)对凡纳滨对虾的终末均重、增重率、特定生长率均没有显著性影响, 仅可显著降低对虾养殖的饲料系数(P < 0.05); 齐欣等(2007)在养殖水体中每日添加1.0×108 CFU/L植物乳杆菌, 彭泽鲫的增重率、饵料系数、存活率与对照组相比, 无显著差异(P > 0.05); 胡宗福等(2020)在基础饲料中添加1.0×106 CFU/g植物乳杆菌, 细鳞鲑的终末均重、增重率、特定生长率显著高于对照组(P < 0.05); 刘长军(2018)在罗非鱼饲料中添加1.0×107 CFU/g植物乳杆菌组, 罗非鱼的平均增重、增重率和特定生长率显著高于对照组(P < 0.05); 郑晓婷等(2016)比较拌料投喂不同剂量0.5%、1%、2%植物乳杆菌的菌液(109 CFU/mL), 0.5%、1%菌液组[即(0.5~1.0)×107 CFU/g]凡纳滨对虾的平均体质量、质量增加率和特定生长率均显著高于对照组(P < 0.05), 饲料系数显著降低(P < 0.05)。根据这些已报道的试验研究结果和本研究结果, 都说明了在饲料或水体中添加1.0×107 CFU/g植物乳杆菌可以有效促进水产养殖动物的生长, 但当添加量达到或高于1.0×108 CFU/g时, 植物乳杆菌对水产养殖动物的生长没有明显促进作用。
植物乳杆菌能分解饲料中的蛋白质、糖类、脂肪等, 提高饲料的消化率和生物价, 其菌体本身还含有大量的营养物质, 可以供给动物生长需要(何志刚, 2013)。这是植物乳杆菌能促进石斑鱼生长的原因之一, 但植物乳杆菌的营养成分和作用机制需深入研究。植物乳杆菌的最适添加量对石斑鱼生长性能的影响是否与生长发育阶段和养殖条件等有关, 亦有待进一步深入研究。
3.2 植物乳杆菌对石斑鱼肠道消化酶活性的影响鱼类对营养物质的消化吸收主要靠消化道分泌的消化酶, 其活性的高低可用于衡量消化能力(Wu et al, 2012)。益生菌能诱导动物分泌消化酶, 这些酶与动物体内的酶共同起作用, 从而提高饲料转化率, 促进动物生长(刘娜娜, 2014)。乳酸杆菌繁殖过程产生大量有机酸使肠道环境偏酸性, 而大多数消化酶的最适pH均偏酸性; 而且有机酸还可加强肠道蠕动和消化酶的分泌, 有利于机体对营养物质的消化吸收(李军亮, 2018)。
本研究中, 饲料中添加植物乳杆菌可以提高肠道消化酶的活性, 但其作用与添加量有关。添加量过高反而对消化酶活性的影响不显著。当饲料中添加1.0×107 CFU/g植物乳杆菌时, 石斑鱼肠道的淀粉酶、脂肪酶、糜蛋白酶分别提高了13% (P > 0.05)、167% (P < 0.05)、61% (P < 0.05), 其中脂肪酶、糜蛋白酶活性显著高于对照组; 当饲料中添加1.0×109 CFU/g植物乳杆菌时, 石斑鱼肠道的淀粉酶活性反而略下降了18% (P > 0.05), 脂肪酶、糜蛋白酶分别提高了118% (P < 0.05)、21% (P > 0.05)。由此表明, 饲料中添加植物乳杆菌对石斑鱼的肠道淀粉酶活性没有明显影响; 对脂肪酶的影响最显著, 但对脂肪酶和糜蛋白酶的影响与添加菌量有直接关联, 只有添加合适的菌量, 才能最大限度提高肠道消化酶活性, 促进营养物的消化吸收, 这与凡纳滨对虾、乌鳢等的研究结果相似。郑晓婷等(2016)比较拌料投喂不同剂量0.5%、1%、2%植物乳杆菌的菌液(109 CFU/mL), 3个菌液组[即(0.5~2.0)×107 CFU/g]的肠道中脂肪酶活性均显著高于对照组(P < 0.05), 肠道胃蛋白酶活性虽高于对照组, 但各组间差异不显著。孔雨昕等(2021)在饲料中添加108 CFU/g植物乳杆菌W21, 可显著增加乌鳢肠道淀粉酶、脂肪酶、蛋白酶活性(P < 0.05); 沙玉杰等(2016)在基础饲料中分别添加(1.0×107 CFU/g)戊糖乳杆菌HC-2和粪肠球菌NRW-2, 与对照组相比, 粪肠球菌NRW-2添加组对虾肠道中蛋白酶、淀粉酶、脂肪酶活力均显著提高(P < 0.05); 戊糖乳杆菌HC-2添加组对虾肠道中蛋白酶、脂肪酶活力均显著提高(P < 0.05), 但淀粉酶活力无显著差异。李利等(2021)在基础饵料中添加0.2%、0.4%、0.8%乳酸菌(> 106 CFU/g), 0.4%、0.8%添加组的脂肪酶、蛋白酶分别显著提高了17.9%、17.8%、21.8%、25.8% (P < 0.05), 但淀粉酶活性无显著差异。王国霞等(2010)在幼虾基础日粮中分别添加0%、0.5%、5%、10%和15%的液体乳酸菌制剂, 0.5%组的凡纳滨对虾淀粉酶、脂肪酶显著高于对照组; 而5%组肠道蛋白酶活性显著高于对照组。林艾影等(2020)在幼鱼基础饲料中分别按1.0×108、3.0×108、5.0×108 CFU/g添加乳酸杆菌和粪肠球菌, 两种乳酸菌对军曹鱼的肠道淀粉酶(AMS)、胰蛋白酶(TRY)和脂肪酶(LPS)活性均显著高于对照组(P < 0.05)。由此说明, 添加不同的乳酸菌投喂水产养殖动物, 可以一定程度地提高消化酶活性, 但影响效果与添加量和乳酸菌种类有关。水产养殖动物饲喂益生菌后, 肠道消化酶活性提高的可能原因是益生菌自身消化酶的补充, 或是益生菌刺激了宿主机体消化酶的分泌增加, 尚有待进一步研究。
3.3 植物乳杆菌对石斑鱼肠道和肝脏抗氧化能力的影响GSH是细胞中重要的非酶抗氧化剂, 可以中和自由基或氧化剂; T-AOC从总体上反映了机体对自由基和活性氧类物质抵抗能力(王文豪等, 2020; 张林宝等, 2020)。本研究显示, 石斑鱼的肠道T-AOC、GSH含量, 随添加菌量增多出现下降趋势; 当饲料中添加1.0×105 CFU/g植物乳杆菌时, 与对照组相比, 肠道的T-AOC、GSH分别提高了93.2% (P < 0.05)、23.2% (P > 0.05), 而肝脏T-AOC、GSH的变化不明显, 表明低剂量添加植物乳杆菌可以一定程度地提高石斑鱼肠道的抗氧化能力; 当添加1.0×109 CFU/g时, 石斑鱼肠道T-AOC、GSH含量略低于对照组, 但变化不明显, 而肝脏的T-AOC、GSH分别显著提高了3.4% (P < 0.05)、10.1% (P < 0.05), 表明高剂量添加植物乳杆菌可以一定程度地提高石斑鱼肝脏的抗氧化能力。
SOD和CAT是抗氧化酶系统中的两种关键酶, 较高的SOD和CAT活性水平意味着细胞具备较高的自由基清除能力(Fawole et al, 2020; Liu et al, 2020), MDA是脂质过氧化最主要的标志物(Lei et al, 2021)。本研究显示, 石斑鱼的肠道CAT、SOD、MDA, 随添加菌量增多出现下降趋势; 当饲料中添加1.0×105 CFU/g植物乳杆菌时, 肠道CAT、SOD分别提高了73.5% (P > 0.05)、2.9% (P < 0.05), MDA降低了17.5% (P > 0.05); 肝脏CAT、SOD分别提高了55.2% (P > 0.05)、11.7% (P > 0.05), MDA显著降低了32.7% (P < 0.05)。表明低剂量添加植物乳杆菌可以一定程度上消除肠道和肝脏中的自由基并抑制脂质过氧化。当添加菌量1.0×109 CFU/g时, 肝脏CAT、SOD分别提高了30.7% (P > 0.05)、24.6% (P < 0.05), MDA显著降低了23.2% (P < 0.05), 说明该添加量可以促进肝脏消除自由基并抑制脂质过氧化。血清中SOD、MAD均呈下降趋势, 但差异不显著, 表明添加植物乳杆菌对石斑鱼血清消除自由基并抑制脂质过氧化的影响不大。
总之, 添加1.0×105 CFU/g植物乳杆菌可以在一定程度上提高肠道的抗氧化能力, 以及清除自由基并抑制脂质过氧化的能力, 保护肠道免于氧化破坏, 增强肠道的代谢功能。而添加1.0×109 CFU/g植物乳杆菌则可以显著提高肝脏的抗氧化和清除自由基并抑制脂质过氧化的能力, 提高肝脏的氧化代谢水平。
3.4 植物乳杆菌对石斑鱼血清代谢和免疫应答的影响血清生化指标是反映机体健康、营养和代谢的重要指标(吴凡等, 2019)。血清白蛋白水平的变化, 反映机体损伤或感染情况; 血清总蛋白水平的变化, 反映肝肾的蛋白质代谢情况(何勤等, 2021)。本研究显示, 植物乳杆菌添加组的白蛋白和总蛋白略低于对照组, 但降低不明显, 表明石斑鱼处于正常营养状况, 蛋白质代谢正常。
血清T-CHO和TG浓度能够反映机体的脂类代谢程度(李宁宇等, 2020), 是判断鱼类应激水平的指标(逯尚尉等, 2011)。植物乳杆菌的代谢产物中含有抗胆固醇因子, 可降低血清中胆固醇含量(何志刚, 2013)。本研究中与对照组比较, 各添加组的T-CHO浓度略微降低, 而TG略有升高, 但均无显著性差异, 表明饲喂植物乳杆菌后, 石斑鱼没有产生应激反应, 血清脂质代谢正常。
ACP、AKP是鱼类重要的非特异性免疫因子, 能破坏和清除入侵体内的异物, 在免疫反应中起到极其重要的作用(Zhao et al, 2012)。本研究中添加组的血清AKP、ACP均低于对照组, 但降低不明显, 表明饲喂植物乳杆菌对石斑鱼血清的免疫应答无显著性影响, 石斑鱼不会产生应激的炎症反应。
4 结论饲料中添加植物乳杆菌能提高云龙石斑鱼的消化酶活性, 增强肠道对蛋白质和脂肪的消化分解, 有助于营养物质的吸收利用, 促进石斑鱼生长; 可以提高肠道的清除自由基并抑制脂质过氧化的抗氧化能力, 促进肠道健康, 增强肠道抗病力; 而对石斑鱼机体代谢不会产生不良影响, 不会引起鱼体产生应激反应。在本试验条件下, 云龙石斑鱼饲料中添加植物乳杆菌的适合添加量为1.0×105~1.0×107 CFU/g。
王文豪, 董宏标, 孙彩云, 等, 2020. 石菖蒲挥发油和水溶性氮酮对鱼用麻醉剂的促皮渗透效果研究. 南方水产科学, 16(4): 62-68 |
王国霞, 黄燕华, 周晔, 等, 2010. 乳酸菌对凡纳滨对虾幼虾生长性能、消化酶活性和非特异性免疫的影响. 动物营养学报, 22(1): 228-234 DOI:10.3969/j.issn.1006-267x.2010.01.035 |
王洋, 2015. 植物乳杆菌素PlnEF与乳酸对嗜水气单胞菌的协同抑制作用及机理研究[D]. 北京: 中国农业大学: 13-30.
|
孔雨昕, 徐晴, 田佳鑫, 等, 2021. 三种乳酸菌对乌鳢肠道消化酶、肠道菌群、肠道形态及紧密连接蛋白mRNA相对表达水平的影响. 吉林农业大学学报: 1-9 |
曲木, 唐子鹏, 赵子续, 等, 2021. 乳酸菌在水产养殖中的应用. 生物化工, 7(3): 131-134 DOI:10.3969/j.issn.2096-0387.2021.03.038 |
刘长军, 2018. 植物乳杆菌对尼罗罗非鱼的肠道黏膜免疫调节及生长性能的影响. 饲料工业, 39(12): 43-48 |
刘娜娜, 刘长军, 李红军, 等, 2014. 益生菌在水产动物饲料中的应用及作用机制研究进展. 饲料工业, 35(14): 53-56 |
齐欣, 魏雪生, 陈颖, 等, 2007. 益生菌对彭泽鲫生长性能及水体环境的影响. 中国饲料, (17): 27-29 DOI:10.3969/j.issn.1004-3314.2007.17.010 |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会, 2021. 中国渔业统计年鉴. , 21-29
|
李宁宇, 刘利平, 华雪铭, 等, 2020. 豆粕影响日本鳗鲡黑仔鳗饲料中发酵豆粕对鱼粉的替代效果: 生长、抗氧化能力以及生化指标. 海洋渔业, 42(3): 352-364 DOI:10.3969/j.issn.1004-2490.2020.03.011 |
李军亮, 2018. 两种益生菌对凡纳滨对虾幼虾和石斑鱼幼鱼生长和抗病力的影响[D]. 湛江: 广东海洋大学: 2-11.
|
李利, 李泽健, 2021. 饲粮中添加乳酸菌对鲤鱼生长性能、鱼体组成及肠道酶活性的影响. 中国饲料, (13): 80-83 |
李瑞, 王劲松, 高梦祥, 2021. 乳酸菌对鱼类生长影响研究进展. 水产学杂志: 1-9 |
杨红玲, 孙云章, 马如龙, 等, 2010. 斜带石斑鱼(Epinephelus coioides)肠道乳酸菌MM1和MM4抑菌特性研究. 海洋与湖沼, 41(4): 543-548 |
吴凡, 蒋明, 文华, 等, 2019. 饲料碳水化合物与脂肪比例对吉富罗非鱼成鱼生长、体成分和血清生化指标的影响. 南方水产科学, 15(4): 53-60 |
何志刚, 2013. 植物乳杆菌在水产养殖中的应用. 科学养鱼, (12): 73-74 |
何勤, 贾睿, 曹丽萍, 等, 2021. 氧化应激对鲤抗氧化状态和免疫功能的影响. 水产学报, 45(1): 33-43 |
沙玉杰, 王雷, 孙国琼, 等, 2016. 饲料中添加两株乳酸菌及其发酵上清液对凡纳滨对虾消化酶活性的影响. 海洋科学, 40(3): 59-64 |
张林宝, 陈海刚, 田斐, 等, 2020. 三唑磷对翡翠贻贝神经毒性与氧化损伤效应的性别差异研究. 南方水产科学, 16(6): 75-80 |
张洪玉, 2019. 干酪乳杆菌YYL3和植物乳杆菌YYL5的生物学特性及其对斑点叉尾鮰生长、免疫及肠道菌群的影响[D]. 上海: 上海海洋大学: 4-12.
|
林艾影, 王维政, 陈刚, 等, 2020. 2种乳酸菌对军曹鱼幼鱼生长及消化酶、免疫酶活性的影响. 广东海洋大学学报, 40(5): 112-117 DOI:10.3969/j.issn.1673-9159.2020.05.014 |
郑玉, 周永灿, 张永政, 等, 2017. 乳酸菌对凡纳滨对虾生长及非特异性免疫力和抗逆性的影响. 热带生物学报, 8(3): 241-247 |
郑晓婷, 段亚飞, 董宏标, 等, 2016. 植物乳杆菌对凡纳滨对虾生长、消化酶活性和肠道组织形态的影响. 水产科学, 35(1): 1-6 |
胡宗福, 牛化欣, 于建华, 等, 2020. 饲料中添加植物乳杆菌对细鳞鲑生长及肠道菌群多样性的影响. 动物营养学报, 32(1): 346-356 DOI:10.3969/j.issn.1006-267x.2020.01.041 |
胡爱心, 刘金松, 许英蕾, 等, 2021. 乳酸菌抑菌作用机制的研究进展. 动物营养学报, 33(12): 1-9 |
逯尚尉, 刘兆普, 余燕, 2011. 密度胁迫对点带石斑鱼幼鱼生长、代谢的影响. 中国水产科学, 18(2): 322-328 |
FAWOLE F J, ADEOYE A A, TIAMIYU L O, et al, 2020. Substituting fishmeal with Hermetia illucens in the diets of African catfish (Clarias gariepinus): effects on growth, nutrient utilization, haemato-physiological response, and oxidative stress biomarker. Aquaculture, 518: 734849 |
LEI Y, SUN Y F, WANG X D, et al, 2021. Effect of dietary phosphorus on growth performance, body composition, antioxidant activities and lipid metabolism of juvenile Chinese mitten crab (Eriocheir sinensis). Aquaculture, 531: 735856 |
LIU Y T, MIAO Y Q, XU N, et al, 2020. Effects of dietary Astragalus polysaccharides (APS) on survival, growth performance, activities of digestive enzyme, antioxidant responses and intestinal development of large yellow croaker (Larimichthys crocea) larvae. Aquaculture, 517: 734752 |
WU Z X, FENG X, XIE L L, et al, 2012. Effect of probiotic Bacillus subtilis Ch9 for grass carp, Ctenopharyngodon idella (Valenciennes, 1844), on growth performance, digestive enzyme activities and intestinal microflora. Journal of Applied Ichthyology, 28(5): 721-727 |
ZHAO L L, YANG X Z, CHENG Y X, et al, 2012. Effects of histamine on survival and immune parameters of the Chinese mitten crab, Eriocheir sinensis. Journal of Shellfish Research, 31(3): 827-834 |
 2022, Vol. 53
2022, Vol. 53


