
中国海洋湖沼学会主办。
文章信息
- 唐亚鹏, 董世瑞, 田吉腾, 周茜, 王印庚, 张天时. 2022.
- TANG Ya-Peng, DONG Shi-Rui, TIAN Ji-Teng, ZHOU Qian, WANG Yin-Geng, ZHANG Tian-Shi. 2022.
- 凡纳滨对虾(Litopenaeus vannamei)循环水养殖系统中养殖效果及菌群结构和功能研究
- STUDY ON STRUCTURE AND FUNCTION OF BACTERIA COMMUNITY AND THE COUTURE EFFECT OF RECIRCULATING AQUACULTURE SYSTEM FOR LITOPENAEUS VANNAMEI
- 海洋与湖沼, 53(2): 466-474
- Oceanologia et Limnologia Sinica, 53(2): 466-474.
- http://dx.doi.org/10.11693/hyhz20210800175
文章历史
-
收稿日期:2021-08-04
收修改稿日期:2021-09-24
2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东青岛 266237;
3. 天津市食品生物技术重点实验室 天津商业大学生物技术与食品科学学院 天津 300134
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China
凡纳滨对虾(Litopenaeus vannamei)是世界范围内最主要养殖的对虾品种。近年来, 随着养殖规模的扩大及高密度养殖模式的发展, 病害、养殖环境恶化及环境污染等问题困扰着对虾养殖业的进一步发展。循环水养殖具有节电、节水、节地等优点, 并可有效减少病原体的入侵, 是我国水产养殖业发展的重要方向(臧维玲等, 2008; Holl et al, 2011; 王峰等, 2013; 黄志涛等, 2016; 张龙等, 2019; 洪越群等, 2019)。
循环水养殖系统的核心是通过硝化细菌将氨氮或亚硝态氮转变成为毒性较小的硝态氮, 再通过反硝化细菌将硝酸盐转化为气态氮(李秀辰等, 2010; Van Rijn, 2013; 刘文畅等, 2016; Qiu et al, 2016)。因此, 形成有效的功能菌群是维持养殖水环境稳定的重要前提。近年来, 开展了许多循环水系统中功能菌群的研究(李秋芬等, 2011; 王威, 2012; Auffret et al, 2013)。但这些研究结果多关注菌群结构组成与水质调节作用的关系, 对菌落中发挥主要作用的功能基因的报道较少。
此外, 养殖环境与对虾疾病的发生有密切的关系, 通过研究养殖环境中的微生物群落结构和多样性以及它们与环境间的相互关系对控制虾病的发生有重要意义。近年来, 已有较多有关对虾养殖水体中微生物群落组成和养殖环境变化关系的报道(Johnson et al, 2008; Sakami et al, 2008)。其中Tang等(2014)比较了南美白对虾养殖池塘高水温(≥30 ℃)和低水温(≤20 ℃)条件下的细菌群落组成, 发现放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)是高水温和低水温条件下丰度最高的门, 且检测到大量未分类的细菌; 与低水温相比, 在属和种水平上, 高水温样本中的细菌群落有更高的丰富度和多样性, 同时发现了一些致病菌, 证明环境因子温度是细菌群落的主要驱动因子。张皓(2015)开展了凡纳滨对虾养殖池塘水体及底泥环境微生物群落动态变化与水环境互作的研究, 探讨了养殖环境中优势细菌、益生菌和潜在致病菌之间的互作和动态变化关系, 证明水体中的氨氮(AN)、化学需氧量(COD)、总氮(TN)对水体中细菌种群影响较大, 不同种类微生物与水质指标相关性不同。
目前, 16S rRNA高通量测序与宏基因组学测序分析技术已成为表征微生物群落结构与功能的常规方法(Tringe et al, 2005; Oh et al, 2011; Bai et al, 2014; Sunagawa et al, 2015; Mitchell et al, 2018; Taş et al, 2021)。本文采用16S rRNA高通量测序与宏基因组学分析等方法, 对凡纳滨对虾循环水养殖系统中生物滤池内细菌群落结构和功能进行分析, 结合养殖过程中养殖水体水质指标变化以及对虾生长状况, 为了解生物滤池中微生物在对虾养殖水体水质调控中发挥作用的机制提供基础资料。
1 材料与方法 1.1 材料实验所用凡纳滨对虾(Litopenaeus vannamei)虾苗购自海南正大集团铺前镇种苗场, 在海阳市黄海水产养殖有限公司进行室内循环水养殖实验, 养殖时间9~11月, 实验共进行63 d。
1.2 方法 1.2.1 循环水养殖设施和操作养殖池为半地下式温棚水泥池, 3个水泥池(2#, 3#, 17#)大小均为10 m×8 m×1.8 m, 养殖水深约1 m。海水取自于砂滤井, 采用同一循环水水质处理系统。
滤料池填料采用自然挂膜工艺培养生物膜20 d, 之后将标粗后的虾苗分苗到循环水车间。在养殖前期(30 d以前)、中期(30~50 d)、后期(50 d以后)的循环量分别为2、4、6~8循环/d。在养殖过程中对生物滤料池进行遮光处理。
1.2.2 日常管理与统计指标对虾标粗后, 初始放养密度为500尾/m2, 每天排污2~3次。养殖前期日投喂饲料3~4次, 养殖中后期日投喂2~3次。实验结束时, 统计测量各池对虾产量及数量, 计算成活率、生长率及饵料转化率。对虾生长性能测定参照张龙等(2019)方法。
1.2.3 水质指标测定方法每隔7 d使用YIS6920型多功能水质测定仪测定水温(T)、盐度(S)、溶解氧(DO)、pH值; 采用五点取样法采集水体表层以下约30 cm处水样500 mL, 经过0.22 μm滤膜抽滤后的水样, 用于氨氮、亚硝酸氮及硝酸氮质量浓度测定, 分别采用《海洋调查规范》(GB/T 12763.4—2007)中的靛酚蓝分光光度法、萘乙二胺分光光度法和锌镉还原法测定。
1.2.4 菌群样本的采集根据水质指标变化, 在养殖第0~7 d (开始运行期, 记作Star)和第45~52 d (水质指标变化平稳期, 记作Stat), 每天取滤料池水样通过0.22 μm滤膜抽滤得到细菌样本放于–80 ℃保存, 用于16S rRNA高通量测序。
1.2.5 基因组DNA的提取和检测将水样的滤膜剪碎, 按照周敏等(2018)的方法对菌群宏基因组DNA进行分离和纯化, 由上海派森诺生物科技股份有限公司做宏基因组测序。
1.2.6 16S rRNA测序分析Star样本进行16S rRNA高通量测序分析。基于OTU聚类的Vsearch (Rognes et al, 2016)方法进行序列拼接, 质量过滤, 去重, 聚类。采用QIIME2的classify-sklearn算法(Bokulich et al, 2018), 使用Naive Bayes分类器进行注释。依据注释结果统计样本在各分类水平中含有的分类单元数量。
1.2.7 宏基因组测序对Stat样本进行宏基因组测序分析。基于Illumina HiSeq 4000高通量测序平台进行双端测序。使用Megahit(vl.0.6)进行序列组装, 采用MetaGeneMark (Zhu et al, 2010)进行基因预测。KEGG数据库进行基因功能注释。通过BLASTN比对(E < 0.001), 使用MEGAN (Huson et al, 2011)软件中的“最低共同祖先”算法(Huson et al, 2007), 将目标序列进行物种注释分类, 获得样本在不同分类水平上的丰度信息。
2 结果与分析 2.1 水质指标变化在养殖实验过程中, 温度、溶解氧、盐度和pH动态变化如图 1所示, 3个养殖池常规水质变化趋势基本一致, 其中, 温度变化范围为23.0~29.4 ℃, 均值(25.92±0.06) ℃, 呈逐渐下降趋势, 随养殖时间的延长气温逐渐下降造成水温降低, 后期使用锅炉加热, 水温有所回升; 溶解氧变化范围为5.4~6.8 mg/L, 均值(6.03±0.04) mg/L, 在养殖过程中溶解氧呈现出波动变化, 可能与系统在内外循环、藻类增氧联合作用有关(杨菁等, 2010); 盐度变化范围为24.5~30.8, 均值(27.92±0.05), 养殖后期盐度逐渐上升, 可能是由于循环水养殖换水量少, 每次仅添加10%的换水量, 水分蒸发量大造成盐度升高; pH变化范围为7.5~8.2, 均值(7.92±0.03), 呈逐渐减小的趋势, 这表明在养殖过程中, 养殖生物量逐渐增大, 对虾呼吸作用加强以及有机物质分解产生的CO2是pH减小的主要原因(陈剑锋等, 2006)。综上所述, 本系统养殖环境符合凡纳滨对虾培养基本要求, 适合凡纳滨对虾的生长(林继辉等, 2004; 沈丽琼等, 2007; 杨菁等, 2010)。
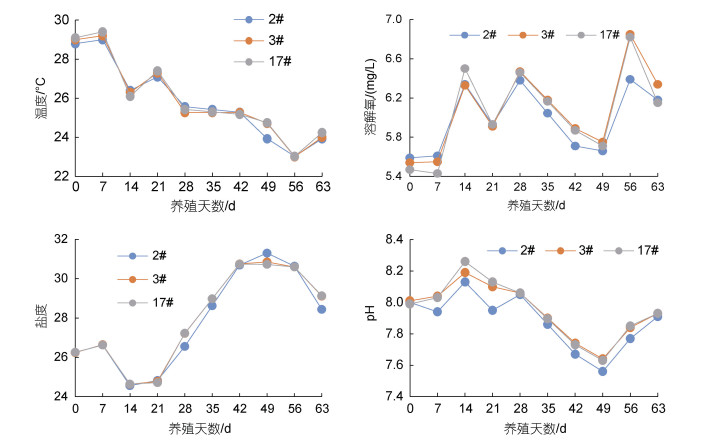 |
| 图 1 养殖池水体的温度、溶解氧、盐度、pH值动态变化 Fig. 1 Dynamic changes of water temperature, dissolved oxygen, salinity and pH in the recirculating aquaculture system |
氨氮、亚硝酸氮及硝酸氮质量浓度变化如图 2所示, 循环水养殖水体氨氮浓度呈逐渐上升趋势, 亚硝酸氮浓度呈先上升后下降的趋势, 其浓度变化范围分别在0.05~1.16和0.11~0.67 mg/L, 均值分别为(0.59±0.07)和(0.31±0.01) mg/L。氨氮及亚硝酸氮主要来源于残饵、粪便等有机物质的分解, 而且凡纳滨对虾排泄作用也可产生氨氮(宋协法等, 2009)。刘健等(2017)发现氨氮与亚硝酸氮质量浓度是凡纳滨对虾养殖中后期的主要限制因子, 在密闭式养殖过程中具有较大波动。本循环水养殖系统将氨氮及亚硝酸氮质量浓度控制在安全范围内, 有利于保持良好水质, 促进对虾生长(孙国铭等, 2002)。本研究中3个养殖池硝酸氮质量浓度均呈上升趋势, 这与索建杰等(2015)研究结果一致。硝酸氮质量浓度变化范围在0.84~ 35.40 mg/L, 均值(14.04±0.38) mg/L。臧维玲等(2008)在室内对凡纳滨对虾进行循环水养殖, 检测硝酸氮质量浓度变化范围在0.680~47.285 mg/L; 张龙等(2019)测得循环水养殖硝酸氮质量浓度最高值达到25.98 mg/L。硝酸氮对对虾毒性作用较小, 浓度高于150 mg/L将对南美白对虾的生长不利(彭自然等, 2004)。
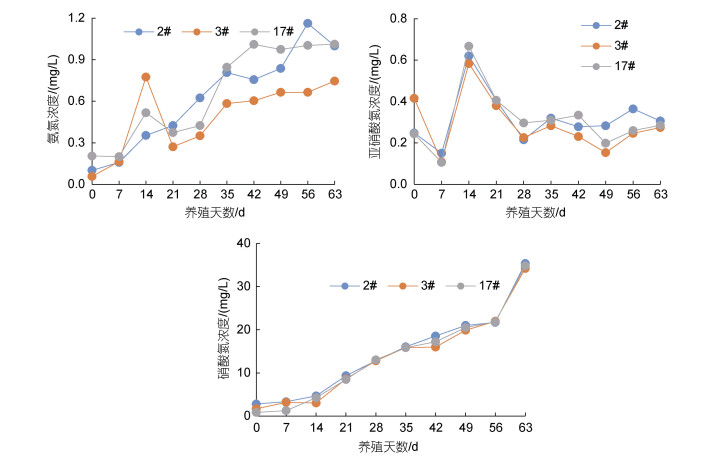 |
| 图 2 养殖池水体的氨氮、亚硝酸氮和硝酸氮质量浓度动态变化 Fig. 2 Dynamic changes in mass concentration of ammonia nitrogen, nitrite nitrogen and nitrate nitrogen in the recirculating aquaculture system |
由表 1可知, 经过63 d养殖, 对虾平均体重达到11.46~12.21 g, 产量为3.14~3.54 kg/m3, 生长率在6.9%~7.5%之间, 存活率为67.16%~72.48%, 饵料转化率为63.92%~80.13%。谢松平等(2015)在室内进行工厂化循环水养殖凡纳滨对虾125~140 d, 平均规格在80.6尾/kg, 平均单位水体产量为3.9 kg/m3, 成活率为42.8%。张龙等(2019)比较了不同养殖模式对凡纳滨对虾生长性能的影响, 发现经过85 d养殖, 循环水养殖凡纳滨对虾存活率(74.58%±1.74%)、饲料转化率(70.56%±3.82%)和产量[(3.91±0.49) kg/m3]显著高于流水养殖凡纳滨对虾存活率(66.90%±3.80%)、饲料转化率(67.14%±3.25%)、产量[(3.47±0.42) kg/m3]。综合以上数据, 本研究养殖效果较为成功, 其中17#养殖效果最好。
| 池号 | 平均体重/g | 单位产量/kg/m3 | 特定生长率/% | 存活率/% | 饵料转化率/% |
| 2# | 11.68±1.31 | 3.14 | 7.06±0.12 | 67.16 | 63.92 |
| 3# | 11.46±2.67 | 3.17 | 6.90±0.14 | 69.14 | 76.92 |
| 17# | 12.21±2.82 | 3.54 | 7.50±0.20 | 72.48 | 80.13 |
根据16S rRNA测序结果, 将Stat和Star样本在属水平物种丰度信息进行统计, 选取相对丰度排名前10的菌属(图 3), 结果显示, 在循环水系统开始运行期和平稳期生物滤池菌群结构差异较大, 在Star期, 滤料池中优势菌属为海杆菌属(Marinobacter)、别样海源菌属(Aliidiomarina)、Planktosalinus、黄杆菌属(Luteolibacter)、盐单胞菌属(Halomonas)、无色杆菌属(Leucobacter)、远洋杆菌属(Pelagibacterium)、SM1A02、ML310M-34和Saccharimonadales, 相对丰度分别为31.37%、9.33%、8.21%、7.25%、6.10%、2.46%、2.35%、1.88%、1.75%、1.60%; 而在Stat期, 滤料池中优势菌属为Parvibaculum (8.57%)、分枝杆菌属Mycobacterium (6.65%)、分枝菌酸杆菌属Mycolicibacterium (6.39%)、食烷菌属Alcanivorax (5.21%)、海杆菌属Marinobacter (3.36%)、中慢生根瘤菌属Mesorhizobium (2.30%)、固氮螺菌属Azospirillum (1.42%)、红杆菌属Rhodobacter (1.34%)、副球菌属Paracoccus (1.29%)和硝化杆菌属Nitrobacter (1.17%)。
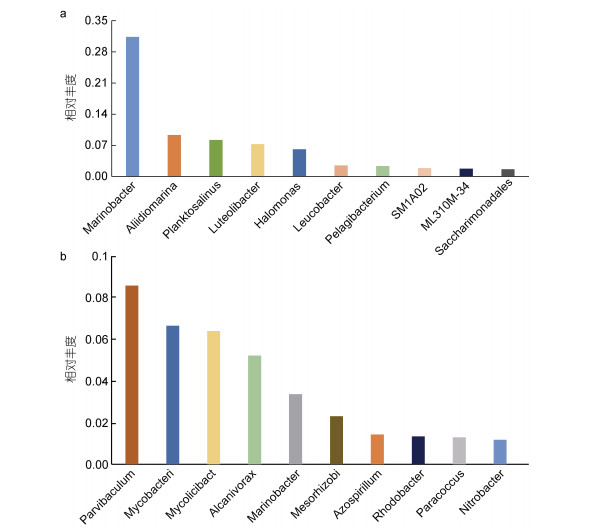 |
| 图 3 水样菌群属水平物种分布柱状图 Fig. 3 The genus abundance in water samples 注: a. Star; b. Stat |
不同时期生物滤池菌群结构出现演替性变化, 从而保证了循环水系统运行过程中水质的稳定。张斌等(2008)在研究膜-生物反应器水质处理系统微生物群落演替过程中发现, 水质的改变会导致微生物群落结构多样性降低, 在反应器不同运行时期, 会出现原种的消亡, 次级种群的强化和演变等过程。张海耿(2011)也发现在生物挂膜初期, 最先适应此环境的细菌迅速繁殖起来, 当系统运行后, 随着生物滤池中的营养盐成分逐渐趋于稳定, 一部分细菌在竞争中被淘汰, 而另一些细菌则慢慢成为优势种群, 还有一些广泛存在的优势菌属, 在系统内物质和能量的代谢中发挥着重要的作用。本研究中, 滤料池在Star期与Stat期菌群结构组成差异较大, 这可能是由于系统运行前期水质变化较大引起的。海杆菌为两个时期共有的优势菌属, 海杆菌是一种广泛存在的反硝化细菌, 能够利用硝酸盐和亚硝酸盐作为氮源, 在反硝化作用下将其还原成氮气, 从而达到脱氮的效果(巫亮等, 2014; Liu et al, 2016; 刘万鑫等, 2017)。在生物滤池开始运行时期, 海杆菌占有绝对的优势, 亚硝酸氮迅速下降而硝酸氮保持不变, 说明该阶段主要由海杆菌反硝化作用占据优势(孟盈盈, 2019)。
氨氮与硝酸氮质量浓度逐渐上升, 亚硝酸氮维持在0.4 mg/L以下, 在水质变化平稳期, 生物滤池中优势菌主要包括分枝杆菌、分枝菌酸杆菌、食烷菌、海杆菌、中慢生根瘤菌、红杆菌和副球菌等反硝化细菌和硝化杆菌(Depkat-Jakob et al, 2010; 张芳, 2015; 杨浩等, 2018; 赵磊, 2019)。硝化作用是由氨氧化菌和亚硝酸盐氧化菌共同作用完成的, 前者将NH4+-N氧化为亚硝态氮(NO2--N), 后者将NO2--N进一步氧化为NO3--N, 硝化杆菌是典型的亚硝酸盐氧化菌, 可将大量的亚硝酸盐氧化为硝酸盐(孙洪伟等, 2018)。在本实验中, 亚硝酸盐浓度较低而氨氮、硝酸盐不断积累, 可能是由于硝化杆菌的作用, 但缺少将氨氮氧化为亚硝态氮的氨氧化菌, 因此造成养殖环境氨氮的积累(Gómez-Jiménez et al, 2005)。反硝化作用主要是由厌氧反硝化细菌进行的还原反应, 可以将硝酸氮(NO3-N)或亚硝酸氮(NO2-N)还原为NH3、NO和N2 (吴伟等, 2013; 孙朦朦, 2014)。硝化-反硝化反应可以通过两种途径实现, 一种是硝酸盐途径: NO2-→NO3-→N2, 另一种是亚硝酸途径NO2-→N2(张丹等, 2003)。在本实验中, 硝酸盐没有减少的趋势而且亚硝酸盐没有堆积, 说明在养殖过程中主要以第二种途径进行反硝化作用。
2.4 菌群基因功能分析通过对比KEGG数据库发现代谢通路中碳水化合物代谢(carbohydrate metabolism)和氨基酸代谢(amino acid metabolism)含有的蛋白数目最多(图 4), 分别为46 643个和40 092个, 这与吕小梅(2014)研究反硝化除磷污泥中菌群功能基因分布情况相似。
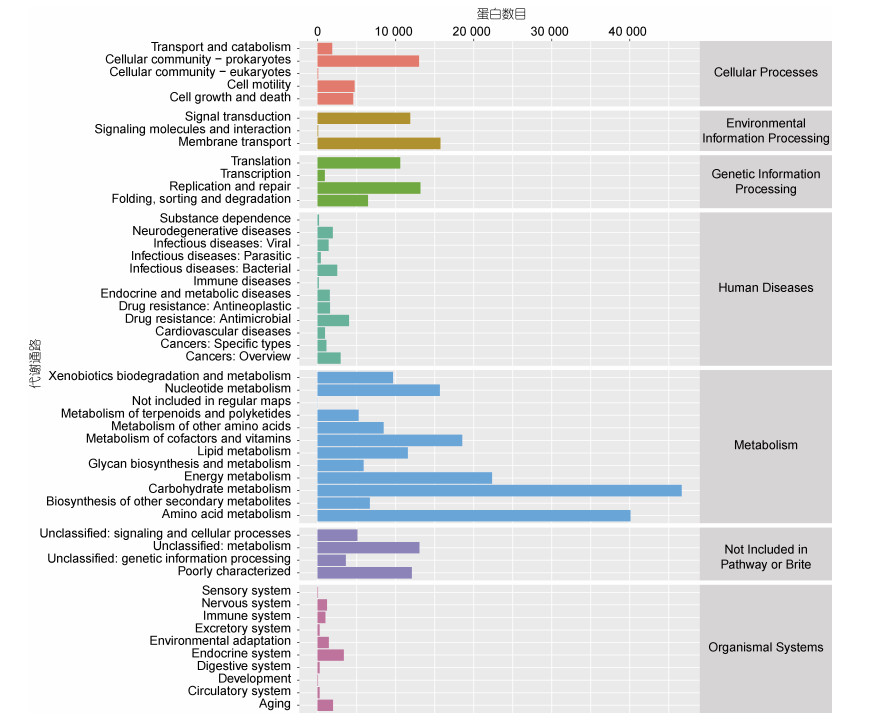 |
| 图 4 KEGG代谢通路注释结果 Fig. 4 Results of KEGG metabolic pathway annotation |
异养反硝化菌可以利用碳源作为电子供体, 将硝态氮或亚硝态氮还原为气态氮, 而且利用有机碳可为反硝化菌提供物质和能量, 以供其生存和繁衍(刘刚等, 2010; 吉芳英等, 2013; 孙朦朦, 2014), 因此碳源对于细菌及反硝化过程起着重要作用。有研究表明, 在乳酸菌中碳代谢作为关键代谢显著影响亚硝酸盐的降解(潘晴, 2018)。此外, 氨基酸也可作为碳源被反硝化细菌所利用, 陈元磊(2015)发现在两种反硝化细菌基因组中, 碳水化合物传递和代谢、氨基酸传递与代谢相关基因最多, 分别占预测基因的8.56%~11.21%、8.44%~10.22%。杨航等(2008)提出丝氨酸、丙氨酸、组氨酸以及亮氨酸均可作为反硝化作用的底物, 钱小青(2001)则发现反硝化脱氮菌能直接利用甘氨酸或丙氨酸作为唯一碳源进行脱氮。在本研究中, 丙酮酸代谢(pyruvate metabolism, 12.75%)、乙醛酸和二羧酸代谢(glyoxylate and dicarboxylate metabolism, 11.88%)在碳水化合物代谢中占有最高丰度; 甘氨酸、丝氨酸和苏氨酸代谢(glycine, serine and threonine metabolism, 12.31%), 缬氨酸、亮氨酸和异亮氨酸降解(valine, leucine and isoleucine degradation, 10.34%)在氨基酸代谢中占有最高丰度, 这说明在本系统中, 有多种氨基酸及二碳、三碳酸作为碳源共同参与反硝化过程。
3 结论本凡纳滨对虾循环水养殖系统在养殖初期氨氮与硝酸氮质量浓度逐渐上升, 水质变化逐渐趋于平稳, 但是本循环水养殖系统始终将氨氮及亚硝酸氮等水质指标浓度控制在安全范围内, 有利于保持良好水质, 促进对虾生长。通过菌群组成丰度分析, 在开始运行期与水质变化平稳期生物滤池中菌群结构差异较大。在开始运行期海杆菌属占绝对优势, 而在平稳期则以分枝杆菌属、分枝菌酸杆菌属、食烷菌属、海杆菌属、中慢生根瘤菌属、红杆菌属、副球菌属等反硝化细菌和硝化杆菌属占据优势。在水质稳定期的菌群基因功能分析中, 通过对比KEGG数据库发现代谢通路中碳水化合物代谢和氨基酸代谢含有的蛋白数目最多, 也进一步说明水体中反硝化菌可以利用多种碳源进行反硝化作用来调节水质, 降低水体中亚硝酸氮浓度, 使氨氮及硝酸氮平稳变化。
综上所述, 本研究通过16S rRNA测序及宏基因组测序技术, 对生物滤池中菌群结构及功能进行了分析, 结合养殖池水质指标变化, 发现对虾循环水养殖系统菌群和水质变化具有明显的时序特征, 在水质变化稳定期亚硝酸盐得到有效控制, 反硝化细菌为优势菌, 可利用多种碳源进行反硝化作用。本次研究结果将为循环水养殖系统中菌群结构与环境因子互作提供参考, 为菌群结构和功能定向调节提供依据。
王威, 2012. 海水循环水养殖系统中生物滤料的微生物挂膜与水处理效果研究[D]. 青岛: 中国海洋大学: 52-54.
|
王峰, 雷霁霖, 高淳仁, 等, 2013. 国内外工厂化循环水养殖研究进展. 中国水产科学, 20(5): 1100-1111 |
吉芳英, 陈思, 刘娜, 2013. 污水处理中微生物反硝化脱氮过程及代谢规律. 四川理工学院学报(自然科学版), 26(4): 10-14 DOI:10.3969/j.issn.1673-1549.2013.04.003 |
吕小梅, 2014. 反硝化除磷菌群结构与工艺调控策略[D]. 哈尔滨: 哈尔滨工业大学: 86-91.
|
刘万鑫, 杜荣斌, 由翠荣, 等, 2017. 几株异养硝化细菌与好氧反硝化细菌的分离与鉴定. 烟台大学学报(自然科学与工程版), 30(3): 249-254 |
刘文畅, 罗国芝, 谭洪新, 等, 2016. 生物絮凝反应器对中试循环水养殖系统中污水的处理效果. 农业工程学报, 32(8): 184-191 |
刘刚, 闻岳, 周琪, 2010. 人工湿地反硝化碳源补充研究进展. 水处理技术, 36(4): 1-5 |
刘健, 侯冬伟, 曾燊正, 等, 2017. 凡纳滨对虾封闭式养殖池塘水体氨氮、亚硝氮、硝氮变化规律及消减措施. 中山大学学报(自然科学版), 56(6): 116-122 |
孙国铭, 汤建华, 仲霞铭, 2002. 氨氮和亚硝酸氮对南美白对虾的毒性研究. 水产养殖, (1): 22-24 DOI:10.3969/j.issn.1004-2091.2002.01.010 |
孙洪伟, 于雪, 李维维, 等, 2018. 游离氨抑制Nitrobacter活性动力学试验. 化工学报, 69(10): 4386-4393 |
孙朦朦, 2014. 两株海水异养硝化-好氧反硝化菌的分离、鉴定、培养、硝化性能及脱氮性能研究[D]. 天津: 天津农学院: 11-13.
|
巫亮, 李荣鹏, 訾小利, 等, 2014. 厌氧及好氧条件下盐度对海杆菌NY-9生长及反硝化能力的影响. 湖北农业科学, 53(23): 5705-5708 |
李秀辰, 李俐俐, 张国琛, 等, 2010. 养殖固体废弃物作碳源的海水养殖废水反硝化净化效果. 农业工程学报, 26(4): 275-279 DOI:10.3969/j.issn.1002-6819.2010.04.047 |
李秋芬, 傅雪军, 张艳, 等, 2011. 循环水养殖系统生物滤池细菌群落的PCR-DGGE分析. 水产学报, 35(4): 579-586 |
杨航, 黄钧, 刘博, 2008. 异养硝化-好氧反硝化菌Paracoccus pantotrophus ATCC 35512的研究进展. 应用与环境生物学报, 14(4): 585-592 DOI:10.3321/j.issn:1006-687X.2008.04.030 |
杨浩, 杨晓妮, 张国珍, 等, 2018. 窖水中微生物降解污染物的关键细菌. 环境科学, 39(10): 4766-4777 |
杨菁, 倪琦, 张宇雷, 等, 2010. 对虾工程化循环水养殖系统构建技术. 农业工程学报, 26(8): 136-140 |
吴伟, 刘道玉, 瞿建宏, 等, 2013. 脱氮副球菌硝酸盐/亚硝酸盐还原酶的活性变化及对养殖水体中无机氮素的转化. 农业环境科学学报, 32(6): 1244-1252 |
沈丽琼, 陈政强, 陈昌生, 等, 2007. 盐度对凡纳滨对虾生长与免疫功能的影响. 集美大学学报(自然科学版), 12(2): 108-113 |
宋协法, 刘鹏, 葛长字, 2009. 温度、盐度交互作用对凡纳滨对虾耗氧和氨氮、磷排泄的影响. 渔业现代化, 36(2): 1-6 |
张丹, 徐慧, 刘耀平, 等, 2003. OLAND生物脱氮系统运行及其硝化菌群的分子生物学检测. 应用与环境生物学报, 9(5): 530-533 |
张龙, 陈钊, 汪鲁, 等, 2019. 凡纳滨对虾循环水养殖系统应用研究. 渔业现代化, 46(2): 7-14 |
张芳, 2015. 不同运行模式下同步硝化反硝化过程的脱氮和N2O释放特征研究[D]. 广州: 华南理工大学: 34-43.
|
张海耿, 2011. 生物滤池及人工湿地净化工厂化海水养殖废水效果研究[D]. 上海: 上海海洋大学: 31.
|
张皓, 2015. 养殖环境微生物群落的动态变化及与水环境的互作[D]. 苏州: 苏州大学: 20-48.
|
张斌, 孙宝盛, 季民, 等, 2008. MBR中微生物群落结构的演变与分析. 环境科学学报, 28(11): 2192-2199 |
陈元磊, 2015. 反硝化菌HS-N10 nos基因簇研究及HS-N03/111扫描基因组分析[D]. 武汉: 华中师范大学: 34-37.
|
陈剑锋, 赖廷和, 童万平, 2006. 南美白对虾工厂化养殖水体pH值的变化特征. 水产科学, 25(9): 456-458 |
林继辉, 李松青, 林小涛, 等, 2004. 凡纳滨对虾摄食与生长的实验研究. 海洋科学, 28(8): 43-46 |
周敏, 王海英, 冷凯良, 等, 2018. 基于宏基因组学的海带降解菌群微生物多样性及其褐藻多糖降解酶系分析. 海洋湖沼通报, (6): 109-117 |
孟盈盈, 2019. 北极低温反硝化细菌的多样性与脱氮能力分析[D]. 青岛: 青岛科技大学: 40-46.
|
赵磊, 2019. 用于沙河水库水质净化的生态浮岛构建与实验研究[D]. 北京: 北京林业大学: 36-38.
|
洪越群, 洪宇聪, 洪宇建, 等, 2019. 工厂化循环水养殖南美白对虾技术. 科学养鱼, (10): 28-29 |
索建杰, 王玉玮, 姜玉声, 等, 2015. 三种凡纳滨对虾养殖模式的水质特征及养殖效果. 水产学杂志, 28(5): 12-17 |
钱小青, 2001. 采用倒置A2/O工艺处理城市污水氮磷脱除功能的试验研究[D]. 青岛: 青岛建筑工程学院: 51-58.
|
黄志涛, 宋协法, 李勋, 等, 2016. 基于高通量测序的石斑鱼循环水养殖生物滤池微生物群落分析. 农业工程学报, 32(S1): 242-247 |
彭自然, 臧维玲, 高杨, 等, 2004. 氨和亚硝酸盐对凡纳滨对虾幼虾的毒性影响. 上海水产大学学报, 13(03): 274-278 |
谢松平, 陈梅芳, 卢宗虎, 2015. 室内工厂化循环水凡纳滨对虾养殖技术初探. 水产养殖, 36(3): 37-39 |
臧维玲, 戴习林, 徐嘉波, 等, 2008. 室内凡纳滨对虾工厂化养殖循环水调控技术与模式. 水产学报, 32(5): 749-757 |
潘晴, 2018. 发酵乳杆菌RC4降解亚硝酸盐的机理研究及应用[D]. 宁波: 宁波大学: 35-37.
|
AUFFRET M, YERGEAU É, PILOTE A, et al, 2013. Impact of water quality on the bacterial populations and off-flavours in recirculating aquaculture systems. FEMS Microbiology Ecology, 84(2): 235-247 |
BAI Y H, LIANG J S, LIU R P, et al, 2014. Metagenomic analysis reveals microbial diversity and function in the rhizosphere soil of a constructed wetland. Environmental Technology, 35(20): 2521-2527 |
BOKULICH N A, KAEHLER B D, RAM R J, et al, 2018. Optimizing taxonomic classification of marker-gene amplicon sequences with QIIME 2's q2-feature-classifier plugin. Microbiome, 6(1): 1-17 |
DEPKAT-JAKOB P S, HILGARTH M, HORN M A, et al, 2010. Effect of earthworm feeding guilds on ingested dissimilatory nitrate reducers and denitrifiers in the alimentary canal of the earthworm. Applied and Environmental Microbiology, 76(18): 6205-6214 |
GÓMEZ-JIMÉNEZ S, GONZÁLEZ-FÉLIX M L, PEREZ-VELAZQUEZ M, et al, 2005. Effect of dietary protein level on growth, survival and ammonia efflux rate of Litopenaeus vannamei (Boone) raised in a zero water exchange culture system. Aquaculture Research, 36(9): 834-840 |
HOLL C M, GLAZER C T, MOSS S M, 2011. Nitrogen stable isotopes in recirculating aquaculture for super-intensive shrimp production: Tracing the effects of water filtration on microbial nitrogen cycling. Aquaculture, 311(1/4): 146-154 |
HUSON D H, AUCH A F, QI J, et al, 2007. MEGAN analysis of metagenomic data. Genome Research, 17(3): 377-386 |
HUSON D H, MITRA S, RUSCHEWEYH H J, et al, 2011. Integrative analysis of environmental sequences using MEGAN4. Genome Research, 21(9): 1552-1560 |
JOHNSON C N, BARNES S, OGLE J, et al, 2008. Microbial community analysis of water, foregut, and hindgut during growth of Pacific white shrimp, Litopenaeus vannamei, in closed-system aquaculture. Journal of the World Aquaculture Society, 39(2): 251-258 |
LIU Y, AI G M, MIAO L L, et al, 2016. Marinobacter strain NNA5, a newly isolated and highly efficient aerobic denitrifier with zero N2O emission. Bioresource Technology, 206: 9-15 |
MITCHELL A L, SCHEREMETJEW M, DENISE H, et al, 2018. EBI Metagenomics in 2017: enriching the analysis of microbial communities, from sequence reads to assemblies. Nucleic Acids Research, 46(D1): D726-D735 |
OH S, CARO-QUINTERO A, TSEMENTZI D, et al, 2011. Metagenomic insights into the evolution, function, and complexity of the planktonic microbial community of Lake Lanier, a temperate freshwater ecosystem. Applied and Environmental Microbiology, 77(17): 6000-6011 |
QIU T L, LIU L L, GAO M, et al, 2016. Effects of solid-phase denitrification on the nitrate removal and bacterial community structure in recirculating aquaculture system. Biodegradation, 27(2/3): 165-178 |
ROGNES T, FLOURI T, NICHOLS B, et al, 2016. VSEARCH: a versatile open source tool for metagenomics. PeerJ, 4(10): 1-22 |
SAKAMI T, FUJIOKA Y, SHIMODA T, 2008. Comparison of microbial community structures in intensive and extensive shrimp culture ponds and a mangrove area in Thailand. Fisheries Science, 74(4): 889-898 |
SUNAGAWA S, COELHO L P, CHAFFRON S, et al, 2015. Structure and function of the global ocean microbiome. Science, 348(6237): 1261359 |
TANG Y Y, TAO P Y, TAN J G, et al, 2014. Identification of bacterial community composition in freshwater aquaculture system farming of Litopenaeus vannamei reveals distinct temperature-driven patterns. International Journal of Molecular Sciences, 15(8): 13663-13680 |
TAŞ N, DE JONG A E, LI Y M, et al, 2021. Metagenomic tools in microbial ecology research. Current Opinion in Biotechnology, 67: 184-191 |
TRINGE S G, VON MERING C, KOBAYASHI A, et al, 2005. Comparative metagenomics of microbial communities. Science, 308(5721): 554-557 |
VAN RIJN J, 2013. Waste treatment in recirculating aquaculture systems. Aquacultural Engineering, 53: 49-56 |
ZHU W H, LOMSADZE A, BORODOVSKY M, 2010. Ab initio gene identification in metagenomic sequences. Nucleic Acids Research, 38(12): e132 |
 2022, Vol. 53
2022, Vol. 53


