中国海洋湖沼学会主办。
文章信息
- 张远帆, 唐君玮, 仉佳文, 葛红星, 吴富村, 张国范. 2022.
- ZHANG Yuan-Fan, TANG Jun-Wei, ZHANG Jia-Wen, GE Hong-Xing, WU Fu-Cun, ZHANG Guo-Fan. 2022.
- 标记方法对皱纹盘鲍(Haliotis discus hannai) 生理、生长及存活性状的影响
- COMPARISON IN PHYSIOLOGICAL, GROWTH, AND SURVIVAL PERFORMANCE OF PACIFIC ABALONE HALIOTIS DISCUS HANNAI BY DIFFERENT TAGGING METHODS
- 海洋与湖沼, 53(3): 735-742
- Oceanologia et Limnologia Sinica, 53(3): 735-742.
- http://dx.doi.org/10.11693/hyhz20211100275
文章历史
-
收稿日期:2021-11-09
收修改稿日期:2022-01-20
2. 中国科学院海洋研究所实验海洋生物学重点实验室 山东青岛 266071;
3. 长岛海洋经济促进中心 山东烟台 265800
2. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. Changdao Marine Economic Promotion Center, Yantai 265800, China
皱纹盘鲍(Haliotis discus hannai Ino)自然分布于我国黄渤海沿岸的辽东半岛、山东半岛, 以及日本和朝鲜部分海域(吕端华, 1978)。作为高蛋白、低脂肪的优质海产品, 自古以来皱纹盘鲍被称为“海产八珍”之一, 经济价值高(蔡明夷等, 2004)。但由于捕捞强度过大等原因, 皱纹盘鲍野生资源遭到严重破坏(张昭, 1979), 迫切需要人工增养殖以恢复和增加其渔业资源量。自20世纪70年代起, 皱纹盘鲍人工育苗技术的成功特别是杂交技术的产业化应用(Nie et al, 2004; Zhang et al, 2004), 加上浅海筏式养殖技术和模式的提升, 使得皱纹盘鲍人工养殖产量迅速增长。2019年我国皱纹盘鲍的养殖占到全球鲍养殖量的85% (林位琅等, 2019), 至2020年我国鲍总产量为203 485 t (中国渔业年鉴, 2021), 其中福建省产量占全国的76%, 成为鲍人工养殖的产业中心。然而, 由于养殖环境的变化, 现有皱纹盘鲍种质不足以支撑产业快速发展, 高水温、赤潮、寒潮等引起的养殖群体高死亡率的问题也制约了皱纹盘鲍产业健康可持续发展(柯才焕, 2013)。因此, 亟需利用人工选育、杂交育种等遗传改良方法培养皱纹盘鲍新品种, 以增加其养殖群体抗逆能力。皱纹盘鲍的人工苗种底播及增殖工作近年来虽有所进展, 但总体上仍面临诸如底播初期及越冬期高死亡率等产业问题(吴富村等, 2020)。
标记技术(labelling/tagging technology)是根据物体所具有或者被具有的特性来分辨不同物体的技术(龙华等, 2006)。贝类标记是指通过物理、化学或生物手段进行个体间、群体间和种群间的区分, 进而开展贝类生长、行为、种群动态及遗传育种等领域的研究。该技术可作为贝类增殖放流效果评价的重要手段(周珊珊等, 2017)。已有研究表明, 鲍个体标记方法主要为物理标记法、化学标记法, 以及采用分子生物学方法对混养或放流群体进行个体身份的重新鉴定。化学标记方法主要是采用浸泡与钙有亲和性的荧光物质如盐酸四环素等进行染色标记(许莉佳, 2012), 但由于药物在渔业生产中的限制, 该类方法应用范围较小; 分子生物学方法近年来随着基因组测序技术的快速进步而逐渐得到发展(亓海刚, 2019), 但对于放流工作因样本采集特别是无损DNA抽提技术限制、测试费用高等困难也较难应用, 对于人工选育工作方面的应用也仅是处于起步阶段。物理标记法多为黏贴标签法, Shepherd等(1983)曾用胶水黏贴具有特定数字编码标记的标签对黑唇鲍(H. rubra)进行研究, 结果表明该方法标签丢失率较高; Prince(1991)将编码的塑料圆盘悬挂在黑唇鲍壳呼吸孔上, 1年后标记保持率为65%~96%, 作者认为该方法对鲍生长刺激较小; Seok等(2002)研究了4种方法(钻孔标记、铜丝标记、螺栓螺母标记及壳面螺母标记)对皱纹盘鲍(H. discus hannai)标记效果, 结果表明螺栓螺母标记法标记率高达96.6%。Koike等(1998)报道了采用金属挂片的标记方法, 即将刻有数字编码的金属薄片挂在鲍壳边缘, 随着鲍个体生长而将金属薄片镶嵌在壳中的方法, 但该标记方法对标记鲍个体的影响等研究未见诸报道。此外, 电子射频的物理标记法也已在鲍科动物中使用, 如将有数字表示的微芯片植入黑唇鲍(H. rubra)体内, 获得了长达10年的有效标记(Prentice et al, 1990); Hale等(2012)研究了勘察加鲍(H. kamtschatkana) PIT (passive integrated tags)标记技术, 结果表明与体内注射标记相比, 在壳背侧外部和内侧黏贴芯片的标志效果较好, 在不影响鲍生长存活下获得了较高的标记保持率。然而PIT技术由于其芯片材质要求高、操作繁琐以及造价昂贵等因素, 在鲍科动物养殖及底播中未见广泛使用。综上所述, 鲍外部标记的物理方法研究主要集中在壳面钻孔、呼吸孔悬挂和黏贴标记等方面, 虽得到广泛报道, 但缺乏对标记效果的评价, 已有的报道也仅限于对标记保持率和对标记鲍个体的生长、存活等研究方面, 缺少结合对鲍个体生理指标影响及底播后行为如敌害生物选择差异等更为系统的研究。
本研究采用金属挂片和塑料黏贴标签两种标记方法, 比较了标记后皱纹盘鲍生理、生长、存活、标记脱落率及敌害选择方面的差异, 旨在通过评估两者间的差异显著性进而为更深入、准确研究标记后个体的系谱记录以及标志物放流后种群评价提供参考。
1 材料与方法 1.1 皱纹盘鲍苗种的标记方法本研究所用金属挂片(clip)标记在Koike等(1998)方法上略有改动。金属挂片宽×长(3 mm×10 mm), 外有数字激光编码、内有倒钩, 卡在鲍外壳边缘, 随鲍壳生长形成永久标记(如图 1a所示); 塑料标签(plastic)标记是采用超强力胶水将聚乙烯标记黏贴在鲍外壳, 以颜色和编号来标记鲍(如图 1b所示)。
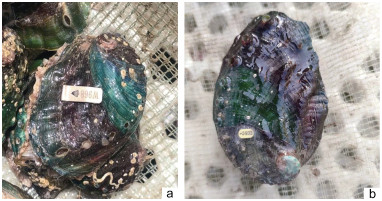 |
| 图 1 皱纹盘鲍金属挂片和塑料标签标记方法 Fig. 1 Tagging on individual Pacific abalone 注: a. 金属挂片标记; b. 塑料黏贴标记 |
为评估上述不同标记方法(clip和plastic)以及空白处理(control)在标记过程中对皱纹盘鲍个体造成的生理胁迫水平差异, 通过感官评定的方法, 记录皱纹盘鲍干露状态下黏液出现的时间, 以判别不同标记方法对皱纹盘鲍的短期胁迫程度。具体为挑选规格大小一致[平均壳长(41.45±3.09) cm]的皱纹盘鲍苗种处理组、对照组各15头, 处理组设置3个重复, 总样本数为120。在室温(20 ℃)、不通风条件下分别进行标记处理, 每组每5头样本从海水中(20 ℃)取出、标记处理(含空白对照组); 然后进行下一轮次每5头样本的处理, 以便尽量消除样本处理间隔时间对结果的影响。最后将处理后的样本放在空白托盘, 观察并记录每个鲍个体呼吸孔出现黏液的时间。
测定标记后皱纹盘鲍心率和耗氧率的指标变化以进一步检测标记对皱纹盘鲍的生理影响。根据标记后黏液时间的结果, 本部分仅研究金属挂片标记(clip)对皱纹盘鲍的生理影响, 未标记组作为对照。皱纹盘鲍样本规格、来源等同黏液记录实验。标记后皱纹盘鲍心率测定按林思恒等(2016)方法, 即采用红外传感器黏附在鲍心脏的壳表面, 微弱的心脏信号经传感器放大显示在配套仪器上(Powerlab 8/30, AD Instruments, Germany), 内置软件(LabChart Version 8.0)计算每分钟心率(BPM)。实验分别测定了实验开始后0.5、1、4、12、24及96 h后clip组和未标记control组皱纹盘鲍心率。呼吸率测定按Zhao等(2021)方法, 通过十通道光纤氧计(OXY-10 ST原型, PreSens Precision Sensing GmbH, Germany)测量一段时间内密闭容器的溶解氧水平, 密闭容器底部有磁力搅拌棒, 保证瓶中氧气均匀分布。实验在13~33 ℃不同温度组下度量金属挂片标记组和未标记组皱纹盘鲍呼吸率, 每组设置6个重复。实验除温度外其他环境因子保持一致。实验时间为2021年6月21日~7月21日。
1.3 生长存活及脱落率的测定方法实验前测量不同规格皱纹盘鲍苗种(大规格组: LS; 小规格组: SM)的起始壳长(SL0, mm), 并分别采用上述两种方法进行标记, 随机抽取各规格组皱纹盘鲍, 按Wu等(2013)叠层笼的鲍养殖方法在5个实验池同质化混养2个月, 具体为实验池规格为10 m× 1 m×0.6 m, 每池随机将标记后的LS组600个、SM组800个按200个/笼的密度装入叠层笼养殖测定, 因此共计测定鲍苗种数量为14 000个; 日常管理上每池保证强充气至水体溶氧在6 mg/L以上, 每日全量换水1次, 投喂海带且海带量控制在次日换水略有剩余为宜。各实验组皱纹盘鲍苗种数量及起始壳长见表 1。实验结束后, 各实验组随机抽取3个养殖叠层笼、每笼50只皱纹盘鲍测量最终壳长(SLt, mm)、壳长的日增长(DGR, μm/d)以研究生长的差异, 计算公式如下:
 (1)
(1)| 实验组 | 起始壳长/mm | 标记方法 | 重复组数 | 每重复组数量 |
| LS | 46.44±3.95 | 金属挂片标记 | 5 | 600 |
| 塑料标签标记 | 5 | 600 | ||
| SM | 20.84±3.72 | 金属挂片标记 | 5 | 800 |
| 塑料标签标记 | 5 | 800 | ||
| 注: 壳长数据表示为平均值±标准差(mean±SD) | ||||
式中, T=实验周期60 d。
实验期间, 每周收集死亡个体并记录死亡个体的标记等信息; 实验结束时统计累计存活率(S, %), 计算公式如下:
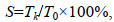 (2)
(2)式中, Tk为统计日的存活数量, T0为起始数量。实验结束后, 统计标记实际脱落数以计算皱纹盘鲍标记脱落率, 实际脱落数为两种标记处理下存活个体脱落数和个体死亡时发生标记脱落数的和。为比较不同标记处理下鲍标记脱落率间是否存在显著差异, 本研究中由于两种标记方法处理下试验个体起始数目相同, 假定两种标记处理下各规格鲍脱落数无显著差异, 则两种处理组的鲍在各重复组内实际脱落数的期望比值应为1︰1。
1.4 敌害生物捕食不同标记皱纹盘鲍的差异研究将按照上述2种标记的皱纹盘鲍(N=240)置入养殖池中暂养2周后(无死亡个体出现), 分别转移到3个相同的1 m×1 m×0.56 m养殖池中(重复组为3), 每池放养clip标记个体40只, plastic标记个体40只, 以及敌害生物多棘海盘车(Asterias amurensis) 3只, 记录第2、4、6、8 d各养殖池皱纹盘鲍死亡数量。因实验条件有限, 仅对大规格组(LS)皱纹盘鲍开展不同方法标记后的敌害测试实验。
1.5 数据处理通过R语言对相关数据进行boxplot作图, 去除个别异常值数据, 然后进行如下数据分析。
对各标记处理(包括空白对照)后皱纹盘鲍产生黏液的时间数据, 以及呼吸率、心率数据, 首先分别采用Shapiro-Wilk方法进行正态性检验和Bartlett方法进行方差齐性检验, 然后分别进行标记处理、重复组因子间, 或者标记、时间、重复组处理因子间, 标记、温度、重复组处理因子间方差分析, 若重复组间无显著差异, 则在合并该因子各水平后重新进行方差分析。数据分析中若数据不符合正态性分布, 则需采用非参统计方法, 选用Kruskal-Wallis估计各处理间差异的显著性。显著性水平设置为P < 0.05。对于两种标记处理下鲍标记实际脱落数的差异, 采用卡方检验差异显著性, 显著性水平设置为P < 0.05。
对于标记后60 d不同规格皱纹盘鲍标记后壳长生长(DGR)和累计死亡率(S)数据, 同样首先采用上述方法进行正态性检验和方差齐性检验, 然后进行苗种来源、标记方法及重复作为变异来源的方差分析, 方差分析显著性水平设置为P < 0.05。
对于不同方法标记后皱纹盘鲍被捕食生存/死亡数据, 采用非参数估计的Kaplan-Merier方法建立不同标记处理和重复组间生存曲线, 采用cox风险比例回归统计不同处理和重复因子间生存曲线的显著性差异, 若重复组间无显著性差异, 则将重复组数据合并后重新开展检验, 显著性水平设置为P < 0.05。
上述数据统计分析均采用R语言multcomp、survival包进行, 相关作图用R语言ggplot2完成。
2 结果 2.1 不同标记方法对皱纹盘鲍生理状态的影响研究通过统计不同标记方法处理后皱纹盘鲍干露状态下黏液出现时间, 结果如图 2所示, 金属挂片法(clip)处理后皱纹盘鲍黏液出现的时间显著早于塑料标签法(plastic)和未标记实验组(control) (P < 0.01); 塑料标签法处理(plastic)后皱纹盘鲍黏液出现的时间与未标记组(control)间无显著差异(P > 0.05)。
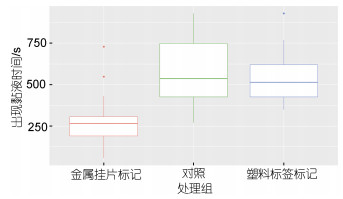 |
| 图 2 不同标记方法处理后皱纹盘鲍干露状态下黏液出现时间比较 Fig. 2 The appearance time of Pacific abalone mucus after tagging in different methods |
标记皱纹盘鲍心率数据如图 3所示, 金属挂片标记组(clip)和未标记组(control)皱纹盘鲍在96 h内无显著变化, 但每个测定时间节点, 金属挂片标记组皱纹盘鲍心率均显著高于未标记组(P < 0.05), 且标记4 h后, 两实验组心率差别较标记1 h时变大。
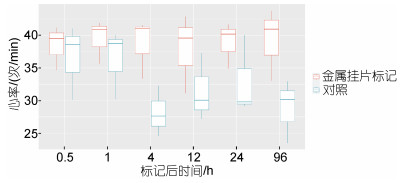 |
| 图 3 金属挂片法标记处理后皱纹盘鲍心率变化图 Fig. 3 Variation of heart rate of clip-tagged Pacific abalone compared with the control |
标记皱纹盘鲍呼吸率数据如图 4所示, 金属挂片标记组和未标记组皱纹盘鲍耗氧率有显著性差异(P < 0.05), 皱纹盘鲍耗氧率在不同温度下显示先下降后上升, 但无显著差异性(P > 0.05)。
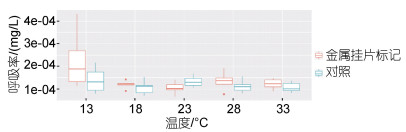 |
| 图 4 不同标记方法处理后皱纹盘鲍呼吸率随温度的比较 Fig. 4 Variation in respiratory rate of clip-tagged Pacific abalone against temperatures 注: 呼吸率为每3 s读数 |
通过方差分析结果发现, 两种标记处理后相同规格皱纹盘鲍60 d壳长的日生长差异不显著(P > 0.05), 但是, 无论是哪种标记方法, 小规格(SM)皱纹盘鲍苗种60 d壳长日生长率显著低于大规格(LS) (P < 0.05, 表 2)。
| 实验组 | 起始壳长/mm | 标记方法 | DGR/(μm/d) |
| LS | 46.44±3.95 | 金属挂片标记 | 71.54±32.91a |
| 塑料标签标记 | 74.21±38.45a | ||
| SM | 20.84±3.72 | 金属挂片标记 | 51.64±44.36b |
| 塑料标签标记 | 53.75±25.73b | ||
| 注: 数据表示为平均值±标准差(mean±SD); 同一实验组内不同标记方法行内相同上标字母表示差异不显著(P > 0.05)。下同 | |||
试验结束后, 我们统计了两种规格皱纹盘鲍在不同标记处理下的存活率, 如表 3所示, 两种标记方式处理下, 大规格皱纹盘鲍苗种的60 d存活率显著高于小规格实验组; 大规格皱纹盘鲍苗种金属挂片法与塑料标签法60 d存活率显著不同, 且金属挂片标记组略低于塑料标签标记组; 但是, 小规格皱纹盘鲍苗种金属挂片标记组显著低于塑料标签标记组, 且60 d存活率为44.38%±3.20%, 几乎是塑料标签标记组的1/2。
| 苗种规格 | 标记方式 | 时间/d | ASR |
| LS | 金属挂片标记 | 60 | 94.80%±3.75%a |
| 塑料标签标记 | 60 | 95.64%±1.73%b | |
| SM | 金属挂片标记 | 60 | 44.38%±3.20%d |
| 塑料标签标记 | 60 | 86.30%±2.66%c |
因在养殖测定过程中缺乏对鲍脱落标记时其壳长规格的记录, 因此将不同规格鲍组间脱落数数据合并。金属挂片标记(clip)和塑料黏贴标记(plastic)方法下鲍实际脱落标记个数平均分别为55±10、88±16, 5个重复组(养殖池)经卡方检验两种方法下实际脱落与理论脱落率均存在显著性差异(P < 0.05), 且金属挂片法(clip)标记脱落率(3.92%±0.75%)低于塑料黏贴标记(plastic)方法的脱落率(6.29%±1.16%)。
2.3 敌害生物对不同标记皱纹盘鲍捕食的差异研究在特定底面积的养殖池中, 模拟了皱纹盘鲍与敌害生物多棘海盘车共同生活的状态, 通过为期8 d的实验, 结果表明, 两种标记方法处理后皱纹盘鲍均被捕食, 随时间的推移存活率逐渐下降, 且8 d存活率均不足80%。但是, 多棘海盘车对两种标记方法处理后的皱纹盘鲍捕食选择没有显著差异(P > 0.05, 图 5)。
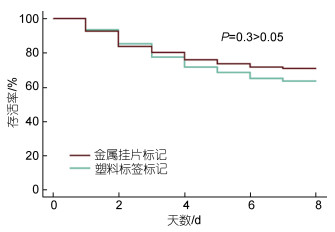 |
| 图 5 不同标记方法处理后皱纹盘鲍被多棘海盘车捕食的生存曲线 Fig. 5 Survival curves of tagged Pacific abalone by predation of A. amurensis in two tagging methods |
黏液被认为是贝类非特异性免疫的第一道屏障(王宜艳等, 2004), 贝类等海洋生物通过黏液与外界环境隔开, 已有报道证明鲍黏液分泌能减轻应激反应(Davies et al, 1998), 而且遭受敌害捕食的鲍等腹足类动物有分泌黏液作为防御机制来防御敌害攻击(Searcy-Bernal et al, 1993)。本研究通过观察呼吸孔的方式, 研究了两种标记处理后皱纹盘鲍干露状态下黏液的出现时间, 而金属挂片标记法皱纹盘鲍的黏液出现更快, 表明金属挂片标记方法对皱纹盘鲍机体更大程度造成胁迫等生理影响, 结合本研究中标记方法对不同规格皱纹盘鲍生长、存活的影响研究结果, 金属挂片标记方法对小规格鲍更易造成生理胁迫; 这些结果均表明今后在金属挂片标记鲍个体时应选择更大规格、尽量缩短标记完成的时间, 以减少皱纹盘鲍被动干露及标记胁迫为机体带来的损伤; 塑料标签标记组与未标记组皱纹盘鲍在操作干露过程中出现黏液的时间无显著差异, 表明塑料标签标志法对皱纹盘鲍几乎没有胁迫效应的存在。
心率的测定是一种重要的反映生物代谢水平变化的方法, 本实验结果表明金属挂片标记组皱纹盘鲍心率均显著高于未标记组, 且金属挂片标记组皱纹盘鲍在96 h内无显著变化, 说明金属挂片标记处理后确在心率这一指标对皱纹盘鲍机体产生生理影响, 且在实验期(4 d)内影响一直未能消除, 受实验条件的影响, 本实验仅有4 d周期, 心率指标的回复与否以及何时恢复到与对照相同水平未能获得相关数据, 今后工作需加强该方面研究。
通过测量耗氧率的变化, 骤变处理下温度和标记对皱纹盘鲍的应激反应更强。结果显示在急剧短暂的刺激下, 标记组的耗氧率显著高于未标记组。Searcy-Bernal等(1993)发现在红鲍标记的早期, 其耗氧率显著上升, 与本实验结果一致。此外, 温度梯度对鲍耗氧率的影响也不显著, 姜娓娓等(2017)表明10~25 ℃下皱纹盘鲍的耗氧率先上升后下降, 且差异不显著, 本实验结果与之类似。这些结果表明短时间内标记刺激鲍的代谢率升高, 而温度不明显。
3.2 不同标记方法对皱纹盘鲍生长存活的影响及标记脱落率研究个体标记被广泛应用于生物领域, 因此评估标记对皱纹鲍影响显的尤为重要。本实验结果显示, 无论是鲍规格还是标记类型对鲍的生长无显著的影响。此外, 标记对鲍短期的生理影响较为显著, 而对生长这一长期生理指标的影响效应较小, 后期的存活计数可间接佐证。Searcy-Bernal等(1993)对红鲍黏贴PIT标签, 结果表明对鲍的生长无影响, 与本实验的结果一致。而关于两种规格苗种日生长率的差异, 可能与标记对小规格苗种的损害效应更强, 或者是皱纹盘鲍的阶段性生长速度有关, 相关结论需要进一步的实验研究佐证。
标记后存活率是判别标记对皱纹盘鲍机体影响程度的一个关键指标, 本研究结果表明, 大规格苗种经两种标记方法处理后, 均表现出较高的存活率, 虽然两种标记方式存在显著差异, 但总体相差甚小。而小规格苗种经金属挂片标记处理后, 表现出较低的存活率(44.38%±3.20%), 几乎是塑料标签标记组的1/2。说明两种标记方式处理小规格苗种后, 大规格苗种机体受影响程度较小, 小规格苗种机体受到较为严重的影响, 且金属挂片标记对小规格皱纹盘鲍造成的损伤更为严重。本实验过程中每周收集死亡鲍个体, 发现小规格鲍苗种在clip标记后的各个实验周内均有死亡发生且早期(3周内)显著高于后期(5周), 表明鲍死亡可能与标记操作造成的肌体损伤有直接关系, 且通过观察后期死亡的个体大都也较瘦弱, 可能表明clip标记操作造成小规格鲍较长时间的胁迫影响。这与周珊珊(2015)利用倒刺型不锈钢标签标记魁蚶幼贝后, 对幼贝的生长存活产生负面影响的结果相似。而有研究表明, 壳面黏贴标志方法对鲍的生长存活影响较小, 是鲍的有效标志方法。
本实验对黏贴标签标记以及金属挂片标记后的皱纹盘鲍经过2个月养殖实验后, 发现每池(1 400个鲍个体)平均仅有55、88个标记的脱落, 脱落率在3.92%~6.29%左右, 这与之前Wu等(2013)结果相似。如此低的比例在鲍的遗传育种研究中是适用的, 但是这种标记方法的实效性还应该在不同环境如海区养殖环境中进行评估。通过统计分析发现, 两种方法下标记脱落率存在显著性差异, 且金属挂片法要优于黏贴标签法。
综上所述, 金属挂片标记法具有保持率高, 对大规格苗种生长存活影响小的优点, 但标记操作过程易引起皱纹盘鲍的生理应激, 对小规格苗种机体损伤较大, 所以可用于遗传育种与增殖放流等大规格苗种标记。塑料标签标记法对皱纹盘鲍不同规格苗种生长存活影响均较小, 但标记保持率较低, 所以可用于遗传育种与增殖放流等小规格苗种标记。
3.3 敌害生物对不同标记皱纹盘鲍捕食的差异研究海星对贝类的喜食习性使其成为海水经济贝类养殖主要的敌害生物种类之一(李成林等, 2008), 我国的海星主要有海燕和海盘车两个科, 其中, 以多棘海盘车危害最为严重(代克涛等, 2015)。因此, 研究标记后皱纹盘鲍被敌害生物的选择差异, 对皱纹盘鲍增殖放流效果评价, 具有重要的意义。本研究结果表明, 两种标记方法处理后的皱纹盘鲍被捕食没有显著差异, 表明金属挂片标记法和塑料标签标记法均可运用到皱纹盘鲍的增殖放流实践中。如Geibel等(2010)通过不锈钢标记对红鲍的生长进行了长达6年的动态追踪; Zhao等(1993)标记重捕法评估了增殖放流对皱纹盘鲍种群的效应。
综上所述, 本研究表明在标记的早期, 金属标记对鲍的生理具有胁迫作用, 在标记形成过程的2个月内, 金属挂件标记的小规格皱纹鲍死亡率高, 而在生长上无论规格大小都无影响。实际应用中由于金属挂片标记不容易脱落、不易腐蚀的特性更适合增殖放流项目。塑料标签适合工厂集约化养殖下的系谱记录, 并可在鲍新品种培育中发挥重要作用。标记形成的后期, 皱纹盘鲍躲避敌害行为上2种标记无显著差异。这一结果说明标记对皱纹盘鲍个体长期追踪具有可行性, 但还需要定期现场调查, 大规模增殖放流结果反馈的验证, 从而建立行之有效的评估模型。
4 结论本研究通过比较金属挂片和塑料黏贴标签两种标记方法对不同规格皱纹盘鲍生理、生长及存活等性状的表现, 发现塑料黏贴标记对皱纹盘鲍无论标记早期的生理胁迫, 还是60 d内的生长、存活均无显著性影响; 而金属标记虽可造成皱纹盘鲍早期生理胁迫、小规格苗种的生长、存活产生不利影响, 但对壳长 > 3 cm的大规格皱纹盘鲍生长、存活以及逃避敌害均无显著影响。本研究验证了皱纹盘鲍个体水平下两种标记方法的有效性及适用性, 将为皱纹盘鲍人工选育以及底播增养殖等工作提供有益指导。
王宜艳, 孙虎山, 陶佃勇, 2004. 皱纹盘鲍外套膜、鳃和足粘液细胞的类型与分布. 动物学杂志, 39(3): 8-11 DOI:10.3969/j.issn.0250-3263.2004.03.002 |
亓海刚, 2019. 皱纹盘鲍基因组单核苷酸多态标记开发与应用[D]. 青岛: 中国科学院海洋研究所.
|
龙华, 郑英, 陈建武, 等, 2006. 生命科学研究中的标记技术. 包头医学院学报, 22(1): 102-109 DOI:10.3969/j.issn.1006-740X.2006.01.064 |
代克涛, 李娇, 关长涛, 等, 2015. 多棘海盘车(Asterias amurensis)对5种双壳贝类的摄食选择性及摄食节律. 渔业科学进展, 36(1): 97-102 |
吕端华, 1978. 中国近海鲍科的研究. 海洋科学集刊, 14: 89-100 |
许莉佳, 2012. 荧光标记斑马鱼稚鱼耳石的效果及其对抗氧化酶活力的影响[D]. 重庆: 西南大学.
|
农业部渔业渔政管理局, 2021. 中国渔业年鉴-2020. 北京: 中国农业出版社, 23
|
李成林, 宋爱环, 胡炜, 等, 2008. 海星侵食贝类的防治对策. 科学养鱼, (8): 48-49 |
吴富村, 阙华勇, 张国范, 2020. 我国皱纹盘鲍底播增养殖历史、现状及未来发展趋势. 海洋科学, 44(8): 56-68 |
张昭, 1979. 国家水产总局召开——全国海水鱼虾养殖会议张昭同志在会上讲话. 中国水产, (1): 8-10 |
林位琅, 林光文, 欧洪来, 等, 2019. 2019年秋季鲍鱼生产形势调研分析. 中国水产, (11): 51-53 |
林思恒, 吴富村, 张国范, 2016. 高温胁迫下皱纹盘鲍不同养殖群体心率变化比较. 海洋科学, 40(11): 84-90 |
周珊珊, 2015. 魁蚶幼贝生境选择及标志技术研究[D]. 青岛: 中国海洋大学.
|
周珊珊, 王伟定, 丰美萍, 等, 2017. 贝类标志技术的研究进展. 浙江海洋学院学报(自然科学版), 36(2): 172-179 DOI:10.3969/j.issn.1008-830X.2017.02.012 |
柯才焕, 2013. 我国鲍鱼养殖产业现状与展望. 中国水产, (1): 27-30 |
姜娓娓, 方建光, 李加琦, 等, 2017. 温度胁迫对皱纹盘鲍生理和生化活动的影响. 中国水产科学, 24(2): 220-230 |
蔡明夷, 柯才焕, 周时强, 等, 2004. 鲍遗传育种研究进展. 水产学报, 28(2): 201-208 |
DAVIES M S, HAWKINS S J, 1998. Mucus from marine molluscs. Advances in Marine Biology, 34: 1-71 |
GEIBEL J J, DEMARTINI J D, HAAKER P L, et al, 2010. Growth of red abalone, Haliotis rufescens (Swainson), along the North Coast of California. Journal of Shellfish Research, 29(2): 441-448 DOI:10.2983/035.029.0221 |
HALE J R, BOUMA J V, VADOPALAS B, et al, 2012. Evaluation of passive integrated transponders for abalone: tag placement, retention, and effect on survival. Journal of Shellfish Research, 31(3): 789-794 DOI:10.2983/035.031.0324 |
KOIKE Y, SUN Z X, TAKASHIMA F, 1988. On the feeding and growth of juvenile hybrid abalones. Aquaculture Science, 36(3): 231-235 |
NIE Z Q, WANG S P, 2004. The status of abalone culture in China. Journal of Shellfish Research, 23(4): 941-945 |
PRENTICE E F, FLAGG T A, MCCUTCHEON C S, 1990. Feasibility of using implantable passive integrated transponder (PIT) tags in salmonids. American Fisheries Society Symposium, 7: 317-322 |
PRINCE J D, 1991. A new technique for tagging abalone. Australian Journal of Marine and Freshwater Research, 42(1): 101-106 DOI:10.1071/MF9910101 |
SEARCY-BERNAL R, MONTAÑO-MOCTEZUMA G, ANGUIANO-BELTRáN C, et al, 1993. Preliminary studies on the use of pit tags to evaluate abalone restocking. Journal of Shellfish Research, 35(3): 677-683 |
SEOK K B, HO L Y, WON P D, 2002. Effects of the tagging methods on the growth and survival of abalone juvenile, Haliotis discus hannai. Korean Journal of Fisheries and Aquatic Sciences, 35(3): 282-288 |
SHEPHERD S A, HEARN W S, 1983. on southern Australian abalone (genus Haliotis). Ⅳ. growth of H. laevigata and H. ruber. Australian Journal of Marine and Freshwater Research, 34(3): 461-475 |
WU F C, ZHANG G F, 2013. Suitability of cage culture for Pacific abalone Haliotis discus hannai ino production in China. Aquaculture Research, 44(3): 485-494 DOI:10.1111/j.1365-2109.2012.03185.x |
ZHANG G F, QUE H Y, LIU X, et al, 2004. Abalone mariculture in China. Journal of Shellfish Research, 23(4): 947-950 |
ZHAO Z M, CONG R H, ZHANG K X, et al, 2021. Illumination can change the periodic variation of the oxygen consumption rate of Crassostrea gigas. Journal of Molluscan Studies, 87(2): eyab012 |
ZHAO B X, TANAKA E, YAMADA J I, et al, 1993. Stock assessment of abalone in Kisakata, Akita Prefecture. Nippon Suisan Gakkaishi, 59(11): 1823-1830 |
 2022, Vol. 53
2022, Vol. 53


