中国海洋湖沼学会主办。
文章信息
- 吕玉晗, 张弛, 戴了疑, 何卫彤, 郑小东. 2022.
- LYU Yu-Han, ZHANG Chi, DAI Liao-Yi, HE Wei-Tong, ZHENG Xiao-Dong. 2022.
- 西太平洋杜氏枪鱿(Uroteuthis duvaucelii)群体形态差异分析
- MORPHOLOGICAL VARIATION ANALYSIS OF UROTEUTHIS DUVAUCELII IN THE COASTAL WATERS OF WESTERN PACIFIC
- 海洋与湖沼, 53(3): 768-777
- Oceanologia et Limnologia Sinica, 53(3): 768-777.
- http://dx.doi.org/10.11693/hyhz20211000241
文章历史
-
收稿日期:2021-10-11
收修改稿日期:2021-11-16
2. 中国海洋大学海水养殖教育部重点实验室 山东青岛 266003;
3. 广东省阳江市农业农村局 广东阳江 529500
2. Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China;
3. Agricultural and Rural Bureau of Yangjiang of Guangdong Province, Yangjiang 529500, China
杜氏枪鱿属于头足纲(Cephalopoda)、闭眼鱿目(Myopsida)、枪鱿科(Loliginidae)、尾枪鱿属(Uroteuthis), 俗称小管、锁管等(Jereb et al, 2010; Young et al, 2019), 广泛分布于西太平洋和印度洋, 特别是我国的黄海、东海和南海以及泰国、菲律宾海域(Jereb et al, 2010; Sabrah et al, 2015)。杜氏枪鱿为一年生种类, 具有繁殖能力强、生命周期短、生长速率快等特点, 经济价值高, 开发潜力大。因其肉质细腻, 味道鲜美, 含有多种人体必需氨基酸和矿物元素, 深受消费者的喜爱, 国内外市场需求一直不断增长, 近些年, 已从副渔获物转变为目标渔获物(Kang et al, 2018)。
国内外学者对杜氏枪鱿的研究主要集中于生长发育、资源评估等方面(Mohamed, 1996; Karnik et al, 2001; Mishra et al, 2012; 方舟等, 2018), 多项研究发现分布于不同海域的杜氏枪鱿存在显著的遗传差异(De Luna Sales et al, 2013; Anderson et al, 2014; Khatami et al, 2018)。形态特征能够直观反映遗传差异, 有关其形态差异和种群结构的研究鲜有报道。作为西太平洋广布种, 杜氏枪鱿易受地理阻隔和生态环境等因素影响, 导致形态发生相应变化以适应复杂生境(Carvalho et al, 1998), 研究不同地理群体的形态差异对于了解种群动态以及探讨隐存多样性是很有必要的。因此, 本研究运用形态学观察和多元统计分析方法(主成分分析、聚类分析、判别分析和单因素方差分析)对西太平洋沿海7个不同地理群体的形态特征进行比较分析, 旨在为杜氏枪鱿种质资源保护、合理利用与科学管理提供重要的形态学资料。
1 材料与方法 1.1 实验材料实验所用样品采集自7个地理群体: 江苏南通(NT)、浙江宁波(NB)、浙江南麂岛(NJD)、福建东山(DS)、广东汕头(ST)、广东阳江(YJ)和泰国湾(GT), 共计202个样品, 具体的采样信息见表 1。各群体样品均为渔船出海捕捞获得, 运输途中冷冻保存, 样品运回实验室后室温解冻清洗, 10%福尔马林溶液固定, 一周后转至75%酒精长期保存(Roper et al, 1983)。
| 群体 | 缩写 | 采样点 | 采样时间(年.月) | 样品数 | 胴背长/mm | |
| 范围 | 平均值±标准差 | |||||
| 南通 | NT | 120°53′E, 31°58′N | 2020.01 | 38(16♀22♂) | 58.12~112.51 | 75.90±14.65 |
| 宁波 | NB | 121°52′E, 29°28′N | 2020.01 | 32(20♀12♂) | 44.58~72.53 | 59.54±8.66 |
| 南麂岛 | NJD | 121°04′E, 27°27′N | 2020.08 | 30(10♀20♂) | 51.83~113.18 | 74.34±12.39 |
| 东山 | DS | 117°25′E, 23°42′N | 2020.01 | 29(13♀16♂) | 42.53~93.57 | 64.98±12.94 |
| 汕头 | ST | 116°40′E, 23°21′N | 2020.01 | 42(23♀19♂) | 47.55~67.95 | 60.00±5.28 |
| 阳江 | YJ | 111°58′E, 21°51′N | 2020.01 | 24(7♀17♂) | 73.45~107.49 | 90.34±8.40 |
| 泰国湾 | GT | 101°21′E, 6°49′N | 2018.11 | 7(4♀3♂) | 67.22~105.91 | 87.49±13.33 |
选取较为完整的固定后样品进行形态测量。测量方法参照Sin等(2009)和Liao等(2010), 包括全长(TL)、体重(TW)、胴背长(DML)、胴腹长(VML)、胴体宽(MW)、头宽(HW)、头长(HL)、鳍长(L/R, FL)、鳍宽(FW)、眼直径(ED)、腕长(AL, 1~4)、腕宽(AW, 1~4)、茎化腕长(HcL, 雄性)。
1.3 齿舌电镜样品制备从样品口部向外挤压口球部分, 至角质颚完全挤出。用镊子将齿舌从角质颚后部小心取出。用蒸馏水清洗齿舌表面的食物残渣, 然后放进5%~7%的NaOH溶液中煮沸。之后把齿舌置于CO2临界点干燥后进行扫描电镜观察并拍照(郑小东等, 2009)。
1.4 角质环获取与观察在带有摄像系统的体视显微镜(型号: Nikon SMZ 800N)下, 用尖嘴镊子将样品第三腕和触腕穗吸盘中的角质环取出, 用海水冲洗干净, 然后拍照并记录齿数。
1.5 多元统计分析由于雌雄样品的第三腕大吸盘角质环齿数存在显著差异, 将雌雄样品分开分析。将各测量数据除以胴背长(DML)进行标准化处理。标准化指标参考Roper等(1983): MWI (胴背宽/胴背长×100)、FLI (鳍长/胴背长×100)、FWI (鳍宽/胴背长×100)、EDI (眼直径/胴背长×100)、ALI (腕长/胴背长×100)、AWI (腕宽/胴背长×100)、HLI (头长/胴背长×100)、HWI (头宽/胴背长×100)和HcL% (茎化腕变形部分占比)。运用SPSS 26.0对标准化数据进行多元统计分析。
主成分分析: 根据雌性19个形态学指标TW、VMLI、MWI、HWI、HLI、FWI、LFLI、RFLI、EDI、LALI4、RALI1、RALI2、RALI3、RALI4、LAWI1、RAWI1、RAWI2、RAWI3、RAWI4; 雄性比雌性多一个指标(HcL%), 计算出主导雌性和雄性群体差异的互不关联的主成分, 参照Brzeski等(1988)的方法计算贡献率和累计贡献率。
判别分析: 采用逐步判别法对形态指标(同主成分)进行分析, 根据判别参数构建判别函数。判别准确率的计算公式参照高晓蕾等(2019):
 (1)
(1)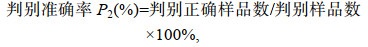 (2)
(2)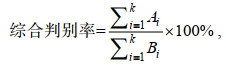 (3)
(3)式中, Ai为第i个群体中判别正确的样品数, Bi为第i个群体中实测的样品数, k为群体。
聚类分析: 计算出雌性和雄性各群体形态指标(同主成分)的平均值, 采用欧氏距离的最短系统聚类法构建聚类图进行聚类分析。
单因素方差分析: 对所有指标(同主成分)先进行方差齐性检验, 对符合条件的指标进行单因素方差分析, 采用图基HSD法进行事后检验(post hoc test)。
2 结果 2.1 角质环形态比较分布于中国沿海的6个群体的角质环形态与Jereb等(2010)的描述相符。雌性群体: 汕头、东山和泰国湾群体的第三腕大吸盘角质环具7个宽板齿, 南麂岛和宁波群体为6~8个, 南通和阳江群体6~7个, 各群体触腕穗角质环齿数均在16~20个之间(表 2); 雄性群体: 第三腕大吸盘角质环全缘具齿, 南通、宁波、南麂岛、东山、汕头和阳江群体角质环前端具8~10个大宽板齿, 后端具3~5个小板齿。泰国湾群体雄性第三腕角质环具7个宽板齿, 后端1/3平滑, 雌性角质环形态与其他6个群体相似。所有群体的触腕穗角质环齿数范围16~22 (表 2, 图 1)。
| 群体 | 缩写 | 第三腕大吸盘角质环齿数/个 | 触腕穗角质环齿数/个 | |||
| ♀ | ♂ | ♀ | ♂ | |||
| 南通 | NT | 6~7 | 11~15 | 17~20 | 17~22 | |
| 宁波 | NB | 6~8 | 12~16 | 16~19 | 16~19 | |
| 南麂岛 | NJD | 6~8 | 15 | 17~20 | 17~19 | |
| 东山 | DS | 7 | 11~15 | 19 | 17~19 | |
| 汕头 | ST | 7 | 11~15 | 17~20 | 17~19 | |
| 阳江 | YJ | 6~7 | 11~14 | 16~20 | 15~19 | |
| 泰国湾 | GT | 7 | 7 | 17~19 | 18~19 | |
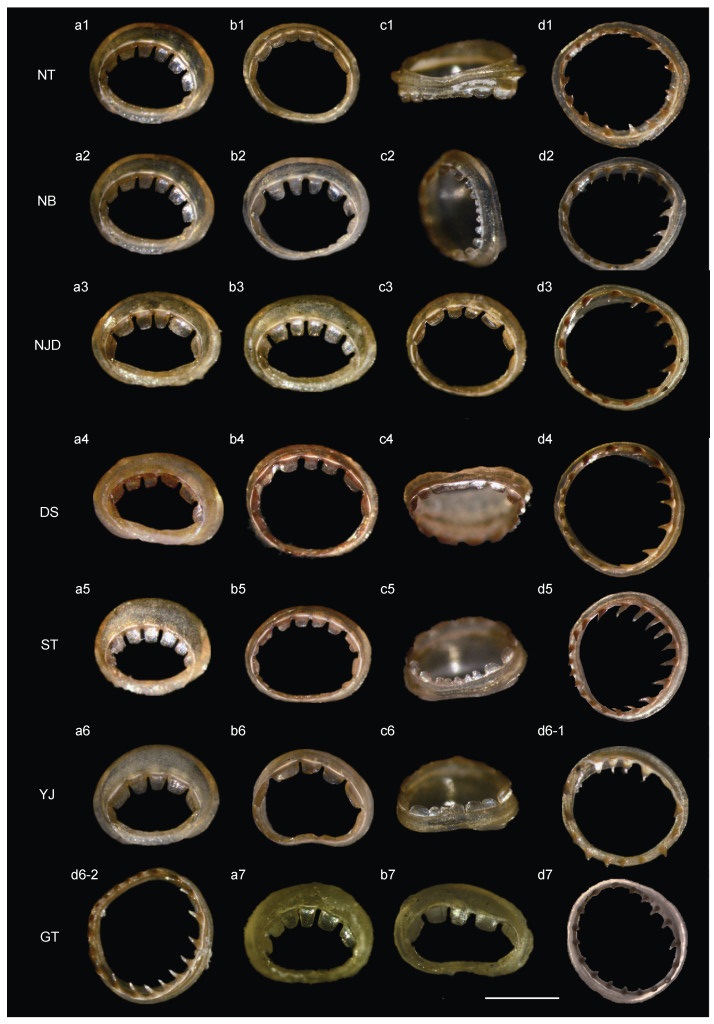 |
| 图 1 杜氏枪鱿7个地理群体吸盘角质环 Fig. 1 Sucker teeth of the seven geographic populations of U. duvaucelii 注: a. 雌性第三腕大吸盘角质环; b, c. 雄性第三腕大吸盘角质环; d. 触腕穗大吸盘角质环。比例尺=700 μm |
泰国湾和阳江齿舌样品的扫描电镜结果见图 2。齿舌排列方式均为: 中央齿1列, 由中央向两侧依次为第一侧齿、第二侧齿和第三侧齿, 齿式3·1·3。齿舌形态特征的测量数据见表 3。阳江样品齿舌: 中央齿有3个齿尖, 左右对称, 高度为0.21~0.22 mm, 宽度为高度的0.62~0.64, 两侧齿尖高度约为中央齿高的0.52~0.64; 第一侧齿的形状和中央齿相似, 比中央齿小, 高度约为中央齿的0.52~0.81; 第二侧齿呈弯刀形, 由于其与第一和第三侧齿连接太紧密, 无法准确测量其宽度和高度; 第三侧齿也是弯刀形, 宽度约为中央齿的0.52~0.59, 高度约是中央齿的两倍。泰国湾样品各齿与中央齿的占比与阳江样品存在一定差异(表 3): 中央齿高度在0.10~0.19 mm, 宽度为中央齿高度的0.63~1.00, 两侧齿尖高度约为中央齿高度的0.45~0.64; 第一侧齿高度和中央齿相同; 第二侧齿呈弯刀形; 第三侧齿宽度约为中央齿的0.58~0.64, 高度约是中央齿的2~3.5倍。
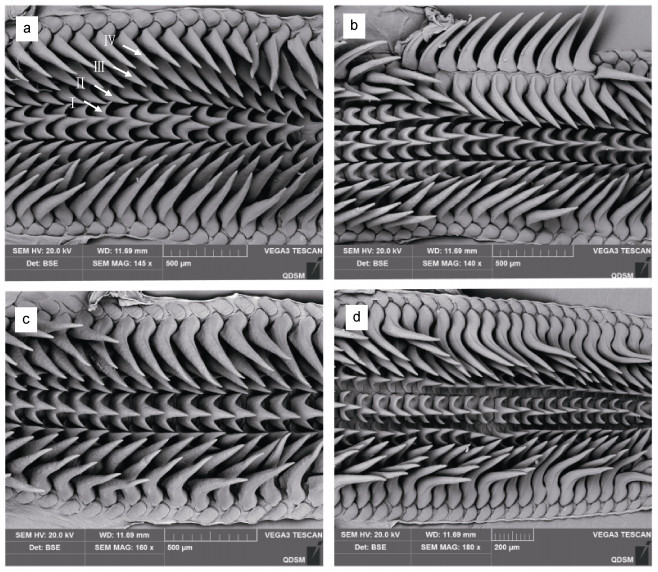 |
| 图 2 杜氏枪鱿齿舌电镜观察 Fig. 2 Radula of U. duvaucelii 注: a. 阳江雌性, b. 阳江雄性, c. 泰国湾雌性, d. 泰国湾雄性。Ⅰ. 中央齿; Ⅱ. 第一侧齿; Ⅲ. 第二侧齿; Ⅳ. 第三侧齿 |
| 采样点 | 性别 | 中央齿 | 第一侧齿 | 第二侧齿 | 第三侧齿 | 齿舌电镜图 |
| 阳江 | ♀ | 3齿尖, 各齿相同 中央齿尖高度: 0.21~0.22 mm 宽度: 0.62~0.64 两侧齿尖高度: 0.57~0.64 |
3齿尖 高度: 0.52~0.55 |
弯刀形 | 弯刀形 宽度: 0.52~0.55 高度: 1.76~1.81 |
图 2a |
| 阳江 | ♂ | 3齿尖, 各齿相同 中央齿尖高度: 0.21~0.22 mm 宽度: 0.62~0.63 两侧齿尖高度: 0.52~0.55 |
3齿尖 高度: 0.76~0.81 |
弯刀形 | 弯刀形 宽度: 0.57~0.59 高度: 2.10~2.14 |
图 2b |
| 泰国湾 | ♀ | 3齿尖, 各齿相同 中央齿尖高度: 0.17~0.19 mm 宽度: 0.63~0.64 两侧齿尖高度: 0.63~0.64 |
3齿尖 高度: 0.89~0.94 |
弯刀形 | 弯刀形 宽度: 0.58~0.59 高度: 2.15~2.35 |
图 2c |
| 泰国湾 | ♂ | 3齿尖, 各齿相同 中央齿尖高度: 0.10~0.11 mm 宽度: 0.97~1.00 两侧齿尖高度: 0.45~0.51 |
3齿尖 高度: 0.95~1.00 |
弯刀形 | 弯刀形 宽度: 0.60~0.64 高度: 3.54~3.80 |
图 2d |
| 注: 中央齿中间齿尖高度为实测数据(mm), 其他数据均为与中央齿中间齿尖高度的比值 | ||||||
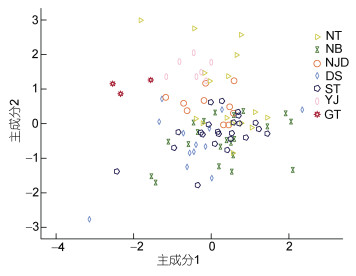
雌性群体的KMO (Kaiser-Meyer-Olkin)和巴特利检测(Bartlett)检验结果为0.634和901.020 (P < 0.005), 表明这19个形态指标可以进行主成分分析(表 4)。共构建5个主成分(特征值均大于1.0), 累积贡献率为63.395%。主成分1中影响群体形态差异的指标为MWI、HcL%、RALI2、RALI3、RALI4、LAWI4、RAWI1、RAWI2、RAWI3和RAWI4, 主成分2中影响群体差异的指标为TWI、FWI、LALI4和RFLI, 主成分3中影响群体差异的指标为VMLI、HWI、HLI和RALI1, 主成分4中影响群体差异的指标为LFLI, 主成分5中影响群体差异的指标为EDI。主成分1和2绘制的散点图显示泰国湾能与其他群体区分开来, 而其他群体间存在较多重叠(图 3)。
| 性状 | 负荷值 | ||||||||||||||||||
| 第一主成分 | 第二主成分 | 第三主成分 | 第四主成分 | 第五主成分 | |||||||||||||||
| ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ||||||||||
| TW | –0.151 | 0.201 | 0.815 | –0.562 | –0.111 | –0.352 | 0.009 | 0.289 | 0.080 | –0.047 | |||||||||
| VMLI | 0.162 | 0.232 | –0.34 | –0.091 | 0.56 | 0.646 | 0.292 | 0.285 | 0.071 | –0.190 | |||||||||
| MWI | 0.445 | –0.01 | –0.422 | 0.419 | 0.272 | 0.574 | 0.260 | 0.237 | 0.150 | –0.281 | |||||||||
| HWI | 0.039 | –0.184 | –0.245 | 0.309 | 0.529 | 0.529 | 0.309 | –0.278 | 0.072 | 0.127 | |||||||||
| HLI | 0.180 | 0.28 | –0.412 | 0.214 | 0.474 | 0.576 | 0.114 | 0.073 | 0.206 | 0.012 | |||||||||
| FWI | 0.272 | 0.513 | 0.549 | –0.084 | 0.362 | –0.075 | –0.005 | –0.251 | 0.027 | –0.207 | |||||||||
| LFLI | –0.084 | 0.253 | 0.490 | –0.454 | 0.138 | 0.101 | 0.732 | 0.637 | –0.106 | 0.062 | |||||||||
| RFLI | –0.131 | 0.246 | 0.620 | –0.426 | 0.231 | –0.004 | 0.159 | 0.661 | 0.538 | 0.003 | |||||||||
| EDI | 0.162 | 0.049 | –0.245 | 0.072 | 0.050 | 0.079 | –0.728 | 0.041 | 0.430 | 0.902 | |||||||||
| LALI4 | 0.422 | 0.776 | 0.525 | –0.245 | 0.318 | 0.148 | –0.058 | –0.206 | 0.205 | 0.082 | |||||||||
| RALI1 | 0.333 | 0.695 | 0.362 | –0.477 | 0.518 | 0.046 | –0.137 | –0.237 | –0.29 | 0.135 | |||||||||
| RALI2 | 0.545 | 0.734 | 0.062 | –0.346 | 0.437 | 0.099 | –0.240 | –0.263 | –0.261 | –0.001 | |||||||||
| RALI3 | 0.441 | 0.769 | 0.266 | –0.193 | 0.272 | 0.222 | –0.291 | –0.105 | –0.455 | –0.018 | |||||||||
| RALI4 | 0.596 | 0.788 | 0.119 | –0.26 | 0.222 | 0.152 | –0.225 | –0.246 | 0.141 | –0.039 | |||||||||
| LAWI4 | 0.598 | 0.634 | 0.129 | 0.411 | –0.365 | –0.383 | 0.241 | –0.036 | 0.183 | –0.149 | |||||||||
| RAWI1 | 0.564 | 0.550 | –0.152 | 0.550 | –0.368 | –0.065 | 0.190 | 0.200 | –0.299 | 0.170 | |||||||||
| RAWI2 | 0.742 | 0.701 | 0.149 | 0.458 | –0.355 | –0.114 | 0.146 | 0.163 | 0.015 | 0.169 | |||||||||
| RAWI3 | 0.647 | 0.585 | 0.044 | 0.610 | –0.399 | –0.127 | 0.069 | 0.292 | 0.153 | 0.068 | |||||||||
| RAWI4 | 0.784 | 0.649 | 0.070 | 0.436 | –0.355 | –0.314 | 0.010 | 0.046 | 0.104 | –0.236 | |||||||||
| HcL% | — | 0.329 | — | –0.088 | — | 0.078 | — | –0.557 | — | –0.059 | |||||||||
| 特征值 | 3.923 | 5.393 | 3.411 | 2.796 | 2.481 | 1.888 | 1.715 | 1.606 | 1.149 | 1.160 | |||||||||
| 贡献率/% | 19.617 | 28.382 | 17.055 | 14.735 | 12.405 | 9.938 | 8.575 | 8.453 | 5.743 | 6.104 | |||||||||
| 累计贡献率/% | ♀: 63.395 | ♂: 67.591 | |||||||||||||||||
| 注: —表示无数据 | |||||||||||||||||||
雄性群体的KMO和巴特利检测检验结果为0.698和789.302 (P < 0.005), 表明这20个形态指标可以进行主成分分析(表 4)。共构建5个主成分(特征值均大于1.0), 累积贡献率为67.591%。主成分1中影响群体形态差异的指标为FWI、LALI4、RALI1、RALI2、RALI3、RALI4、LAWI4、RAWI1、RAWI2、RAWI3和RAWI4, 主成分2中影响群体差异的指标为TW, 主成分3中影响群体差异的指标为VMLI、MWI、HWI和HLI, 主成分4中影响群体差异的指标为LFLI和RFLI, 主成分5中影响群体差异的指标为EDI。基于主成分1和2绘制的散点图显示纵轴和横轴所有群体均有重叠(图 4)。
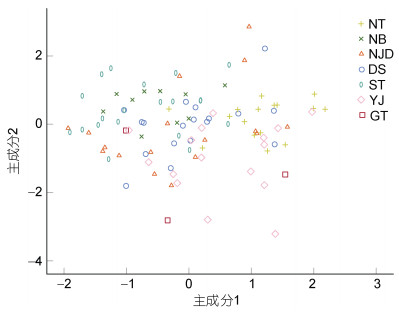 |
| 图 4 杜氏枪鱿雄性7个地理群体主成分1、2散点图 Fig. 4 Scatter plot of the first and second principal components for principal component analysis of seven male populations of U. duvaucelii |
采用逐步判别法分别对雌、雄群体进行判别分析, 建立费希尔判别函数。雌性群体判别函数:
南通群体: Y1=0.181X1+1.647X2+4.570X3–0.213X4+155.049X5–209.394
宁波群体: Y2= –0.276X1+1.759X2+4.652X3–0.565X4+156.767X5–190.200
南麂岛群体: Y3= –0.098X1+2.421X2+3.619X3+1.065X4+99.192X5–190.436
东山群体: Y4= –0.329X1+2.104X2+4.686X3–0.570X4+154.315X5–197.538
汕头群体: Y5= –0.311X1+2.025X2+4.691X3–0.380X4+156.680X5–206.161
阳江群体: Y6=0.109X1+1.532X2+4.616X3–0.353X4+153.744X5–198.697
泰国湾群体: Y7=–0.123X1+1.788X2+4.887X3–0.463X4+150.934X5–205.114
判别函数中, X1为TW、X2为HWI、X3为RFLI、X4为FWI、X5为RALI1。
雄性群体判别函数:
南通群体: Y1= 1.741X1+2.004X2+7.895X3–88.597
宁波群体: Y2= 2.083X1+0.824X2+7.810X3–48.995
南麂岛群体: Y3= 1.762X1+1.696X2+5.891X3–63.808
东山群体: Y4= 1.469X1+1.864X2+5.805X3–65.988
汕头群体: Y5= 1.360X1+1.671X2+5.841X3–56.897
阳江群体: Y6= 3.191X1+1.478X2+8.968X3–97.242
泰国湾群体: Y7=2.731X1+1.777X2+5.833X3–88.873
判别函数中, X1为TW、X2为LALI4、X3为LAWI4。
为验证其有效性, 将所有样品相对应变量值分别代入判别函数中, 被判别样品属于最大函数值所对应的群体(表 5)。雌性群体综合判别准确率为58.7%, 南麂岛群体的判别准确率最高, 为80.0%, 南通和泰国湾群体的判别准确率较低, 分别为26.7%和25.0% (表 5)。雄性群体的综合判别准确率为57.3%, 阳江群体的判别准确率最高, 为93.8%, 南麂岛群体的判别准确率最低, 为23.5% (表 5)。
| 群体 | 样品数目 | 判别准确率/% | 预测分类 | ||||||||||||||||||||||||||
| ♀ | ♂ | ♀ | ♂ | NT | NB | NJD | DS | ST | YJ | GT | |||||||||||||||||||
| P1 | P2 | P1 | P2 | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ||||||||||||
| NT | 15 | 16 | 26.7 | 6.7 | 68.8 | 56.3 | 4 | 11 | 5 | 0 | 0 | 0 | 0 | 3 | 4 | 0 | 1 | 2 | 1 | 0 | |||||||||
| NB | 19 | 20 | 63.2 | 57.9 | 30.0 | 0.0 | 0 | 0 | 12 | 6 | 0 | 4 | 1 | 2 | 6 | 2 | 0 | 6 | 0 | 0 | |||||||||
| NJD | 10 | 17 | 80.0 | 70.0 | 23.5 | 17.6 | 0 | 3 | 0 | 0 | 8 | 4 | 0 | 3 | 2 | 3 | 0 | 4 | 0 | 0 | |||||||||
| DS | 14 | 18 | 50.0 | 42.9 | 72.2 | 55.6 | 0 | 2 | 3 | 0 | 0 | 1 | 7 | 13 | 4 | 2 | 0 | 0 | 0 | 0 | |||||||||
| ST | 23 | 20 | 73.9 | 69.6 | 65.0 | 45.0 | 0 | 0 | 2 | 1 | 0 | 0 | 4 | 6 | 17 | 13 | 0 | 0 | 0 | 0 | |||||||||
| YJ | 7 | 16 | 71.4 | 57.1 | 93.8 | 87.5 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 15 | 0 | 0 | |||||||||
| GT | 4 | 3 | 25.0 | 0.0 | 33.3 | 0.0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 2 | 1 | 1 | 1 | |||||||||
| 综合判别率/% | 58.7 | 57.3 | |||||||||||||||||||||||||||
雌、雄群体的聚类分析结果相似, 南通及阳江与泰国湾群体聚为一支, 宁波、南麂岛、东山和宁波群体聚为一支。在雌性群体中, 东山和汕头群体距离最近, 最先聚为一支, 然后再与南麂岛和宁波群体聚合。雄性群体中, 宁波和汕头群体先聚为一支, 然后再与东山和南麂岛群体聚合。
2.6 单因素方差分析雌性群体分析结果显示, 东山和汕头与南通、阳江和泰国湾群体之间的TW存在显著差异, 与宁波和南麂岛群体差异不显著, 其他形态指标差异不显著(表 6)。雄性群体所有形态指标差异均不显著(表 7)。
| 性状 | 群体(♀) | ||||||
| NT | NB | NJD | DS | ST | YJ | GT | |
| TW | 22.933±4.343bc | 13.859±3.278ab | 19.708±3.219abc | 11.730±3.415a | 11.964±1.693a | 27.260±3.747c | 21.667±4.777bc |
| VMLI | 84.003±3.009ab | 86.074±5.016b | 85.732±2.302ab | 88.862±5.596b | 86.283±3.985b | 79.938±6.119a | 83.612±2.427ab |
| MWI | 40.128±3.679ab | 46.340±5.185c | 44.052±2.324bc | 42.973±3.641bc | 43.930±3.767bc | 36.470±1.782a | 39.713±4.159ab |
| HWI | 21.908±2.370a | 24.275±3.887ab | 29.871±1.928c | 28.484±4.136bc | 27.271±2.054bc | 21.663±3.141a | 24.511±3.931ab |
| HLI | 26.476±3.130ab | 28.515±4.706b | 27.324±3.725ab | 29.853±5.649b | 29.135±5.771b | 21.589±3.514a | 24.914±5.086ab |
| FWI | 1.034±0.087ab | 1.019±0.121ab | 0.875±0.102a | 0.992±0.134ab | 1.072±0.128b | 0.994±0.079ab | 0.889±0.078a |
| LAWI4 | 4.540±1.490ab | 4.947±0.837b | 4.134±0.627ab | 4.016±1.404a | 4.522±0.949ab | 4.311±0.998ab | 3.541±0.324a |
| RAWI1 | 3.373±0.336ab | 3.514±0.435b | 3.172±0.440ab | 3.039±0.464ab | 3.268±0.400ab | 3.235±0.640ab | 2.792±0.694a |
| RAWI2 | 4.586±0.460b | 4.437±0.548ab | 4.234±0.371ab | 3.845±0.784ab | 4.334±0.620ab | 4.075±0.707ab | 3.675±0.475a |
| RAWI3 | 5.002±0.497ab | 5.245±0.822b | 4.582±0.840ab | 4.076±0.963a | 4.666±0.844ab | 4.500±0.547ab | 4.095±0.354a |
| RAWI4 | 4.853±1.702b | 4.830±0.999b | 4.236±0.754ab | 3.595±1.292ab | 4.361±0.833ab | 4.287±0.765ab | 2.914±0.251a |
| 注: 不同群体标有相同字母表示它们之间无显著性差异(P > 0.05), 标有不同字母表示有显著性差异(P < 0.05) | |||||||
| 性状 | 群体(♂) | ||||||
| NT | NB | NJD | DS | ST | YJ | GT | |
| TW | 15.709±2.544ab | 16.524±2.891ab | 18.369±7.118bc | 13.460±2.464a | 11.754±1.672a | 23.697±3.002d | 21.879±2.726cd |
| VMLI | 84.240±6.337ab | 84.361±3.252ab | 83.910±3.591a | 86.113±6.491ab | 83.351±4.233a | 83.255±5.534a | 90.505±1.976b |
| MWI | 41.729±3.691ab | 45.982±6.488b | 43.588±5.540a | 42.027±5.544ab | 43.802±4.287ab | 38.065±4.108ab | 43.751±4.932ab |
| HWI | 21.707±6.563a | 25.235±6.240ab | 27.717±4.530ab | 27.369±1.809ab | 27.632±2.716ab | 22.052±3.371ab | 27.920±6.204b |
| LALI4 | 49.908±4.230c | 37.221±7.266a | 43.019±6.315abc | 44.428±3.492abc | 39.415±5.218abc | 45.373±5.555bc | 45.017±11.799bc |
| RALI1 | 37.230±4.465b | 25.900±2.516a | 32.270±4.367ab | 35.754±4.700b | 26.463±4.136a | 38.929±6.522b | 39.187±17.924b |
| RALI2 | 46.045±4.232c | 35.800±3.653a | 39.157±6.846abc | 40.386±4.790bc | 37.811±6.152ab | 41.221±5.932bc | 40.639±8.164bc |
| RALI3 | 52.795±4.165b | 42.773±5.539a | 45.174±6.806ab | 47.422±5.006ab | 44.175±6.770a | 49.575±5.632ab | 49.477±5.311ab |
| RALI4 | 46.622±5.223b | 37.666±2.641a | 39.740±4.754a | 41.098±12.500ab | 40.774±5.760ab | 43.338±4.049ab | 42.304±5.539ab |
| LAWI4 | 5.891±0.622d | 4.731±0.503bc | 4.324±0.853ab | 4.771±0.995bc | 4.797±0.764bc | 5.392±1.001cd | 3.664±0.489a |
| RAWI2 | 5.348±0.615b | 4.651±0.511ab | 4.661±1.090ab | 4.553±0.741ab | 4.107±0.824a | 4.549±0.618ab | 4.111±0.242a |
| RAWI4 | 5.942±0.940c | 4.598±0.517ab | 4.242±0.744ab | 4.609±0.941ab | 4.611±0.819ab | 4.974±0.997bc | 3.655±0.513a |
| HcL% | 0.546±0.034b | 0.513±0.019ab | 0.485±0.029a | 0.508±0.042ab | 0.510±80.052ab | 0.529±0.047ab | 0.520±0.010ab |
| 注: 不同群体标有相同字母表示它们之间无显著性差异(P > 0.05), 标有不同字母表示有显著性差异(P < 0.05) | |||||||
多元统计分析方法具有适用范围广、分析精准等特点, 广泛应用于头足类的物种鉴定及群体形态差异研究(Sin et al, 2009; Liao et al, 2010; 高晓蕾等, 2019; 霍莉莉等, 2021; 李嘉华等, 2022)。主成分分析能够将多个测量数据降维、转换为新的综合指标, 分析结果可以反映群体间的主要形态差异(魏源博等, 2021)。使用主成分分析法分析形态差异时, 累积贡献率可以根据样本容量的大小来调整(Voss et al, 1990)。本研究中雌、雄群体的主成分累计贡献率均较低, 这可能与该种类具有近海洄游的习性及群体间地理隔离不完全等因素有关。雌、雄群体的散点图均显示各群体间的形态差异较小(图 3, 图 4)。聚类分析和单因素方差均表明各群体的形态测量指标无显著差异。雌、雄群体的判别分析结果基本一致, 综合判别准确率均较低, 表明各群体的形态差异不显著, 判别分析不能根据形态差异做出准确分析。此外, 南通雌性和雄性群体的判别率均较低, 这可能是由于其独特的地理位置导致的。南通地处长江入海口北部, 易受到夏秋季长江冲淡水北支的影响, 中国台湾暖流、黄海暖流和东海沿岸流分别沿海岸线流动, 水文条件复杂, 促进了杜氏枪鱿幼体和成体的扩散, 增加了南通和其他群体间基因交流的概率(Wu et al, 2014; 何利军等, 2021)。
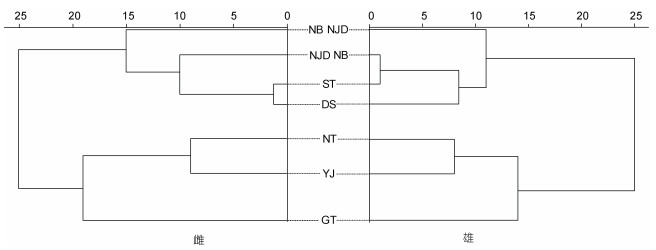 |
| 图 5 杜氏枪鱿7个地理群体聚类图 Fig. 5 Diagram of cluster analysis of seven geographic populations of U. duvaucelii |
枪鱿吸盘上具角质环, 不同种类的角质环上小齿的齿形和齿数存在差异, 性成熟个体小齿的形态和齿数较稳定, 是分类鉴别的重要特征(董正之, 1988; 卢重成等, 2017)。第三腕角质环齿数在泰国湾雄性样品(7个)与其他群体样品(11~15个)间存在较大差异。采用扫描电镜技术对泰国湾和阳江群体的齿舌进行观察和比较分析, 发现其齿舌的形态和大小也具有明显差异(图 2, 表 3)。泰国湾为半封闭水域, 位于太平洋最西端, 地理位置特殊, 不易受到表层海流以及沿岸流的影响, 特殊的环境因素和地理条件可能阻碍该地区杜氏枪鱿群体与其他群体的基因交流, 使其在形态上向着独立的方向进化, 导致形态产生差异(李立, 2014)。其余6个群体间形态特征无显著差异, 可能是由于中国沿岸流(东海表层环流、东海沿岸流和南海表层流等)作用使得群体间能够频繁进行基因交流, 无形态差异产生(Chao, 1990; Fang et al, 2005; 何利军等, 2021)。
4 结论本研究基于形态学观察和多元统计分析方法分析了南通、宁波、南麂岛、东山、汕头、阳江和泰国湾的杜氏枪鱿群体的形态差异。结果表明, 泰国湾群体与其他6个群体形态差异显著, 主要差异在于雄性第三腕大吸盘角质环齿数和齿舌形态, 是否由环境因素还是遗传变异导致的, 尚需深入研究。本研究为杜氏枪鱿的分类鉴定和多样性保护提供了形态学数据参考。
致谢 中国海洋大学渔业海洋学实验室博士研究生郭建忠和硕士研究生李志新提供样品, 中国海洋大学贝类遗传育种研究室硕士研究生王丽华和黄俊杭协助实验, 谨致谢忱。
方舟, 金岳, 胡飞飞, 等, 2018. 南海北部秋季杜氏枪乌贼角质颚形态和生长特征. 南方水产科学, 14(4): 17-26 DOI:10.3969/j.issn.2095-0780.2018.04.003 |
卢重成, 钟文松, 2017. 台湾产头足类动物图鉴. 台中, 中国: 自然科学博物馆, 240-243
|
李立, 2014. 中国海和泰国湾海域海平面的经向涛动. 海洋学报, 36(9): 7-17 DOI:10.3969/j.issn.0253-4193.2014.09.002 |
李嘉华, 陈舜, 陈万东, 等, 2022. 南麂列岛中华蛸(Octopus sinensis)形态与遗传多样性分析. 海洋与湖沼, 53(2): 486-495 |
何利军, 任慧敏, 许莎莎, 等, 2021. 印度洋-西太平洋海洋动物谱系地理演化格局. 海洋与湖沼, 52(2): 468-486 |
郑小东, 林祥志, 王昭凯, 等, 2009. 中国东南沿海8种蛸的齿舌形态学研究. 水生生物学报, 33(6): 1210-1213 |
高晓蕾, 许然, 张志新, 等, 2019. 中国沿海长蛸群体形态性状的差异. 水产学报, 43(7): 1593-1602 |
霍莉莉, 南泽, 侯纯强, 等, 2021. 黄渤海长蛸群体的形态多样性研究. 中国海洋大学学报, 51(S1): 146-153 |
魏源博, 张桂蓉, 李雷, 等, 2021. 雅鲁藏布江异齿裂腹鱼不同群体的形态差异. 华中农业大学学报, 40(3): 238-247 |
ANDERSON F E, BERGMAN A, CHENG S H, et al, 2014. Lights out: the evolution of bacterial bioluminescence in Loliginidae. Hydrobiologia, 725(1): 189-203 DOI:10.1007/s10750-013-1599-1 |
BRZESKI V J, DOYLE R W, 1988. A morphometric criterion for sex discrimination in tilapia [M] // PULLIN R S V, BHUKASWAN T, TONGUTHAI K, et al. The Second International Symposium on Tilapia in Aquaculture. Manila: ICLARM Conference Proceedings: 439-444.
|
CARVALHO G R, NIGMATULLIN C M, 1998. Stock structure analysis and species identification [M] // RODHOUSE P G, O'DOR R. Illex Recruitment Dynamics. Rome: FAO: 199-232.
|
CHAO S Y, 1990. Circulation of the East China Sea, a numerical study. Journal of Oceanography, 46(6): 273-295 DOI:10.1007/BF02123503 |
DE LUNA SALES J B, SHAW P W, HAIMOVICI M, et al, 2013. New molecular phylogeny of the squids of the family Loliginidae with emphasis on the genus Doryteuthis Naef, 1912: mitochondrial and nuclear sequences indicate the presence of cryptic species in the southern Atlantic Ocean. Molecular Phylogenetics and Evolution, 68(2): 293-299 DOI:10.1016/j.ympev.2013.03.027 |
FANG G H, SUSANTO D, SOESILO I, et al, 2005. A note on the South China Sea shallow interocean circulation. Advances in Atmospheric Sciences, 22(6): 946-954 DOI:10.1007/BF02918693 |
JEREB P, ROPER C F E, 2010. Cephalopods of the world. an annotated and illustrated catalogue of cephalopod species known to date. Vol. 2. Myopsid and Oegopsid squids [R]. Rome: Food and Agriculture Organization of the United Nations: 108-109.
|
KANG L S, ZHANG S Y, WU C W, et al, 2018. Molecular phylogeny of Loliginidae inferred from mitochondrial DNA sequence variation. Mitochondrial DNA Part A, 29(4): 600-605 DOI:10.1080/24701394.2017.1325482 |
KARNIK N S, CHAKRABORTY S K, 2001. Length-weight relationship and morphometric study on the squid Loligo duvauceli (d'Orbigny) (Mollusca/Cephalopoda) off Mumbai (Bombay) waters, west coast of India. Indian Journal of Marine Sciences, 30(4): 261-263 |
KHATAMI S, TAVAKOLI-KOLOUR P, VALINASSAB T, et al, 2018. Molecular identification and phylogenetic relationships of Coleoidea (Mollusca: Cephalopoda) from the Persian Gulf and Oman Sea reveals a case of cryptic diversity. Molluscan Research, 38(2): 77-85 DOI:10.1080/13235818.2017.1381062 |
LIAO C H, LIU T Y, HUNG C Y, 2010. Morphometric variation between the swordtip (Photololigo edulis) and mitre (P. chinensis) squids in the waters off Taiwan. Journal of Marine Science and Technology, 18(3): 405-412 |
MISHRA A S, NAUTIYAL P, SOMVANSHI V S, 2012. Length-weight relationship, condition factor and sex ratio of Uroteuthis (Photololigo) duvaucelii (d'Orbigny, 1848) from Goa, west coast of India. Journal of the Marine Biological Association of India, 54(2): 65-68 |
MOHAMED K S, 1996. Estimates of growth, mortality and stock of the Indian squid Loligo duvauceli Orbigny, exploited off Mangalore, southwest coast of India. Bulletin of Marine Science, 58(2): 393-403 |
ROPER C F E, VOSS G L, 1983. Guidelines for taxonomic descriptions of cephalopod species. Memoirs of the National Museum Victoria, 44: 49-63 |
SABRAH M M, EL-SAYED A Y, EL-GANINY A A, 2015. Fishery and population characteristics of the Indian squids Loligo duvauceli Orbigny, 1848 from trawl survey along the north-west Red Sea. The Egyptian Journal of Aquatic Research, 41(3): 279-285 DOI:10.1016/j.ejar.2015.07.003 |
SIN Y W, YAU C, CHU K H, 2009. Morphological and genetic differentiation of two loliginid squids, Uroteuthis (Photololigo) chinensis and Uroteuthis (Photololigo) edulis (Cephalopoda: Loliginidae), in Asia. Journal of Experimental Marine Biology and Ecology, 369(1): 22-30 DOI:10.1016/j.jembe.2008.10.029 |
VOSS R S, MARCUS L F, ESCALANTE P P, 1990. Morphological evolution in muroid rodents I. Conservative patterns of craniometric covariance and their ontogenetic basis in the neotropical genus Zygodontomys. Evolution, 44(6): 1568-1587 DOI:10.1111/j.1558-5646.1990.tb03847.x |
WU H, SHEN J, ZHU J R, et al, 2014. Characteristics of the Changjiang plume and its extension along the Jiangsu Coast. Continental Shelf Research, 76: 108-123 DOI:10.1016/j.csr.2014.01.007 |
YOUNG R E, MICHAEL V, KATHARINA M, 2019. Cephalopoda Cuvier 1797. Octopods, squids, nautiluses, etc. http://tolweb.org/Cephalopoda/19386/2019.03.26 in The Tree of Life Web Project [EB/OL]. http://tolweb.org/.
|
 2022, Vol. 53
2022, Vol. 53