中国海洋湖沼学会主办。
文章信息
- 钟雨霞, 俞志明, 刘姗姗, 曹西华, 宋秀贤. 2022.
- ZHONG Yu-Xia, YU Zhi-Ming, LIU Shan-Shan, CAO Xi-Hua, SONG Xiu-Xian. 2022.
- 芽孢杆菌(Bacillus)及其复合粘土对典型赤潮生物的去除作用研究
- REMOVAL EFFECT OF TYPICAL RED TIDE ORGANISMS WITH BACILLUS AND MICROBIAL MODIFIED CLAY
- 海洋与湖沼, 53(5): 1089-1097
- Oceanologia et Limnologia Sinica, 53(5): 1089-1097.
- http://dx.doi.org/10.11693/hyhz20220100015
文章历史
-
收稿日期:2022-01-20
收修改稿日期:2022-03-22
2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 山东青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 山东青岛 266071
2. Laboratory of Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
赤潮是指由于海洋中微型浮游生物快速增殖或聚集, 导致生态系统结构与功能破坏的一种生态异常现象(俞志明等, 2019)474。赤潮暴发会破坏近海生态环境, 造成水产养殖业巨大损失, 严重制约海洋经济发展(Wang et al, 2021; Zingone et al, 2021)。2012年在福建沿海发生了以米氏凯伦藻为优势种的有毒赤潮, 导致大量养殖鲍鱼死亡, 直接经济损失达20亿元, 成为我国赤潮灾害有记录以来造成经济损失最严重的一次近海赤潮(李雪丁, 2021)。随着全球气候变暖、近海富营养化加剧, 有害赤潮呈现全球扩张态势, 危害范围、程度逐年增加(Fu et al, 2008; 于仁成等, 2016; Gu et al, 2021)。因此, 寻求更有效、更安全的赤潮治理方法愈显重要。
目前, 有害赤潮常见的治理方法主要分为物理、化学、生物等方法(Prasath et al, 2021)。其中, 利用溶藻细菌防治赤潮是一个研究热点(Jeong, 2019)。近年来, 报道具有溶藻作用的细菌主要包括交替单胞菌(Alteromonas)(Shi et al, 2018)72、假交替单胞菌(Pseudoalteromonas)(Lyu et al, 2019)、弧菌(Vibrio) (Zhang et al, 2014)、芽孢杆菌(Bedoshvili et al, 2021)等。其中, 芽孢杆菌相较于其他溶藻细菌, 不仅具备能形成芽孢、稳定性高等优点, 而且具有改善水质、提高水产动物免疫力等作用, 已经被广泛应用于水产养殖微生态制剂(蔡红丹等, 2021; 雷新雨等, 2021)。由此可见, 芽孢杆菌具有除藻、改善水质的双重作用, 有望作为有益除藻菌被应用于赤潮治理中。但是, 迄今为止有关芽孢杆菌对有害赤潮生物的去除作用研究鲜有报道。
改性粘土治理赤潮技术主要是利用粘土颗粒与赤潮生物间的絮凝作用, 使赤潮生物沉降至水底、失活, 从而达到消除赤潮的目的(俞志明等, 2019)480。该技术具有治理效率高、成本低、应急性强、环境友好等优点, 被广泛应用于近海赤潮治理(Yu et al, 2017)。如果能将应急性强的改性粘土方法与具有除藻、改善水质双重作用的芽孢杆菌联合使用, 发挥各自的优点, 有望开发出更具特色的赤潮治理技术。为此, 本文研究了几种常见芽孢杆菌对近海典型赤潮生物的去除作用, 筛选出去除赤潮生物效果较好的解淀粉芽孢杆菌, 尝试将其与粘土进行复合, 探讨了该复合体系对典型赤潮生物的去除作用与主要影响因素, 为进一步发展和优化改性粘土治理赤潮技术体系提供了重要参考。
1 材料与方法 1.1 实验材料本研究所用的高岭土购自印度尼西亚BINTANG PUSPITA BUMIDWIPA公司, 蒙脱土、膨润土购买自阿拉丁公司。
实验所用我国近海典型赤潮生物种东海原甲藻、赤潮异弯藻和米氏凯伦藻, 均取自中国科学院海洋生态与环境科学重点实验室赤潮藻种库。将指数生长期的藻液分别接种在L1培养基中, 在(20±1) ℃、光照强度为72 μmol photons/(m2·s)、光暗比12 h︰12 h的条件下培养。
本研究所用的芽孢杆菌均来自青岛根源生物技术有限公司, 为固体粉末态。称取0.1 g/L菌粉经LB液体培养基培养24 h后, 利用LB固体培养基平板划线分离纯化并进行鉴定, 得到4株纯化后的芽孢杆菌, 分别为枯草芽孢杆菌(Bacillus subtilis)、短小芽孢杆菌(Bacillus pumilus)、蜡样芽孢杆菌(Bacillus cereus)和解淀粉芽孢杆菌(表 1)。用LB液体培养基培养上述获得的芽孢杆菌, 接种量为106 cells/mL, 于恒温震荡培养箱中(30 ℃, 200 r/min)培养24 h生长至稳定期, 用于实验。
| 编号 | 最接近的属 | 相似度 | 最接近的种 | 相似度 |
| A | Bacillus sp. KY264972.1 |
100% | Bacillus subtilis MT240918.1 |
100% |
| B | Bacillus sp. MK213183.1 |
100% | Bacillus pumilus MN581181.1 |
100% |
| C | Bacillus sp. KJ943910.1 |
99.90% | Bacillus cereus MW559383.1 |
100% |
| D | Bacillus sp. MH298776.1 |
99.90% | Bacillus amyloliquefaciens MH210892.1 |
99.90% |
称取一定质量的粘土于250 mL锥形瓶中, 利用高压蒸汽锅在121 ℃下灭菌30 min后, 置于紫外灯下灭菌20 min, 冷却至室温。在LB液体培养基中加入无菌粘土, 配制成每升含有25 g粘土的新的培养基, 接种芽孢杆菌, 其初始密度为106 cells/mL, 置于恒温震荡培养箱(30 ℃, 200 r/min)中震荡培养(熟化)一定时间, 得到微生物复合粘土。
按照上述方法, 分别制备出不同种类粘土(高岭土、蒙脱土、膨润土)的微生物复合粘土, 以及不同熟化时间(0、8、12、24 h)的微生物复合粘土。
1.2.2 微生物及其复合粘土去除赤潮生物实验(1) 赤潮生物去除率的计算方法
赤潮生物去除实验主要是将一定量的除藻材料(微生物、微生物复合粘土等)添加到赤潮藻液中, 处理一定时间后观察添加除藻材料前后上层藻液中藻细胞密度的变化, 其对赤潮生物的去除作用通常用去除率表示(刘姗姗等, 2021)1171:
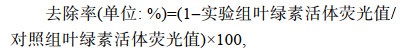 (1)
(1)(2) 微生物除藻实验
不同芽孢杆菌除藻实验: 取50 mL指数生长中后期的东海原甲藻藻液于50 mL比色管中, 实验所用藻密度见表 2。实验分为对照组与实验组, 每组设置3个平行; 在实验组中加入生长稳定期的芽孢杆菌发酵液, 使其在藻液中的密度分别为2、3、4×106 cells/mL, 颠倒混匀后, 置于常规培养条件下静置培养, 于24 h取样, 测定叶绿素活体荧光值, 计算去除率。
| 赤潮生物 | 初始藻密度/(cells/mL) |
| 东海原甲藻 | 1×105 |
| 米氏凯伦藻 | 5×104 |
| 赤潮异弯藻 | 1×105 |
解淀粉芽孢杆菌对不同赤潮生物的去除实验: 取50 mL指数生长中后期的藻液于50 mL比色管中, 实验所用赤潮生物种类及对应藻密度见表 2。实验分为对照组与实验组, 每组设置3个平行; 在实验组中加入生长稳定期的解淀粉芽孢杆菌发酵液, 使其在藻液中的密度为106 cells/mL, 颠倒混匀后, 置于常规培养条件下静置培养, 于24、36、48 h取样, 测定叶绿素活体荧光值, 计算去除率。
菌体、发酵上清液和培养基对赤潮生物的去除实验: 将生长稳定期(菌密度约为5×108 cells/mL)芽孢杆菌发酵液离心(3 824×g, 10 min)得到沉淀和上清液: 将沉淀用无菌生理盐水洗涤3次, 最后等体积重悬, 得到菌体; 将上清液用0.22 µm的针头滤膜过滤3次得到无菌发酵上清液。取50 mL处于指数生长期中后期的藻液置于比色管中, 实验所用赤潮生物种类及对应藻密度见表 2。实验分为对照组和实验组, 每组设3个平行; 在实验组中分别加入发酵液、菌体及发酵上清液(发酵上清液添加体积与发酵液添加体积相同), 在发酵液和菌体实验组中, 解淀粉芽孢杆菌在藻液中的密度为106 cells/mL, 颠倒混匀后, 置于常规培养条件下静置培养, 于24 h取样, 测定叶绿素活体荧光值, 计算去除率。
(3) 微生物复合粘土除藻实验
取50 mL指数生长中后期的东海原甲藻藻液于50 mL比色管中, 实验所用藻密度见表 2。实验分为对照组与实验组, 每组设置3个平行; 实验组分别加入一定量的微生物复合粘土、未添加粘土的微生物(与微生物复合粘土悬浊液添加体积相同)、高岭土(与微生物复合粘土添加粘土浓度相同), 颠倒混匀后, 置于常规培养条件下静置培养, 于24 h取样, 测定叶绿素活体荧光值, 计算去除率。
1.2.3 解淀粉芽孢杆菌对赤潮藻细胞裂解的影响取1 mL指数生长中后期的藻液(实验用藻同1.2.2节)于24孔板中, 加入一定体积生长稳定期的解淀粉芽孢杆菌发酵液, 使解淀粉芽孢杆菌在藻液中的密度为106 cells/mL, 混匀后静置培养, 于不同时间点用倒置显微镜观察芽孢杆菌对赤潮藻细胞裂解的影响。
1.3 细菌计数方法微生物除藻实验: 采用流式细胞仪(BD FACS Calibur, 美国)进行测定。用SYBR Green I染色剂(体积比1︰10 000)染色样品, 避光放置15 min后, 使用流式细胞仪进行检测, 依据前向散射信号(forward scatter, FSC)、侧向散射信号(side scatter, SSC)、DNA与SYBR Green I结合后经激发所产生的绿色荧光信号(FL1, 波长为515~545 nm)等参数, 利用绝对计数管(BD Trucount tubes, 美国)确定细菌密度。
微生物复合粘土除藻实验: 均采用稀释涂布平板法计算细菌密度。吸取发酵液(微生物复合粘土组、未添加粘土的微生物组) 1 mL, 加入到9 mL无菌生理盐水中, 在涡旋振荡器上震荡5 s, 得到10−1稀释液, 再从10−1稀释液中取1 mL, 加入到9 mL无菌生理盐水中, 得到10−2稀释液, 诸如此类, 稀释至10−6、10−7, 取10−6、10−7稀释倍数的稀释液0.1 mL涂布到LB固体平板上, 放置于30 ℃恒温培养箱中, 培养1 d, 至清晰菌落长出, 计算菌落数目。
1.4 数据分析利用FlowJo10.6.2软件进行细菌数量的读取和分析, 运用Excel和Origin 2019对数据进行处理及绘图。使用SPSS 26软件ANOVA、LSD功能对数据进行方差分析, 对各实验与对照组均值之间的差异性进行显著性检验, 结果表示为平均值±标准偏差。
2 结果 2.1 芽孢杆菌对典型赤潮生物的去除作用 2.1.1 不同芽孢杆菌对东海原甲藻的去除作用本文选用4株水产养殖常用的芽孢杆菌, 考察了不同密度芽孢杆菌对东海原甲藻的去除作用。结果表明, 4株芽孢杆菌都对东海原甲藻具有一定去除作用, 且随着芽孢杆菌添加量的增加, 去除作用加强(图 1)。其中, 解淀粉芽孢杆菌的去除作用最强; 相同添加密度下, 其去除率显著高于其他3株芽孢杆菌(P<0.05)。随着解淀粉芽孢杆菌添加量的增加, 去除作用增强: 当添加量约为2×106 cells/mL时, 添加24 h后的去除率为40%左右; 当添加量增加至4×106 cells/mL时, 去除率升至60%。因此, 本文以解淀粉芽孢杆菌为实验对象, 进一步研究了其对其他赤潮生物(赤潮异弯藻和米氏凯伦藻)的去除作用。
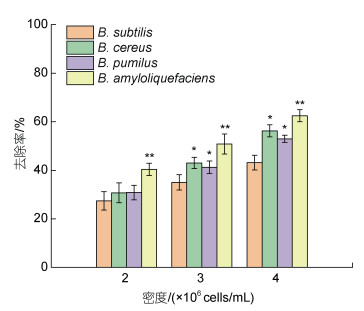 |
| 图 1 4株芽孢杆菌对东海原甲藻的去除率(24 h) Fig. 1 Removal efficiency of 4 different strains of Bacillus on P. donghaiense (24 h) |
(1) 解淀粉芽孢杆菌对不同赤潮生物的去除率
当解淀粉芽孢杆菌添加量为106 cells/mL, 24 h后对米氏凯伦藻、赤潮异弯藻和东海原甲藻的去除率分别为80%、60%和40% (图 2), 48 h后对米氏凯伦藻和对赤潮异弯藻的去除率达到90%, 而对东海原甲藻的去除率仅为70%左右。由此可见, 相同添加量下, 解淀粉芽孢杆菌对赤潮异弯藻和米氏凯伦藻的去除率高于东海原甲藻。
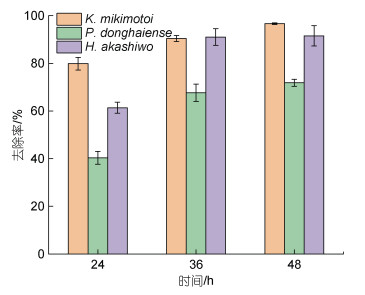 |
| 图 2 解淀粉芽孢杆菌发酵液对不同赤潮生物的去除率 Fig. 2 Removal efficiency of B. amyloliquefaciens fermentation broth on different algae 注: 解淀粉芽孢杆菌的添加量为106 cells/mL |
(2) 解淀粉芽孢杆菌对赤潮生物细胞作用的显微观察
不同赤潮生物细胞在解淀粉芽孢杆菌作用下的形态变化如图 3所示。实验组在菌密度为106 cells/mL处理24 h后, 赤潮生物细胞的细胞膜遭到破坏, 细胞变形、裂解, 内容物流出(图 3a, 3b), 与对照组赤潮生物细胞形态结构完整形成了鲜明对比。显微镜观察发现, 发酵液处理24 h后, 约50%赤潮异弯藻和米氏凯伦藻的藻细胞裂解, 视野中细菌数量明显增加; 而在东海原甲藻实验组中, 虽然也观察到细菌数量明显增加, 但仅有大约30%的藻细胞裂解, 大部分藻细胞出现“脱壳”现象, 观察到大量只有细胞壁的空壳(图 3c)。本研究首次发现芽孢杆菌能够使东海原甲藻细胞出现“脱壳”现象, 其主要原因可能是解淀粉芽孢杆菌破坏了东海原甲藻的巨胞生长带(megacytic growth band)。由于巨胞生长带位于东海原甲藻的两个主板之间, 是细胞生长分裂的区域(Shi et al, 2018)77, 由此导致内容物流出, 留下细胞壁碎片, 形成“空壳”。
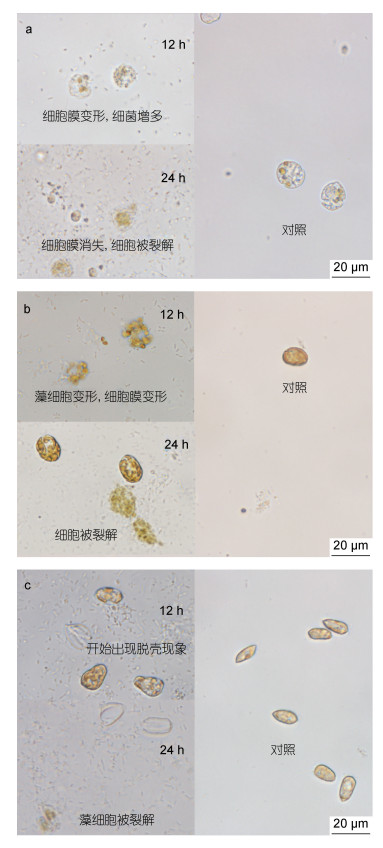 |
| 图 3 添加解淀粉芽孢杆菌发酵液后对赤潮藻细胞裂解的影响 Fig. 3 Effects of algae cell lysis after adding B. amyloliquefaciens fermentation broth 注: a. K. mikimotoi; b. H. akashiwo; c. P. donghaiense |
(3) 菌体、发酵上清液和培养基对赤潮生物的去除作用辨析
解淀粉芽孢杆菌发酵液包含了菌体、培养基和细菌分泌物等多种组分, 为了辨析该发酵液中的主要除藻组分, 本文分别研究了解淀粉芽孢杆菌的发酵液、菌体、发酵上清液和培养基等各组分对赤潮生物的去除作用。将各组分分别添加至赤潮藻液24 h, 结果如图 4所示: 发酵液对东海原甲藻去除率为40%, 其中贡献较大的是滤液, 达到34%, 菌体和培养基对藻细胞的去除作用相对较弱。该现象在米氏凯伦藻和赤潮异弯藻实验中更加明显: 发酵液对米氏凯伦藻和赤潮异弯藻的去除率分别为88%、67%, 其中滤液的去除率分别达到86%和60%。由此可见, 发酵液的主要除藻作用来自于滤液, 而滤液主要由培养基和细菌分泌物组成, 在本实验条件下前者的去除作用不明显, 因此可以推断细菌分泌物应是发酵液去除赤潮生物的主要有效组分。
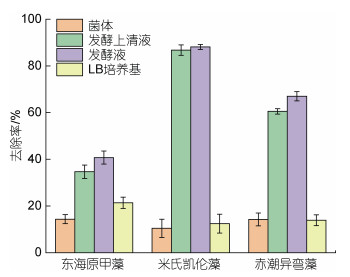 |
| 图 4 不同处理组对赤潮生物的去除率(24 h) Fig. 4 Removal efficiency of different treatments on different algae (24 h) 注: 添加5×108 cells/mL的解淀粉芽孢杆菌发酵液150 µL, 实验所用藻液体积为50 mL |
将粘土与解淀粉芽孢杆菌按照1.2.1节制备成微生物复合粘土, 其对东海原甲藻的去除作用如图 5所示。结果表明, 解淀粉芽孢杆菌与高岭土复合后能显著提升其去除率(P<0.05), 与仅添加微生物、粘土处理组相比, 去除率分别提升5%~20%、37%~54%; 且在较低的添加浓度下, 微生物复合粘土的提升作用更明显。为进一步探讨微生物复合粘土去除率提高的原因, 对解淀粉芽孢杆菌在微生物复合粘土悬浊液中的密度进行测定。结果如表 3所示, 解淀粉芽孢杆菌与高岭土复合熟化24 h后, 其细菌密度是未添加粘土组细菌密度的2倍, 说明高岭土有效促进了解淀粉芽孢杆菌的生长, 进而提升了对东海原甲藻的去除作用。
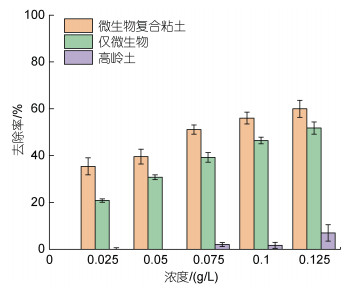 |
| 图 5 微生物与粘土复合前后对东海原甲藻的去除率(24 h) Fig. 5 Removal efficiency of B. amyloliquefaciens on P. donghaiense before and after adding clay (24 h) |
| 添加体积/µL | 微生物组 | 微生物复合粘土组 |
| 菌密度 /(×106 cells/mL) |
菌密度 /(×106 cells/mL) |
|
| 50 | 0.65 | 1.30 |
| 100 | 1.30 | 2.65 |
| 150 | 1.95 | 3.97 |
| 200 | 2.60 | 5.29 |
| 250 | 3.25 | 6.62 |
| 注: 菌密度指添加到藻液后解淀粉芽孢杆菌密度, 实验所用藻液体积为50 mL | ||
由于粘土种类及熟化时间可能影响微生物复合粘土对赤潮生物的去除作用, 本文分别考察了不同种类粘土及熟化时间对微生物复合粘土去除赤潮生物的影响(图 6)。
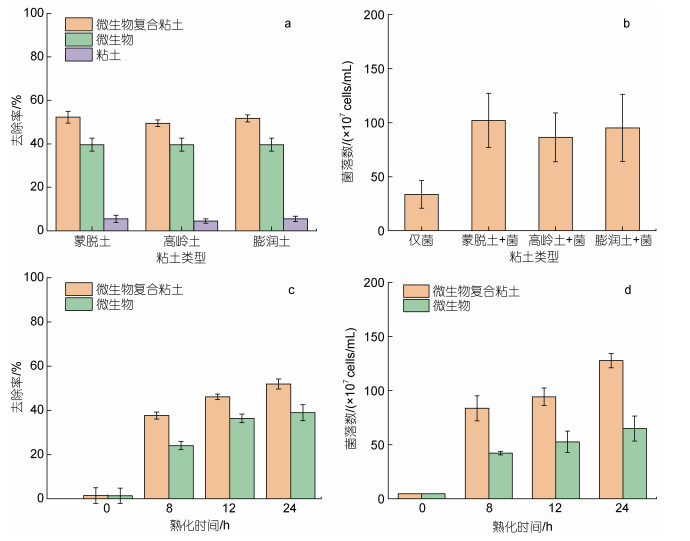 |
| 图 6 不同粘土种类与熟化时间对东海原甲藻去除率的影响(24 h) Fig. 6 Effects of different clay and incubation time on removal efficiency of P. donghaiense (24 h) 注: a. 解淀粉芽孢杆菌与不同类型粘土熟化24 h对东海原甲藻的去除率(24 h); b. 与不同类型粘土熟化24 h后的微生物密度; c. 与高岭土熟化不同时间对东海原甲藻的去除率(24 h); d. 与高岭土熟化不同时间后的微生物密度(添加到藻液中的粘土浓度0.075 g/L) |
如图 6a所示, 改变微生物复合粘土中的粘土种类(蒙脱土、高岭土、膨润土)对其去除东海原甲藻的影响不大, 去除率均为50%左右。前面(2.2.1)实验结果表明, 高岭土能够有效促进解淀粉芽孢杆菌的生长, 图 6b的结果进一步证明其他种类的粘土也具有这种促进作用, 该促进作用与实验选用的粘土种类差别不大。
选取实验室常用的粘土材料高岭土, 进一步研究了微生物复合粘土不同熟化时间对去除赤潮生物的影响。结果显示随着熟化时间的增加, 微生物复合粘土的去除率也随之增加; 熟化时间为24 h时, 添加0.075 g/L微生物复合粘土的去除率达到51.93% (图 6c)。与此同时, 测定了不同熟化时间微生物复合粘土悬浊液与未加粘土组微生物悬浊液中芽孢杆菌的密度, 结果如图 6d所示: 熟化时间为8 h时微生物复合粘土组的细菌密度约为8.3×108 cells/mL, 而未加粘土组微生物悬浊液的细菌密度约4.2×108 cells/mL; 当熟化时间为24 h时, 细菌密度达到本实验范围中的最大值, 微生物复合粘土组悬浊液的细菌密度约为1.28×109 cells/mL, 未加粘土组微生物悬浊液中的细菌密度约为6.5×108 cells/mL。上述结果进一步表明, 粘土可以显著提升解淀粉芽孢杆菌的生物量(P<0.05), 这也是导致微生物复合粘土随着熟化时间增加, 去除率提高的主要原因。
3 讨论 3.1 芽孢杆菌去除赤潮生物的机制分析前期研究曾表明芽孢杆菌是一类具有溶藻功能的细菌。例如, 程捷(2021)研究发现赖氨酸芽孢杆菌(Lysinibacillus fusiformis)通过分泌小分子代谢物质来裂解铜绿微囊藻(Microcystis aeruginosa)藻细胞, Chen等(2021)发现芽孢杆菌B1分泌的次黄嘌呤能够造成赤潮异弯藻产生氧化应激, 使得藻细胞膜脂质过氧化, 导致藻细胞死亡。但是有关解淀粉芽孢杆菌对有害藻赤潮生物的除藻效果及作用机理尚未见有研究报道。
通常, 溶藻细菌可通过直接作用和间接作用两种方式抑制藻细胞的生长。直接作用是指细菌直接攻击藻细胞, 使藻细胞裂解死亡(Imai et al, 2021)。比如荧光假单胞菌(Pseudomonas fluorescens)粘附在硅藻类的冠盘藻(Stephanodiscus hantzschii)细胞壁上, 侵蚀其细胞壁, 使其裂解失活(Jung et al, 2008)。间接作用是指细菌通过营养竞争、群体感应(Quorum sensing)、分泌胞外产物等方式来抑制藻细胞生长或者裂解藻细胞(Meyer et al, 2017)883。目前发现的大部分细菌的溶藻方式是通过分泌胞外活性物质产生溶藻作用, 这些胞外活性物质的结构多种多样: 从极性来看, 涵盖了从极性很高的氨基酸衍生物到极性较低的脂肪酸; 从分子量来看, 有分子量在500 g/mol以下的小分子代谢物、中等分子量物质类似肽、还有类似酶这种kDa以上的大分子类物质, 其复杂的结构使得分析某类细菌具体起作用的溶藻物质十分困难(Meyer et al, 2017)887。迄今研究发现, 溶藻细菌分泌的溶藻活性物质主要包括生物碱类、酶类、氨基酸衍生物、多肽蛋白质类、聚酮化合物类等。不同的活性物质导致藻细胞死亡的作用方式也不同(Mayali et al, 2008; Zheng et al, 2013; Zhang et al, 2016), 目前大部分的研究都将这些胞外活性物质产生的溶藻作用归为间接作用。
本研究发现解淀粉芽孢杆菌的滤液在去除赤潮生物中发挥了主要作用, 说明解淀粉芽孢杆菌去除赤潮生物以间接作用为主, 可能是解淀粉芽孢杆菌的代谢物质导致典型赤潮生物的死亡。王继华等(2017)的研究结果表明, 解淀粉芽孢杆菌在生长代谢过程能够产生多种代谢物质, 比如抗菌蛋白、脂肽类、磷脂类、多烯类、氨基酸类和聚酮化合物等, 这些分泌物质具有抗菌作用。本研究结果进一步表明, 这些分泌物质除了抗菌作用外, 还具有去除赤潮生物的作用。由于解淀粉芽孢杆菌广泛存在于自然海域, 易于培养和生产, 所以被广泛应用于抑菌剂及水产养殖等相关领域(张维娜等, 2017; Woldemariamyohannes et al, 2020)。本研究结果表明其在赤潮防控方面也可发挥重要作用, 进一步提升和拓展了芽孢杆菌的生态价值和环保功能, 具有重要的意义。
3.2 芽孢杆菌复合粘土去除赤潮生物的机制分析如前所述, 利用溶藻细菌控制有害赤潮是目前人们关注的一个研究热点(石新国, 2021)。尽管已取得很多进展, 但在实际应用中仍存在效率低、时效长、难以大规模应用等问题(刘萍等, 2016)。因此, 与其他除藻技术联合使用、优势互补是解决上述问题的重要途径。粘土絮凝法是一种利用絮凝沉降原理快速去除水体中赤潮生物的方法, 而溶藻细菌治理赤潮只能依靠其自然沉降。如果将粘土方法与溶藻细菌相结合, 从原理上讲可优势互补, 能够解决单独使用溶藻细菌时存在的问题。
本研究结果证明了两者结合的可能性和可行性, 并且发现随着熟化时间的增加, 溶藻细菌生物量增加, 其去除率也提高, 微生物复合粘土的去除率与微生物密度呈正相关关系(图 7)。
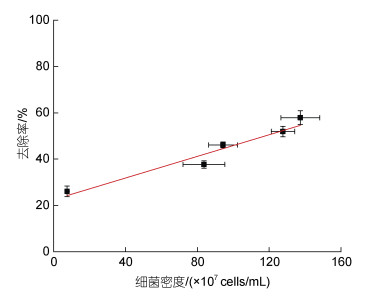 |
| 图 7 微生物复合粘土对东海原甲藻的去除率与微生物复合粘土中细菌密度的相关性 Fig. 7 Relationship between bacterial density in microbial modified clay and removal efficiency of microbial modified clay on P. donghaiense |
我们前期对EM菌的研究表明, 无机改性粘土能局部富集EM菌及其分泌的溶藻物质, 提升该菌的局部密度, 从而增强EM菌对东海原甲藻的去除作用(刘姗姗等, 2021)1178。与之类似, 本研究所使用的微生物复合粘土一方面通过粘土颗粒的絮凝作用聚集更多的赤潮藻细胞、快速沉降; 另一方面, 粘土颗粒通过与芽孢杆菌熟化、培养, 表面富集了大量芽孢杆菌, 显著增强了对赤潮生物细胞的破坏作用。由此可见, 解淀粉芽孢杆菌复合粘土通过促进芽孢杆菌生长、富集赤潮生物、提升局部灭藻效果是其展现较高去除率的主要原因。此外, 微生物与粘土复合后能提升对有机物的降解能力, 加速对碳氢化合物的有效降解(Sarkar et al, 2012; Biswas et al, 2017), 对赤潮发生后导致有机质较高的恶劣环境具有较好的改善作用。由此可见, 微生物复合粘土是对我们前期提出的改性粘土治理赤潮技术的进一步拓展, 具有显著而广阔的发展前景。
4 结论(1) 解淀粉芽孢杆菌可以通过代谢产物破坏典型赤潮生物的细胞壁和细胞膜, 导致赤潮藻细胞内容物流出、藻细胞死亡, 从而对赤潮生物产生去除作用。研究结果表明, 解淀粉芽孢杆菌对米氏凯伦藻和赤潮异弯藻的去除效果高于东海原甲藻。
(2) 解淀粉芽孢杆菌与高岭土复合后, 其生物量比未添加粘土组明显增加。在此基础上制备的解淀粉芽孢杆菌复合粘土对东海原甲藻的去除效果明显提升, 主要是由于该复合粘土可以促进芽孢杆菌生长、富集赤潮生物、提升局部灭藻效果所致。
于仁成, 刘东艳, 2016. 我国近海藻华灾害现状、演变趋势与应对策略. 中国科学院院刊, 31(10): 1167-1174 |
王继华, 徐世强, 张木清, 2017. 解淀粉芽孢杆菌的研究进展. 亚热带农业研究, 13(3): 191-195 |
石新国, 李悦, 肖宇淳, 等, 2021. 中肋骨条藻高效溶藻菌FDHY-C3的分离鉴定及溶藻作用研究. 海洋环境科学, 40(1): 114-121 |
刘姗姗, 俞志明, 宋秀贤, 等, 2021. 微生物复合改性粘土去除东海原甲藻(Prorocentrum donghaiense)初探. 海洋与湖沼, 52(5): 1170-1179 |
刘萍, 张吉强, 2016. 固定化溶藻菌除藻效果研究. 环境工程, 34(12): 28-31 |
李雪丁, 2021. 近20年福建沿海赤潮的发生特点. 海洋环境科学, 40(4): 601-610 |
张维娜, 高亮, 于丹, 等, 2017. 解淀粉芽孢杆菌对河蟹养殖水体中致病菌的抑制作用及对水质的调控作用. 水产科技情报, 44(4): 169-172 |
俞志明, 陈楠生, 2019. 国内外赤潮的发展趋势与研究热点. 海洋与湖沼, 50(3): 474-486 |
程捷, 2021. 赖氨酸芽孢杆菌Lysinibacillus fusiformis DMC-2的溶藻特性及机理的探究[D]. 重庆: 西南大学: 51.
|
雷新雨, 陈玉珂, 王桂芹, 等, 2021. 芽孢杆菌在水产养殖中的研究进展. 饲料工业, 42(20): 46-49 |
蔡红丹, 莫坤联, 胡永华, 等, 2021. 饲料中添加复合芽孢杆菌对石斑鱼生长、免疫及肠道菌群的影响. 饲料研究, 44(21): 64-70 |
BEDOSHVILI Y, BAYRAMOVA E, SUDAKOV N, et al, 2021. Impact of Algicidal Bacillus mycoides on diatom Ulnaria acus from lake Baikal. Diversity, 13(10): 469 DOI:10.3390/d13100469 |
BISWAS B, CHAKRABORTY A, SARKAR B, et al, 2017. Structural changes in smectite due to interaction with a biosurfactant-producing bacterium Pseudoxanthomonas kaohsiungensis. Applied Clay Science, 136: 51-57 DOI:10.1016/j.clay.2016.11.008 |
CHEN B B, ZHAO L, YU Q J, 2021. Toxicological effects of hypoxanthine on Heterosigmaakashiwo: mechanism of growth inhibition and change in hemolytic toxin content. Ecotoxicology and Environmental Safety, 226: 112797 DOI:10.1016/j.ecoenv.2021.112797 |
FU F X, ZHANG Y H, WARNER M E, et al, 2008. A comparison of future increased CO2 and temperature effects on sympatric Heterosigma akashiwo and Prorocentrum minimum. Harmful Algae, 7(1): 76-90 DOI:10.1016/j.hal.2007.05.006 |
GU H F, WU Y R, LÜ S H, et al, 2021. Emerging harmful algal bloom species over the last four decades in China. Harmful Algae, 111: 102059 |
IMAI I, INABA N, YAMAMOTO K, 2021. Harmful algal blooms and environmentally friendly control strategies in Japan. Fisheries Science, 87(4): 437-464 DOI:10.1007/s12562-021-01524-7 |
JEONG S Y, 2019. Algicidal activity of strain MS-51 against a HAB causing Alexandrium tamarense. International Journal of Applied Environmental Sciences, 14(6): 655-663 |
JUNG S W, KIM B H, KATANO T, et al, 2008. Pseudomonas fluorescens HYK0210-SK09 offers species-specific biological control of winter algal blooms caused by freshwater diatom Stephanodiscus hantzschii. Journal of Applied Microbiology, 105(1): 186-195 DOI:10.1111/j.1365-2672.2008.03733.x |
LYU Y H, ZHOU Y X, LI Y, et al, 2019. Optimized culturing conditions for an algicidal bacterium Pseudoalteromonas sp. SP48 on harmful algal blooms caused by Alexandrium tamarense. Microbiology Open, 8: e803 |
MAYALI X, FRANKS P J S, TANAKA Y, et al, 2008. Bacteria-induced motility reduction in Lingulodinium polyedrum (dinophyceae). Journal of Phycology, 44(4): 923-928 DOI:10.1111/j.1529-8817.2008.00549.x |
MEYER N, BIGALKE A, KAULFUß A, et al, 2017. Strategies and ecological roles of Algicidal bacteria. FEMS Microbiology Reviews, 41(6): 880-899 DOI:10.1093/femsre/fux029 |
PRASATH B B, WANG Y, SU Y P, et al, 2021. Coagulant plus Bacillus nitratireducens fermentation broth technique provides a rapid Algicidal effect of toxic red tide dinoflagellate. Journal of Marine Science and Engineering, 9(4): 395 DOI:10.3390/jmse9040395 |
SARKAR B, XI Y F, MEGHARAJ M, et al, 2012. Bioreactive organoclay: a new technology for environmental remediation. Critical Reviews in Environmental Science and Technology, 42(5): 435-488 DOI:10.1080/10643389.2010.518524 |
SHI X G, LIU L M, LI Y, et al, 2018. Isolation of an algicidal bacterium and its effects against the harmful-algal-bloom dinoflagellate Prorocentrum donghaiense (Dinophyceae). Harmful Algae, 80: 72-79 DOI:10.1016/j.hal.2018.09.003 |
WANG D Z, ZHANG S F, ZHANG H, et al, 2021. Omics study of harmful algal blooms in China: current status, challenges, and future perspectives. Harmful Algae, 107: 102079 DOI:10.1016/j.hal.2021.102079 |
WOLDEMARIAMYOHANNES K, WAN Z, YU Q L, et al, 2020. Prebiotic, probiotic, antimicrobial, and functional food applications of Bacillus amyloliquefaciens. Journal of Agricultural and Food Chemistry, 68(50): 14709-14727 DOI:10.1021/acs.jafc.0c06396 |
YU Z M, SONG X X, CAO X H, et al, 2017. Mitigation of harmful algal blooms using modified clays: theory, mechanisms, and applications. Harmful Algae, 69: 48-64 DOI:10.1016/j.hal.2017.09.004 |
ZHANG H J, LV J L, PENG Y, et al, 2014. Cell death in a harmful algal bloom causing species Alexandrium tamarense upon an algicidal bacterium induction. Applied Microbiology and Biotechnology, 98(18): 7949-7958 DOI:10.1007/s00253-014-5886-1 |
ZHANG H J, PENG Y, ZHANG S, et al, 2016. Algicidal effects of prodigiosin on the harmful algae Phaeocystis globosa. Frontiers in Microbiology, 7: 602 |
ZHENG X W, ZHANG B Z, ZHANG J L, et al, 2013. A marine algicidal actinomycete and its active substance against the harmful algal bloom species Phaeocystis globosa. Applied Microbiology and Biotechnology, 97(20): 9207-9215 DOI:10.1007/s00253-012-4617-8 |
ZINGONE A, ESCALERA L, ALIGIZAKI K, et al, 2021. Toxic marine microalgae and noxious blooms in the Mediterranean Sea: A contribution to the global HAB status report. Harmful Algae, 102: 101843 DOI:10.1016/j.hal.2020.101843 |
 2022, Vol. 53
2022, Vol. 53


