
中国海洋湖沼学会主办。
文章信息
- 王明飞, 庄昀筠, 葛汝平, 陈洪举, 刘光兴. 2022.
- WANG Ming-Fei, ZHUANG Yun-Yun, GE Ru-Ping, CHEN Hong-Ju, LIU Guang-Xing. 2022.
- 夏季南黄海浮游甲壳动物死体比例的初步研究
- PRELIMINARY STUDY ON CARCASS PROPORTION OF CRUSTACEAN ZOOPLANKTON IN THE SOUTH YELLOW SEA IN SUMMER
- 海洋与湖沼, 53(5): 1108-1120
- Oceanologia et Limnologia Sinica, 53(5): 1108-1120.
- http://dx.doi.org/10.11693/hyhz20211200310
文章历史
-
收稿日期:2021-12-06
收修改稿日期:2022-02-26
2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 山东青岛 266200
2. Marine Ecology and Environmental Science Laboratory, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266200, China
浮游动物在海洋生态系统中发挥着重要作用, 同时在生物泵中也扮演着重要的角色(Ducklow et al, 2001)。很多研究显示, 海洋中的浮游动物并不都是活体, 还存在着大量的死体(Carcasses), 死体比例在5%~90%不等(Terazaki et al, 1988; Genin et al, 1995; Haury et al, 1995)。浮游动物死体是海洋沉降碳通量的重要组成部分, 并且构成了总颗粒有机碳通量的很大一部分(高达40%)(Sampei et al, 2009; Frangoulis et al, 2010, 2011; Sampei et al, 2012)。而在以往下沉通量的相关研究中, 浮游动物死体的贡献被严重低估(Turner, 2002)。因此, 了解自然海区浮游动物的死体比例及其分布情况, 对于深入认识海洋生态系统的结构以及物质循环和能量流动都至关重要。
最初, 研究者通过辨别浮游动物是否具有运动性, 或样品中的个体是否存在破损、腐烂等情况判断浮游动物是否为活体(Wheeler, 1967; Weikert, 1977; Genin et al, 1995; Haury et al, 1995)。但使用上述方法费时耗力且有较大误差。Dressel等(1972)指出可以利用中性红染色区分海洋浮游动物的死活状态, 活体将被染成鲜红色, 而死体不着色或着浅红色。这种方法可以迅速地定量分析自然海区浮游动物的死体比例。经过不断地改进和完善, 中性红染色法得到了广泛地应用, 并取得了丰富的研究成果(Fleming et al, 1978; Tang et al, 2006; Elliott et al, 2009; Ivory et al, 2014; bbeŞİktepeet al, 2015; Krautz et al, 2017; 牟文秀, 2021)。
目前, 国内关于浮游动物死体比例的研究仅有零星的报道。万艾勇(2010)和Wang等(2020)对胶州湾及邻近海域中华哲水蚤(Calanus sinicus)的死体比例进行了研究, 发现中华哲水蚤死体比例较低, 雌体的死体比例为3.8%~11.1%, 雄体的死体比例为2.6%~10.4%, 低于其他海域。陆家昌等(2016)研究发现, 钦州湾浮游动物死体约占总丰度的25%。中国近海浮游动物死体比例相关研究还很不充分, 这不利于我们对于海洋生态系统生态过程的深入了解。
南黄海是我国重要的陆架边缘海, 上有季风驱动, 外有太平洋强西边界流(黑潮), 内受黄海沿岸低盐流和长江冲淡水等影响, 并且还存在季节性的冷水团, 形成了复杂的水文环境, 也造就了其丰富的生物多样性(吴德星等, 2006)。关于南黄海浮游动物的群落组成和分布等的相关报道很多(左涛等, 2004; Zhang et al, 2007; 时永强等, 2016; 贺雨涛等, 2019; Wang et al, 2021)。但对于南黄海浮游动物的死体比例、分布情况以及受控因素等的相关研究尚未见报道。本研究利用2019年夏季在南黄海获取的WP2型浮游生物网采样品, 分析了浮游甲壳动物的种类组成及其死体比例, 并探讨了浮游甲壳动物死体比例与环境因子之间的关系。了解南黄海复杂的海洋生态系统中浮游甲壳动物的死体比例, 对于深入认识南黄海海洋生态动力学过程和边缘海碳通量具有重要的意义。
1 材料与方法 1.1 调查海区及站位设置于2019年7月26日至8月2日, 搭载“蓝海101”海洋调查船在南黄海(121°00′~124°00′E; 32°00′~ 36°00′N)开展综合大面站调查, 主要设置4条纬向断面, 共16个站位(图 1)。
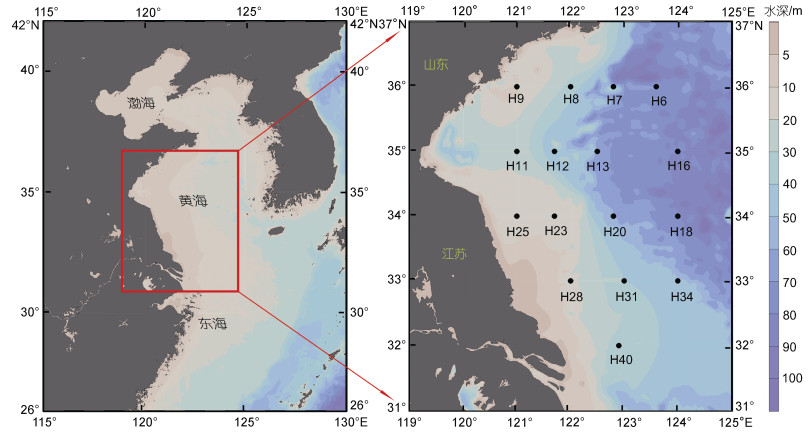 |
| 图 1 研究海区及站位 Fig. 1 Survey area and sampling stations |
将两个WP2型浮游生物网(网口面积0.25 m2, 筛绢孔径200 μm)网口固定在同一平面, 以≤0.8 m/s的速度, 底表垂直拖网采集浮游动物。为了避免冲网过程中的剧烈扰动造成浮游动物死亡, 在网口离开水面时, 保持网口超出水面, 缓慢上下拖曳数次, 将动物样品收集到网底管中。拖网完成后, 将其中一个WP2网中的动物样品收集到1 L的广口瓶中, 每升加入10 g/L中性红溶液1.5 mL在黑暗条件下原位海水培养15 min。将培养后的样品采用200 μm筛绢过滤, 并使用原位海水多次冲洗, 去除动物体表多余染料后, 液氮保存。将另一个WP2网中的动物样品保存于5%的福尔马林海水溶液中。
样品带回实验室进行后续分析。分析时, 采用相同盐度的海水解冻液氮中保存的样品, 每10 mL体积水样中加入1 mL盐酸(1 mol/L), 调节pH值小于7使其显色, 然后在体视显微镜(Leica S8APO型, 德国)下镜检、计数。颜色鲜红者为活体, 无色或粉红色者为死体。显色后的浮游动物采用SONY A 6300相机拍照。中性红样品处理与采集的时间间隔约12个月。甲醛样品, 实验室内在体视显微镜下镜检计数(Li et al, 2022)。
采集表、底层水样, 然后将水样过GF/F膜, 用铝箔包裹, 液氮保存, 用于叶绿素a浓度分析。实验室内, 用90%丙酮在4 ℃、避光条件下萃取24 h, 然后用紫外荧光分光光度计(F-4500, Hitachi, 日本)测量叶绿素a的浓度。海水的温度和盐度由随船温盐深剖面仪CTD (SBE911Plus, 美国)采集。
1.3 数据分析与处理浮游动物的丰度以每立方米水体中的个数表示(ind./m3)。浮游甲壳动物的优势种由优势度(Y)确定:
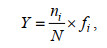 (1)
(1)式中: ni表示第i种浮游甲壳动物的数量; N表示所有浮游甲壳动物的总数量; fi表示第i种浮游甲壳动物在总调查站位出现的频率。当Y≥0.02时, 即认为该物种为优势种(徐兆礼等, 1989)。
各站位水柱平均叶绿素a浓度用ρs表示, 计算公式(孙伟, 2008)如下:
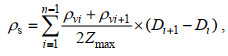 (2)
(2)式中: ρvi为第i层叶绿素a的浓度(单位: μg/L), Di为第i层的深度(单位: m), n为采样层数, Zmax为最大采样深度(单位: m)。
采用Ocean Data View 5.2.0软件绘制站位图和环境因子分布图。应用R语言绘制浮游动物死体比例的散点饼图。使用Canoco 5软件对主要优势种及类群的死体比例与环境因子进行冗余分析(Redundancy Analysis, RDA)。应用SPSS 26中的配对样本T检验分析中性红样品与甲醛样品之间的类群丰度是否具有显著性差异。为便于数据分析, 物种丰度数据进行lg(X+1)转化。
2 结果 2.1 研究海区环境因子南黄海表层平均温度为(26.7±0.9) ℃, 总体呈现出由北向南先降低后升高的趋势, 低值区位于研究海域西南部。底层平均温度为(15.2±6.2) ℃, 呈现出由近岸向外海、西南向东北部逐渐降低的趋势。表底温差呈现由西南向东北增大的趋势, 最大温差达18.3 ℃。表层盐度平均为30.2±2.0, 呈现出由北向南递减的趋势。底层盐度平均为32.3±0.8, 由研究海域西南向东北逐渐升高。表、底层叶绿素a平均浓度分别为(2.20±3.9)、(1.80±3.2) μg/L, 均呈现出西南高、东北低的特点(图 2)。
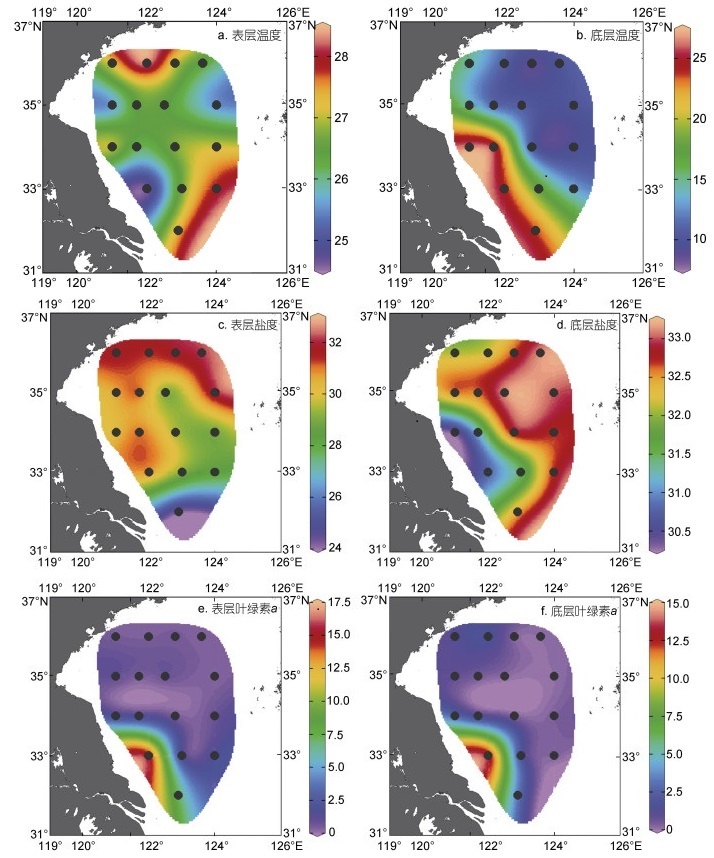 |
| 图 2 南黄海夏季海水温度(℃)、盐度和叶绿素a (μg/L)的平面分布 Fig. 2 Distribution of seawater temperature (℃), salinity and chlorophyll a (μg/L) of the South Yellow Sea in summer |
中性红样品中共记录浮游动物成体50种, 浮游幼虫18种, 合计68个种类。其中浮游甲壳动物平均丰度最高[(1 378.3±929.84) ind./m3], 其后依次为浮游幼虫[(76.1±125.7) ind./m3]、原生动物[(17.0±65.8) ind./m3]、毛颚类[(9.9±9.5) ind./m3]、水母类[(2.1±3.9) ind./m3]和被囊类[(1.3±2.4) ind./m3]。甲醛样品中记录浮游动物成体59种, 幼体23种, 合计82个种类。各类群的平均丰度, 依次为甲壳类[(1 854.9±1 080.3) ind./m3]、原生动物[(1 245.2±3 125.7) ind./m3]、被囊类[(160.0±360.2) ind./m3]、毛颚类[(159.1±118.8) ind./m3]、浮游幼虫[(132.4±127.3) ind./m3]和水母类[(4.9±9.0) ind./m3](表 1)。配对样本T检验结果显示, 水母类、甲壳类和浮游幼虫在中性红样品和甲醛样品中的丰度无显著差异; 但中性红样品中原生动物、被囊类和毛颚类的丰度显著低于甲醛样品(P < 0.05)。原生动物、被囊类和毛颚类动物等身体含水量高的类群在经过液氮冻融, 保存效果不佳。中性红显色结果显示浮游甲壳动物的保存和染色效果均较好(图 3), 但水母类染色效果不佳。因此, 本文重点关注浮游甲壳动物的死体比例。不同浮游动物类群的死体比例差异明显(表 1)。
| 类群 | 中性红样品 | 甲醛样品 | |||
| 种类数 | 平均丰度/(ind./m3) | 死体比例/% | 种类数 | 平均丰度/(ind./m3) | |
| 原生动物 | 1 | 17.0±65.8 | 0.6 | 1 | 1 245.2±3 125.7 |
| 水螅水母 | — | — | — | 8 | 0.4±0.7 |
| 管水母 | 1 | 2.1±3.9 | * | 1 | 4.0±8.7 |
| 栉水母 | — | — | — | 1 | 0.5±1.2 |
| 枝角类 | 2 | 166.0±357.0 | 19.1 | 2 | 172.4±411.5 |
| 桡足类 | 31 | 1202.9±937.4 | 38.6 | 31 | 1 669.9±1 025.6 |
| 涟虫类 | 1 | 0.5±1.8 | 5.1 | 1 | 0.2±0.5 |
| 磷虾类 | 2 | 4.3±8.6 | 3.1 | 2 | 3.5±9.9 |
| 端足类 | 3 | 1.8±2.5 | 4.5 | 3 | 2.8±5.1 |
| 等足类 | 1 | < 0.1 | 100.0 | 1 | < 0.1 |
| 糠虾类 | 1 | < 0.1 | 0.0 | 1 | 0.2±0.6 |
| 十足类 | 2 | 2.8±4.3 | 3.4 | 1 | 5.9±16.9 |
| 被囊类 | 3 | 1.3±2.4 | * | 3 | 160.0±360.2 |
| 毛颚类 | 2 | 9.9±9.5 | 81.4 | 3 | 159.1±118.8 |
| 浮游幼虫 | 18 | 76.1±125.7 | 7.0 | 23 | 132.4±127.3 |
| 共计 | 68 | 1 484.7±1 518.9 | — | 82 | 3 556.5±5 212.7 |
| 注: —表示该物种在该样品中未发现; *表示该物种未被中性红染色 | |||||
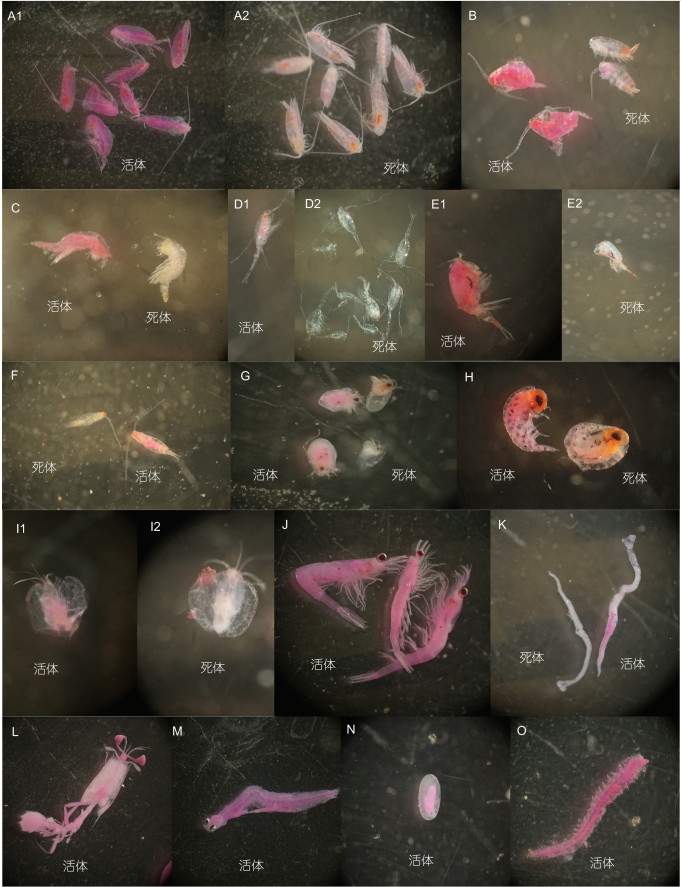 |
| 图 3 显微镜下中性红染色的各类浮游动物 Fig. 3 Zooplankton treated with neutral red under microscope view 注: A1, A2: 哲水蚤; B: 拟哲水蚤; C: 猛水蚤; D1, D2: 长腹剑水蚤; E1, E2: 大眼剑水蚤; F: 纺锤水蚤; G: 枝角类; H: 端足类; I1, I2: 介形类; J: 磷虾类; K: 毛颚类; L: 阿利玛幼虫; M: 仔鱼; N: 鱼卵; O: 多毛类幼体 |
浮游甲壳动物平均丰度为(1 378.3±929.84) ind./m3, 由近岸向外海呈现出先降低后升高的趋势。总丰度在H25站达到峰值3 701.6 ind./m3, H23站最低, 仅为368.6 ind./m3。浮游甲壳动物死体比例介于5.0%~ 68.8%, 平均值为33.3%。死体比例的平面分布总体呈现出近海低, 东部及东北部外海水域高的趋势。最高值出现在H6站(68.8%), 最低值出现在H11站(5.0%)(图 4)。
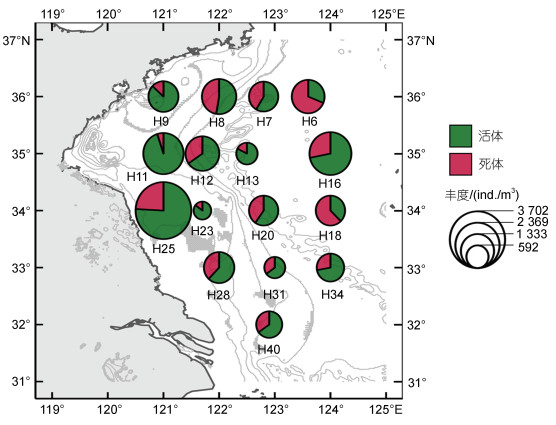 |
| 图 4 浮游甲壳动物总丰度和死体比例的平面分布 Fig. 4 Distribution of abundance and carcass proportion of crustacean zooplankton |
研究海区浮游甲壳类动物的优势种包括小拟哲水蚤(Paracalanus parvus)、鸟喙尖头溞(Penilia avirostris)、近缘大眼剑水蚤(Corycaeus affinis)、羽长腹剑水蚤(Oithona plumifera)、中华哲水蚤(Calanus sinicus)、拟长腹剑水蚤(O. similis)和克氏纺锤水蚤(Acartia clausi)等。其中, 小拟哲水蚤的丰度由近岸向外海呈现出先降低后升高的趋势, 丰度最高值出现在H25站, 为3 648.9 ind./m3, 丰度在H12站最低, 为162.4 ind./m3。小拟哲水蚤平均死体比例为33.0%, 在H6站死体比例最高, 为71.6%。鸟喙尖头溞、羽长腹剑水蚤、拟长腹剑水蚤和克氏纺锤水蚤仅在个别站位出现且丰度较高(图 5)。鸟喙尖头溞在H11站丰度最高为1 299.8 ind./m3, 其平均死体比例最低, 为17.9%。羽长腹剑水蚤、拟长腹剑水蚤和克氏纺锤水蚤分别在H16、H18和H8丰度达到峰值, 分别为1 082.7、334.0和379.1 ind./m3。羽长腹平均死体比例为52.5%, H18站死体比例最高(98.2%)。拟长腹剑水蚤的平均死体比例最高, 达62.0%, 在个别站位死体比例接近100%。克氏纺锤水蚤丰度较高的站位死体比例也较高。近缘大眼剑水蚤平均死体比例为18.8%, 死体比例分布呈现由南向北递减的趋势(图 5)。中华哲水蚤的丰度分布呈现出近岸低, 黄海冷水团影响区域高的特点。中华哲水蚤的死体比例在4.7%~71.0%, 死体比例最高值出现在H18站, 最低值出现在H7站, 平均死体比例为26.2%。
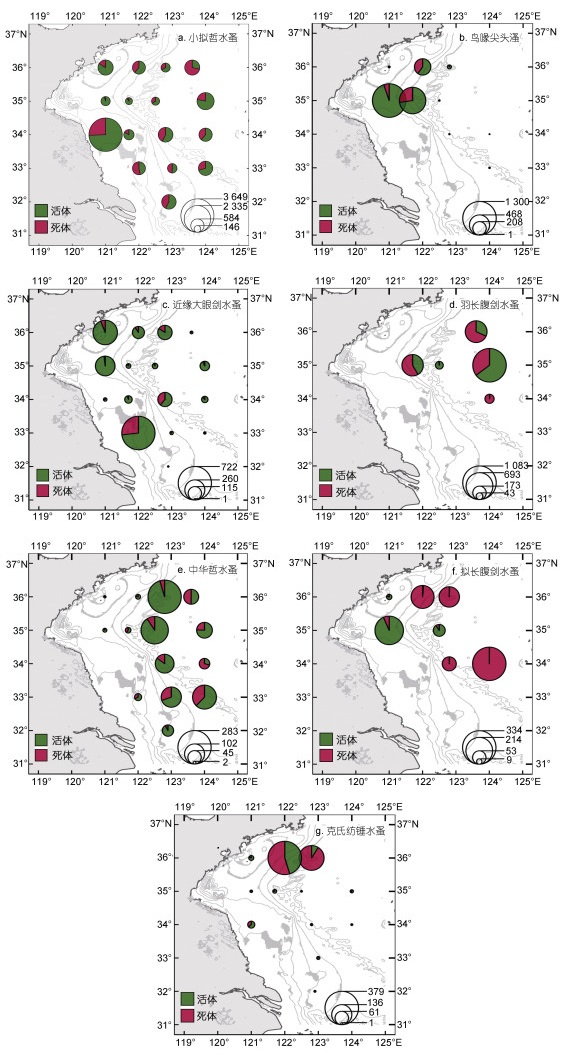 |
| 图 5 浮游甲壳动物优势种丰度和死体比例的平面分布 Fig. 5 Distribution of carcass proportion and abundance of dominant species of crustacean zooplankton 注: 右下角图例表示丰度, 单位: ind./m3 |
浮游甲壳动物主要优势种死体比例的去趋势对应分析(Detrended Correspondence Analysis, DCA)结果显示, 第一轴梯度长度为0.38, 长度小于3, 选用冗余分析更为准确。为防止低丰度种类死体比例偶然性的影响, 在进行RDA分析时剔除了丰度 < 10 ind./m3的站位。因表底温差与底层温度两个变量存在强共线性, 当解释变量矩阵中存在表底温差变量而再引入底层温度变量时, 总解释度将不再增加, 所以Canoco5软件自动剔除了底层温度变量而保留了贡献度更大的表底温差变量。分析结果显示, 第一主轴特征值为0.64, 第二个主轴特征值为0.21, 前两个主轴的累计解释变化率达85.1%。其中, 表底温差对浮游甲壳动物死体比例差异性的解释度最高, 为52.9% (P < 0.01)。RDA双序图显示, 近缘大眼剑水蚤、拟长腹剑水蚤、小拟哲水蚤以及浮游甲壳动物总的死体比例与表层叶绿素a具有较强的负相关性, 与水深、表层温度以及表底温差呈明显正相关。表层盐度与克氏纺锤水蚤死体比例呈明显正相关, 与鸟喙尖头溞、中华哲水蚤死体比例有明显负相关性(图 6)。
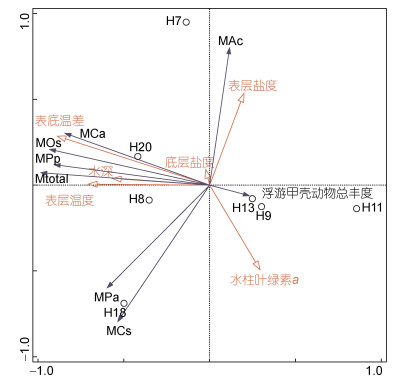 |
| 图 6 浮游甲壳动物优势种死体比例与环境因子RDA分析 Fig. 6 RDA analysis of environmental factor and mortality of dominant species in crustacean zooplankton 注: MAc: 克氏纺锤水蚤死体比例; MCa: 近缘大眼剑水蚤死体比例; MOs: 拟长腹剑水蚤死体比例; MPp: 小拟哲水蚤死体比例; MPa: 鸟喙尖头溞死体比例; MCs: 中华哲水蚤死体比例; Mtotal: 浮游甲壳动物总死体比例 |
全球范围内, 浮游动物死体比例的相关研究主要是以桡足类为主。研究主要集中在北半球的中、低纬度海区。基于有限的观测数据和不同海区之间水文环境的差异, 尚不能准确解析桡足类死体比例在空间尺度上变化的受控规律(表 2)。从全球尺度来看, 在封闭的海湾水域, 桡足类的死体比例大多低于受强烈洋流影响的开阔大洋海域(Wheeler, 1967; Böttger-schnack, 1995; Yahel et al, 2005; Tang et al, 2006; Kimmel et al, 2009; Homma et al, 2010; 万艾勇, 2010; Ivory et al, 2014; beŞİktepe et al, 2015; Tang et al, 2019a), 其主要的原因可能是海湾具有与开阔大洋相比更为稳定的生存环境。高纬度海域浮游桡足类死体比例与低纬度海域相比呈现出更大的差异性, 可能与高纬度海域极端光照气候导致的季节性资源限制有关。研究指出, 斯瓦尔巴特群岛(Svalbard)和南极宇航员海(Cosmonaut Sea)浮游桡足类死体比例变化较大, 极夜时期死体比例明显高于其他时期, 而且不同水层差异较大, 一些水层死体比例高达94%和100% (Daase et al, 2014; Daase et al, 2021; 牟文秀, 2021)。而中低纬度海域浮游桡足类死体比例大多不超过60% (Haury et al, 1995; Tang et al, 2006; Kimmel et al, 2009; Ivory et al, 2014; Giesecke et al, 2019)。本研究结果显示, 夏季南黄海浮游桡足类死体比例在3.6%~69.7%之间, 平均为38.6%, 与全球浮游桡足类的平均死体比例(12%~60%)大致相符(Tang et al, 2014)。在本研究还发现不同生物类群之间死体比例也存在差异。枝角类平均死体比例为19.1%; 涟虫类、磷虾类、端足类和十足类死体比例较低(3.1%~5.1%); 而糠虾类无死体记录。另外, 等足类死体比例为100%, 这可能与其低丰度(< 0.1 ind./m3)导致的偶然性有关(表 1)。
| 研究海区 | 调查时间/(年.月) | 死体比例/% | 死体鉴定方法 | 文献来源 |
| 美国大西洋沿岸(Atlantic off American Coast, 20°~38°N) | 1966.10 | 50~70 | 形态识别 | Wheeler, 1967 |
| 非洲大西洋沿岸(Atlantic off African Coast, 10°~20°N) | 1972.2~3 | 16~28 | 形态识别 | Weikert, 1977 |
| 大西洋(Atlantic, 31.3°N; 25.4°W) | 1985.6~7 | 25~50 | 形态识别 | Roe, 1988 |
| 日本海(Sea of Japan, 38°~42°N; 132°~140°E) | 1970.8;1984.3~1985.12 | 16~28 | 形态识别 | Terazaki et al, 1988 |
| 红海(Red Sea) | 1980.10~11;1981.2 | 1~50 | 形态识别 | Böttger-schnack, 1990 |
| 红海(Red Sea) | 1987.7~8 | < 10~29 | 形态识别 | Böttger-schnack, 1995 |
| 埃拉特湾(Gulf of Eilat) | 1990.7~9;1991.7~9 | 22~65 | 形态识别 | Genin et al, 1995 |
| 加利福尼亚太平洋沿岸(Pacific near California, 30°~33°N) | 1984/1989/1990/1991.9 | 10~60 | 形态识别 | Haury et al, 1995 |
| 阿拉伯海(Arabian Sea) | 1987.4~5 | 5~70 | 形态识别 | Böttger-schnack, 1996 |
| 北太平洋(North Pacific, 42°N; 145.5°E) | 1996.9~1997.10 | ≤75 | 形态识别 | Yamaguchi et al, 2001 |
| 北太平洋(Across North Pacific, 40°~50°N) | 1998.8 | 10~90 | 形态识别 | Yamaguchi et al, 2002 |
| 阿卡巴湾(Gulf of Aqaba) | 1996.2~1997.7 | 10~20 | 形态识别 | Yahel et al, 2005 |
| 切萨皮克湾(Lower Chesapeake Bay) | 2005.6~7 | 约29 | 形态识别 | Tang et al, 2006 |
| 墨西哥湾北部(Northern Gulf of Mexico) | 2003/2004/2006/2007.8 | 30~60 | 中性红染色 | Kimmel et al, 2009 |
| 白令海阿留申群岛(Aleutian Basin of the Bering Sea) | 2006.6 | ≤70 | 形态识别 | Homma et al, 2010 |
| 胶州湾 | 2008.12~2009.11 | < 16 | 中性红染色 | 万艾勇, 2010 |
| 斯瓦尔巴特群岛(Svalbard) | 2012.1 | 9~94 | 形态识别 | Daase et al, 2014 |
| 大槌湾(Otsuchi Bay) | 2013.5; 2013.7 | 6.2~21.1 | 中性红染色 | Ivory et al, 2014 |
| 梅尔辛湾(Mersin Bay) | 2006.3~2007.2 | 2.6~29.5 | 中性红染色 | beŞİktepe2015 et al, 2015 |
| 洪堡海流系统(Southern Humboldt Current System) | 2015.1~2016.4 | 4.3~76.9 | 中性红染色 | Krautz et al, 2017 |
| 英吉利海峡(English Channel) | 1988.3~2015.11 | ≤20 | 形态识别 | Maud et al, 2018 |
| 比格尔海峡(Beagle Channel) | 2016.10 | 18~22 | 中性红染色 | Giesecke et al, 2019 |
| 北大西洋(North Atlantic, 24°~32°N) | 2014.3~4 | 14~91 | 中性红染色 | Tang et al, 2019a |
| 斯瓦尔巴特群岛(Svalbard) | 2016.1/5/8;2017.1 | 2~35 | 中性红染色 | Daase et al, 2021 |
| 南极宇航员海(Cosmonaut Sea) | 2019.12~2020.1 | 10~100 | 中性红染色 | 牟文秀, 2021 |
| 南黄海 | 2019.7~8 | 38.6 | 中性红染色 | 本研究 |
浮游甲壳动物死亡是诸多生态因素影响的结果, 如温度、盐度、饵料、寄生性疾病、有害藻类等(Delgado et al, 1999; bgÓmez-gutiÉrrezet al, 2003; Sopanen et al, 2006; Tang et al, 2019b)。研究认为, 温度越高, 浮游甲壳动物的死亡风险越高, 较高的温度会增加自然种群中的疾病和寄生性疾病, 同时较高的温度还会提高浮游甲壳动物的代谢水平, 使浮游甲壳动物面临饥饿的风险增加, 并降低其最大寿命(Gophen, 1976; Tsuda, 1994; Harvell et al, 2002; Böttger-schnack et al, 2008)。此外, 温度通过影响捕食者的数量和捕食率从而对浮游甲壳动物的死亡率产生影响(Myers et al, 1983)。跃层中温度的突变也是导致浮游甲壳动物大量死亡的原因(Terazaki, 1988)。盐度的变化也会导致某些耐盐性差的物种死亡(Isinibilir et al, 2011)。浮游植物作为甲壳类浮游动物的饵料, 对浮游甲壳动物的生长和繁殖起着重要作用。研究指出, 夏季黄海平均叶绿素浓度较低(田洪阵等, 2020)。因此, 夏季饵料的短缺加上捕食者的捕食可能会对浮游甲壳动物的死亡产生影响。还有研究显示, 在航运繁忙的海域, 船舶产生的湍流也是导致浮游动物死亡的重要原因(Bickel et al, 2011)。
小拟哲水蚤为调查海域的绝对优势种。本研究结果也显示, 小拟哲水蚤的死体比例与表层温度显著正相关(图 6)。研究指出, 小拟哲水蚤主要分布在上层水体中, 且夏季形成的温跃层会阻碍小拟哲水蚤的下移(王真良等, 1989)。万艾勇(2010)研究了胶州湾桡足类优势种的死体比例与环境因子的关系, 发现夏季海水的高温是造成小拟哲水蚤死体比例升高主要环境因子。Krautz等(2017)在洪堡海流系统(Humboldt Current System)南部的研究中指出, 拟哲水蚤属的死体比例与最高温度呈显著正相关。并且发现小拟哲水蚤丰度的峰值区出现在表层温度相对更低的区域, 这说明表层高温不利于小拟哲水蚤的生存(图 5)。
研究指出, 近缘大眼剑水蚤和拟长腹剑水蚤在上下水层分布比较均匀(王真良等, 1989)。温跃层剧烈的温度变化可能也会对其生存产生影响(Terazaki et al, 1988)。蒋翰鹏等(2009)通过室内培养试验指出温度剧烈变化会导致近缘大眼剑水蚤死亡比例的显著升高, 温度由28 ℃突变至32 ℃时, 死亡率由31.9%升高至60.8%。拟长腹剑水蚤在表底温差最大的站位H7、H8、H18和H20站死体比例最高(98.6%~99.8%), 同时拟长腹剑水蚤在这些站位丰度也较高, 可能是温度的剧烈变化导致了其大量死亡(图 5)。而近缘大眼剑水蚤在表、低温度均较高的H34和H40死体比例较高, 分别为41.7%和45.2%。且该区域丰度较低, 说明该区域不适合近缘大眼剑水蚤的生存, 相反在丰度较高的H9和H28死体比例较低, 分别为6.0%和26.8% (图 5)。
克氏纺锤水蚤是一种较适于低温生活的桡足类, 在温度大于18 ℃时, 几乎完全消失, 因此在夏季丰度较低(郑重等, 1965)。克氏纺锤水蚤在夏季也会向外海的深处移动, 但其垂直移动不显著, 主要分布在中下层(郑重等, 1965; 王真良等, 1989)。因此, 表层温度对克氏纺锤水蚤的死体比例影响较小。Cervetto等(1999)指出克氏纺锤水蚤最适盐度在24~30之间。调查发现克氏纺锤水蚤仅在H7和H8站丰度较高, 在其他站位分布较少, 且在该站位区域死体比例较高, 分别为91.1%和54.8% (图 5)。可能与该区域表底盐度均较高(32~33)有关。Krautz等(2017)指出在洪堡海流系统南部受季节性淡水输入影响的区域, 纺锤水蚤属的死体比例与最低盐度呈负相关关系。可见盐度对克氏纺锤水蚤的生存影响较大。
本研究发现, 中性红样品中浮游动物的种类组成和丰度与甲醛样品相比有差异。其中, 在甲醛样品中记录到的水螅水母并未在中性红样品中出现, 这是因为水螅水母经过冻融酸化后裂解, 而管水母凭借厚实的中胶层能够保存下来。由于水螅水母的丰度很低, 其损失未对中性红样品和甲醛样品中水母类丰度的差异性产生显著影响。低温同样也不利于毛颚类和被囊类等动物的保存, 低温使其破碎导致记录到的丰度偏低, 且其身体的破损会导致中性红染料浸出, 对记录到的死体比例结果产生影响。另外, 有研究表明个体较小的桡足类染色后褪色较快(Krautz et al, 2017), 样品长时间保存也可能导致褪色, 导致死体比例的统计值偏高。本研究中, 长腹剑水蚤较高的死体比例(图 5)也可能也与此有关。这需要在今后的研究中留意。目前, 与粪便通量相比, 作为碳输出载体的浮游动物死体受到的关注仍然较少, 尽管浮游动物死体对碳通量很重要, 这值得我们进一步跟踪调查研究。
4 结论南黄海夏季浮游甲壳动物死体比例在5.0%~ 68.8%之间, 平均死体比例为33.3%, 与全球浮游桡足类的平均死体比例大致相符。不同浮游甲壳动物类群及优势种之间的死体比例存在差异。温度和盐度是影响南黄海夏季浮游甲壳动物死体比例分布的重要环境因子。表层温度是驱动小拟哲水蚤死亡比例分布的主要环境因素, 拟长腹剑水蚤和近缘大眼剑水蚤的死体比例受表底温差影响较大。而盐度是影响克氏纺锤水蚤死体比例分布的重要环境因子。
致谢 本研究的数据及样品采集得到国家自然科学基金委员会共享航次计划项目(41849901号)的支持。该航次(航次编号: NORC2019-01)由“蓝海101”号科考船实施, 在此一并致谢。傅书南、王宁等协助采样, 谨致谢忱。
万艾勇, 2010. 胶州湾桡足类优势种死亡比例的研究[D]. 青岛: 中国科学院研究生院: 10-46.
|
王真良, 刘晓丹, 1989. 北黄海浮游动物昼夜垂直移动的初步研究. 黄渤海海洋, 7(4): 50-54 |
左涛, 王荣, 王克, 等, 2004. 夏季南黄海浮游动物的垂直分布与昼夜垂直移动. 生态学报, 24(3): 524-530 DOI:10.3321/j.issn:1000-0933.2004.03.019 |
田洪阵, 刘沁萍, GOES J I, 等, 2020. 基于2002—2018年MODIS数据的黄海叶绿素a时空变化研究. 海洋通报, 39(1): 101-110 |
孙伟, 2008. 青岛近岸海域叶绿素a与初级生产力调查研究[D]. 青岛: 中国海洋大学: 22-25.
|
牟文秀, 2021. 南极宇航员海浮游动物群落结构及其被动沉降对碳通量的贡献[D]. 青岛: 中国科学院大学(中国科学院海洋研究所): 35-39.
|
时永强, 孙松, 李超伦, 等, 2016. 初夏南黄海浮游动物功能群丰度年际变化. 海洋与湖沼, 47(1): 1-8 |
吴德星, 兰健, 2006. 中国东部陆架边缘海海洋物理环境演变及其环境效应. 地球科学进展, 21(7): 667-672 DOI:10.3321/j.issn:1001-8166.2006.07.002 |
陆家昌, 姜发军, 许铭本, 等, 2016. 2015年冬季钦州湾浮游动物死体对海洋生态系统的影响. 广西科学, 23(4): 325-330 |
郑重, 郑执中, 王荣, 等, 1965. 烟、威鲐鱼渔场及邻近水域浮游动物生态的初步研究. 海洋与湖沼, 7(4): 329-354 |
贺雨涛, 刘光兴, 房静, 等, 2019. 2008年夏季南黄海浮游动物群落特征. 海洋环境科学, 38(4): 494-502 |
徐兆礼, 陈亚瞿, 1989. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系. 生态学杂志, 8(4): 13-15, 19 |
蒋翰鹏, 孙雪峰, 张辉, 等, 2009. 温度和盐度突变对近缘大眼剑水蚤存活率的影响. 水产科学, 28(6): 347-349 DOI:10.3969/j.issn.1003-1111.2009.06.012 |
BEŞİKTEPE Ş, TANG K W, MANTHA G, 2015. Seasonal variations of abundance and live/dead compositions of copepods in Mersin Bay, northeastern Levantine Sea (eastern Mediterranean). Turkish Journal of Zoology, 39(3): 494-506 |
BICKEL S L, HAMMOND J D M, TANG K W, 2011. Boat-generated turbulence as a potential source of mortality among copepods. Journal of Experimental Marine Biology and Ecology, 401(1/2): 105-109 |
BÖTTGER-SCHNACK R, 1990. Community structure and vertical distribution of cyclopoid copepods in the Red Sea. Marine Biology, 106(3): 473-485 DOI:10.1007/BF01344328 |
BÖTTGER-SCHNACK R, 1995. Summer distribution of micro- and small mesozooplankton in the Red Sea and Gulf of Aden, with special reference to non-calanoid copepods. Marine Ecology Progress Series, 118(1/3): 81-102 |
BÖTTGER-SCHNACk R, 1996. Vertical structure of small metazoan plankton, especially noncalanoid copepods. I. Deep Arabian Sea. Journal of Plankton Research, 18(7): 1073-1101 DOI:10.1093/plankt/18.7.1073 |
CERVETTO G, GAUDY R, PAGANO M, 1999. Influence of salinity on the distribution of Acartia tonsa (Copepoda, Calanoida). Journal of Experimental Marine Biology and Ecology, 239(1): 33-45 DOI:10.1016/S0022-0981(99)00023-4 |
DAASE M, SØREIDE J E, 2021. Seasonal variability in non-consumptive mortality of Arctic zooplankton. Journal of Plankton Research, 43(4): 565-585 DOI:10.1093/plankt/fbab042 |
DAASE M, VARPE Ø, FALK-PETERSEN S, 2014. Non-consumptive mortality in copepods: occurrence of Calanus spp. carcasses in the Arctic Ocean during winter. Journal of Plankton Research, 36(1): 129-144 DOI:10.1093/plankt/fbt079 |
DELGADO M, ALCARAZ M, 1999. Interactions between red tide microalgae and herbivorous zooplankton: the noxious effects of Gyrodinium corsicum (Dinophyceae) on Acartia grani (Copepoda: Calanoida). Journal of Plankton Research, 21(12): 2361-2371 DOI:10.1093/plankt/21.12.2361 |
DRESSEL D M, HEINLE D R, GROTE M C, 1972. Vital staining to sort dead and live copepods. Chesapeake Science, 13(2): 156-159 DOI:10.2307/1351022 |
DUCKLOW H W, STEINBERG D K, BUESSELER K O, 2001. Upper ocean carbon export and the biological pump. Oceanography, 14(4): 50-58 DOI:10.5670/oceanog.2001.06 |
ELLIOTT D T, TANG K W, 2009. Simple staining method for differentiating live and dead marine zooplankton in field samples. Limnology and Oceanography: Methods, 7(8): 585-594 DOI:10.4319/lom.2009.7.585 |
FLEMING J M, COUGHLAN J, 1978. Preservation of vitally stained zooplankton for live/dead sorting. Estuaries, 1(2): 135-137 DOI:10.2307/1351607 |
FRANGOULIS C, PSARRA S, ZERVAKIS V, et al, 2010. Connecting export fluxes to plankton food-web efficiency in the Black Sea waters inflowing into the Mediterranean Sea. Journal of Plankton Research, 32(8): 1203-1216 DOI:10.1093/plankt/fbq010 |
FRANGOULIS C, SKLIRIS N, LEPOINT G, et al, 2011. Importance of copepod carcasses versus faecal pellets in the upper water column of an oligotrophic area [J]. Estuarine, Coastal and Shelf Science, 92(3): 456-463.
|
GENIN A, GAL G, HAURY L, 1995. Copepod carcasses in the ocean. II. Near coral reefs. Marine Ecology Progress Series, 123(1/3): 65-71 |
GIESECKE R, HÖFER J, VALLEJOS T, et al, 2019. Death in southern Patagonian fjords: copepod community structure and mortality in land-and marine-terminating glacier-fjord systems. Progress in Oceanography, 174: 162-172 DOI:10.1016/j.pocean.2018.10.011 |
GÓMEZ-GUTIÉRREZ J, PETERSON W T, DE ROBERTIS A, et al, 2003. Mass mortality of krill caused by parasitoid ciliates. Science, 301(5631): 339 DOI:10.1126/science.1085164 |
GOPHEN M, 1976. Temperature effect on lifespan, metabolism, and development time of Mesocyclops leuckarti (Claus). Oecologia, 25(3): 271-277 DOI:10.1007/BF00345104 |
HARVELL C D, MITCHELL C E, WARD J R, et al, 2002. Climate warming and disease risks for terrestrial and marine biota. Science, 296(5576): 2158-2162 DOI:10.1126/science.1063699 |
HAURY L, FEY C, GAL G, et al, 1995. Copepod carcasses in the ocean. I. Over seamounts. Marine Ecology Progress Series, 123: 57-63 DOI:10.3354/meps123057 |
HOMMA T, YAMAGUCHI A, 2010. Vertical changes in abundance, biomass and community structure of copepods down to 3000 m in the southern Bering Sea. Deep Sea Research Part I: Oceanographic Research Papers, 57(8): 965-977 DOI:10.1016/j.dsr.2010.05.002 |
ISINIBILIR M, SVETLICHNY L, HUBAREVA E, et al, 2011. Adaptability and vulnerability of zooplankton species in the adjacent regions of the Black and Marmara Seas. Journal of Marine Systems, 84(1/2): 18-27 |
IVORY J A, TANG K W, TAKAHASHI K, 2014. Use of Neutral Red in short-term sediment traps to distinguish between zooplankton swimmers and carcasses. Marine Ecology Progress Series, 505: 107-117 DOI:10.3354/meps10775 |
KIMMEL D G, BOICOURT W C, PIERSON J J, et al, 2009. A comparison of the mesozooplankton response to hypoxia in Chesapeake Bay and the northern Gulf of Mexico using the biomass size spectrum [J]. Journal of Experimental Marine Biology and Ecology, 381 Suppl 1: S65-S73.
|
KIØRBOE T, HIRST A G, 2008. Optimal development time in pelagic copepods. Marine Ecology Progress Series, 367: 15-22 DOI:10.3354/meps07572 |
KRAUTZ M C, HERNÁNDEZ-MIRANDA E, VEAS R, et al, 2017. An estimate of the percentage of non-predatory dead variability in coastal zooplankton of the southern Humboldt Current System. Marine Environmental Research, 132: 103-116 DOI:10.1016/j.marenvres.2017.10.008 |
LI Y X, GE R P, CHEN H J, et al, 2022. Functional diversity and groups of crustacean zooplankton in the southern Yellow Sea. Ecological Indicators, 136(7): 108699 |
MAUD J L, HIRST A G, ATKINSON A, et al, 2018. Mortality of Calanus helgolandicus: sources, differences between the sexes and consumptive and nonconsumptive processes. Limnology and Oceanography, 63(4): 1741-1761 DOI:10.1002/lno.10805 |
MYERS R A, RUNGE J A, 1983. Predictions of seasonal natural mortality rates in a copepod population using life-history theory. Marine Ecology-Progress Series, 11(2): 189-194 |
ROE H S J, 1988. Midwater biomass profiles over the Madeira Abyssal Plain and the contribution of copepods. Hydrobiologia, 167(1): 169-181 |
SAMPEI M, SASAKI H, FOREST A, et al, 2012. A substantial export flux of particulate organic carbon linked to sinking dead copepods during winter 2007–2008 in the Amundsen Gulf (southeastern Beaufort Sea, Arctic Ocean). Limnology and Oceanography, 57(1): 90-96 DOI:10.4319/lo.2012.57.1.0090 |
SAMPEIH M, SASAKI I, HATTORI H, et al, 2009. Significant contribution of passively sinking copepods to downward export flux in Arctic waters. Limnology and Oceanography, 54(6): 1894-1900 DOI:10.4319/lo.2009.54.6.1894 |
SOPANEN S, KOSKI M, KUUPPO P, et al, 2006. Toxic haptophyte Prymnesium parvum affects grazing, survival, egestion and egg production of the calanoid copepods Eurytemora affinis and Acartia bifilosa. Marine Ecology-Progress Series, 327: 223-232 DOI:10.3354/meps327223 |
TANG K W, BACKHAUS L, RIEMANN L, et al, 2019a. Copepod carcasses in the subtropical convergence zone of the Sargasso Sea: implications for microbial community composition, system respiration and carbon flux. Journal of Plankton Research, 41(4): 549-560 DOI:10.1093/plankt/fbz038 |
TANG K W, FREUND C S, SCHWEITZER C L, 2006. Occurrence of copepod carcasses in the lower Chesapeake Bay and their decomposition by ambient microbes [J]. Estuarine, Coastal and Shelf Science, 68(3/4): 499-508.
|
TANG K W, GLADYSHEV M I, DUBOVSKAYA O P, et al, 2014. Zooplankton carcasses and non-predatory mortality in freshwater and inland sea environments. Journal of Plankton Research, 36(3): 597-612 DOI:10.1093/plankt/fbu014 |
TANG K W, IVORY J A, SHIMODE S, et al, 2019b. Dead heat: copepod carcass occurrence along the Japanese coasts and implications for a warming ocean. ICES Journal of Marine Science, 76(6): 1825-1835 DOI:10.1093/icesjms/fsz017 |
TERAZAKI M, WADA M, 1988. Occurrence of large numbers of carcasses of the large, grazing copepod Calanus cristatus from the Japan Sea. Marine Biology, 97(2): 177-183 DOI:10.1007/BF00391300 |
TSUDA A, 1994. Starvation tolerance of a planktonic marine copepod Pseudocalanus newmani Frost. Journal of Experimental Marine Biology and Ecology, 181(1): 81-89 DOI:10.1016/0022-0981(94)90105-8 |
TURNER J T, 2002. Zooplankton fecal pellets, marine snow and sinking phytoplankton blooms. Aquatic Microbial Ecology, 27(1): 57-102 |
WANG S W, WAN A Y, ZHANG G T, et al, 2020. Annual occurrence of Calanus sinicus carcasses in the Jiaozhou Bay and the adjacent waters. Journal of Ocean University of China, 19(5): 1163-1168 DOI:10.1007/s11802-020-4379-3 |
WANG X, WANG Z L, ZHANG X L, et al, 2021. The distribution of zooplankton and the influencing environmental factors in the South Yellow Sea in the summer. Marine Pollution Bulletin, 167: 112279 DOI:10.1016/j.marpolbul.2021.112279 |
WEIKERT H, 1977. Copepod carcasses in the upwelling region south of cap Blanc, N. W. Africa. Marine Biology, 42(4): 351-355 DOI:10.1007/BF00402197 |
WHEELER E H JR, 1967. Copepod detritus in the deep sea. Limnology and Oceanography, 12(4): 697-702 DOI:10.4319/lo.1967.12.4.0697 |
YAHEL R, YAHEL G, GENIN A, 2005. Near-bottom depletion of zooplankton over coral reefs: I: diurnal dynamics and size distribution. Coral Reefs, 24(1): 75-85 DOI:10.1007/s00338-004-0449-z |
YAMAGUCHI A, IKEDA T, 2001. Abundance and population structure of three mesopelagic Paraeuchaeta species (Copepoda: Calanoida) in the Oyashio region, western subarctic Pacific Ocean with notes on their carcasses and epizoic ciliates. Plankton Biology and Ecology, 48(2): 104-113 |
YAMAGUCHI A, WATANABE Y, ISHIDA H, et al, 2002. Community and trophic structures of pelagic copepods down to greater depths in the western subarctic Pacific (WEST-COSMIC). Deep Sea Research Part I: Oceanographic Research Papers, 49(6): 1007-1025 DOI:10.1016/S0967-0637(02)00008-0 |
ZHANG G T, SUN S, YANG B, 2007. Summer reproduction of the planktonic copepod Calanus sinicus in the Yellow Sea: influences of high surface temperature and cold bottom water. Journal of Plankton Research, 29(2): 179-186 DOI:10.1093/plankt/fbm005 |
 2022, Vol. 53
2022, Vol. 53


