
中国海洋湖沼学会主办。
文章信息
- 陈国柱, 钟镇霄, 杨旻珉, 邢钱钱, 夏正龙, 唐琼英, 易少奎, 蔡缪荧, 杨杰, 杨国梁. 2022.
- CHEN Guo-Zhu, ZHONG Zhen-Xiao, YANG Min-Min, XING Qian-Qian, XIA Zheng-Long, TANG Qiong-Ying, YI Shao-Kui, CAI Miu-Ying, YANG Jie, YANG Guo-Liang. 2022.
- 罗氏沼虾(Macrobrachium rosenbergii)初次性成熟性腺发育的组织学观察
- HISTOLOGICAL OBSERVATION OF GONAD DEVELOPMENT DURING THE FIRST SEXUAL MATURITY OF MACROBRACHIUM ROSENBERGII
- 海洋与湖沼, 53(5): 1208-1218
- Oceanologia et Limnologia Sinica, 53(5): 1208-1218.
- http://dx.doi.org/10.11693/hyhz20211200350
文章历史
-
收稿日期:2021-12-29
收修改稿日期:2022-02-19
2. 江苏数丰水产种业有限公司 江苏高邮 225654
2. Jiangsu Shufeng Prawn Breeding Co. Ltd., Gaoyou 225654, China
罗氏沼虾(Macrobrachium rosenbergii), 又称马来西亚大虾、淡水长臂虾, 隶属甲壳纲(Crustacea)、十足目(Decapoda)、长臂虾科(Palaemonidae)、沼虾属(Macrobrachium)。该虾栖息于热带、亚热带地区的咸水及半咸水水域, 是世界上个体最大的淡水虾。因其生长快、食性广等优良养殖及商业特性而被广泛养殖(潘家模, 1994)。我国罗氏沼虾养殖产量现已占世界总产量的60%左右, 成为罗氏沼虾养殖第一大国(FAO, 2020)。生长与繁殖性能是最重要的两个生物学指标, 随着我国罗氏沼虾产业的迅速发展, 加强罗氏沼虾基础生物学研究显得尤为重要。
目前对甲壳类动物性腺发育相关研究主要集中在以下几方面: 组织学上, 各学者将性腺外部形态与内部组织结构相结合, 对波纹龙虾(Panulirus homarus) (刘慧玲等, 2009)、克氏原螯虾(Procambarus clarkia) (黄文虎, 2012)、凡纳滨对虾(Litopenaeus vannamei) (颜素芬等, 2004)、中华绒螯蟹(Eriocheir sinensis) (薛鲁征等, 1987; 堵南山等, 1988)、锯缘青蟹(Scylla serrata) (上官步敏等, 1991)等的卵巢或精巢的发育周期进行了划分, 并探索其生殖细胞的发生过程; 内分泌学上, 罗氏沼虾的性腺发育通常与其眼柄的X器官窦状腺复合体、Y器官及大颚器官分泌的多种蜕皮及性腺发育相关的激素相结合进行研究(蔡生力, 1998; 朱小明等, 2001; Felterman et al, 2011); 行为学上, 研究者对克氏原螯虾(徐增洪, 2014)、罗氏沼虾(王春等, 2009; Habashy, 2013)、日本沼虾(Macrobrachium nipponense) (徐红艳, 2001)等求偶、交媾前后、产卵等繁殖行为进行了系统的观察描述, 雄虾在性成熟后繁殖交配季节表现出明显的占区、求偶等行为。形态学方面, 邢钱钱等(2021)发现罗氏沼虾雌虾性成熟后可能通过头胸甲和腹部形态性状的变化增强其个体繁殖力; 与其类似, Chow等(1991)发现凡纳滨对虾性成熟后雌虾的头胸甲宽显著大于雄虾; Primavera等(1998)认为斑节对虾(Penaeus monodon)在仔虾时期雌雄个体规格及生长表现相似, 只在雌虾性成熟后表现出性二态性。以上研究表明性腺发育过程往往伴随着外部形态的变化。繁殖生物学方面, 胡润豪等(2021)认为长臂虾类产卵量受卵巢发育状况的影响。在分子机制方面, 姜虎成(2015)通过转录组分析了部分基因在克氏原螯虾性腺不同发育时期的调控机制和表达情况; 江红霞(2017)在日本沼虾中发现卵黄蛋白原(Vg)、组织蛋白酶L (CTSL)、半胱氨酸蛋白酶抑制因子(CST)等12个可能与日本沼虾性早熟密切相关基因。除上述研究外, 许多学者还通过人为调控如营养(Jover et al, 1999; Carmona-Osalde et al, 2005)、养殖密度(戴习林等, 2016a, 2016b)、光照(张龙岗等, 2014)等外部环境因素探索了外界环境变化对甲壳类动物性腺发育的影响。
罗氏沼虾由仔虾发育至成虾, 达到初次性成熟这一阶段生长较快, 性腺发育与生长是同步进行的, 整个过程包含了复杂的行为、外部形态及性腺形态的变化。赵云龙等(1998)的研究表明, 罗氏沼虾的雌性生殖系统包括卵巢和输卵管, 根据卵黄积累情况将卵子发生过程大致分为5期。王玉凤等(1997)对罗氏沼虾雄性生殖系统进行了结构划分, 并探索了生殖细胞发育过程中RNA、DNA及蛋白质合成和分布规律。朱春华等(2011)研究表明罗氏沼虾仔虾后15 d出现生殖原基, 外部性征分化略早于内部性征分化, 这与戴习林等(2016b)对性别分化及性腺原基出现时间的研究结论一致。这些研究结果使我们对罗氏沼虾的生殖系统结构、性腺发育过程等有了初步认识, 但对雌虾卵巢发育的外部形态与内部组织学变化规律的对应关系研究还不够深入, 对雄虾精巢的发育规律也未准确阐明, 对罗氏沼虾性腺发育过程的认识还需进一步深入。从能量分配的角度考虑, 若不能满足罗氏沼虾初次性腺发育及生长所需营养, 罗氏沼虾后期的生长、繁殖性能将会受到严重的影响。
因此, 研究罗氏沼虾性腺发育的基本规律, 掌握罗氏沼虾繁殖及生长的关键节点, 对增强亲虾繁殖力、提高育苗成活率、保证商品虾生长的营养供给意义重大。本研究基于前人对虾蟹类物种性腺发育的研究方法, 将性腺外部形态与其组织学相结合进行观察, 对罗氏沼虾初次性成熟性腺外部形态及组织学变化规律进行系统研究, 以期进一步完善罗氏沼虾的繁殖生物学资料, 助力罗氏沼虾的产业发展。
1 材料与方法 1.1 实验用虾实验用罗氏沼虾(Macrobrachium rosenbergii)来自江苏数丰水产种业有限公司育种中心淡化时间相同的9个家系仔虾, 个体规格(2.9±0.16) g, 每个家系挑选200个个体, 保证雌雄比1︰1左右, 共计1 800尾仔虾用于本实验养殖取样。实验用虾取样时间段为2020年8月1日~10月4日。
1.2 饲养管理将每个家系的200尾仔虾分别置于9个面积为17 m2的水泥池饲养, 初期养殖密度约为12尾/m2。各池的光照(0~1 380 lx)、水温(28~32 ℃)等养殖条件一致, 投喂饲料由江苏富裕达粮食制品股份有限公司供应, 日投喂量为每池虾总重的8%~10%, 分别于早上8:00、下午4:00及晚上10:00分3次进行投喂。养殖中后期除投喂人工饲料外, 适当增投螺蛳肉(按每次配合饲料投喂量的4~5倍投喂)进行强化培育。水质指标保持在: pH 7.5~8.0、溶氧8~11 mg/L、氨氮0.05~0.25 mg/L、亚硝酸盐0.1~0.3 mg/L。
1.3 取样及测量以7 d为一周期, 分池饲养后即对各池进行采样, 每个家系随机捕捞雌雄各3尾, 9个池共取54尾, 实验共取样10个周期。将待取样虾置于冰上10 min以降低其活力, 对每尾虾的头胸甲背面进行拍照后解剖, 对性腺进行拍照、取样、称性腺重(gonadal weight, GW), 计算性腺指数(gonadal index, GIS), 并选取厚度约0.2~0.5 cm的性腺组织采用4%组织固定液固定, 定期更换固定液以便长期保存, 供后续组织切片观察分析。
1.4 切片制作、H.E染色及拍照测量采用常规石蜡切片的制作流程及苏木精-伊红(H.E)染色方法研究性腺的组织学(赵惠玲等, 2004; 杨捷频, 2006)。性腺外部形态在体式解剖镜下观察并拍照, 性腺组织结构特征通过组织切片在显微镜下观察并拍照, 拍摄图片导入Photoshop CS6, 使用标尺工具校准原图标尺后进行细胞长短径测量。
1.5 性腺发育分期性腺的解剖观察侧重于通过解剖后肉眼观察结合解剖镜观察性腺外部形态结构(体积、颜色、表面色素覆盖程度等), 而组织学观察则侧重于通过切片观察性腺内部细胞种类、各类细胞所占比率及排布状态。本研究基于性腺的解剖观察与组织学观察综合变化情况对性腺进行发育时期的划分。
2 结果 2.1 卵子发生根据罗氏沼虾卵巢切片观察卵细胞发育时相, 发现其卵细胞的大小、H.E染色变化、卵黄物质积累、各类细胞在卵巢中的分布存在规律性变化。此过程中的卵细胞存在5个发育时期, 即: 卵原细胞、卵黄合成前期卵母细胞、内源性卵黄合成期卵母细胞、外源性卵黄合成期卵母细胞及成熟卵细胞。
卵原细胞: 细胞呈不规则圆形, 长径9~11 μm, 短径7~9 μm; 整个细胞被细胞核占据大部分, 核呈嗜碱性, 核仁不明显, 胞质染色浅, 均匀分布于细胞核周围, 整个细胞几乎跟细胞核颜色一致。
卵黄合成前期卵母细胞: 卵原细胞随着卵巢发育, 体积逐渐增大, 由生发区向外推移形成卵黄合成期卵母细胞, 形状不规则, 长径28~32 μm, 短径20~24 μm; 细胞核圆形, 核仁部分可见, 圆形, 1~2个, 呈强嗜碱性, 细胞质较卵原细胞增多, 呈蓝紫色。
内源性卵黄合成期卵母细胞: 细胞形状为椭圆或不规则多边形, 长径40~48 μm, 短径30~36 μm; 核质分区明显, 细胞核圆形, 染色质呈蓝色, 胞质由嗜碱性转变为嗜酸性, 呈深红色。
外源性卵黄合成期卵母细胞: 细胞体积迅速增大, 早期长径88~93 μm, 短径71~76 μm; 细胞核呈卵圆形, 部分细胞已形成单个较大核仁, 呈嗜碱性, 核质同样呈嗜碱性, 细胞质内出现脂滴颗粒, 到发育后期胞质内脂滴颗粒数目明显增多, 体积约早期的2倍。长径220~240 μm, 短径116~138 μm, 颗粒大小增大, 细胞核开始出现不规则形状。
成熟卵细胞: 细胞体积达到最大, 长径400~ 480 μm, 短径220~270 μm, 中间充斥着大量脂滴, 单个细胞之间已难以区分界限, 核仁在视野内几乎消失, 卵细胞透过卵巢肉眼可见, 罗氏沼虾即将蜕壳抱卵。
2.2 卵巢发育分期解剖发现, 卵巢由左右两叶构成, 前端闭合, 呈倒V字型。处于增殖期的卵巢覆盖于罗氏沼虾心脏的下方, 肝胰腺的后上方。卵巢解剖结构观察与组织学观察的变化表现出一一对应的高同步性, 可根据卵巢占罗氏沼虾体重的比率(性腺指数)、卵巢的体积、颜色(表面色素覆盖程度), 以及卵巢内细胞种类的组成、分布情况, 将卵巢发育过程分为以下8个时期。
Ⅰ期卵巢(增殖期): 该期卵巢体积极小且受到血淋巴的影响, 肉眼观察极难分辨该期卵巢的形态和颜色。解剖镜观察, 卵巢已隐约区分左右两叶, 前端闭合处延伸至整个肝胰腺背面约1/7处, 最大宽度小于心脏宽度, 颜色接近透明, 卵巢背面无色素覆盖(图 1a)。切片观察, 卵巢中的细胞主要由卵原细胞和滤泡细胞组成, 存在极少数排列在卵巢外围发育初期的卵母细胞(图 2a)。卵巢性腺指数0.16%。
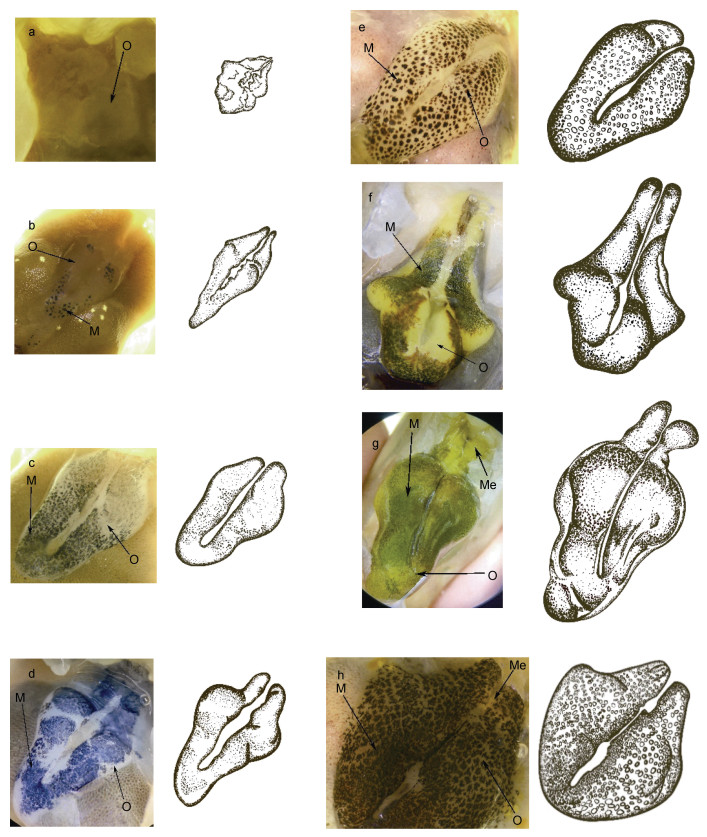 |
| 图 1 罗氏沼虾卵巢不同发育时期解剖镜下外部形态观察 Fig. 1 Observation of the external morphology of M. rosenbergii ovaries at different developmental stages under anatomical microscope 注: a. 增殖期卵巢; b. 发育前期卵巢; c. 发育中期卵巢; d. 发育后期卵巢; e. 发育末Ⅰ期卵巢; f. 发育末Ⅱ期卵巢; g. 成熟期卵巢; h. 退化期卵巢。O: 卵巢; M: 黑色素; Me: 成熟卵子 |
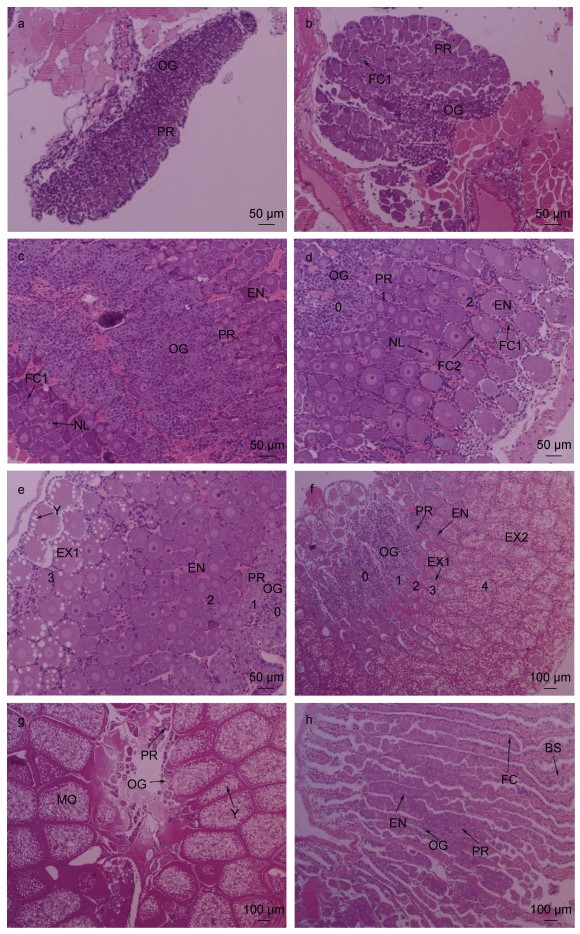 |
| 图 2 罗氏沼虾卵巢不同发育时期组织学特征 Fig. 2 Histological characteristics of the ovaries of M. rosenbergii at different developmental stages 注: a. 增殖期卵巢(×100); b. 发育前期卵巢(×100); c. 发育中期卵巢(×100); d. 发育后期卵巢(×100); e. 发育末Ⅰ期卵巢(×100); f. 发育末Ⅱ期卵巢(×40); g. 成熟期卵巢(×40); h. 退化期卵巢(×40)。OG: 卵原细胞; PR: 卵黄合成前期卵母细胞; EN: 内源性卵黄合成期卵母细胞; EX1: 外源性卵黄合成前期卵母细胞; EX2: 外源性卵黄合成中、晚期卵母细胞; MO: 成熟卵子; FC: 滤泡细胞; FC1: Ⅰ型滤泡细胞; FC2: Ⅱ型滤泡细胞; NL: 细胞核; Y: 卵黄颗粒; BS: 血窦; 0: 中心区; 1: 外围1区; 2: 外围2区; 3: 外围3区; 4: 外围4区 |
Ⅱ期卵巢(发育前期): 肉眼观察, 卵巢体积较增殖期增加2~3倍, 已可见卵巢轮廓。解剖镜观察, 卵巢前端闭合处向肝胰腺前端缓慢延伸至1/5~1/4处, 最大宽度接近心脏宽度。整体颜色呈半透明乳白色, 背面较增殖期于前端闭合处和中端开始出现少量黑色素覆盖(图 1b)。切片观察, 卵原细胞集中分布在卵巢的中心区域(生发区), 外周卵黄合成前期卵母细胞数目明显增加, 滤泡细胞开始由卵巢生发区向外迁移, 表现围绕卵母细胞形成单个滤泡腔的趋势(图 2b)。卵巢性腺指数0.18%。
Ⅲ期卵巢(发育中期): 肉眼观察, 卵巢体积较发育前期增加约2倍, 卵巢整体呈乳白色。解剖镜观察, 前端闭合处已延伸覆盖至整个肝胰腺的1/3处, 最大宽度已超过心脏宽度, 左右两叶卵巢背面出现1条黑色素带, 覆盖了整个卵巢背面约2/3面积(图 1c)。切片观察, 卵巢中心仍主要为卵原细胞, 其外周环绕了大量卵黄合成前期卵母细胞。此外, 在卵黄合成前期卵母细胞外周出现了部分内源性卵黄合成期卵母细胞, 数量较卵黄合成前期卵母细胞少, 滤泡细胞已基本环绕于单个卵母细胞周围形成滤泡腔(图 2c)。性腺指数0.21%。
Ⅳ期卵巢(发育后期): 肉眼观察, 卵巢体积进一步增大, 卵巢整体呈乳白色。解剖镜观察, 前端闭合处延伸至肝胰腺背面约2/3处, 最大宽度较发育中期更宽, 卵巢内隐约可见少量乳黄色区域, 其背面色素带未见明显变化(图 1d)。切片观察, 整个卵巢可分为中心区、外围1区、外围2区三个区域, 中心为生发区, 以卵原细胞为主, 外围2区为卵巢最外围, 分布大量内源性卵黄合成期卵母细胞。外围1区在中心区和外围2区之间, 以卵黄合成前期卵母细胞为主。观察区域面积大小发现, 外围2区>外围1区>中心区。此外, 环绕在单个滤泡腔周围的滤泡细胞有增加趋势(图 2d)。性腺指数0.34%。
Ⅴ期卵巢(发育末Ⅰ期): 肉眼观察, Ⅴ期的卵巢体积虽在增加, 但增长幅度不大, 整个卵巢呈明显的乳黄色。解剖镜观察, 卵巢背面色素带明显, 色素分布区域明显增加(图 1e)。切片观察, 卵巢可分为中心区、外围1区、外围2区、外围3区共4个区域, 主要细胞类型分别为卵原细胞、卵黄合成前期卵母细胞、内源性合成期卵母细胞、外源性合成早期卵母细胞; 各区域大小为: 外围3区>外围2区>外围1区>中心区。从该阶段开始, 环绕在单个滤泡腔周围的滤泡细胞数目迅速增加(图 2e)。性腺指数0.49%。
Ⅵ期卵巢(发育末Ⅱ期): 肉眼观察, 卵巢体积迅速增长且横向增长明显, 卵巢呈金黄色。解剖镜观察, 卵巢表面色素带斑点变得愈发致密, 且颜色开始向墨绿色转变(图 1f)。切片观察, 卵巢可按照第Ⅴ期类似的区域划分方式分为中心区、外围1区、外围2区、外围3区、外围4区共5个区域, 主要细胞类型分别为卵原细胞、卵黄合成前期卵母细胞、内源性卵黄合成期卵母细胞、外源性卵黄合成早期卵母细胞、外源性卵黄合成中、晚期卵母细胞; 各区域大小为: 外围4区>外围3区>外围2区>外围1区>中心区。以成熟度为标准, 卵原细胞、卵黄合成前期卵母细胞、内源性卵黄合成期卵母细胞由卵巢中心向外呈单条脊索状依次排列, 整个卵巢呈辐射型向外发育, 越靠近卵巢膜, 成熟度越高(图 2f)。性腺指数0.77%。
Ⅶ期卵巢(成熟期): 肉眼观察, 卵巢体积增至整个发育期的最大。其前叶最远可覆盖整个肝胰腺、胃, 延伸至罗氏沼虾的额剑处, 整体呈桔黄色。解剖镜观察, 其背面的黑色素转变为墨绿色, 覆盖了整个卵巢背面, 透过极薄的卵巢外膜隐约可见卵巢内部呈卵圆形的成熟卵子(图 1g)。切片观察, 视野下主要为成熟卵母细胞, 外源性卵黄合成期卵母细胞极少, 内源性卵黄合成期卵母细胞消失, 卵巢中心区存在少量卵原细胞和卵黄合成前期卵母细胞(图 2g)。性腺指数5.7%。
Ⅷ期卵巢(退化期): 肉眼观察, 卵巢干瘪, 体积较小, 颜色趋近半透明, 在肝胰腺背面的覆盖程度接近Ⅲ期卵巢。解剖镜观察, 黑色素带的覆盖程度与Ⅵ期卵巢接近, 几乎覆盖了整个卵巢背面, 色素重新转变为黑色(图 1h)。切片观察, 卵巢内细胞种类主要包括卵原细胞、卵黄合成前期卵母细胞、内源性卵黄合成期卵母细胞、滤泡细胞4类, 由卵巢中心生发区向卵巢膜分布, 在内源性卵黄合成期卵母细胞之间可看到大量已排出成熟卵子的滤泡空腔和滤泡细胞(图 2h)。性腺指数0.63%。
罗氏沼虾卵巢发育各时期性腺指数的变化趋势如图 3, 雌虾的性腺指数因其发育时期的不同存在一个先缓慢增加, 至Ⅵ~Ⅶ期迅速增加, 而Ⅶ~Ⅷ期迅速下降的过程。
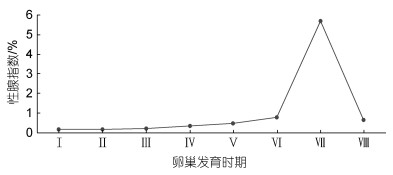 |
| 图 3 罗氏沼虾不同卵巢发育时期性腺指数(GIS)变化规律 Fig. 3 Changes of gonadal index (GIS) in different ovarian developmental periods of M. rosenbergii |
罗氏沼虾的精巢与卵巢的位置一致, 位于心脏下方, 肝胰腺后上部。整个精巢由许多生精小管组成, 覆盖于肝胰腺上。精巢解剖观察结果与组织学观察的同步性较差, 外部形态和内部组织学变化表现出存在一定关联性但又相对独立的变化过程。根据精巢发育过程中体积、颜色、表面色素覆盖程度、精巢内细胞种类的组成结构差异将其分为4个发育时期。
Ⅰ期精巢: 肉眼观察, 因受到血淋巴的影响, 极难分辨。解剖镜观察, 该期精巢较小, 半透明, 前端闭合, 后端分离, 整个精巢呈V型。精巢表面无色素覆盖, 精巢末端无法从解剖镜下观察到明显的输精管(图 4a)。切片观察, 精巢中精原细胞占绝大部分, 细胞之间排列紧密, 生精小管之间夹杂着极少量的营养细胞(图 5a)。性腺指数0.17%。
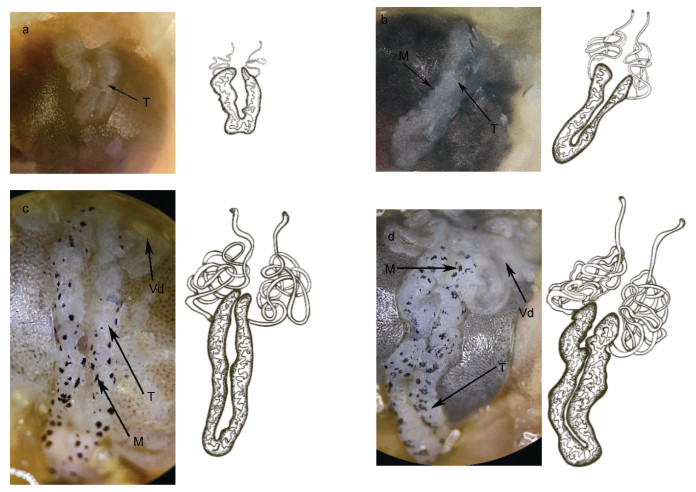 |
| 图 4 罗氏沼虾精巢不同发育时期解剖镜下外部形态观察 Fig. 4 Observation of the external morphology of the testis of M. rosenbergii at different developmental stages under anatomical microscope 注: a. Ⅰ期精巢; b. Ⅱ期精巢; c. Ⅲ期精巢; d. Ⅳ期精巢。T: 精巢; M: 黑色素; Vd: 输精管 |
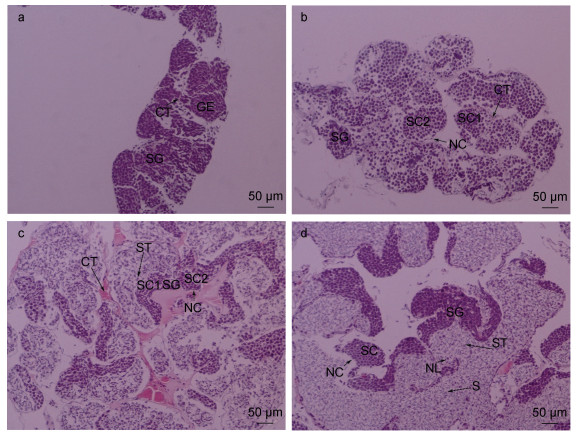 |
| 图 5 罗氏沼虾精巢不同发育时期组织学特征 Fig. 5 Histological characteristics of the testes of Macrobrachium rosenbergii at different developmental stages 注: a. Ⅰ期精巢(×100); b. Ⅱ期精巢(×100); c. Ⅲ期精巢(×100); d. Ⅳ期精巢(×100)。GE: 生殖上皮; SG: 精原细胞; SC1: 初级精母细胞; SC2: 次级精母细胞; ST: 精细胞; S: 精子; NC: 营养细胞; CT: 结缔组织; GE: 生殖上皮 |
Ⅱ期精巢: 肉眼观察, 已可见精巢组织, 颜色呈半透明乳白色, 精巢前端与胃后缘之间存在一透明膜状组织粘连, 将整个精巢拉长至胃的末端。解剖镜观察, 精巢表面存在少量黑色素斑点, 单侧精巢明显变粗, 末端隐约可见输精管(图 4b)。切片观察, 营养细胞围绕在单个生精小管边缘排布, 不同发育时期的生殖细胞可同时存在于同一生精小管中且彼此分界并不明显, 生殖细胞总数有所增加(图 5b)。性腺指数0.23%。
Ⅲ期精巢: 肉眼观察, 精巢体积较发育初期有进一步增长, 精巢两叶进一步增粗; 精巢整体呈乳白色。解剖镜观察, 背面覆盖的黑色素斑点呈线状排列, 且黑色素斑点数量增多, 单个斑点覆盖面积增大, 精巢后端的输精管已清晰可见(图 4c)。切片观察, 精原细胞所占比例较发育初期明显减少, 而精细胞所占比例明显增多, 且存在一定数量的精细胞正在转变为成熟精子的变态过程。整个精巢的细胞数量随着精巢的不断发育也有明显增多的趋势(图 5c)。性腺指数0.23%。
Ⅳ期精巢: 肉眼观察, 成熟期的精巢体积增至最大, 颜色乳白色。解剖镜观察, 两叶精巢表面如桑葚状凹凸不平, 其表面覆盖的黑色素斑点因精巢的乳白色而显得更深。精巢末端盘曲着大团输精管(图 4d)。精巢中生殖细胞包括了精原细胞、初级精母细胞、次级精母细胞、精细胞、成熟精子五类, 生殖细胞总数此时达到最大, 精细胞与成熟精子混杂在一起分布于生精小管一侧(图 5d)。性腺指数0.26%。
罗氏沼虾精巢生殖细胞发育各时期性腺指数的变化趋势如图 6。雄虾的性腺指数因其发育时期的不同存在缓慢增加的趋势, 但增长幅度较小。
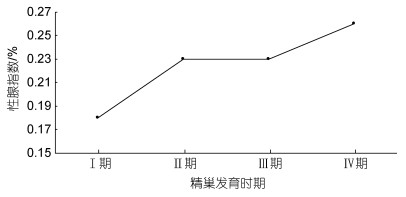 |
| 图 6 罗氏沼虾不同精巢发育时期性腺指数(GIS)变化 Fig. 6 Variation of gonadal index (GIS) at different development stages of M. rosenbergii testes |
国内外学者对甲壳动物的卵巢发育时期划分标准并不一致, 但存在相似之处。刘慧玲等(2009)按卵巢组织学特征、不同卵细胞发育时期所占比例、卵巢形态及颜色将波纹龙虾卵巢发育分为6个时期。栗治国等(2014)根据脊尾白虾(Exopalaemon carinicauda)卵巢颜色及卵巢成熟指数将卵巢发育分为6个时期。Guimarães等(2021)以低平斜纹蟹(Plagusia depressa)卵巢形态、组织结构、各类生殖细胞频率以及卵巢的位置将卵巢发育过程分为4个时期。Chen等(2019)在红纹鞭腕虾(Lysmata vittata)卵巢发育分期中以卵巢长度、颜色为划分标准。上官步敏等(1991)根据锯缘青蟹卵巢外部特征及组织学特征将卵巢发育分为未发育期、发育早期、发育期、将成熟期、成熟期和排卵后期。总体来说, 国内外学者都将卵巢的外部形态与内部组织结构作为卵巢发育分期的划分标准。本研究将罗氏沼虾的卵巢颜色、体积、卵巢表面的色素分布情况等外部特征与卵巢内生殖细胞所处发育阶段、各阶段细胞比例进行了分析, 同时结合性腺指数的变化将卵巢发育分为8个时期。分析发现卵巢外部形态与内部组织结构的变化相互对应, 因此可以根据卵巢颜色、体积、色素分布情况推测其内部组织细胞发育情况。
此外, 卵巢随着发育趋于成熟, 其对应的各时期生殖细胞存在特殊分布及排列规律。增殖期卵巢内生殖细胞成团分布, 并未出现一定规律性, 这一现象持续至发育前期。从发育中期开始至发育末期, 各时期生殖细胞围绕卵巢中心向外表现出规律性排列, 生殖细胞存在由卵巢中心向外逐渐成熟的趋势, 且不同时期生殖细胞之间出现分区。单个生殖细胞由卵巢中心生发区向外呈脊索状排列, 不同发育时期的生殖细胞之间可划分出较为明显的环状分区, 各分区的生殖细胞发育阶段比较单一, 这一生殖细胞分区现象持续至成熟期消失。何绪刚等(2002)在武湖日本沼虾卵巢发育研究中提到关于卵巢发育方向的讨论, 通过切片组织观察认为日本沼虾的卵巢发育是由腹面向背面发生。本研究通过组织切片观察发现, 罗氏沼虾的卵巢发育是由中央向四周横向发生, 可能存在卵巢由腹面向背面发生的趋势。
3.2 卵子发生关于甲壳类动物卵子发生阶段的划分标准目前主要有2类, 部分学者先根据卵细胞大小、形态将其分为: 卵原细胞、初级卵母细胞、次级卵母细胞及成熟卵子4个时期, 然后根据生殖细胞内是否出现油滴或卵黄颗粒, 再将次级卵母细胞细分为早、中、晚3个亚期(King, 1948; 薛鲁征等, 1987; 樊玉杰, 2005; 黄楷翔等, 2011)。而另一部分学者则以卵细胞是否开始卵黄合成, 将卵子的发生分为卵原细胞期、卵黄蛋白合成前期、内源性卵黄蛋白合成期、外源性卵黄蛋白合成期以及成熟期5个时期(Bomirski et al, 1976; 上官步敏等, 1991; Minagawa et al, 1997; 颜素芬等, 2004; 栗治国等, 2014; Guimarães, 2021)。
本研究参照第2类划分标准, 结合对应的卵巢发育阶段, 将雌虾卵子发生过程分为5个时期, 且由于外源性卵黄合成期卵母细胞在发育前后体积变化较大, 将外源性卵黄蛋白合成期再细分为早期和晚期2个亚期。在整个卵子发生过程中, 卵巢内的滤泡细胞作为卵细胞发育的营养供给细胞发挥着重要作用。随着卵子不断发育成熟, 滤泡细胞由卵巢中央向外迁移, 多个滤泡细胞围绕单个卵子形成滤泡腔, 且滤泡细胞由早期的近圆形变为长梭形, 这一过程中滤泡细胞与卵子的接触面积不断增大。观察整个卵子发生过程, 这一系列变化似乎与卵黄合成的启动保持较高的同步性, 推测滤泡细胞对卵子发育及营养物质积累具有重要作用。
3.3 精巢发育有关甲壳类动物精巢发育周期划分的研究国内外鲜有报道。栗治国等(2014)以年为周期将脊尾白虾的精巢发育划分为休止期、增殖期、成熟期。杨筱珍等(2010)根据日本新糠虾(Neomysis japonica)精巢组织学及外部性征变化, 将雄性生殖系统发育分为4个时期。堵南山等(1988)将中华绒螯蟹的精巢发育粗略分为休止期和发育期。Souza等(2018)根据美人虾(Stenopus hispidus)精巢的外部特征将精巢发育划分为成熟期和发育期。罗氏沼虾的精巢发育分期目前未见报道, 本研究根据精巢外部形态发育特征(精巢体积、颜色、表面色素分布), 将精巢发育时期分为Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期。
在罗氏沼虾雄虾性腺初次成熟过程中, Ⅰ期精巢中生殖细胞为单一精原细胞, 不具备产生精子的能力, 其余3个发育期精巢均具备产生成熟精子的能力。这是基于对雄虾输精管及精巢的组织学观察发现, Ⅰ期精巢输精管内未见成熟精子, 而Ⅱ期、Ⅲ期、Ⅳ期精巢包含精原细胞在内的所有时期细胞, 虽然各时期细胞所占比例存在较大差异, 但输精管内均存在成熟精子, 即Ⅱ期至Ⅳ期精巢除精原细胞的增殖外, 成熟精子也在同步生产。由此推测, Ⅰ期精巢外部形态与内部组织学变化保持较高同步性, 主要进行原始生殖细胞的积累、雄性生殖系统功能及结构的完善过程, 而Ⅱ期、Ⅲ期、Ⅳ期外部形态与内部组织学变化不再完全同步, 精巢外部形态结构与生殖细胞进入一个具有一定关联性, 但又相对独立的发育阶段。生殖细胞发育周期在精巢内反复循环, 同时精巢、输精管仍不断增粗、增长, 产生精子数量不断增加, 是雄虾生殖能力的强化过程。雄虾精巢生殖功能完善后, 精子在精巢不断产出, 后于输精管内积累达到一定数量, 待雌虾卵子成熟后, 随时可与雌虾交配繁殖。本研究也发现雄虾精子成熟过程较雌虾卵子成熟过程所需时间更短。
此外, 雄虾的精巢由大量生精小管组成, 在单个生精小管中, 往往精原细胞所在的生发区单独集中于生精小管一侧分布, 切片下观察单个生精小管之间横切面中的生发区并不存在集中分布的现象, 可能与精巢从虾体剥离后进行切片的人为因素导致。切片观察同一雄虾精巢, 各生精小管间存在明显的发育阶段的不同步性, 这与许多研究者得出的同一雄虾不同生精小管内生殖细胞发育不同步的结论一致(蔡生力, 1998; Felterman et al, 2011), 但总体以某一发育时期生精小管为主导。
4 结论本研究通过性腺外部形态观察结合常规石蜡切片观察的方法, 总结了雌雄罗氏沼虾初次性成熟卵巢的形态及组织学变化规律。结果表明: 罗氏沼虾卵巢发育可分为8个时期, 卵巢在营养物质积累时期(Ⅵ~Ⅶ期)体积及内部细胞种类、体积变化明显; 雄虾精巢的发育可划分为4个时期, 精巢体积随个体生长缓慢增大, 内部细胞种类、体积变化较小。生产上可尝试通过卵巢颜色、体积等特征间接判断其所处发育时期, 对卵巢快速发育时期亲虾进行强化培育(投喂配合饲料同时搭配动物性饵料等), 增大初次性成熟亲虾个体规格, 助力种虾选育及虾苗生产。
上官步敏, 刘正琮, 李少菁, 1991. 锯缘青蟹卵巢发育的组织学观察. 水产学报, 15(2): 96-103 |
王玉凤, 堵南山, 赖伟, 1997. 罗氏沼虾雄性生殖系统的组织化学研究. 中国水产科学, 4(3): 13-16 DOI:10.3321/j.issn:1005-8737.1997.03.003 |
王春, 成永旭, 2009. 罗氏沼虾繁殖行为的再描述. 动物学杂志, 44(4): 102-110 DOI:10.3969/j.issn.0250-3263.2009.04.016 |
邢钱钱, 杨旻珉, 陈国柱, 等, 2021. 罗氏沼虾性成熟前后形态性状对体质量的通径分析. 水产学报: 1-13 |
朱小明, 李少菁, 2001. 甲壳动物幼体蜕皮的调控. 水产学报, 25(4): 379-384 |
朱春华, 薛海波, 李郁娇, 等, 2011. 壬基酚(NP)对罗氏沼虾幼虾生长和性别分化的影响. 水产学报, 35(3): 365-371 |
刘慧玲, 李长玲, 黄翔鹄, 等, 2009. 波纹龙虾卵巢的解剖学与组织学研究. 水产科学, 28(7): 387-390 DOI:10.3969/j.issn.1003-1111.2009.07.006 |
江红霞, 2017. 日本沼虾雌性性早熟相关基因的筛选、克隆、表达与功能分析[D]. 杨凌: 西北农林科技大学: 1-10.
|
杨捷频, 2006. 常规石蜡切片方法的改良. 生物学杂志, 23(1): 45-46 DOI:10.3969/j.issn.2095-1736.2006.01.015 |
杨筱珍, 杨丽丽, 杨丽娜, 等, 2010. 日本新糠虾雄性生殖系统发育的组织学研究. 中国水产科学, 17(5): 941-950 |
何绪刚, 张训蒲, 龚世园, 等, 2002. 武湖日本沼虾卵巢发育研究. 华中农业大学学报, 21(2): 148-151 DOI:10.3321/j.issn:1000-2421.2002.02.012 |
张龙岗, 钟君伟, 刘羽清, 等, 2014. 光照和饵料对克氏原螯虾亲虾性腺发育的影响. 河北渔业, (7): 6-7, 43 DOI:10.3969/j.issn.1004-6755.2014.07.002 |
赵云龙, 彭欣夏, 李祥, 1998. 罗氏沼虾雌性生殖系统的组织学研究. 华东师范大学学报(自然科学版), (3): 81-85 |
赵惠玲, 王青, 王蔚魁, 2004. 人体及动物组织H.E染色石蜡切片法的技术改进. 动物学杂志, 39(3): 42-43 DOI:10.3969/j.issn.0250-3263.2004.03.008 |
胡润豪, 史文军, 王盼, 等, 2021. 长臂虾科几种重要经济虾类的繁殖生物学研究进展. 海洋渔业, 43(4): 485-502 DOI:10.3969/j.issn.1004-2490.2021.04.010 |
姜虎成, 2015. 克氏原螯虾转录组测序数据发掘和性腺发育相关基因功能初步研究[D]. 上海: 上海海洋大学: 43-90.
|
栗治国, 张成松, 李富花, 等, 2014. 脊尾白虾的性腺发育及组织结构观察. 水产学报, 38(3): 362-370 |
徐红艳, 2001. 日本沼虾和黄颡鱼摄食与繁殖行为生态学的研究[D]. 武汉: 华中农业大学: 1-15.
|
徐增洪, 周鑫, 水燕, 等, 2014. 克氏原螯虾繁殖行为生态学的实验研究. 中国水产科学, 21(2): 382-389 |
堵南山, 薛鲁征, 赖伟, 1988. 中华绒螯蟹(Eriocheir sinensis)雄性生殖系统的组织学研究. 动物学报, (4): 329-333, 389-390 |
黄文虎, 2012. 克氏原螯虾的精巢、输精管及精荚组织学与精巢周年变化研究[D]. 武汉: 华中农业大学: 7-12.
|
黄楷翔, 吴瑞梹, 陈弘成, 2011. 粗糙沼虾繁殖周期及其卵巢发育研究. 热带海洋学报, 30(1): 159-164 DOI:10.3969/j.issn.1009-5470.2011.01.023 |
蔡生力, 1998. 甲壳动物内分泌学研究与展望. 水产学报, 22(2): 154-161 |
樊玉杰, 2005. 红螯螯虾(Cherax quadricarinatus)生殖系统发育的研究[D]. 上海: 华东师范大学: 9-27.
|
颜素芬, 姜永华, 2004. 南美白对虾卵巢结构及发育的组织学研究. 海洋湖沼通报, (2): 52-58 DOI:10.3969/j.issn.1003-6482.2004.02.008 |
潘家模, 1994. 罗氏沼虾养殖新技术. 上海: 上海科学技术出版社, 1-40
|
薛鲁征, 堵南山, 赖伟, 1987. 中华绒螯蟹(Eriocheir sinensis)雌性生殖系统的组织学研究. 华东师范大学学报(自然科学版), (3): 88-97 |
戴习林, 王海洋, 过正乾, 等, 2016a. 罗氏沼虾多次产卵对子代生长与遗传结构的影响研究. 上海海洋大学学报, 25(4): 488-496 |
戴习林, 周梦颖, 鞠波, 等, 2016b. 养殖密度对罗氏沼虾生长、性别分化与性腺发育的影响. 水产学报, 40(12): 1874-1882 |
BOMIRSKI A, KLEK-KAWINSKA E, 1976. Stimulation of oogenesis in the sand shrimp, Crangon crangon, by a human gonadotrophi. General and Comparative Endocrinology, 30(3): 239-242 DOI:10.1016/0016-6480(76)90074-5 |
CARMONA-OSALDE C, OLVERA-NOVOA M A, RODRÍGUEZ-SERNA M, 2005. Effect of the protein-lipids ratio on growth and maturation of the crayfish Procambarus (Austrocambarus) llamasi. Aquaculture, 250(3): 692-699 |
CHEN D M, LIU F, ZHU Z H, et al, 2019. Ontogenetic development of gonads and external sexual characters of the protandric simultaneous hermaphrodite peppermint shrimp, Lysmata vittata (Caridea: Hippolytidae). PLoS ONE, 14(4): e0215406 DOI:10.1371/journal.pone.0215406 |
CHOW S, SANDIFER P A, 1991. Differences in growth, morphometric traits, and male sexual maturity among Pacific white shrimp, Penaeus vannamei, from different commercial hatcheries. Aquaculture, 92: 165-178 DOI:10.1016/0044-8486(91)90018-3 |
FAO, 2020. Fishery and aquaculture statistics. Global fishery and aquaculture production statistics v2020.1.1 (FishstatJ). In: FAO Fisheries and Aquaculture Department. Rome: Updated 2020. http://www.fao.org/fishery/statistics/software/fishstatj/en.
|
FELTERMAN M, ZOU E M, 2011. The exogenous methyl farnesoate does not impact ecdysteroid signaling in the crustacean epidermis in vivo. Aquaculture, 317(1/2/3/4): 251-254 |
GUIMARÃES M P, CALADO T C D S, BARROS M S F, 2021. Gonad development in mature females of tidal spray crab Plagusia depressa (Brachyura: Plagusiidae). Acta Zoologica, 102(3): 227-236 DOI:10.1111/azo.12337 |
HABASHY M M, 2013. On the breeding behaviour and reproduction of the freshwater prawn, Macrobrachium rosenbergii (de Man 1879) (Decapoda-Crustacea) under laboratory conditions. Aquaculture Research, 44(3): 395-403 DOI:10.1111/j.1365-2109.2011.03044.x |
JOVER M, FERNÁNDEZ-CARMONA J, DEL RÍO M C, et al, 1999. Effect of feeding cooked-extruded diets, containing different levels of protein, lipid and carbohydrate on growth of red swamp crayfish (Procambarus clarkii). Aquaculture, 178(1/2): 127-137 |
KING J E, 1948. A study of the reproductive organs of the common marine shrimp, Penaeus setiferus (Linnaeus). Biological Bulletin, 94(3): 244-262 DOI:10.2307/1538251 |
MINAGAWA M, SANO M, 1997. Oogenesis and ovarian development cycle of the spiny lobster Panulirus japonicus (Decapoda: Palinuridae). Marine and Freshwater Research, 48(8): 875-888 DOI:10.1071/MF97170 |
PRIMAVERA J H, PARADO-ESTEPA F D, LEBATA J L, 1998. Morphometric relationship of length and weight of giant tiger prawn Penaeus monodon according to life stage, sex and source. Aquaculture, 164(1/2/3/4): 67-75 |
SOUZA T L, BRAGA A A, LÓPEZ-GRECO L S, et al, 2018. Functional morphology of the male reproductive system in Callichirus major (Crustacea: Decapoda: Axiidea): Evidence of oocytes in the gonad. Acta Zoologica, 99(1): 32-41 DOI:10.1111/azo.12189 |
 2022, Vol. 53
2022, Vol. 53


