
中国海洋湖沼学会主办。
文章信息
- 玄文丹, 崔国辰, 李哲, 魏裙倚, 陶迎新, 刘连为, 陈峰, 陈新军, 朱文斌. 2022.
- XUAN Wen-Dan, CUI Guo-Chen, LI Zhe, WEI Qun-Yi, TAO Ying-Xin, LIU Lian-Wei, CHEN Feng, CHEN Xin-Jun, ZHU Wen-Bin. 2022.
- 东太平洋赤道海域茎柔鱼(Dosidicus gigas)小型群体资源分布及其渔场环境特征
- DISTRIBUTION AND ENVIRONMENTAL DEPENDENCY OF SMALL SCHOOLS OF SQUID DOSIDICUS GIGAS AND IN THE EQUATOR OF EASTERN PACIFIC OCEAN
- 海洋与湖沼, 53(5): 1234-1241
- Oceanologia et Limnologia Sinica, 53(5): 1234-1241.
- http://dx.doi.org/10.11693/hyhz20211200324
文章历史
-
收稿日期:2021-12-12
收修改稿日期:2022-01-24
2. 浙江省海洋水产研究所 浙江舟山 316021;
3. 江苏省海安市水产技术推广站 江苏海安 226600;
4. 农业农村部重点渔场渔业资源科学观测实验站 浙江舟山 316021;
5. 浙江省海洋渔业资源可持续利用技术研究重点实验室 浙江舟山 316021;
6. 上海海洋大学海洋科学学院 上海 201306
2. Zhejiang Marine Fisheries Research Institute, Zhoushan 316021, China;
3. Haian Aquatic Product Technology Promotion Department of Jiangsu Province, Haian 226600, China;
4. Scientific Observing and Experimental Station of Fishery Resources for Key Fishing Grounds, Ministry of Agriculture and Rural Affairs, Zhoushan 316021, China;
5. Key Laboratory of Sustainable Utilization of Technology Research for Fishery Resource of Zhejiang Province, Zhoushan 316021, China;
6. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China
茎柔鱼(Dosidicus gigas)属头足纲(Cephalopoda)、枪形目(Teuthoidea)、柔鱼科(Ommastrephidae)、茎柔鱼属(Dosidicus) (陈新军等, 2009), 为大洋性浅海种, 广泛分布于125°W以东的加利福尼亚(37°N)与智利(47°S)间的沿岸海域(Nigmatullin et al, 2001), 栖息水层深度可达1 200 m (Jereb et al, 2010)。茎柔鱼资源丰富, 在世界渔业中占据重要地位, 根据FAO统计数据, 1992~2001年茎柔鱼全球年捕捞产量平均为20×104 t, 2003年约为40×104 t, 2004年陡增至80×104 t, 之后常年维持70×104 t左右。2014和2015年茎柔鱼的全球年捕捞产量均在100×104 t以上, 其中2014年产量达116.2×104 t, 为历史最高产量, 2018年总产量为89.2×104t。茎柔鱼也是我国远洋渔业的主捕品种之一, 自2001年我国开始对秘鲁海域实施探捕以来, 茎柔鱼资源已逐渐成为我国头足类产量的重要组成部分, 约占我国头足类产量的30% (陈新军等, 2006)。茎柔鱼具有生命周期短, 产卵后死亡的特点, 其资源变动受到环境变化的显著影响(Nigmatullin et al, 2001)。
国内外已有较多关于茎柔鱼的报道。Nigmatullin等(2001)发现茎柔鱼根据分布海域及个体大小差异可分为不同种群, 小型群体被发现主要分布在赤道附近, 大型群体主要分布在高纬度海域, 中型群体与小型群体、大型群体有混合现象。王韫沛等(2019)对东太平洋赤道海域茎柔鱼耳石进行研究, 推测胴长组350~400 mm为赤道茎柔鱼耳石生长拐点。汪金涛等(2014)建立茎柔鱼资源补充量预测模型, 发现相比于索饵栖息环境, 产卵栖息环境对资源补充量的影响更大。Ichii等(2002)研究了海洋环境变化对茎柔鱼资源量的影响, 发现茎柔鱼的资源丰度与上升流密切相关。Arkhipkin等(2015)研究了外界温度对茎柔鱼成体大小和生命周期的影响, 证实了海表面温度与茎柔鱼生命周期的长短成负相关关系。截至目前, 有关茎柔鱼的研究多集中于种群结构、日龄与生长、生物学特性以及环境变化对资源的影响, 针对茎柔鱼小型群体开展资源分布及渔场环境状况分析的研究报道还较少。
了解渔业资源的生物学特性是深入研究其种群结构、繁殖和摄食生态的基础, 结合最新渔业、环境数据对东太平洋赤道海域茎柔鱼进行监测有助于了解当前资源状况, 为后期管理提供依据(Zhu et al, 2021)。本文基于2019年12月~2020年4月生产探捕数据, 结合同期卫星遥感数据, 对东太平洋赤道海域茎柔鱼种群结构进行研究, 并针对特定种群分析其资源分布及渔场环境特性, 以期为今后该特定种群远洋生产作业提供科学指导。
1 材料与方法 1.1 数据来源及研究区域生物学调查样品来源于“新吉利15”号随机抽样渔获物, 2019年12月~2020年2月份专项探捕调查过程中随机抽取1 148尾赤道茎柔鱼样本, 科学观察员每天现场测量30尾茎柔鱼样本, 剩余样本冷冻后带回实验室分析测定。
产量数据来源于舟山新吉利远洋渔业有限公司的“新吉利15”号以及舟山海洋渔业公司的“舟渔902”、“舟渔905”、“明兴轮”渔捞记录资料, 记录内容包含作业时间、捕捞产量(t)、作业位置(经度、纬度), 作业时间为2019年12月~2020年4月, 调查位置为东太平洋赤道海域(0°~5°S, 101°~116°W; 图 1), 本研究忽略渔船间差异。
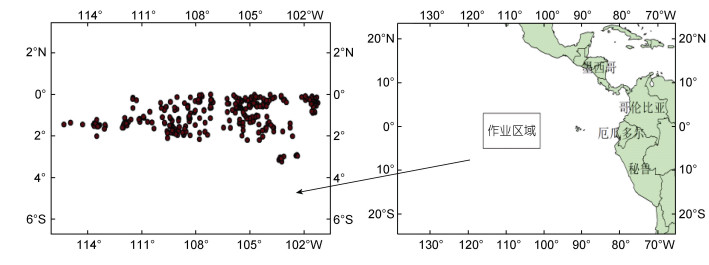 |
| 图 1 茎柔鱼调查海域 Fig. 1 The survey area of D. gigas 注: 左图为调查站位 |
海洋环境数据海表温度(sea surface temperature, SST)及叶绿素a (chl a) 来源于美国Ocean Data网站(https://oceandata.sci.gsfc.nasa.gov), 时间分辨率为月, 空间分辨率为9 km。
1.2 数据处理将茎柔鱼解冻后进行生物学测定, 测量了所有样本的胴长(mantle length, ML)、体重(body weight, BW), 胴长用板尺测量, 精确至1 mm; 体重用杆秤测量, 精确至5 g。性别、摄食强度及性腺发育程度采用肉眼观测。
对生产数据和环境数据进行预处理, 利用Arcgis 10.0软件将环境NC数据可视化处理为栅格数据, 为使生产数据与环境数据相匹配, 将所有月份渔获量及环境数据按照0.5°×0.5°单元格划分进行统一分辨率提取, 并将处理后的SST、chl a、单位捕捞努力量渔获量CPUE (catch per unit effort)叠加。
1.3 研究方法 1.3.1 基础生物学数据分析采用频率分布法分析茎柔鱼胴长、体重组成, 组间距分别为25 mm和125 g。
茎柔鱼胴长-体重关系采用幂函数拟合(费鸿年等, 1990), 表达式为:
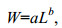 (1)
(1)式中, W为体重, L为胴长, a、b为参数, a为条件因子, 常表征鱼群生存环境优越程度; b为异速生长因子, 当b=3时, 表示鱼类个体等速生长; b > 3时, 表示鱼体呈正异速增长; b < 3时, 鱼体呈负异速增长(Froese, 2006)。
1.3.2 单位捕捞努力量渔获量(CPUE)与环境的关系分析利用名义CPUE(t/d)表征渔获量高低(杨香帅等, 2019)。其计算公式为
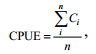 (2)
(2)式中, Ci为第i天的茎柔鱼渔获量, n为各船总作业天数。经运算以0.9、2.0、4.6 t/d作为节点将CPUE从低到高归类为Ⅰ、Ⅱ、Ⅲ、Ⅳ四个等级, 将CPUE与SST、chl a分别叠加。
1.3.3 不同因子对CPUE的影响在本研究选择温度、叶绿素a作为环境因子, 经度、纬度作为空间因子, 月份作为时间因子。建立模型之前, 先利用相关性分析对影响因子进行筛选, 具有显著相关性的两个因子保留一个(李迎冬等, 2021)。初步选择月份、经度、温度、叶绿素a作为影响因子。本研究以单位捕捞努力量渔获量(CPUE)为非独立变量, 海表温度(SST)、叶绿素a浓度(chl a)、经度(Longitude)、月份(Month)为解释变量, GAM (generalized additive model)模型表达式如下:
 (3)
(3)其中, CPUE代表单位捕捞努力量渔获量, Mon代表月份, Lon代表经度, SST代表海表温度, chl a代表叶绿素a, ε代表误差。利用P值以及F值检验影响因子重要性, F值越大, 因子越重要; P值越小, 结果越显著(南洋等, 2020)。将GAM模型中上下95%的置信区间虚实线最接近的部分定义为渔场最适环境范围(戴澍蔚等, 2017)。
本文采用SPSS 19.0软件计算CPUE四分位数, Excel 2016软件绘制胴长、体重频率分布图, Arcgis 10.0软件绘制研究区及环境因素图, Hdfview 3.0计算单元格SST、chl a值, R语言“mgcv”包进行GAM模型分析。
2 结果与分析 2.1 群体结构茎柔鱼胴长范围为136~407 mm, 平均胴长为239.8 mm。按性别区分茎柔鱼胴长组成, 雌性胴长范围145~380 mm, 平均胴长(240.5±29.2) mm; 雄性胴长范围136~407 mm, 平均胴长(236.9±28.7) mm。雌性和雄性优势胴长组均为200~275 mm, 分别占雌性和雄性样本总数的83.31%和89.07% (图 2)。样本体重范围为117~1 557 g。雌性样本体重范围为117.4~1 460.0 g, 雄性体重范围为120.0~1 556.8 g, 其中雌性和雄性优势体重组均为225~475 g, 分别占雌性和雄性样本总数86.80%和90.93% (图 2)。
 |
| 图 2 茎柔鱼胴长、体重频率分布 Fig. 2 Frequency distribution of mantle length and body weight of D. gigas |
茎柔鱼的胴长与体重的关系存在显著的性别差异(ANCOVA, F=12.101, P < 0.01), 因此按雄雌分别探究胴长与体重的关系(图 3)。根据体重和胴长的幂指数拟合关系: 雌性, W=7×10–5L2.821 6 (R2=0.923, n=773); 雄性, W=7×10–5L2.826 2 (R2=0.937, n=375)。
 |
| 图 3 东太平洋茎柔鱼胴长-体重拟合关系 Fig. 3 Mental length-weight relationship of D. gigas in the eastern Pacific Ocean |
根据1 148尾茎柔鱼样本的性腺判定, 雌性773尾, 雄性375尾, 雌雄比例约为2︰1。除1尾样本无法判定性腺成熟度外, 其余772尾雌性样本, Ⅰ期36尾, Ⅱ期622尾, Ⅲ期103尾, Ⅳ期8尾, Ⅴ期3尾。根据茎柔鱼性腺成熟度划分, Ⅰ、Ⅱ期为性未成熟, 占雌性样本的85.2%; Ⅲ、Ⅳ期为性成熟, 占雌性样本的14.4%; Ⅴ期为繁殖后, 占雌性样本的0.4%。根据性腺成熟度占比分析, 绝大部分雌性茎柔鱼处于未成熟阶段。
解剖1 148尾茎柔鱼样本, 判定空胃个体176尾, 占比15.3%; 1级个体430尾, 占比37.4%; 2级个体273尾, 占比23.8%; 3级个体227尾, 占比19.8%; 4级个体42尾, 占比3.7%。
2.3 渔获量及CPUE月变化2019年12月~2020年4月东太平洋茎柔鱼渔获量及CPUE波动明显(图 4), 各月渔获量呈先上升后下降趋势。2月渔获量最高, 为405.8 t, 占全部渔获量的37.15%, 1月次之, 为354.2 t, 占全部渔获量的32.42%, 4月渔获量最低, 为33.2 t, 占全部渔获量的3.04%; CPUE曲线除2月增加外, 总体呈下降趋势, 2019年12月CPUE最高为6.7 t/d, 4月最低为1.3 t/d。
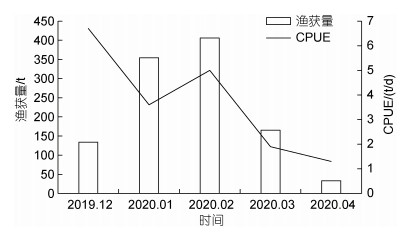 |
| 图 4 东太平洋茎柔鱼产量及CPUE月变化 Fig. 4 Monthly variation of yield and CPUE of D. gigas in the eastern Pacific Ocean |
由表 1可知, 2019年12月~2020年4月SST呈逐渐增加趋势, chl a浓度变化幅度较小, 各月高CPUE (> 4.6 t/d)海域SST均值也呈逐渐增大趋势。渔场大多分布于海洋锋带附近, 各月份作业海域chl a差异小。
| 时间(年.月) | SST范围/℃ | chl a范围/(mg/m3) | 高CPUE海域SST均值/℃ | 高CPUE海域chl a均值/(mg/m3) |
| 2019.12 | 22.68~26.29 | 0.07~0.26 | 24.35 | 0.19 |
| 2020.01 | 23.26~27.49 | 0.07~0.27 | 24.25 | 0.18 |
| 2020.02 | 24.57~27.77 | 0.09~0.27 | 25.09 | 0.16 |
| 2020.03 | 25.77~28.36 | 0.10~0.36 | 26.33 | 0.20 |
| 2020.04 | 26.18~29.15 | 0.08~0.28 | — | — |
GAM模型拟合结果如下(图 5)。海表温效应图显示, 茎柔鱼CPUE随海表温上升而不断下降, 上下95%的置信区间虚实线最接近的部分为24.5~25.5 ℃, 即最适SST范围为24.5~25.5 ℃; 最适chl a范围是0.16~0.20 mg/m3; 经度效应图显示, 经度集中分布于105°~114°W; 从月份效应图可以发现CPUE的月份变化较大, 2019年12月显著高于其他月份, 2020年1~4月CPUE整体变化不大。
 |
| 图 5 CPUE与SST、chl a、经度、月份的GAM模拟结果 Fig. 5 The GAM simulation results of CPUE and SST, chl a, longitude and month |
SST、chl a、经度、月份与CPUE的GAM模型检验结果如表 2, 月份与CPUE关系极显著(P < 0.001)其他因子在CPUE上的回归均不显著(P > 0.05)。月份因子对应F值最大, 说明月份在模型构建中最重要。
| 影响因子 | F值 | P值 |
| 月份 | 9.130 3 | 2.599×10–6*** |
| 经度 | 0.916 5 | 0.341 |
| 海表温 | 0.876 7 | 0.351 |
| 叶绿素a | 0.707 3 | 0.402 |
| 注: ***表示0.001水平上显著相关(P < 0.001) | ||
调查期间, 赤道茎柔鱼平均胴长为239.8 mm, 优势胴长为200~275 mm。根据Nigmatullin等(2001)的茎柔鱼群体划分方法, 这一时期该海域的茎柔鱼属于小型群体(130~340 mm)。本次东太平洋赤道海域茎柔鱼探捕调查中, 茎柔鱼的优势胴长范围与类似探捕调查的结果分布在类似区间(陈新军等, 2012; 章寒等, 2019)。此外茎柔鱼小型群体被发现主要分布在赤道附近(Nigmatullin et al, 2001), 本次调查对象分布赤道海域, 进一步证实其为小型群体。
异速生长因子反映了生物个体的生长率及其身体形态发育等特征(韩飞等, 2019)。样本中茎柔鱼的胴长和体重存在明显的幂指数关系, 异速生长因子b < 3, 表明调查期间该海域的茎柔鱼群体表现出负异速增长。2013年茎柔鱼的异速生长因子b稍大于3, 群体表现为等速生长或微弱正异速生长(陆化杰等, 2014)。有研究表明, b值大小与生活阶段的不同有关(刘勇等, 2006)。章寒等(2019)推断2~3月为赤道茎柔鱼生长发育期, 本文茎柔鱼样本时间跨度为12月~翌年2月, 2013年陆化杰等(2014)研究渔捞日志时间跨度为4~6月, 分别处于生长发育期前后; 此外, 同一海域食物丰度差异以及栖息环境变化也会对茎柔鱼b值造成影响(韩飞等, 2019), 因此, 该异速生长因子与前期研究结果的差异可能反映了生长阶段和海洋环境的变化。
3.2 茎柔鱼渔获量的月际变化2019年12月至2020年4月各月渔获量呈先上升后下降趋势(图 4), 这与各月份渔船作业总天数不同有关, 各月作业总天数分别为20、98、81、89、25 d, 产量与作业天数呈正相关。2020年3月渔船作业位置分散, 可能是部分茎柔鱼达到性成熟胴长后开始离开赤道海域进行洄游所致, 章寒等(2019)推断2~3月为赤道茎柔鱼生长发育期, 茎柔鱼进行洄游, 本次鉴定结果表明性成熟茎柔鱼较少, 侧面支持该结论, 因此鱼群位置分散是导致3月产量低的原因。
除2020年2月外, 各月CPUE整体呈下降趋势(图 4)。许骆良等(2015)研究表明茎柔鱼全年产卵, 但产卵高峰期为10月至翌年1月, 主要为11月, 茎柔鱼产卵后死亡导致CPUE下降。此外2019年秋季至2020年春季中东太平洋发生一次弱厄尔尼诺事件(洪洁莉等, 2020), 厄尔尼诺事件导致茎柔鱼渔场水温变暖, 适宜栖息地面积减少(温健等, 2020), 资源丰度下降, 故厄尔尼诺事件也是造成不同月份产量及CPUE差异的原因。
3.3 茎柔鱼CPUE的影响因子GAM模型结果显示除月份外其他因子在CPUE上的回归均不显著(P > 0.05) (表 2)。SST与CPUE无显著相关性原因可能是茎柔鱼具备昼夜垂直移动特性, 夜晚上游至0~200 m水层活动, 因此除表层水温外, 垂直分层水温也会对CPUE空间分布造成影响。如刘赫威等(2021)研究认为200 m水层海水温度对阿根廷滑柔鱼(Illex argentinus)栖息地的分布影响最为重要; 杨胜龙等(2019)发现水温垂直结构的变化会影响黄鳍金枪鱼(Thunnus albacares)的水平空间分布。此外, 方星楠等(2022)对东太平洋赤道海域茎柔鱼渔场时空分布进行研究, 发现SST与CPUE显著相关, 与本文结果不一致, 原因可能是渔获物捕捞月份不同, 茎柔鱼发育阶段存在差异。有研究表明, 各环境因子对茎柔鱼的不同生长阶段的影响不同(方学燕等, 2017), 本文作业时间为2019年12月~2020年4月, 茎柔鱼主要处于生长发育期前, 方星楠等(2022)作业时间为2017年1~7月。
chl a浓度是表征浮游植物丰富程度的一个重要参数(党晓岩等, 2019), 本研究chl a与CPUE无显著关系, 原因可能是形成渔场的关键取决于浮游生物的量和规模(许永久等, 2007), 而除chl a浓度外, 营养盐、海流等环境因子同样影响浮游生物(宋利明等, 2020)。如王之明等(2018)根据2017年7月草海丰水期水质数据, 发现营养盐对浮游植物影响程度最大, 唐森铭等(2017)发现东海chl a略有上升趋势, 但浮游植物群落结构和生物量有明显的变化, 推测这与气候变化背景下海洋热动力环境的长期变化及其对营养盐供给的影响关系密切。此外本次研究区域chl a浓度变化不大(0.07~0.36 mg/m3), 因此chl a对CPUE的影响不明显。
月份作为时间因子, 对东太平洋茎柔鱼CPUE影响最为显著, 其不直接影响茎柔鱼资源的分布及大小, 而是通过温度、盐度等环境因子间接影响(邱永松, 1988)。不同月份除SST及chl a浓度存在不同外, 初级生产力也有差异, 厄尔尼诺事件导致上升流减弱, 致使初级生产力下降。
茎柔鱼CPUE月间变化显著, 说明并非单一环境因子影响, 本文只考虑SST、chl a单一因子效应, 并未考虑不同因子间协同效应(如SST变化会对chl a造成影响), 今后应考虑各因子间协同作用。通常随着收集数据越来越多, 显著性可能增强(谢恩阁等, 2019), 今后可以收集长时间序列数据, 以便更加精确了解各环境因子对茎柔鱼CPUE的影响。
4 结论(1) 综合分析东太平洋赤道海域茎柔鱼空间分布、作业时间、基础生物学数据, 结合已有研究结果, 明确了本次调查对象主要为茎柔鱼小型群体。
(2) 茎柔鱼小型群体生长发育期(2~3月)对渔场分布有重要影响, 生长发育期前茎柔鱼集群度高, 生长发育期后逐渐分散活动。
(3) 影响茎柔鱼CPUE的环境因子复杂, 需综合考虑多个环境因素及其交互影响。
王之明, 王堃, 刘绥华, 等, 2018. 草海丰水期chl-a空间分布与环境因子相关关系. 人民长江, 49(14): 34-39 |
王韫沛, 陈新军, 方舟, 等, 2019. 东太平洋赤道海域茎柔鱼耳石外部形态特征分析. 海洋湖沼通报, (6): 147-156 |
方学燕, 陈新军, 冯永玖, 等, 2017. 基于综合环境因子的协同克里金法分析茎柔鱼资源丰度空间分布. 海洋学报, 39(2): 62-71 DOI:10.3969/j.issn.0253-4193.2017.02.006 |
方星楠, 余为, 陈新军, 2022. 东太平洋赤道海域茎柔鱼渔场的时空分布. 水产科学, 41(3): 475-483 |
刘勇, 严利平, 程家骅, 2006. 东海北部和黄海南部鲐鱼生长特性及合理利用. 中国水产科学, 13(5): 814-822 DOI:10.3321/j.issn:1005-8737.2006.05.019 |
刘赫威, 余为, 陈新军, 等, 2021. 基于不同水层海水温度的阿根廷滑柔鱼栖息地模型构建. 大连海洋大学学报, 36(6): 1035-1043 |
许永久, 张敏, 2007. 东南太平洋智利竹筴鱼渔场浮游生物数量分布及与渔场关系. 海洋渔业, 29(4): 289-295 |
许骆良, 陈新军, 汪金涛, 2015. 2003-2012年秘鲁外海茎柔鱼资源丰度年间变化分析. 上海海洋大学学报, 24(2): 280-286 |
李迎冬, 张崇良, 纪毓鹏, 等, 2021. 山东半岛南部海域小黄鱼时空分布及其与环境因子的关系. 中国水产科学, 28(4): 442-450 |
杨香帅, 邹晓荣, 徐香香, 等, 2019. ENSO现象对东南太平洋智利竹筴鱼资源丰度及其渔场变动的影响. 上海海洋大学学报, 28(2): 290-297 |
杨胜龙, 张忭忭, 张衡, 等, 2019. 黄鳍金枪鱼垂直移动及水层分布研究进展. 水产科学, 38(1): 119-126 |
邱永松, 1988. 南海北部大陆架鱼类群落的区域性变化. 水产学报, 12(4): 303-313 |
汪金涛, 陈新军, 高峰, 等, 2014. 基于环境因子的东南太平洋茎柔鱼资源补充量预报模型研究. 海洋与湖沼, 45(6): 1185-1191 |
宋利明, 许回, 陈明锐, 等, 2020. 毛里塔尼亚海域日本鲭时空分布与海洋环境的关系. 上海海洋大学学报, 29(6): 868-877 |
陆化杰, 王从军, 陈新军, 2014. 东太平洋赤道公海茎柔鱼生物学特性. 广东海洋大学学报, 34(4): 1-8 |
陈新军, 刘必林, 王尧耕, 2009. 世界头足类. 北京: 海洋出版社
|
陈新军, 李建华, 易倩, 等, 2012. 东太平洋赤道附近海域茎柔鱼(Dosidicus gigas)渔业生物学的初步研究. 海洋与湖沼, 43(6): 1233-1238 |
陈新军, 赵小虎, 2006. 秘鲁外海茎柔鱼产量分布及其与表温关系的初步研究. 上海水产大学学报, 15(1): 65-70 |
南洋, 张倩倩, 张碧辉, 2020. 基于GAM模型分析中国典型区域网格化PM2.5长期变化影响因素. 环境科学, 41(2): 499-509 |
洪洁莉, 郑志海, 2020. 2020年春季我国气候特征及成因分析. 气象, 46(10): 1375-1384 |
费鸿年, 张诗全, 1990. 水产资源学. 北京: 中国科学技术出版社, 1-21
|
党晓岩, 伍玉梅, 樊伟, 等, 2019. 黄、东海Chl a浓度与环境因子的相关分析. 中国海洋大学学报, 49(S1): 93-101 |
唐森铭, 蔡榕硕, 郭海峡, 等, 2017. 中国近海区域浮游植物生态对气候变化的响应. 应用海洋学学报, 36(4): 455-465 |
章寒, 郑基, 虞聪达, 等, 2019. 东太平洋赤道海域茎柔鱼主要生物学特性比较研究. 中国水产科学, 26(4): 745-755 |
韩飞, 陈新军, 林东明, 等, 2019. 东太平洋赤道海域茎柔鱼体征生长及生殖投入. 水产学报, 43(12): 2511-2522 |
温健, 贡静雯, 李婷, 等, 2020. 异常气候条件下秘鲁外海茎柔鱼栖息地的时空变动. 海洋学报, 42(10): 92-99 |
谢恩阁, 陈新军, 汪金涛, 等, 2019. 基于水温因子的太平洋褶柔鱼冬生群剩余产量模型研究. 海洋学报, 41(12): 71-77 |
戴澍蔚, 唐峰华, 樊伟, 等, 2017. 北太平洋公海日本鲭资源分布及其渔场环境特征. 海洋渔业, 39(4): 372-382 |
ARKHIPKIN A, ARGÜELLES J, SHCHERBICH Z, et al, 2015. Ambient temperature influences adult size and life span in jumbo squid (Dosidicus gigas). Canadian Journal of Fisheries and Aquatic Sciences, 72(3): 400-409 |
FROESE R, 2006. Cube law, condition factor and weight-length relationships: history, meta-analysis and recommendations. Journal of Applied Ichthyology, 22(4): 241-253 |
ICHII T, MAHAPATRA K, WATANABE T, et al, 2002. Occurrence of jumbo flying squid Dosidicus gigas aggregations associated with the countercurrent ridge off the Costa Rica Dome during 1997 El Niño and 1999 La Niña. Marine Ecology Progress Series, 231: 151-166 |
JEREB P, ROPER C F E, 2010. Cephalopods of the World: An Annotated and Illustrated Catalogue of Cephalopod Species Known to Date. Volume 2: Myopsid and Oegopsid Squids. Rome: Food and Agriculture Organization of the United Nations:: 605 |
NIGMATULLIN C M, NESIS K N, ARKHIPKIN A I, 2001. A review of the biology of the jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae). Fisheries Research, 54(1): 9-19 |
ZHU W B, LU Z H, DAI Q, et al, 2021. Transition to timely and accurate reporting: an evaluation of monitoring programs for China's first Total Allowable Catch (TAC) pilot fishery. Marine Policy, 129: 104503 |
 2022, Vol. 53
2022, Vol. 53


