
中国海洋湖沼学会主办。
文章信息
- 姚昕, 孙省利, 张才学, 廖海晴, 彭宇航. 2022.
- YAO Xin, SUN Xing-Li, ZHANG Cai-Xue, LIAO Hai-Qing, PENG Yu-Hang. 2022.
- 硇洲岛大型海藻场软体动物群落的季节演替及其与环境因子的关系
- RELATIONSHIP BETWEEN SEASONAL SUCCESSION OF MOLLUSC COMMUNITIES AND ENVIRONMENTAL FACTORS IN NAOZHOU ISLAND, SOUTH CHINA SEA
- 海洋与湖沼, 53(5): 1258-1268
- Oceanologia et Limnologia Sinica, 53(5): 1258-1268.
- http://dx.doi.org/10.11693/hyhz20211200355
文章历史
-
收稿日期:2021-12-31
收修改稿日期:2022-03-13
2. 广东海洋大学海洋资源与环境监测中心 广东湛江 524088
2. Marine Resources and Environmental Monitoring Center, Guangdong Ocean University, Zhanjiang 524088, China
硇洲岛位于粤西湛江市东南部的海域上, 距离湛江市区约40 km, 岛屿陆地面积为56 km2, 北临东海岛, 西临雷州半岛, 是典型的潮间带生态系统, 潮间带是海洋与陆地物质循环和能量交换不可或缺的桥梁。其东部沿岸长期受海浪侵蚀, 只有岛南部海岸是砂质岸, 其余岛上地貌均以玄武岩台地为主, 属于火山岛屿(张文杰等, 2012)。其地势为四周向中间逐渐隆起, 因此岛上充足的降雨绝大部分流入海洋, 岛屿周围并无河流, 海水盐度变化不大。气候上属于热带气候, 此地适宜底栖生物生存, 四周水产品丰富。硇洲岛东部也是天然海藻场, 其中以马尾藻Sargassum、羊栖菜Hizikia fusifarme和石莼Ulva lactuca等居多(张才学等, 2020)。底栖生物被誉为“生态系统工程师”, 其通过生物作用对整个生态系统做出重要贡献(Covich et al, 1999), 因此也可以作为生态指标的一部分, 用于监控滨海水质的状态(Rossaro et al, 2007; Miler et al, 2013; Lazaridou et al, 2018), 底栖生物的多样性反映出地理环境的多样性。但近几十年发现大型海藻的生物量及丰度大量减少, 同时伴随着底栖软体生物的减少。底栖生物的减少量与生态受到的危害程度成正比, 某些无脊椎动物会将致病菌传播给脊椎动物, 导致其生物量下降, 而部分鱼类的死亡导致生态系统的恶性循环(Covich et al, 1999), 对底栖生物的研究对于掌握海洋生态系统具有重要作用(李亚芳等, 2018)。目前对于硇洲岛底栖软体生物的研究较少, 对此进行调查有助于海洋生态修复的研究。
1 材料与方法 1.1 样品的采集和分析 1.1.1 采集地点与方法硇洲岛为火山爆发后产生的岛屿, 属于北热带海洋性气候。从地质来看, 自下而上为第四纪广组滨海沉积物和风化残积土, 表层为大量玄武岩掺杂红色亚黏土(孔中恒, 2004; 张文杰等, 2012)。其潮汐属于半日不规则潮型, 潮高基准为190 cm, 全年平均为192 cm (国家海洋信息中心, 2020)。于2011~2012年在湛江市硇洲岛采集底栖软体动物, 根据岛屿地形以及当地人们活动影响设置5个采样断面, 5个断面地理位置分别为D1 (110.64°E, 20.93°N)、D2 (110.63°E, 20.92°N)、D3 (110.62°E, 20.89°N)、D4 (110.61°E, 20.87°N)和D5 (110.62°E, 20.84°N) (图 1)。根据岛屿的地貌设置每条断面6个采样位点, 其中高潮区1个, 所在位置平均潮高为3.50 m; 中潮区分为中上潮区、中潮区和中下潮区共3个, 所在位置平均潮高分别为2.26 m、1.90 m和1.40 m; 低潮区分为低上潮区和低下潮区共2个, 所在位置平均潮高分别为1.10 m和0.80 m。在春季、夏季、秋季和冬季大潮时分别进行底栖软体动物的调查, 定量取样面积为0.25 m×0.25 m, 确定取样具体地点应当是在经过观察之后选取的具有代表性的地点, 采集方法按照《海洋调查规范》(GB/T 12763.6- 2007) (中华人民共和国国家质量监督检验检疫总局等, 2008)进行, 取样时需先将取样框内清理干净, 采集后现场用海水简单清洗, 将取得样品装入密封袋中并加入甲醇固定液, 带回实验室进行分析。
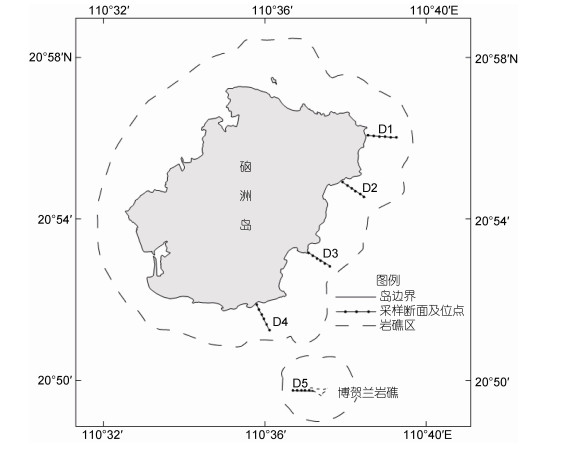 |
| 图 1 采样断面及其站位 Fig. 1 Sampling section and location |
水质样品在每个断面退潮时水深1 m处用5 L聚乙烯塑料桶采集; 叶绿素a (chl a)样品用1 L聚乙烯瓶在表层采集, 加入10 g/L的MgCO3共5 mL保存, 并在24 h内完成检测; 水温(WT)和pH值采用Thermo Orion520M-01A多参数测量仪现场测定; 盐度(SAL)采用Orion130A盐度计现场测定。
总有机碳(TOC)采用非色散红外线吸收法, 所用仪器为岛津TOC-VCSH总有机碳分析仪; 悬浮物(SS)采集后在24 h内使用0.45 μm水系混合滤膜进行抽滤; chl a采用丙酮萃取法; 总无机氮(DIN)即NO2-、NO3-和NH4+, 分别采用盐酸萘乙二胺分光光度法、锌-镉还原法以及次溴酸盐氧化法; 磷酸盐(PO43-)和硅酸盐(SiO32-)分别采用磷钒钼黄分光光度法和硅钼黄法。
1.1.2 数据处理方法使用Microsoft Office 2016进行数据初步统计和分析, Origin Pro 2017进行图片绘制, 相关性分析使用SPSS 26.0与Canoco5.0进行分析。
相对重要性指数IRI (Pianka, 1971), 其计算公式为:
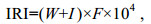 (1)
(1)物种多样性指数采用Shannon-Wiener多样性指数(H') (徐兆礼等, 1989), 其计算公式为:
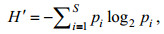 (2)
(2)Pielou均匀度指数(J) (Shannon, 2001), 其计算公式为:
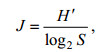 (3)
(3)Margalef物种丰富度指数(d) (Ulanowicz, 2001), 其计算公式为:
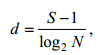 (4)
(4)Simpson优势度指数(D) (Pielou, 1966), 其计算公式为:
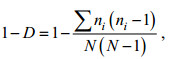 (5)
(5)种间更替率R (周伟男等, 2013), 其计算公式为:
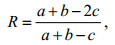 (6)
(6)以上式中, W为某一种类的生物量占总生物量的比, I为某一种类的个体数占总个数的比, S代表物种总数, ni为第i种的个体数, F为第某一种在各站位或各季节间出现的频率, 本文采用季节频率, 视IRI≥1 000为优势种, pi为第i种在全部采样中的比例, ɑ和b为两季节的种类数, c为两季节的共有种类数, R值在0~1之间, 数越大代表群落更替越明显, R值为0表示两季节相同, R值为1表示两季节无相同种。
2 结果 2.1 硇洲岛软体动物种类组成及优势种演替规律此次调查发现硇洲岛共有软体动物104种, 其中双壳纲39种, 占总数的37.50%, 栖息密度占总密度的7.76%; 腹足纲59种, 占总数的56.73%, 栖息密度占比为91.32%, 是软体动物的中主要物种; 多板纲4种, 占总数的3.85%, 栖息密度占比为0.88%; 头足纲2种, 占总数的1.92%, 栖息密度占比为0.04%。
其种类数随季节变化, 秋季最多共61种, 春季32种, 夏季51种, 冬季55种。各季节间共有种类数为19~33种。有8个种类为3个季节共有种, 分别为: 僧帽牡蛎Saccostrea cucullata、岐脊加夫蛤G. divaricatum、筐核果螺Drupa fiscella、变化短齿蛤Brachidontes variabilis、日本花棘石鳖Liolophura japonica、葡萄核果螺Drupa uva、嫁
| 名称 | 春/夏 | 春/秋 | 春/冬 | 夏/秋 | 夏/冬 | 秋/冬 |
| 共有种数 | 20 | 18 | 19 | 33 | 31 | 33 |
| 种类数 | 32/51 | 32/61 | 32/55 | 51/61 | 51/55 | 61/55 |
| 更替率R | 0.68 | 0.76 | 0.72 | 0.58 | 0.59 | 0.60 |
优势种以栖息密度作为统计依据, 对硇洲岛底栖软体动物研究发现优势种共10种, 以繁殖率高, 个体较小和质量较轻的种类为主。其中腹足纲8种, 分别为: 粗糙滨螺Littoraria articulata、粒结节滨螺Nodilittorina radiata、双带盾桑椹螺Clypemorus bifasciatus、疣荔枝螺Thais clavigera、筐核果螺Drupa fiscella、塔结节滨螺Nodilittorina trochoides、平轴螺Planaxis sulcatus、单齿螺Monodonta labio; 双壳纲2种: 嫁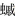
| 季节 | 序号 | 优势种 | 季节栖息密度/(ind./m2) | IRI |
| 春季 | 1 | 粒结节滨螺Nodilittorina radiata | 6 861 | 5 682.76 |
| 2 | 塔结节滨螺Nodilittorina trochoides | 1 760 | 1 495.84 | |
| 3 | 双带盾桑椹螺Clypemorus bifasciatus | 1 623 | 5 304.93 | |
| 4 | 嫁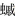 Cellana toreuma Cellana toreuma |
899 | 1 223.93 | |
| 5 | 单齿螺Monodonta labio | 600 | 1 115.43 | |
| 夏季 | 1 | 塔结节滨螺Nodilittorina trochoides | 4 832 | 3 184.93 |
| 2 | 粒结节滨螺Nodilittorina radiata | 3 744 | 3 184.93 | |
| 3 | 双带盾桑椹螺Clypemorus bifasciatus | 848 | 2 180.29 | |
| 4 | 筐核果螺Drupa fiscella | 304 | 1 200.86 | |
| 秋季 | 1 | 粒结节滨螺Nodilittorina radiata | 3 616 | 3 499.94 |
| 2 | 塔结节滨螺Nodilittorina trochoides | 3 280 | 3 109.82 | |
| 3 | 平轴螺Planaxis sulcatus | 916 | 1 704.15 | |
| 4 | 双带盾桑椹螺Clypemorus bifasciatus | 704 | 1 711.86 | |
| 5 | 疣荔枝螺Thais clavigera | 284 | 1 632.31 | |
| 冬季 | 1 | 粒结节滨螺Nodilittorina radiata | 2 784 | 1 133.53 |
| 2 | 粗糙滨螺Littoraria articulata | 672 | 4 594.47 | |
| 3 | 平轴螺Planaxis sulcatus | 416 | 1 389.00 | |
| 4 | 僧帽牡蛎Saccostrea cucullata | 128 | 1 484.82 | |
| 5 | 疣荔枝螺Thais clavigera | 112 | 1 059.01 |
全年优势种为粒结节滨螺Nodilittorina radiata; 3个季节共有优势种为双带盾桑椹螺Clypemorus bifasciatus和塔结节滨螺Nodilittorina trochoides。优势群落由春季的双带盾桑椹螺、塔结节滨螺、单齿螺和嫁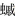
软体动物分布特征较为明显, 其高潮区种类数为3种, 中上区32种, 中中区32种, 中下区41种, 低上区28种以及低下区34种。其栖息密度存在季节变化: 大体上由高潮区向低潮区逐渐降低, 高潮区栖息密度最大, 低潮区栖息密度最少。春季变化量最大, 高潮区密度最大, 中中区位居第二, 中上区密度较低; 夏季与春季相比略有相似, 在中中区向中下区有一定的回弹; 秋季与冬季相似, 栖息密度由高潮区向低潮区逐渐降低(图 2)。
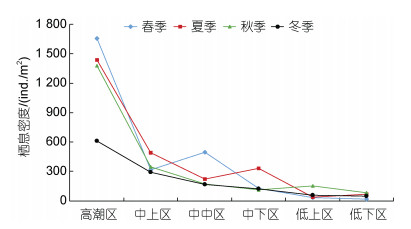 |
| 图 2 硇洲岛软体动物栖息密度潮间带分布与季节的关系 Fig. 2 The relationship between intertidal zone distribution and seasons of mollusk habitat density on Naozhou Island |
对不同季节以及全年断面的软体动物栖息密度进行聚类分析以及MDS分析, 综合考虑优势种以及栖息密度, 可以将硇洲岛分为2个底栖软体动物群落: 群落1为粗糙滨螺-粒结节滨螺-双带盾桑椹螺群落。此群落分布在硇洲岛边缘, 包括D1~D4断面。优势种为粗糙滨螺、粒结节滨螺、双带盾桑椹螺、疣荔枝螺、筐核果螺、塔结节滨螺、平轴螺、单齿螺、僧帽牡蛎和嫁
不同季节的软体动物群落有所不同, 除秋季外的3个季节分为3个群落且相似性均在40%以上, 秋季在35%的相似性上分为3个群落(图 3)。
 |
| 图 3 硇洲岛软体动物各季节聚类分析及MDS分析图 Fig. 3 Seasonal cluster analysis and MDS analysis of molluscs in Naozhou Island |
春季群落1为粒结节滨螺-双带盾桑椹螺-疣荔枝螺群落, 优势种为粒结节滨螺、双带盾桑椹螺、疣荔枝螺、粗糙滨螺、塔结节滨螺、平轴螺、嫁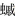
夏季群落1为粗糙滨螺-粒结节滨螺-疣荔枝螺群落, 优势种为粗糙滨螺、粒结节滨螺、疣荔枝螺、筐核果螺、塔结节滨螺、单齿螺、僧帽牡蛎、双带盾桑椹螺、平轴螺和嫁
秋季群落1为粗糙滨螺-粒结节滨螺-双带盾桑椹螺群落, 优势种为粗糙滨螺、粒结节滨螺、双带盾桑椹螺、疣荔枝螺、筐核果螺、塔结节滨螺、平轴螺、僧帽牡蛎和单齿螺, 包括D1、D3和D4断面; 群落2为疣荔枝螺-筐核果螺-平轴螺群落, 优势种为疣荔枝螺、筐核果螺、平轴螺和单齿螺, 仅包括D2断面; 群落3为粗糙滨螺-疣荔枝螺-筐核果螺群落, 优势种为粗糙滨螺、疣荔枝螺、筐核果螺和僧帽牡蛎, 仅包括D5断面。
冬季群落1为粗糙滨螺-粒结节滨螺-疣荔枝螺群落, 优势种为粗糙滨螺、粒结节滨螺、疣荔枝螺、筐核果螺、塔结节滨螺、平轴螺、僧帽牡蛎、嫁
对硇洲岛底栖软体动物的物种多样性分析发现, 各季节软体动物栖息密度存在季节变化趋势, 按降序排列为春季(441.26 ind./m2)、夏季(431.55 ind./m2)、秋季(374.24 ind./m2)和冬季(215.60 ind./m2), 年平均值为365.66 ind./m2 (图 4)。季度Shannon-Wiener多样性指数变化范围为2.45~3.42, 按降序排列为冬季、秋季、夏季和春季, 年均值为2.99; 季度Pielou物种均匀度指数变化范围为0.53~0.66, 按降序排列为冬季、秋季、夏季和春季, 年均值为0.58; 季度Margalef物种丰富度指数变化范围为2.42~4.61, 按降序排列为秋季、冬季、夏季和春季, 年均值为3.73; Simpson指数变化范围为0.69~0.80, 按降序排列为秋季、冬季、夏季和春季, 年均值为0.76 (表 3)。
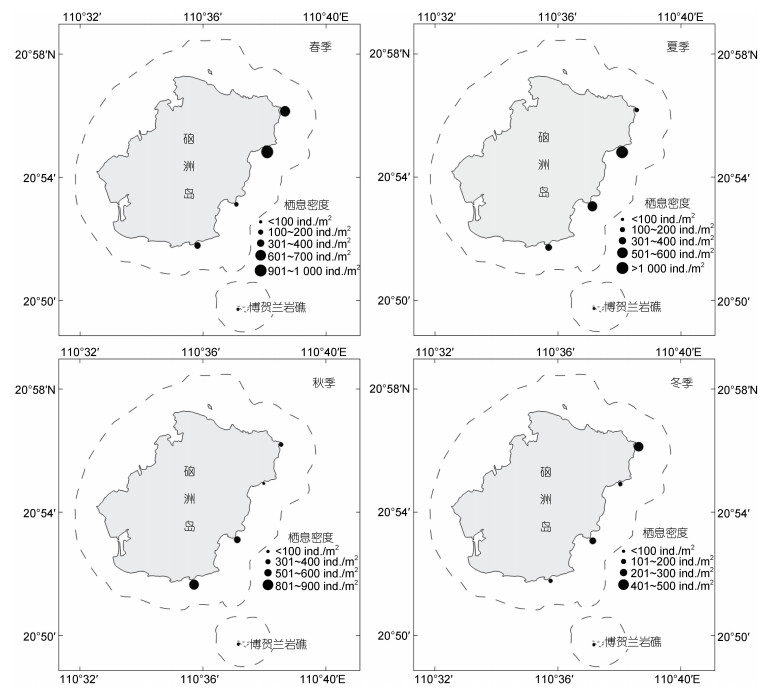 |
| 图 4 硇洲岛软体动物栖息密度分布气泡图 Fig. 4 The bubble map of mollusk habitat density distribution in Naozhou Island |
| 项目 | d | j | H' | D |
| 春季 | 2.42 | 0.53 | 2.45 | 0.69 |
| 夏季 | 3.80 | 0.56 | 2.94 | 0.77 |
| 秋季 | 4.61 | 0.58 | 3.16 | 0.80 |
| 冬季 | 4.10 | 0.66 | 3.42 | 0.79 |
| 平均 | 3.73 | 0.58 | 2.99 | 0.76 |
| 最小值 | 2.42 | 0.53 | 2.45 | 0.69 |
| 最大值 | 4.61 | 0.66 | 3.42 | 0.80 |
通过ABC曲线分析硇洲岛底栖软体动物的稳定性, W值(W-statistic)反应生物量与栖息密度的关系, 为正值表示群落稳定未受到干扰或者受到微弱干扰, 反之为负值。调查发现D1~D4断面的生物均受到不同程度的干扰, 其栖息密度曲线除D4断面个别交叉点之外, 均在生物量曲线之上, 其W值均小于零, D5断面离人类活动区域较远, W为正值, 但丰度曲线与生物量曲线有小部分交叉, 表示受到干扰, 只是程度远不及其他断面(图 5)。
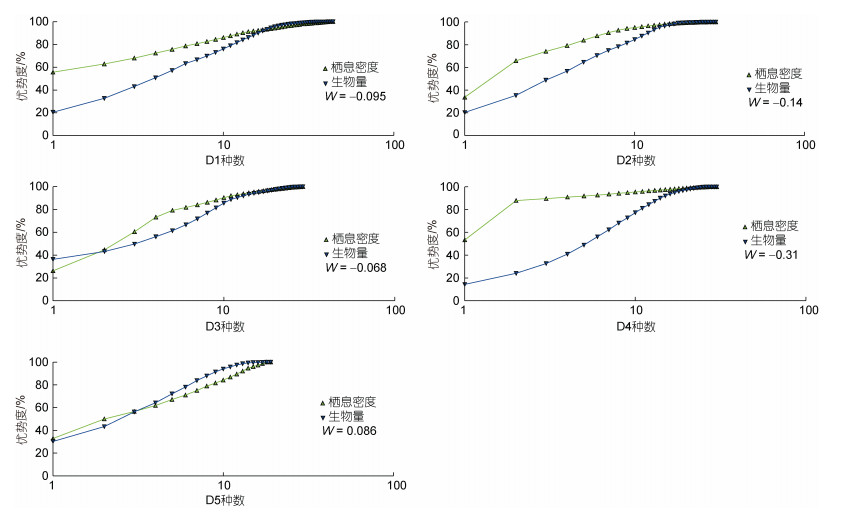 |
| 图 5 各断面全年ABC曲线图 Fig. 5 The annual ABC curves of each section |
通过SPSS软件去除异常值分析硇洲岛环境因子包括: DIN、chl a、WT、SAL、TOC、pH、SS、SiO32-和PO43-, 发现底栖软体动物栖息密度与SS和TOC显著正相关(图 6)。
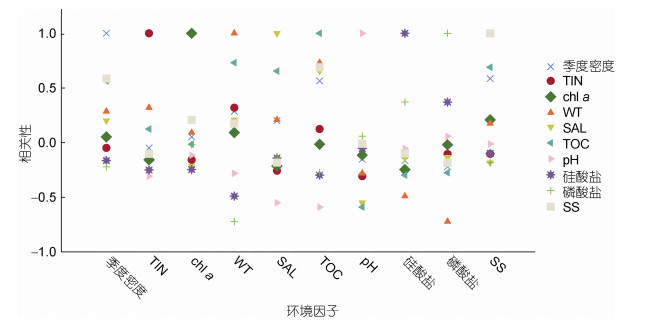 |
| 图 6 软体动物密度和环境因子的关系 Fig. 6 The relationship between mollusk density and environmental factors |
硇洲岛东部为大型海藻场, 通过张才学等(2020)的研究综合发现, 底栖软体动物在垂直分布上与大型海藻成相反趋势, 即软体动物栖息密度由高潮区向低潮区逐渐降低, 大型海藻的分布与此相反(图 7)。
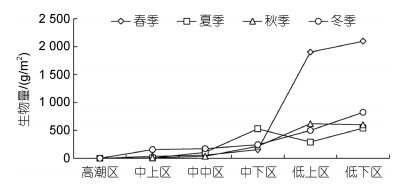 |
| 图 7 各季节大型海藻生物量的垂直分布和季节变化 Fig. 7 Vertical distribution and seasonal variation of marcoalgae biomass in each season |
通过Canoco5.0软件首先进行偏对应分析(DCA分析) (Flores et al, 1998; Muylaert et al, 2000; 杜飞雁等, 2011), 结果发现其梯度长度为2.81, 小于3, 因此使用冗余分析(RDA分析), 不同优势种与不同环境因子呈现相关性(图 8)。RDA分析中第一轴与第二轴解释累积变量的28.60%, 环境变量对物种的解释值为98.34%, pH、WT与SiO32-是环境因子中影响力最大的因子。除粗糙滨螺、筐核果螺和平轴螺外, 其余优势种均与WT呈正相关, 其中疣荔枝螺与WT显著正相关; 疣荔枝螺、双带盾桑椹螺、粒结节滨螺、单齿螺、塔结节滨螺和嫁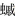
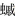
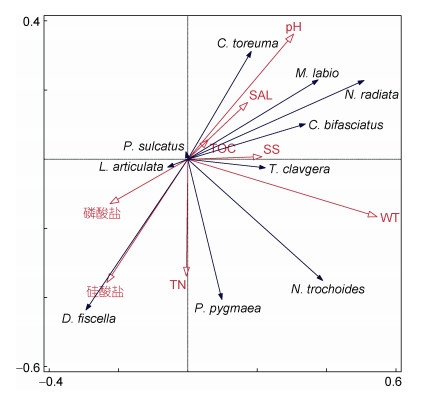 |
| 图 8 软体动物优势种RDA分析 Fig. 8 RDA analysis of dominant species of mollusks |
硇洲岛地质的表层主要为湖光岩组及其风化残积土(张文杰等, 2012), 不同的地质环境造成底栖生物的构成、栖息密度以及生物量的不同, 本次调查发现底栖软体动物104种, 共4纲, 双壳纲39种, 腹足纲59种, 多板纲4种以及头足纲2种。其种类数量高于国内其他大多数潮间带岛屿(表 5)。与林炜等(2002)的研究相比, 软体动物的种类有很大程度的增加, 一方面是因为采集位置的不同, 在硇洲岛的西侧与东海岛隔海相望, 当地通过轮渡和小型渔船的形式通行, 进而对底栖生物产生很大影响, 另一方面采集条件限制导致一定影响。
| 岛屿名称 | 种类数量 /种 |
栖息密度/(ind./m2) | 调查年份 | 数据来源 |
| 硇洲岛 | 104 | 365.66 | 2011 | 本研究 |
| 南麂岛 | 63 | 506.50 | 2010 | 毕耜瑶等, 2016 |
| 横琴岛 | 52 | — | 2013 | 罗艳等, 2017 |
| 韭山列岛 | 18 | 472.00 | 2017 | 冯明等, 2021 |
| 渤海南部 | 46 | 149.59 | 2011 | 陈琳琳等, 2016 |
| 注: “—”表示未发现数据 | ||||
底栖生物的分布与当地的地形、地质以及覆盖水有着直接的关系(Lucatelli et al, 2020), 这些非生物属性导致当地环境因子与海洋整体环境的差异。粤西的近岸海流较为特殊, 此区域潮汐模式为不规则半日潮(丁文兰, 1986; Xie et al, 2015), 整个粤西沿岸通过多因素表明为上升流区域(Lopes et al, 2005), 在硇洲岛附近其海流运动方向不规则, 但可以看出尺度为100 km的气旋涡特征, 表层海水大致为自东向西的环流, 夏季自下而上产生较弱的上升流(谢玲玲等, 2012; 许金电等, 2013; 王新星等, 2015), 秋季会产生较强的上升流(杨士瑛等, 2003), 上升流会带来SS含量的升高, 在一定程度上影响TOC含量的变化, 为底栖软体动物提供营养物质, 因此在整体上通过相关性分析发现栖息密度与这些因素相关。
硇洲岛海域与其他海域相比, 底栖生物丰富, 人类活动的影响较小。人类活动也会对软体动物产生影响, 岛上没有大型企业, 但在岛屿东部岸线附近有人工池塘, 其养殖废水即使经过处理排放也会对环境产生影响。从图 4可看出D5断面由于离硇洲岛有一定距离, 因此受到人类活动影响较小, W为正值, 但也有部分生物其栖息密度曲线在生物量曲线之上; 其余断面由于养殖废水的原因, 均受到不同程度的影响, 尤其D2和D4断面受影响严重, 两个断面为养殖废水直排点, 每个断面显示出不同的栖息密度。
硇洲岛周围充斥着岩礁区, 其表层的残积土为大型海藻提供了良好的栖息环境, 形成了天然的大型海藻场, 此地区大型海藻的生物量占整个底栖生物40%以上(张才学等, 2020), 海藻为底栖动物提供食物摄入, 因此对底栖软体动物的分布产生影响, 此外, 不同的生物有不同的习性, 导致在垂直分布上其与大型海藻的分布成反比。在低潮区海藻共54种, 其中主要的大型海藻为马尾藻与羊栖菜, 接受海浪影响较多, 有研究表明(Miller et al, 2012)褐藻作为悬浮饵料为底栖生物提供了营养来源, 因此限制了软体动物发展, 栖息密度小, 只有一些个体较大, 质量较重的生物存在, 种数为47种, 与中潮区相同的种数为27种, 这些生物大部分为腹足纲, 通过腹部吸附在礁石上以抵抗风浪, 又可通过腹足缓慢爬行应对环境变化, 它们以褐藻碎片褐藻次级代谢产物以及部分小型藻类作为食, 通过齿舌刮取或鳃丝和纤毛共同作用过滤截留食物。双壳纲中的僧帽牡蛎和嫁
优势种由春季到夏季的转变只有2个优势种发生了变化, 此时上升流增强(谢玲玲等, 2012), 带来底部的营养物质和水交换, 优势种由单齿螺和嫁
(1) 本次调查共采集大型底栖软体动物104种, 其中双壳纲39种, 腹足纲59种, 多板纲4种, 头足纲2种。优势种共10种, 分别为: 粗糙滨螺、粒结节滨螺、双带盾桑椹螺、疣荔枝螺、筐核果螺、塔结节滨螺、平轴螺、单齿螺、矮拟帽贝和嫁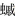
(2) 软体动物整体上栖息密度与海水悬浮物含量和总有机碳含量呈显著正相关, 优势种的季节变化与上升流相关, 而人类活动对两者均有影响。
(3) 软体动物在垂直分布上与大型海藻成相反趋势, 在低潮区大型海藻占优, 主要藻类为褐藻门中的马尾藻和羊栖菜, 软体动物栖息密度小, 这与动物本身的结构和食性有关, 腹足纲大部分动物依靠齿舌和鳃丝纤毛以褐藻碎片、褐藻代谢产物以及部分小型藻类摄食。
丁文兰, 1986. 南海潮汐和潮流的分布特征. 海洋与湖沼, 17(6): 468-480 |
王新星, 于杰, 李永振, 等, 2015. 南海主要上升流及其与渔场的关系. 海洋科学, 39(9): 131-137 |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008. 海洋调查规范第6部分: 海洋生物调查: GB/T 12763.6-2007[S]. 北京: 中国标准出版社: 1-157.
|
孔中恒, 2004. 雷州半岛火山岩的水文地质特征与富水规律. 热带地理, 24(2): 136-139 DOI:10.3969/j.issn.1001-5221.2004.02.009 |
冯明, 韩庆喜, 严润玄, 2021. 浙江韭山列岛岩礁潮间带大型底栖动物群落特征和功能性状. 生态学杂志, 40(5): 1469-1477 |
毕耜瑶, 蔡厚才, 陈万东, 等, 2016. 南麂岛岩礁潮间带软体动物种类数量变化及其演替. 渔业现代化, 43(3): 65-73 DOI:10.3969/j.issn.1007-9580.2016.03.013 |
许金电, 蔡尚湛, 宣莉莉, 等, 2013. 2006年夏季琼东、粤西沿岸上升流研究. 海洋学报, 35(4): 11-18 DOI:10.3969/j.issn.0253-4193.2013.04.002 |
杜飞雁, 王雪辉, 贾晓平, 等, 2011. 大亚湾海域大型底栖生物种类组成及特征种. 中国水产科学, 18(4): 877-892 |
李亚芳, 杜飞雁, 王亮根, 等, 2018. 粤西海陵湾养殖区邻近海域大型底栖动物生态学特征. 海洋与湖沼, 49(6): 1294-1307 |
杨士瑛, 鲍献文, 陈长胜, 等, 2003. 夏季粤西沿岸流特征及其产生机制. 海洋学报, 25(6): 1-8 |
张才学, 周伟男, 孙省利, 等, 2020. 硇洲岛大型海藻群落的季节演替. 热带海洋学报, 39(1): 74-84 |
张文杰, 谭红兵, 陈喜, 等, 2012. 广东硇洲岛地下水化学演化及成因机理. 水文, 32(3): 51-59 DOI:10.3969/j.issn.1000-0852.2012.03.010 |
陈琳琳, 王全超, 李晓静, 等, 2016. 渤海南部海域大型底栖动物群落演变特征及原因探讨. 中国科学: 生命科学, 46(9): 1121-1134 |
林炜, 钟海莹, 唐以杰, 2002. 硇洲岛潮间带不同生境底栖软体动物物种多样性研究. 热带海洋学报, 21(3): 14-22 DOI:10.3969/j.issn.1009-5470.2002.03.003 |
国家海洋信息中心, 2020. 数据可视化潮汐潮流站位点[EB/OL]. (2022-01-05)[2022-02-08]. http://mds.nmdis.org.cn/pages/visualization.html.
|
罗艳, 林丽华, 张翠萍, 等, 2017. 珠海横琴岛海域大型底栖生物的生态特征. 海洋湖沼通报, (5): 69-79 |
周伟男, 孙省利, 李荣冠, 等, 2013. 湛江湾大型底栖动物的群落结构和多样性特征. 广东海洋大学学报, 33(1): 1-8 DOI:10.3969/j.issn.1673-9159.2013.01.003 |
徐兆礼, 陈亚瞿, 1989. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系. 生态学杂志, 8(4): 13-15, 19 |
谢玲玲, 曹瑞雪, 尚庆通, 2012. 粤西近岸环流研究进展. 广东海洋大学学报, 32(4): 94-98 |
COVICH A P, PALMER M A, CROWL T A, 1999. The role of benthic invertebrate species in freshwater ecosystems: zoobenthic species influence energy flows and nutrient cycling. BioScience, 49(2): 119-127 DOI:10.2307/1313537 |
FLORES L N, BARONE R, 1998. Phytoplankton dynamics in two reservoirs with different trophic state (Lake Rosamarina and Lake Arancio, Sicily, Italy). Hydrobiologia, 369: 163-178 |
LAZARIDOU M, NTISLIDOU C, KARAOUZAS I, et al, 2018. Harmonisation of a new assessment method for estimating the ecological quality status of Greek running waters. Ecological Indicators, 84: 683-694 DOI:10.1016/j.ecolind.2017.09.032 |
LOPES M R M, DE M BICUDO C E, CARLA FERRAGUT M, 2005. Short term spatial and temporal variation of phytoplankton in a shallow tropical oligotrophic reservoir, Southeast Brazil. Hydrobiologia, 542(1): 235-247 DOI:10.1007/s10750-004-8332-z |
LUCATELLI D, GOES E R, BROWN C J, et al, 2020. Geodiversity as an indicator to benthic habitat distribution: an integrative approach in a tropical continental shelf. Geo-Marine Letters, 40(6): 911-923 DOI:10.1007/s00367-019-00614-x |
MILER O, PORST G, MCGOFF E, et al, 2013. Morphological alterations of lake shores in Europe: a multimetric ecological assessment approach using benthic macroinvertebrates. Ecological Indicators, 34: 398-410 DOI:10.1016/j.ecolind.2013.06.002 |
MILLER R J, PAGE H M, 2012. Kelp as a trophic resource for marine suspension feeders: a review of isotope-based evidence. Marine Biology, 159(7): 1391-1402 DOI:10.1007/s00227-012-1929-2 |
MUYLAERT K, SABBE K, VYVERMAN W, 2000. Spatial and temporal dynamics of phytoplankton communities in a freshwater tidal estuary (Schelde, Belgium). Estuarine, Coastal and Shelf Science, 50(5): 673-687 DOI:10.1006/ecss.2000.0590 |
PIANKA E R, 1971. Ecology of the agamid lizard Amphibolurus isolepis in western Australia. Copeia, (3): 527-536 |
PIELOU E C, 1966. Species-diversity and pattern-diversity in the study of ecological succession. Journal of Theoretical Biology, 10(2): 370-383 DOI:10.1016/0022-5193(66)90133-0 |
ROSSARO B, MARZIALI L, CARDOSO A C, et al, 2007. A biotic index using benthic macroinvertebrates for Italian lakes. Ecological Indicators, 7(2): 412-429 DOI:10.1016/j.ecolind.2006.04.002 |
SHANNON C E, 2001. A mathematical theory of communication. ACM SIGMOBILE Mobile Computing and Communications Review, 5(1): 3-55 DOI:10.1145/584091.584093 |
ULANOWICZ R E, 2001. Information theory in ecology. Computers & Chemistry, 25(4): 393-399 |
XIE M X, YAO S S, LI W D, et al, 2015. Investigation of the movement characteristics of West Guangdong Longshore Ocean Current System, China. Journal of Coastal Research, 73(sp1): 364-368 |
 2022, Vol. 53
2022, Vol. 53


