中国海洋湖沼学会主办。
文章信息
- 孟周, 魏永杰, 王晓波, 韩庆喜. 2022.
- MENG Zhou, WEI Yong-Jie, WANG Xiao-Bo, HAN Qing-Xi. 2022.
- 浙江三门湾海域主要底上动物生态位及种间联结性
- NICHE AND INTERSPECIES ASSOCIATION OF MAJOR EPIFAUNA IN SANMEN BAY OF ZHEJIANG PROVINCE, CHINA
- 海洋与湖沼, 53(5): 1269-1278
- Oceanologia et Limnologia Sinica, 53(5): 1269-1278.
- http://dx.doi.org/10.11693/hyhz20211200314
文章历史
-
收稿日期:2021-12-07
收修改稿日期:2022-02-12
2. 国家海洋局宁波海洋环境监测中心站 浙江宁波 315012;
3. 禹治环境科技(浙江)有限公司 浙江宁波 315199
2. Marine Environmental Monitoring Centre of Ningbo, SOA, Ningbo 315012, China;
3. Yuzhi Environmental Technology (Zhejiang) Co., Ltd., Ningbo 315199, China
海洋底上动物(marine epifauna)是指生活在海洋底表, 固着或附着在坚硬基质(如岩礁、动物的外壳等), 或爬行在基底之上的生物生态类群(李新正等, 2010)。底上动物种类丰富, 具有运动性较差且生活环境相对稳定的特点, 通过对它们的物种组成和群落结构动态变化进行研究, 能清楚地展现海洋环境变化和污染状况, 因此底上动物在环境污染监测中具有重要的指示作用(张均龙等, 2016)。底上动物与底内动物、底游动物合称为底栖动物, 共同完成沉积物和水之间的颗粒和溶解养分交换, 即海底-中上层耦合作用(Kristensen et al, 2014)。不仅如此, 底栖动物还在生态系统的物质循环和能量流动过程中发挥着重要作用, 如有机质分解、生物地球化学循环和食物网内营养物质的转移等(Constable, 1999; Carvalho et al, 2007)。大型底上动物是大型底栖动物(分选时无法通过0.5 mm筛网的底栖生物)中的主要类群, 主要以浮游动物、藻类以及颗粒有机物为食(刘晓收等, 2020), 参与海洋生态系统中的物理、化学和生物过程, 具有极高的研究价值。自20世纪90年代以来, 生态位理论成为生态学研究领域的热点, 是现代生态学研究中的主要内容, 其反映生物在生态学的独特地位, 是研究物种间、物种与环境间关系的重要理论依据, 被广泛应用于植物、动物群落的研究(李凡等, 2018; 刘坤等, 2021)。
三门湾位于我国海岸的中心, 三面环山, 岸线蜿蜒曲折, 入湾河流众多, 是天然的半封闭海湾。湾内海域辽阔, 气候温和湿润, 加之入湾河流带来丰富的营养物质, 为湾内海洋生物提供充足的食物, 三门湾也是海洋生物重要的栖息、觅食和育幼的场所(中国海湾志编纂委员会, 1992)。另外, 三门湾土地资源丰富, 沿岸滩涂面积可达130 km2, 是浙江省经济贝类育苗和养殖的主要基地之一。20世纪80年代以来, 随着社会经济迅猛发展, 核电站建设、过度捕捞和污水排放等人类扰动活动进一步增强, 对三门湾近岸海域生态环境造成巨大破坏, 使得海域内渔业资源衰退, 赤潮和水体富营养化等灾害频发(聂振林等, 2018; 俞松立等, 2021)。生态位理论是进行资源修复、可持续利用和物种生境保护的重要依据, 被越来越多的学者应用于海洋生物群落的研究, 如刘惠等(2019)通过对杭州湾游泳动物生态位的分析, 揭示了游泳动物种间的资源利用情况及竞争关系; 徐晓群等(2013)分析了三门湾海域浮游动物优势种后发现, 其空间生态位与物种生活类型、摄食情况密切相关; 蒋巧丽等(2021)借助生态位理论在时间、空间两个维度上探讨了该海域主要虾蟹类的生态位宽度、生态位分化及其与环境因子之间的关系。以上虽然涵盖不同海域的游泳动物、浮游动物及甲壳类的生态位研究, 但关于三门湾底上动物生态位和种间联结性计算的研究未见报道。本文以2017年、2018年在三门湾海域内进行的两次海洋底拖网数据为基础, 探讨该海域内的主要大型底上动物的生态位宽度和种间联结性, 以期客观展现三门湾海域大型底上动物的种间关系及其对环境资源的利用情况, 为三门湾海域环境治理与保护提供理论依据和数据支撑。
1 材料与方法 1.1 样品的采集与处理2017年和2018年8月(夏季), 在浙江北部三门湾海域租用渔船“浙三渔运80570”(2017年)和“浙三渔运80139” (2018年)进行大型底上动物样品采集工作。调查区域为29°00′~29°20′N, 121°57′~121°92′E, 区域范围内设置9个站位(图 1)。由于湾内沉积物较硬, 生物采集用网口宽为1.5 m的阿氏拖网进行, 每个站位进行一次拖网, 拖网时间为15 min, 拖速为3 kn。采集后的生物样品经75%的酒精固定后装入样品瓶带回实验室处理。在实验室, 进行冲洗挑拣处理, 在体视显微镜SZ61 (奥林巴斯, 东京)下进行分类鉴定, 主要种类应尽可能鉴定到种。鉴定计数完成后, 用精度为0.01 g的电子天平YP6002B (力辰邦西, 上海)对所有样品进行称重处理。样品的采集、处理过程依据《海洋调查规范》(GB/T 12763.6-2007)执行。
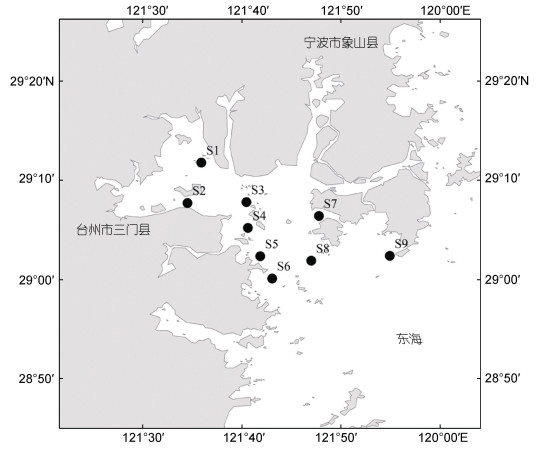 |
| 图 1 2017~2018三门湾采样站位图 Fig. 1 Location of sampling stations in Sanmen Bay in summer 2017 and 2018 |
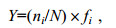 (1)
(1)式中, Y代表优势度指数, N为各个站位捕获的底上动物的总个体数, ni为第种生物的总个体数, fi为该物种在每个调查站位出现的频率。当物种的优势度Y > 0.02, 该物种即为优势种(Mcnaughton, 1967)。
1.2.2 生态位宽度借助Shannon指数(Shannon et al, 1963)完成计算:
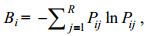 (2)
(2)式中, Bi代表该物种的生态位宽度; Pij为第i种生物在第j个站位的个体数目占第i种生物全部个体数的比例; R代表总站位数, Bi∈[0, R]。
1.2.3 生态位重叠借助Pianka指数(Pianka, 1973)完成计算:
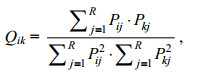 (3)
(3)式中, Qik代表生态位重叠度; Pij和Pkj为第i种生物和第k种生物在第j个站位的个体数目占第i种生物全部个体数的比例, R代表总站位数。Qik∈[0, 1]。
1.2.4 总体联结性总体联结性借助方差比率法(variance ratio, VR) (Schluter, 1984)来完成测定, 用W来检验关联显著程度:
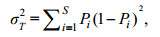 (4)
(4) (5)
(5)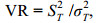 (6)
(6)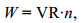 (7)
(7)式中, S为总物种数, Pi=ni/n为物种i出现的频率, 其中n为总站位数, ni则为物种i出现的站位数。Tj为站位j种出现的数目, t代表站位中的平均物种数。当VR < 1时, 物种间存在负相关; 当VR=1时, 物种间无关联性; 反之当VR > 1时, 物种间存在正相关。方差比率(VR)偏离1的显著程度借助W值进行判定: 若总体关联性不显著, 则χ2分布在90%的置信区间χ2 0.95 (n) < W < χ2 0.05(n), 反之则关联性显著。
1.2.5 种对间联结性采用连续校正公式(王伯荪等, 1985)来计算种对间联结性, 公式如下:
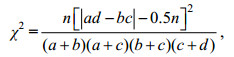 (8)
(8)式中, n为湾内的总站位数, a为两种对间同时出现的站位数; b或c则为出现其中一种的站位数; d为两种对都不存在的站位数。两个物种间的正、负联结性展现在ad-bc的正负性上。由卡方值分布表可知χ2 0.01 (1)=6.6.35, χ2 0.05(1)=3.814。若χ2 > 6.635, 表现为极显著联结; 3.814 < χ2 < 6.635, 表现为显著联结; 当χ2 < 3.814时, 联结性不显著。当其中某个物种的出现频度为100%时, 它与其他物种组成种对后, 式中的b、d值将均为0, 但若将b、d值加权为1, 得到的结果较为客观。
联结系数(AC)公式(王伯荪等, 1985)如下:
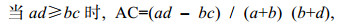 (9)
(9)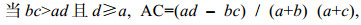 (10)
(10)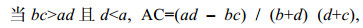 (11)
(11)式中, AC值的取值范围为[–1, 1]。当AC值越接近1时, 表示种对间正联结性越强; 当AC为0时, 表示种对间相互独立; 反之当AC越接近–1时, 表示种对间负联结性越强。
共同出现百分率(PC)公式(王伯荪等, 1985)如下:
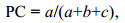 (12)
(12)式中, PC值的取值范围为[0, 1]。当PC趋近于1时, 表示种间正联结越紧密; PC等于0时说明种对间相互独立。
1.3 数据分析采样站位图借助ArcGIS Map 10.6绘制; 用R中的“spaa”、“ade4”包完成生态位宽度值、生态位重叠值以及种对间联结的计算。底上动物生态位宽度分布图使用GraphPad Prism 8.0绘制; 采用英国普利茅斯实验室(Plymouth Marine Laboratory, UK)开发的PRIMER 6.0进行生态位宽度CLUSTER等级聚类图的绘制。以上所有数据的整理和保存均在Microsoft Office Excel 2019中进行。
2 结果与分析 2.1 优势种组成对三门湾海域的两次底拖网所得生物进行鉴定, 结果显示2017、2018年共采集大型底上动物53种, 分属6门10纲38科。在2017年出现32种生物, 由优势种计算公式(Y > 0.02)得出, 优势种有5种, 包括甲壳动物中的哈氏仿对虾(Mierspenaeopsis hardwickii)、中国毛虾(Acetes chinensis)和软体动物的棒锥螺(Turritella terebra)、红带织纹螺(Nassarius succinctus), 而鱼类最少, 仅有中华栉孔虾虎鱼(Ctenotrypauchen chinensis)一种。2018年获得底上动物48种, 明显高于2017年, 2018年的7种优势种中以鱼类居多, 有孔虾虎鱼(Trypauchen vagina)、中华栉孔虾虎鱼和龙头鱼(Harpadon nehereus)三种; 甲壳动物和软体动物中各有2种, 分别是脊尾白虾(Palaemon carinicauda)、哈氏仿对虾、棒锥螺以及纵肋织纹螺(Nassarius variciferus)其中哈氏仿对虾、中华栉孔虾虎鱼、棒锥螺为两年优势种, 优势地位较为稳固(表 1)。
| 调查时间 | 物种名 | 频度 | 优势度 |
| 2017年 | 中华栉孔虾虎鱼(Ctenotrypauchen chinensis) | 0.778 | 0.035 |
| 哈氏仿对虾(Mierspenaeopsis hardwickii) | 0.556 | 0.050 | |
| 中国毛虾(Acetes chinensis) | 0.333 | 0.140 | |
| 棒锥螺(Turritella terebra) | 0.667 | 0.071 | |
| 红带织纹螺(Nassarius succinctus) | 1.000 | 0.064 | |
| 2018年 | 孔虾虎鱼(Trypauchen vagina) | 0.778 | 0.059 |
| 中华栉孔虾虎鱼(Ctenotrypauchen chinensis) | 0.667 | 0.028 | |
| 龙头鱼(Harpadon nehereus) | 0.667 | 0.024 | |
| 脊尾白虾(Palaemon carinicauda) | 1.000 | 0.107 | |
| 哈氏仿对虾(Mierspenaeopsis hardwickii) | 0.778 | 0.034 | |
| 棒锥螺(Turritella terebra) | 0.444 | 0.156 | |
| 纵肋织纹螺(Nassarius variciferus) | 0.667 | 0.027 |
鉴于本次三门湾海域底上动物采样获得的物种较多, 本文结合大型底栖动物(彭松耀等, 2015; 汤雁滨等, 2016)和游泳动物(张苗苗等, 2018)的相关研究, 对采集到的优势种和非优势种进行筛选, 将两次采样同时出现的22种大型底上动物作为主要大型底上生物进行研究。通过生态位宽度公式计算后发现, 三门湾海域的主要大型底上动物生态位宽度值变化范围在0.00~2.07之间, 不同物种间生态位宽度值差异明显。根据生态位宽度值大小将之划分成3段(图 2), 分别为a宽生态位(Bi≥2.0)、b中生态位(1.0≤ Bi≤2.0)、c窄生态位(Bi≤1.0), 文中图表出现的物种编号所对应的物种均与图 2相同。
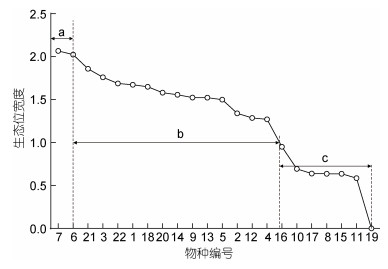 |
图 2 主要大型底上动物生态位宽度分布 Fig. 2 The niche width distribution of major epifauna 注: 物种编号为: 1. 半褶织纹螺Nassarius sinarum, 2. 棒锥螺Turritella terebra, 3. 哈氏仿对虾Mierspenaeopsis hardwickii, 4. 海地瓜Acaudina molpadioides, 5. 海仙人掌Cavernularia habereri, 6. 红带织纹螺Nassarius succinctus, 7. 脊尾白虾Palaemon carinicauda, 8. 拉氏红狼牙虾虎鱼Odontamblyopus rubicundus, 9. 龙头鱼Harpadon nehereus, 10. 毛蚶Anadara kagoshimensis, 11. 泥蚶Tegillarca granosa, 12. 日本 Charybdis japonica, 13. 三疣梭子蟹Portunus trituberculatus, 14. 窝纹网虾蛄Dictyosquilla foveolata, 15. 细巧仿对虾Batepenaeopsis tenella, 16. 小刀蛏Cultellus attenuates, 17. 小荚蛏Siliqua minima, 18. 窄体舌鳎Cynoglossus gracilis, 19. 爪哇拟塔螺Turricula javana, 20. 中华管鞭虾Solenocera crassicornis, 21. 中华栉孔虾虎鱼Ctenotrypauchen chinensis, 22. 纵肋织纹螺Nassarius variciferus Charybdis japonica, 13. 三疣梭子蟹Portunus trituberculatus, 14. 窝纹网虾蛄Dictyosquilla foveolata, 15. 细巧仿对虾Batepenaeopsis tenella, 16. 小刀蛏Cultellus attenuates, 17. 小荚蛏Siliqua minima, 18. 窄体舌鳎Cynoglossus gracilis, 19. 爪哇拟塔螺Turricula javana, 20. 中华管鞭虾Solenocera crassicornis, 21. 中华栉孔虾虎鱼Ctenotrypauchen chinensis, 22. 纵肋织纹螺Nassarius variciferus |
利用PRIMER软件对三门湾海域底上动物的生态位宽度的相似性矩阵进行等级聚类分析(CLUSTER)后, 所研究的22种主要底上动物被划为3类大型底上动物组(如图 3), 第Ⅰ组为脊尾白虾和红带织纹螺。第Ⅱ组由纵肋织纹螺、半褶织纹螺(Nassarius sinarum)、窄体舌鳎(Cynoglossus gracilis)、哈氏仿对虾、中华栉孔虾虎鱼、中华管鞭虾(Solenocera crassicornis)、窝纹网虾蛄(Dictyosquilla foveolata)、三疣梭子蟹(Portunus trituberculatus)、龙头鱼、海仙人掌(Cavernularia habereri)、日本
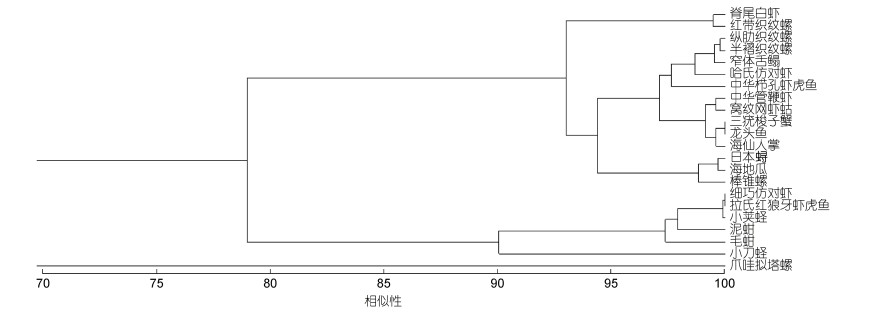 |
| 图 3 2017~2018三门湾生态位宽度聚类分析 Fig. 3 Cluster analysis of niche width of epifauna in Sanmen Bay in summer 2017 and 2018 |
三门湾海域主要大型底上动物生态位重叠值Qik如表 2所示, 有231对底上动物种对, 其变化范围在[0~0.95]之间。爪哇拟塔螺和海地瓜的生态位重叠值最高为0.95, 其次是拉氏红狼牙虾虎鱼和龙头鱼为0.93, 说明它们利用资源的能力比较强且方式极为接近。其中Qik > 0.6 (生态位显著重叠)共有58对, 占总对数的25.1%, Qik > 0.3 (生态位重叠有意义)共有151对, 占总对数的65.4%, 表明此次采样的大型底上动物达到有意义的种对比例较高。生态位重叠值Qik=0有16对, 占总对数的6.93%, 则说明小刀蛏和海仙人掌、毛蚶和爪哇拟塔螺等种对的资源利用能力较弱, 在本次采样的站位分布少, 生态位重叠值低, 毛蚶与泥蚶、三疣梭子蟹、细巧仿对虾等多个物种的生态位重叠值为0, 则表明毛蚶与它们利用环境资源的方式差异极大。
| 编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 2 | 0.67 | ||||||||||||||||||||
| 3 | 0.61 | 0.18 | |||||||||||||||||||
| 4 | 0.28 | 0.22 | 0.48 | ||||||||||||||||||
| 5 | 0.30 | 0.15 | 0.72 | 0.63 | |||||||||||||||||
| 6 | 0.72 | 0.48 | 0.67 | 0.36 | 0.64 | ||||||||||||||||
| 7 | 0.73 | 0.66 | 0.77 | 0.64 | 0.77 | 0.84 | |||||||||||||||
| 8 | 0.27 | 0.00 | 0.63 | 0.14 | 0.25 | 0.50 | 0.43 | ||||||||||||||
| 9 | 0.52 | 0.11 | 0.76 | 0.35 | 0.37 | 0.68 | 0.60 | 0.93 | |||||||||||||
| 10 | 0.42 | 0.87 | 0.09 | 0.17 | 0.00 | 0.32 | 0.47 | 0.00 | 0.03 | ||||||||||||
| 11 | 0.63 | 0.08 | 0.45 | 0.41 | 0.20 | 0.40 | 0.30 | 0.00 | 0.35 | 0.00 | |||||||||||
| 12 | 0.23 | 0.20 | 0.21 | 0.40 | 0.42 | 0.35 | 0.39 | 0.10 | 0.18 | 0.16 | 0.12 | ||||||||||
| 13 | 0.60 | 0.13 | 0.80 | 0.16 | 0.43 | 0.75 | 0.59 | 0.82 | 0.92 | 0.00 | 0.43 | 0.10 | |||||||||
| 14 | 0.73 | 0.59 | 0.57 | 0.36 | 0.24 | 0.72 | 0.73 | 0.63 | 0.72 | 0.56 | 0.26 | 0.31 | 0.58 | ||||||||
| 15 | 0.27 | 0.09 | 0.42 | 0.88 | 0.50 | 0.44 | 0.58 | 0.40 | 0.57 | 0.00 | 0.31 | 0.35 | 0.31 | 0.51 | |||||||
| 16 | 0.36 | 0.37 | 0.32 | 0.14 | 0.00 | 0.55 | 0.44 | 0.81 | 0.78 | 0.43 | 0.00 | 0.17 | 0.62 | 0.79 | 0.40 | ||||||
| 17 | 0.27 | 0.08 | 0.80 | 0.16 | 0.59 | 0.26 | 0.50 | 0.46 | 0.41 | 0.00 | 0.00 | 0.02 | 0.51 | 0.18 | 0.01 | 0.02 | |||||
| 18 | 0.62 | 0.48 | 0.64 | 0.55 | 0.34 | 0.51 | 0.61 | 0.28 | 0.50 | 0.55 | 0.69 | 0.16 | 0.53 | 0.50 | 0.35 | 0.37 | 0.31 | ||||
| 19 | 0.20 | 0.11 | 0.31 | 0.95 | 0.56 | 0.26 | 0.52 | 0.00 | 0.21 | 0.00 | 0.35 | 0.34 | 0.00 | 0.26 | 0.89 | 0.00 | 0.00 | 0.31 | |||
| 20 | 0.71 | 0.25 | 0.63 | 0.13 | 0.23 | 0.80 | 0.54 | 0.71 | 0.87 | 0.15 | 0.54 | 0.16 | 0.92 | 0.72 | 0.32 | 0.72 | 0.19 | 0.55 | 0.00 | ||
| 21 | 0.79 | 0.35 | 0.58 | 0.46 | 0.34 | 0.66 | 0.56 | 0.18 | 0.51 | 0.28 | 0.92 | 0.34 | 0.58 | 0.52 | 0.37 | 0.27 | 0.08 | 0.81 | 0.33 | 0.71 | |
| 22 | 0.43 | 0.21 | 0.75 | 0.25 | 0.80 | 0.85 | 0.73 | 0.49 | 0.56 | 0.15 | 0.18 | 0.21 | 0.69 | 0.48 | 0.25 | 0.32 | 0.55 | 0.37 | 0.14 | 0.58 | 0.40 |
| 注: 表内物种编号同图 2 | |||||||||||||||||||||
借助方差比率法计算得出VR=2.35 (VR > 1, 呈正相关), 则表示三门湾海域大型底上动物总体关联性呈正相关, 表明该群落结构处于较为稳定的阶段, 各物种对资源环境利用状态较好, 生态系统功能结构也趋于成熟。W值被用来检验VR偏离1的显著程度, W=21.16 (表 3)不在置信区间χ2 0.95(n) < W < χ2 0.05(n)之间, 22个主要大型底上动物物种间的总体关联性显著。
| ST2 | σT2 | VR | W | χ2[χ0.05(N)2, χ0.95(N)2] | 测定结果 |
| 3.73 | 8.77 | 2.35 | 21.16 | (3.33, 16.92) | 显著正关联 |
鉴于脊尾白虾、红带织纹螺和中华栉孔虾虎鱼在9个站位均有出现, 出现频度为100%, 因此将三者在公式中的b、d值加权为1后, χ2检验的结果显示(表 4), 由22种大型底上动物组成的231个种对中, 其中有229对种对的联结性不显著, 种对间较为独立, 占总对数的99.1%, 表明该海域各个物种间相互依赖程度低。仅纵肋织纹螺和龙头鱼、窄体舌鳎和窝纹网虾蛄组成的2对种对的联结性显著, 且呈显著正关联, 占0.87%。
| 编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 2 | 0.08 | ||||||||||||||||||||
| 3 | 0.14 | 0.50 | |||||||||||||||||||
| 4 | 0.56 | 0.08 | 0.14 | ||||||||||||||||||
| 5 | 0.06 | 0.39 | 0.01 | 0.06 | |||||||||||||||||
| 6 | 0.04 | 0.01 | 0.17 | 0.04 | 0.20 | ||||||||||||||||
| 7 | 0.04 | 0.01 | 0.17 | 0.04 | 0.20 | 0.04 | |||||||||||||||
| 8 | 0.08 | 0.01 | 0.50 | 0.08 | 0.39 | 0.01 | 0.01 | ||||||||||||||
| 9 | 2.01 | 0.01 | 0.50 | 0.08 | 0.39 | 0.01 | 0.01 | 0.01 | |||||||||||||
| 10 | 0.08 | 0.01 | 0.50 | 0.08 | 0.97 | 0.01 | 0.01 | 0.01 | 0.01 | ||||||||||||
| 11 | 0.08 | 0.01 | 0.50 | 0.08 | 0.39 | 0.01 | 0.01 | 0.01 | 0.01 | 0.01 | |||||||||||
| 12 | 0.06 | 0.39 | 0.01 | 0.06 | 0.14 | 0.20 | 0.01 | 0.39 | 0.39 | 0.39 | 0.39 | ||||||||||
| 13 | 0.06 | 0.39 | 0.01 | 0.06 | 0.14 | 0.20 | 0.01 | 0.39 | 0.97 | 0.97 | 0.39 | 0.14 | |||||||||
| 14 | 0.56 | 0.08 | 0.14 | 0.56 | 1.41 | 0.04 | 0.01 | 0.08 | 0.08 | 0.08 | 0.08 | 0.06 | 0.06 | ||||||||
| 15 | 0.08 | 0.01 | 0.50 | 0.08 | 0.39 | 0.01 | 0.01 | 0.01 | 0.01 | 0.01 | 0.01 | 0.39 | 0.39 | 0.08 | |||||||
| 16 | 0.56 | 0.08 | 0.14 | 0.56 | 2.76 | 0.01 | 0.01 | 0.08 | 0.08 | 2.01 | 0.08 | 0.06 | 0.06 | 0.56 | 0.08 | ||||||
| 17 | 0.06 | 0.39 | 0.01 | 0.06 | 0.95 | 0.20 | 0.01 | 0.39 | 0.39 | 0.97 | 0.97 | 0.14 | 0.95 | 1.41 | 0.39 | 0.06 | |||||
| 18 | 0.56 | 0.08 | 0.14 | 0.56 | 1.41 | 0.04 | 0.01 | 0.08 | 0.08 | 0.08 | 0.08 | 0.06 | 0.06 | *5.06 | 0.08 | 0.56 | 1.41 | ||||
| 19 | 0.14 | 0.50 | 1.72 | 0.14 | 0.01 | 0.17 | 0.01 | 0.50 | 0.50 | 0.50 | 0.50 | 0.01 | 0.01 | 0.14 | 0.50 | 0.14 | 0.01 | 0.14 | |||
| 20 | 0.56 | 0.08 | 0.14 | 0.56 | 0.06 | 0.04 | 0.01 | 0.08 | 2.01 | 0.08 | 0.08 | 0.06 | 2.76 | 0.56 | 0.08 | 0.56 | 0.06 | 0.56 | 0.14 | ||
| 21 | 0.01 | 0.01 | 0.01 | 0.01 | 0.20 | 1.01 | 0.01 | 0.00 | 0.01 | 0.01 | 0.01 | 0.20 | 0.20 | 0.04 | 0.01 | 0.04 | 0.20 | 0.04 | 0.17 | 0.04 | |
| 22 | 2.01 | 0.01 | 0.50 | 0.08 | 0.39 | 0.01 | 0.01 | 0.01 | *4.14 | 0.01 | 0.01 | 0.39 | 0.97 | 0.08 | 0.01 | 0.08 | 0.39 | 0.08 | 0.50 | 2.01 | 0.01 |
| 注: 表内物种编号同图 2; *加粗数字表示显著正关联 | |||||||||||||||||||||
借助公式得联结系数(AC)后, 结果如图 4所示, 表明在231个大型底上动物种对中, 种对间表现为正联结的有78对, 占总对数的33.8%。其中有28对正联结性较高(AC≥0.6), 占总对数的12.1%; 联结性程度一般(0.2≤AC < 0.6)的存在50对, 占总对数的21.6%; 种对间趋近于相互独立(–0.2≤AC < 0.2)的数目最多, 出现83对, 占35.9%; 呈现负联结的种对数目最少, 有70对, 占总对数30.3%; 有32对种对的负联结程度较高(AC < –0.6)的, 占13.9%; 负联结程度一般(–0.6≤AC < –0.2)的种对与负联结性较高种对的数目相近, 有38对, 占总对数的16.5%。
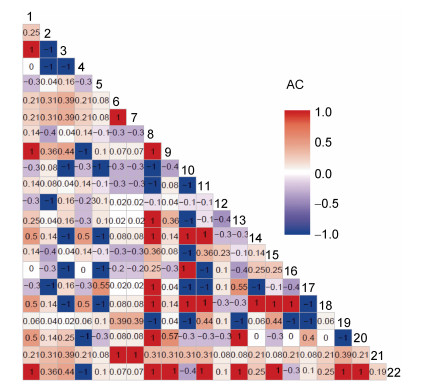 |
| 图 4 联结系数AC半矩阵图 Fig. 4 Semi-matrix diagram of inters pecific association (AC) |
共同出现百分率(PC)是湾内底上动物种对间正联结性强弱的体现, 其中有16个种对表现为相互独立(PC=0), 占总种对数的6.9%; 正联结性最弱(0 < PC≤0.2)的有34对, 占总对数的14.7%; 正联结性程度较弱(0.2 < PC≤0.4)的数目最多, 有77个, 占总对数的33.3%; 有38个正联结程度一般(0.4 < PC≤0.6), 占16.5%; 正联结程度较强(0.6 < PC≤0.8)的有51个, 占总对数的22.1%; 正联结性最强(0.6 < PC≤0.8)的数目最少, 有15个, 占总对数的6.5% (图 5)。
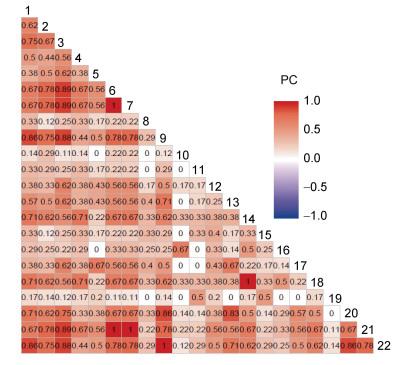 |
| 图 5 共同出现百分率PC半矩阵图 Fig. 5 Semi-matrix diagram of the percentage co-occurrence (PC) |
生态位宽度反映生物对环境的适应性, 是研究某物种在一定层次上一定范围内生存和发展所需的资源(物质、能量、空间等)以及它在该范围内产生的影响的重要手段之一(张光明等, 1997; 韩晓凤等, 2020)。通常所研究的生态位, 是指在特定尺度(时间、空间、生命层次)下物种的职能地位, 生态位宽度值越大, 则表明该物种的资源竞争力越强(王凤等, 2006; 戴冬旭等, 2019)。本研究调查的主要大型底上动物的空间生态位宽度差异较大, 分段现象明显(图 1), 分为a组、b组和c组, 其中a组脊尾白虾和红带织纹螺生态位宽度值最大, 它们既是优势种又是广生态位种, 在调查的9个站位中的生物量分布较均匀。脊尾白虾是近海广温、广盐分布种, 其食性广而杂, 这种生活习性使得它具有较强的环境适应能力, 同时这也表明物种生态位宽度会受生活习性的影响(时冬晴等, 2007; 胡成业等, 2015)。三门湾是半封闭型海湾, 受波浪影响较弱, 属沉积型海岸, 滩涂广阔, 而近岸海域受沿岸流、台湾暖流和黄海水团等水系的交汇影响(蔡如星, 1991), 盐度偏低, 非常适宜红带织纹螺这种低盐广温性物种的生存。b组中生态位分布物种数高于其余两组, 该段物种数目占主要底上动物总物种数的59%。中华栉孔虾虎鱼(1.86)、哈氏仿对虾(1.76)、纵肋织纹螺(1.69)、半褶织纹螺(1.67)等13种底上动物较为均匀的分布在中生态位, 彼此间差距较小。其中中华栉孔虾虎鱼在所有站位均有出现且属于优势种, 但仍是中生态位种, 这也验证了有关虾蟹类生态位的研究(丁朋朋等, 2019; 蒋巧丽等, 2021), 优势种不一定分布在广生态位。窄生态位的物种数较少(7种), 其中小刀蛏(0.95)最高, 爪哇拟塔螺(0.00)最低, 生态位宽度值差距大, 分布不均匀。爪哇拟塔螺仅存在于1个站位, 数目较少且分布局限性较大, 生态位宽度值低可能与其出现率和个体数较低有关。
3.2 生态位重叠生态位重叠是指物种对在其与各种环境因子联系上的相似性, 能清楚的展现物种分布站位的重叠情况, 是物种间竞争关系的基础(李 等, 2003; 张琳琳等, 2020)。一般来说, 两物种的生态位重叠值越小, 其利用资源能力的差异性越高。本次调查的22种主要大型底上动物生态位宽度分布并不均匀, 生态位宽度值较大的物种如脊尾白虾、中华栉孔虾虎鱼等, 分布范围广, 适应性强, 极易与其他物种形成竞争关系, 因此与其他物种生态位重叠值也普遍较高。同样的, 窄生态位物种如爪哇拟塔螺(Bi=0), 资源利用能力有限, 竞争能力弱, 与其他种群的重叠值也较小。但生态位重叠值与宽度值并不成绝对的正相关, 爪哇拟塔螺和海地瓜重叠值高达0.95, 红带织纹螺(Bi=2.06)属广生态位种, 但其与小荚蛏的生态位重叠值仅有0.26。原因可能是由于爪哇拟塔螺为肉食性, 海地瓜为杂食性, 二者都以一些微小生物(原生动物、小型桡足类)为食且喜栖居浅海泥沙底。毛蚶与三疣梭子蟹、细巧仿对虾、小荚蛏生态位重叠值均为0, 可能与毛蚶的生活习性关系密切。毛蚶主要栖息水域在一些咸淡水交汇的内湾和平静的浅海, 水深5~7 m, 而三疣梭子蟹则主要分布在近浅海10~30 m的泥沙底质海区, 二者的栖息环境有明显差异(王庆志等, 2015)。三疣梭子蟹和细巧仿对虾食性比较相近, 与毛蚶食性不同。毛蚶在栖息底质虽与小荚蛏较为接近, 但在适宜温度、盐度以及分布水层方面仍存在区别(柴雪良等, 2008)。毛蚶分布水层以及食性的不同是可能是导致它与其他生物的生态位重叠值较小的主要原因。不同底上动物生态位重叠程度不同, 说明它们既相互独立又相互依赖, 在一定程度上有着较好的共存关系(董静瑞等, 2017)。
等, 2003; 张琳琳等, 2020)。一般来说, 两物种的生态位重叠值越小, 其利用资源能力的差异性越高。本次调查的22种主要大型底上动物生态位宽度分布并不均匀, 生态位宽度值较大的物种如脊尾白虾、中华栉孔虾虎鱼等, 分布范围广, 适应性强, 极易与其他物种形成竞争关系, 因此与其他物种生态位重叠值也普遍较高。同样的, 窄生态位物种如爪哇拟塔螺(Bi=0), 资源利用能力有限, 竞争能力弱, 与其他种群的重叠值也较小。但生态位重叠值与宽度值并不成绝对的正相关, 爪哇拟塔螺和海地瓜重叠值高达0.95, 红带织纹螺(Bi=2.06)属广生态位种, 但其与小荚蛏的生态位重叠值仅有0.26。原因可能是由于爪哇拟塔螺为肉食性, 海地瓜为杂食性, 二者都以一些微小生物(原生动物、小型桡足类)为食且喜栖居浅海泥沙底。毛蚶与三疣梭子蟹、细巧仿对虾、小荚蛏生态位重叠值均为0, 可能与毛蚶的生活习性关系密切。毛蚶主要栖息水域在一些咸淡水交汇的内湾和平静的浅海, 水深5~7 m, 而三疣梭子蟹则主要分布在近浅海10~30 m的泥沙底质海区, 二者的栖息环境有明显差异(王庆志等, 2015)。三疣梭子蟹和细巧仿对虾食性比较相近, 与毛蚶食性不同。毛蚶在栖息底质虽与小荚蛏较为接近, 但在适宜温度、盐度以及分布水层方面仍存在区别(柴雪良等, 2008)。毛蚶分布水层以及食性的不同是可能是导致它与其他生物的生态位重叠值较小的主要原因。不同底上动物生态位重叠程度不同, 说明它们既相互独立又相互依赖, 在一定程度上有着较好的共存关系(董静瑞等, 2017)。
种间联结性是不同种个体在空间分布中关联程度的反映(李 等, 2003), 通过测定种间联结性, 可以揭示种对间的相互作用关系(互助性和对抗性)和功能地位(白欢欢, 2018), 了解不同生态环境对物种分布广度的影响, 展现物种间竞争的结果, 对探讨群落演替的内在机制有着重要的参考价值(徐满厚等, 2016)。总体联结性结果显示, 三门湾海域主要底上动物之间呈显著正相关, 这表明底上动物群落结构已趋于稳定, 能很好地利用环境资源。χ2检验表明, 研究中的231个种对中, 仅有2对呈显著关联, 所占比例很低, 其余种对趋近于相互独立, 这一结果可能是湾内海域宽阔, 风小浪缓, 这些物种易于寻找到有利生存的环境, 彼此的依赖程度降低(邓小艳等, 2018), 整体关联度下降。另一原因可能是近年来, 三门湾海域富营养化程度加剧, 水体中长期含有过量的有机质和营养盐(梁静香等, 2020), 底上动物种类更新频率加快, 群落演替程度上升, 最终导致种对间的关联性减弱(刘惠等, 2019)。但χ2检验只能对种间联结性做定性判断, 无法区分其大小, 且在检验中联结性表现不显著的种对也可能存在关联。
等, 2003), 通过测定种间联结性, 可以揭示种对间的相互作用关系(互助性和对抗性)和功能地位(白欢欢, 2018), 了解不同生态环境对物种分布广度的影响, 展现物种间竞争的结果, 对探讨群落演替的内在机制有着重要的参考价值(徐满厚等, 2016)。总体联结性结果显示, 三门湾海域主要底上动物之间呈显著正相关, 这表明底上动物群落结构已趋于稳定, 能很好地利用环境资源。χ2检验表明, 研究中的231个种对中, 仅有2对呈显著关联, 所占比例很低, 其余种对趋近于相互独立, 这一结果可能是湾内海域宽阔, 风小浪缓, 这些物种易于寻找到有利生存的环境, 彼此的依赖程度降低(邓小艳等, 2018), 整体关联度下降。另一原因可能是近年来, 三门湾海域富营养化程度加剧, 水体中长期含有过量的有机质和营养盐(梁静香等, 2020), 底上动物种类更新频率加快, 群落演替程度上升, 最终导致种对间的关联性减弱(刘惠等, 2019)。但χ2检验只能对种间联结性做定性判断, 无法区分其大小, 且在检验中联结性表现不显著的种对也可能存在关联。
为更全面地对三门湾主要底上生物的种间联结性进行分析, 在χ2检验的基础上, 引入联结系数(AC)和共同出现百分率(PC)来弥补其不能反映种间联结性大小的缺陷。联结系数(AC)是种间联结性强弱的体现, 在联结系数计算的结果中三门湾底上动物中趋于相互独立的种对数所占比例最高, 这也验证χ2检验的结果。由共同出现百分率(PC)可知, 纵肋织纹螺和中华管鞭虾与其他物种组成的种对在最强正联结的种对中所占的比重最大, 说明它们具备较强的竞争优势和生存能力。当然, 正联结性强的种对的生态位重叠值不一定高, 如纵肋织纹螺和龙头鱼, 这可能与种对间分布的频率、栖息环境以及食性有较大关联。
4 结论三门湾海域的主要大型底上动物中, 脊尾白虾和红带织纹螺生态位宽度值最高, 它们在该海域具有较强的环境适应性和资源利用能力, 在竞争中处于优势。而毛蚶、小荚蛏等7种主要底上动物处于窄生态位, 环境适应性差, 分布局限性较大。哈氏仿对虾与红带织纹螺、拉氏红狼牙虾虎鱼、龙头鱼等多个物种重叠值较高, 存在较强的竞争关系。种间联结性结果显示三门湾海域的底上动物群落结构已经趋于稳定, 能较好地利用环境资源, 湾内大多数物种近于相互独立, 并未明显的表现出正或负的联结性。将生态位与种间联结性相结合后发现, 它们与群落的更替演变密切相关, 可作为三门湾海域进一步制定生态保护和资源修复策略的理论基础。同时依据物种独特的种间关系, 制定科学的增殖放流策略, 也可用于维持生态系统稳定和海洋资源的可持续利用。
丁朋朋, 高春霞, 彭欣, 等, 2019. 浙江南部近海主要虾类的时空生态位及种间联结性. 应用生态学报, 30(11): 3942-3950 |
王凤, 鞠瑞亭, 李跃忠, 等, 2006. 生态位概念及其在昆虫生态学中的应用. 生态学杂志, 25(10): 1280-1284 DOI:10.3321/j.issn:1000-4890.2006.10.024 |
王庆志, 张明, 滕炜鸣, 等, 2015. 毛蚶养殖生物学研究进展. 大连海洋大学学报, 30(4): 437-443 |
王伯荪, 彭少麟, 1985. 南亚热带常绿阔叶林种间联结测定技术研究——Ⅰ. 种间联结测式的探讨与修正. 植物生态学与地植物学丛刊, 9(4): 274-285 |
中国海湾志编纂委员会, 1992. 中国海湾志第五分册(上海市和浙江省北部海湾). 北京: 海洋出版社, 234-236
|
邓小艳, 刘建国, 郭朋军, 等, 2018. 小洋山邻近海域主要游泳动物生态位及种间联结性. 海洋学报, 40(1): 96-105 DOI:10.3969/j.issn.0253-4193.2018.01.011 |
白欢欢, 2018. 黄山松群落主要木本植物营养生态位和种间联结特征研究[D]. 北京: 中国林业科学研究院: 1-9.
|
刘坤, 俞存根, 许永久, 等, 2021. 舟山群岛东侧海域春秋季主要甲壳类物种的空间生态位分析. 浙江大学学报(理学版), 48(4): 450-460, 480 |
刘晓收, 倪大朋, 钟鑫, 等, 2020. 黄海大型底栖动物食物网结构和营养关系研究. 中国海洋大学学报(自然科学版), 50(9): 20-33 |
刘惠, 俞存根, 郑基, 等, 2019. 杭州湾灰鳖洋海域秋季主要游泳动物生态位与种间联结. 生态学报, 39(11): 3828-3836 |
汤雁滨, 廖一波, 寿鹿, 等, 2016. 南麂列岛潮间带大型底栖动物群落优势种生态位. 生态学报, 36(2): 489-498 |
李凡, 徐炳庆, 吕振波, 等, 2018. 莱州湾鱼类群落优势种生态位. 生态学报, 38(14): 5195-5205 |
李  , 朱金兆, 朱清科, 2003. 生态位理论及其测度研究进展. 北京林业大学学报, 25(1): 100-107 DOI:10.3321/j.issn:1000-1522.2003.01.022 , 朱金兆, 朱清科, 2003. 生态位理论及其测度研究进展. 北京林业大学学报, 25(1): 100-107 DOI:10.3321/j.issn:1000-1522.2003.01.022 |
李新正, 刘录三, 李宝泉, 等, 2010. 中国海洋大型底栖生物: 研究与实践. 北京: 海洋出版社, 8-20
|
时冬晴, 叶建生, 2007. 脊尾白虾的生物学特性及健康养殖技术. 渔业经济研究, (5): 40-42 |
张光明, 谢寿昌, 1997. 生态位概念演变与展望. 生态学杂志, 16(6): 46-51 DOI:10.3321/j.issn:1000-4890.1997.06.010 |
张均龙, 史本泽, 赵峰, 等, 2016. 中国海洋底栖生物学发展回顾与展望. 海洋科学集刊, (1): 194-204 |
张苗苗, 王咏雪, 田阔, 等, 2018. 台州玉环北部沿岸海域主要游泳动物生态位和种间联结性. 应用生态学报, 29(11): 3867-3875 |
张琳琳, 周永东, 蒋日进, 等, 2020. 浙江中南部近岸海域春季主要鱼类空间生态位. 应用生态学报, 31(2): 659-666 |
胡成业, 水玉跃, 杜肖, 等, 2015. 浙江苍南南部沿岸海域主要游泳动物生态位及种间联结性. 应用生态学报, 26(10): 3195-3201 |
俞松立, 王咏雪, 韩晓凤, 等, 2021. 三门湾海域渔业生物群落结构及营养级变化特征. 大连海洋大学学报, 36(3): 478-487 |
聂振林, 王咏雪, 胡成业, 等, 2018. 三门湾春秋季鱼类群落特征及其与环境因子的关系. 水产学报, 42(9): 1390-1398 |
柴雪良, 张永普, 宣瑛, 等, 2008. 若干环境因子对成体小荚蛏存活的影响. 海洋学研究, 26(1): 45-51 DOI:10.3969/j.issn.1001-909X.2008.01.007 |
徐晓群, 曾江宁, 陈全震, 等, 2013. 浙江三门湾浮游动物优势种空间生态位. 应用生态学报, 24(3): 818-824 |
徐满厚, 刘敏, 翟大彤, 等, 2016. 植物种间联结研究内容与方法评述. 生态学报, 36(24): 8224-8233 |
梁静香, 周永东, 王忠明, 等, 2020. 三门湾大型底栖动物群落结构及其与环境因子的关系. 应用生态学报, 31(9): 3187-3193 |
彭松耀, 李新正, 王洪法, 等, 2015. 南黄海春季大型底栖动物优势种生态位. 生态学报, 35(6): 1917-1928 |
董静瑞, 水柏年, 胡成业, 等, 2017. 温州南部沿岸海域主要鱼类的生态位及种间联结性. 应用生态学报, 28(5): 1699-1706 |
蒋巧丽, 许永久, 郑基, 等, 2021. 浙江披山海域主要虾蟹类时空生态位及种间联结性. 应用生态学报, 32(7): 2604-2614 |
韩晓凤, 王咏雪, 求锦津, 等, 2020. 台州南部近岸海域春秋季主要鱼类生态位及其种间联结性. 水产学报, 44(4): 621-631 |
蔡如星, 1991. 浙江动物志(软体动物). 杭州: 浙江科学技术出版社, 1-8
|
戴冬旭, 俞存根, 刘惠, 等, 2019. 南麂列岛东侧海域主要游泳动物生态位及种间联结性. 应用生态学报, 30(12): 4249-4258 |
CARVALHO S, BARATA M, GASPAR M B, et al, 2007. Enrichment of aquaculture earthen ponds with Hediste diversicolor: Consequences for benthic dynamics and natural productivity. Aquaculture, 262(2/3/4): 227-236 |
CONSTABLE A J, 1999. Ecology of benthic macro-invertebrates in soft-sediment environments: A review of progress towards quantitative models and predictions. Australian Journal of Ecology, 24(4): 452-476 |
KRISTENSEN E, DELEFOSSE M, QUINTANA C O, et al, 2014. Influence of benthic macrofauna community shifts on ecosystem functioning in shallow estuaries. Frontiers in Marine Science, 1: 41 |
MCNAUGHTON S J, 1967. Relationships among functional properties of Californian grassland. Nature, 216(5111): 168-169 |
PIANKA E R, 1973. The structure of lizard communities. Annual Review of Ecology and Systematics, 4(1): 53-74 |
SCHLUTER D, 1984. A variance test for detecting species associations, with some example applications. Ecology, 65(3): 998-1005 |
SHANNON C E, WEAVER W, 1963. The Mathematical Theory of Communication. Chicago: University of Illinois Press, 3-55
|
 2022, Vol. 53
2022, Vol. 53


