中国海洋湖沼学会主办。
文章信息
- 武奕鑫, 王孝聪, 周振淞, 何晨, 潘良浩, 宋桂雪. 2022.
- WU Yi-Xin, WANG Xiao-Cong, ZHOU Zhen-Song, HE Chen, PAN Liang-Hao, SONG Gui-Xue. 2022.
- 固相萃取法提取典型海水溶解有机质及其红外光谱和固态13C核磁共振表征
- EXTRACTION OF REPRESENTATIVE MARINE DISSOLVED ORGANIC MATTER BY SOLID PHASE EXTRACTION AND CHARACTERIZATION IN INFRARED SPECTROMETRY AND SOLID-STATE 13C NUCLEAR MAGNETIC RESONANCE
- 海洋与湖沼, 53(6): 1360-1369
- Oceanologia et Limnologia Sinica, 53(6): 1360-1369.
- http://dx.doi.org/10.11693/hyhz20220300047
文章历史
-
收稿日期:2022-03-03
收修改稿日期:2022-06-14
2. 中国石油大学(北京)理学院 北京 102249;
3. 中国石油大学(北京)重质油国家重点实验室 北京 102249;
4. 广西科学院广西红树林研究中心 广西北海 536000
2. College of Science, China University of Petroleum (Beijing), Beijing 102249, China;
3. State Key Laboratory of Heavy Oil Processing, China University of Petroleum (Beijing), Beijing 102249, China;
4. Guangxi Mangrove Research Center of Guangxi Academy of Sciences, Beihai 536000, China
海水中可通过0.45 μm滤膜的天然有机物被定义为溶解性有机质(dissolved organic matter, DOM)。DOM是海洋有机碳库的主体组分(> 95%) (Hansell et al, 2013), 在海洋生物地球化学循环中起着重要作用。海洋中大量的DOM分子耐受生物降解, 周期可长达数千年, 被称为惰性有机质(refractory DOM, rDOM)。微型生物碳泵(microbial carbon pump, MCP)理论框架提出海洋中的活性DOM可以通过微型生物代谢活动被转化为rDOM, 是研究海洋碳汇的基础(蔡阮鸿等, 2021), 研究DOM和rDOM分子组成及有机分子结构有助于深入理解海洋碳汇过程及形成机制和生物效应。但由于DOM是由成千上万个分子组成的复杂天然有机质混合物, 解析其结构和分子组成一直是个难题和巨大挑战(Arakawa et al, 2017; Zhang et al, 2018a)。
海水中DOM含量低(0.5~2.0 mg C/L), 化学成分复杂、盐度高(30~35), 受海水DOM提取技术的限制, 常见分析海水有机质的方法有海水总碳总氮分析、紫外可见光谱(UV-vis)、三维荧光光谱(EEM)、分子排阻色谱(HP-SEC-TOC)、同位素分析(δ13C和Δ14C)、溶解氨基酸等。但大多分析技术只能对DOM整体组成、光敏成分(如有色溶解性有机质chromophore DOM, cDOM; 荧光溶解性有机质fluorescent DOM, fDOM)的大概类别及其初步来源等信息进行分析, 想得到分子水平的组成和分子有机结构等仪器表征信息, 还需借助超高分辨率质谱和核磁共振波谱(NMR)等最先进的分析技术(Song et al, 2018; Li et al, 2019), 这些表征技术均需要大量的DOM样品。此外, 不同实验室间的分析比对、微生物培养等也需要克级标准品/对照品的DOM样品, 这就需要高效富集提取出纯度高(低盐分)且性质稳定的DOM固体样品。
自20世纪70年代末开始采用XAD系列大孔树脂提取地表水DOM以来, 研究人员陆续开发了超滤法(ultrafiltration, UF)、电渗析耦合反渗透法(reverse osmosis/electrodialysis, RO/ED)以及固相萃取法(solid-phase extraction, SPE)等富集提取技术(Green et al, 2015)。相较于其他固相萃取如C18)富集方法, Bond Elut PPL树脂(安捷伦, 经修饰的苯乙烯-二乙烯基苯共聚物)固相萃取法在海水DOM分析中的应用最为广泛。Dittmar等(2008)曾比较6种固相萃取树脂对海水DOM的富集效果, 结果表明PPL固相萃取(PPL-SPE)法更具有代表性, 且提取效率不随盐度变化降低, 此外该树脂还适用于其他水体环境(Chen et al, 2016; Li et al, 2016)。将SPE小柱方法扩大, 使用填充PPL (500 g)定制树脂(玻璃柱)处理大体积海水已有报道(Green et al, 2014), 但该方法的一些关键参数对回收率的影响未见报道。
基于PPL小柱富集DOM的原理, 本文进行了海水PPL-DOM (通过PPL树脂提取的DOM)富集放大实验, 搭建了小型自动化两级过滤、调酸、树脂柱提取富集装置, 完善了提取纯化工艺; 同时, 本文测试了PPL树脂长期使用的稳定性、重复性, 研究了上样速率、洗脱体积等影响参数。应用该技术提取2个近岸表层海水和1个红树林湿地潮沟水等多个批次水样的DOM, 装置均运行可靠, 方法回收率稳定。同时本文使用元素分析、荧光分析、红外光谱、固态13C核磁共振仪分析了样品基本成分和结构特征, 证明所提取样品的可靠性和稳定性。
1 材料与方法 1.1 水样信息鳌山湾表层海水: 夏季批次, 2019年8月1~8日, 青岛鳌山湾北湾(36°22′55″N, 120°49′35″E); 秋冬春季批次, 分别于2020年10月7~21日、2020年12月3~28日和2021年4月1~20日在鳌山湾南湾(36°20′03″N, 120°42′27″E)采集; 威海市桑沟湾贝藻养殖区表层海水(采样点以海带养殖为主): 2021年6月26日采集, 位置37°05′51″N, 122°34′40″E。海水用聚乙烯水桶运回实验室处理。红树林湿地潮沟水: 2021年5月7~12日, 位置为北海市峒尾红树林自然保护小区落潮潮沟(21°29′47″N, 108°59′44″E)。潮沟水样采集后立即在广西红树林研究中心处理。提取富集装置流程图见图 1。
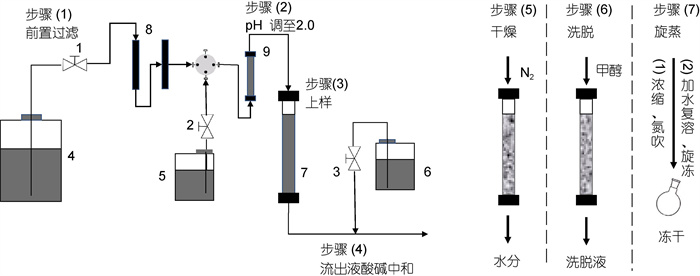 |
| 图 1 DOM提取、富集和冻干流程示意图 Fig. 1 Schematic diagram of the procedure of DOM extraction, purification and freeze-drying 注: 1~3: 蠕动泵; 4: 海水; 5: 酸液; 6: 碱液; 7: PPL树脂玻璃柱; 8: 净水过滤器(PP棉滤芯孔径5 μm)与精密过滤盘(滤膜孔径0.45 μm); 9: 酸液混合柱 |
DOM提取的自动化装置包括过滤、泵送、调酸、树脂柱吸附以及流出液酸碱中和等系统, 以及DOM的洗脱、浓缩、纯化和冻干过程(图 1)。
提取流程包括: (1) 树脂活化: 中压玻璃层析柱(高50 cm, 内径5 cm)填装200 g新购Bond Elut PPL树脂[柱床高度30 cm, 柱体积(BV) 600 mL]后, 3倍柱体积(用3 BV表示, 下文同)甲醇(色谱纯)活化和3倍柱体积酸化水(优级纯盐酸酸化的超纯水, pH 2.0)淋洗。
(2) 过滤和上样(步骤1~3): 精密蠕动泵(BT100-2J, 保定兰格恒流泵有限公司)泵送水样过孔径5 μm聚乙烯熔喷棉滤芯净水过滤器和混合纤维素酯滤膜(MCE, 孔径0.45 μm, 美国默克公司), 管线中水样与0.1 mol/L稀盐酸在线调节(混合瓶)酸化海水pH至2.0, 随后水样中的极性有机分子经PPL树脂柱后被吸附, 流出液与碱液中性后排放。
(3) 脱盐、干燥、洗脱和旋蒸(步骤4~7): 吸附完成后的树脂柱用pH值为2.0的水淋洗除去树脂中的绝大多数盐分, 将柱子在真空干燥器(45 ℃)干燥, 再使用高纯氮(> 99.999%)彻底吹干树脂。最后干燥后的树脂经甲醇(3~4 BV)洗脱得黄色洗脱液, 再经减压旋转蒸发(40 ℃)去除大部分甲醇近干(剩约20~30 mL), 残余甲醇用氮气吹干, 加少量水稀释混匀后冻干得淡黄色粉末状PPL-DOM。
(4) 树脂清洗: 洗脱后的PPL树脂使用甲醇(约15 BV)进行淋洗, 初步清洗(0~8 BV)可使用重蒸甲醇, 最后使用色谱纯甲醇(约7 BV)完成树脂清洗, 若后续处理样品为深远海的低溶解有机碳(dissolved organic carbon, DOC)浓度海水, 建议整个清洗过程均使用色谱纯甲醇进行清洗。清洗后的树脂可使用高纯氮吹干其中甲醇, 用于下一批次水样的处理。
1.3 分析仪器与方法 1.3.1 DOC测定总有机碳分析仪(Shimadzu TOC-L, 日本)测定水样DOC, 测定DOC前需在约30 mL样品中添加40 μL磷酸(85%~90%, HPLC级)清除样品中的无机碳。
1.3.2 甲醇洗脱液中DOC浓度的估算紫外分光光度计(Shimadzu UV2700, 日本)测定PPL-DOM甲醇溶液中DOM浓度; 标准溶液配制: 取已知碳含量PPL-DOM (碳含量46.7%)复溶于甲醇中, 配置成系列有机碳(OC)标准溶液(线性范围1.0~20.0 mg/L)。测定溶液254 nm吸光度(A), 经计算得标准曲线:
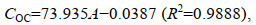 (1)
(1)式中, COC为甲醇溶液中PPL-DOM有机碳浓度, A为DOM甲醇溶液在254 nm吸光度。该方法检出限为0.5 mg C/L。
有色溶解性有机质(cDOM)代表了DOM中可吸收紫外可见光的组分, 一定程度上cDOM的紫外吸收系数可以反映水体cDOM的丰度(郭卫东等, 2018)。但不同环境水体cDOM的吸光系数受有机质结构的影响, 而cDOM的化学结构主要与其来源有关(李奕洁等, 2015), 如河口区cDOM存在更多的陆地维管植物代谢产物贡献, 而在远海以浮游植物代谢产物贡献为主, 这种cDOM来源差异会导致不同水体DOM的吸光度与DOC浓度之间的关系不一致。因此使用该方法只是用来估算甲醇中DOC含量(半定量), 建议使用同一海域海水的DOM配制标准溶液参比样品来计算标准曲线公式。
1.3.3 元素分析采用元素分析仪(Unicube, Elementar Analysensysteme GmbH, 德国)测定, 结果均已扣除样品水分与灰分(水分: 马弗炉75 ℃, 两次测定, 直到恒重; 灰分: 马弗炉550 ℃, 灼烧5 h)。
1.3.4 红外光谱(FTIR)采用傅里叶变换红外光谱仪(Nicolet iS50, Thermo Scientific, 美国)测定, 光谱采集范围4 000~500 cm–1, 取约1 mg样品与100 mg KBr研磨压片; Nicolet软件包Omnic 8.1采集和处理。
1.3.5 三维荧光光谱使用荧光光谱仪(HORIBA Aqualog®, HORIBA Scientific, 日本)进行EEM分析, 激发波长λEx 240~600 nm, 发射波长λEm 246~600 nm, 扫描间隔3 nm, 扫描速度300 nm/min。样品溶液中DOM浓度为5 mg/L, 超纯水作空白对照。
1.3.6 固态13C NMR波谱使用NMR波谱仪(Avance NEO 600, Bruker, 德国; 150.90 MHz 13C NMR)。样品填装于3.2 mm圆柱氧化锆转子中测试, 获得全边带抑制交叉极化(Cross Polarization/Total Suppression of Sidebands, CP/TOSS)和偶极去相(dipolar dephasing, DD) 13C NMR谱图(DD谱图中可以观察未被H取代的碳(non protonated)和易活动基团(如-OCH3和C-CH3)的信号), 谱图使用金刚烷作标定。CP/TOSS谱图积分: 烷基碳(alkyl), 化学位移0×10−6~45×10−6, 氮碳/甲氧基(-NCH/-OCH3) 45×10−6~ 60×10−6, 碳水化合物(-OCH-, HOCH2-) 60×10−6~94× 10−6, 碳水化合物端头碳(-OCHO-) 94×10−6~110×10−6, 烯烃碳/芳烃碳(olefins, aryl) 117×10−6~150×10−6, 取代芳香碳(aryl C-O/N-) 150×10−6~164×10−6, 羧基/酰胺(COO, -NC=O) 164×10−6~191×10−6, 酮/醛/蒽醌191×10−6~230×10−6 (Mao et al, 2012a)。
2 结果与讨论 2.1 PPL固相萃取法主要影响参数研究了PPL小柱法放大的PPL柱实验参数, 如控制吸附效率最关键的上样速率、洗脱体积, 并评估了PPL树脂的重复使用性。
首先进行PPL树脂的空白测试。使用过滤后的超纯水过清洗干净的PPL树脂柱, 流出液DOC 0.08 mg C/L (RSD 12.0%), 该值接近测定低限(LOD) 0.040 mg/L, 未发现有污染引入和树脂流失。使用马弗炉灼烧除碳的海盐配置成人工海水(DOC 0.71 mg C/L, 相对标准偏差RSD 13.3%, 盐度为34~35)泵送入清洗干净的PPL树脂柱, 取流出液测定DOC (n=3), 人工海水流出液DOC 0.85 mg C/L (RSD 11.5%)。
2.1.1 上样流速不同上样流速对PPL玻璃柱的DOC吸附效率和DOC回收率的影响见图 2。DOC回收率为树脂吸附前后水样DOC的差值与原水样DOC值之比, 单位时间内的DOC回收率作为DOC吸附效率。当流速从13 BV/h降低到4 BV/h时, DOC吸附效率下降, 从5.52 mg C/h减少到2.82 mg C/h; 而DOC回收率升高较快, 从35%升高到56%, 即上样较慢时, 虽然DOC吸附效率稍低但回收率较高。流速在6~8 BV/h时, DOC吸附效率有较大程度的下降, 回收率均超过50%, 但回收率增长较缓。经综合考虑, 优选8 BV/h的上样流速, DOC吸附效率可达4.8 mg C/h, 一天(24 h)吸附有机碳115.2 mg (DOM约230 mg)。
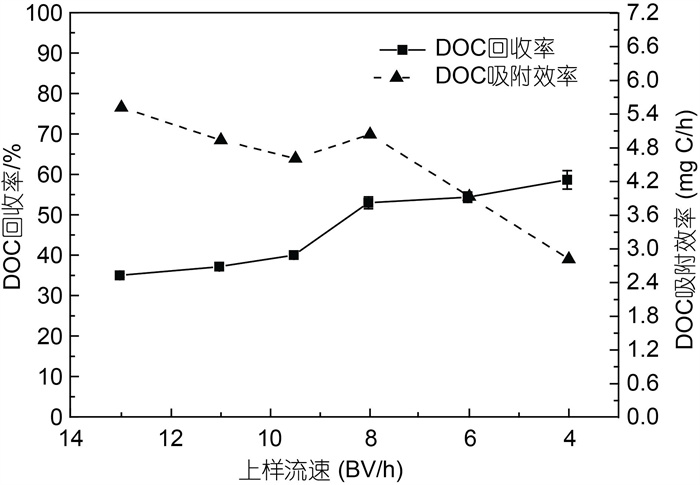 |
| 图 2 上样流速对有机碳回收率及吸附效率的影响 Fig. 2 Effects of flow rate on DOC recovery and adsorption efficiency 注: BV: 倍柱体积; DOC: 溶解有机碳 |
评估甲醇的洗脱体积对DOM回收率的影响。首先使用PPL树脂柱(200 g)富集2 400 L鳌山湾海水(冬季批次), 随上样量增加每克PPL树脂DOC回收率如图 3a所示, 结果显示DOC回收率稳定在60%左右, 表明PPL树脂未达到饱和吸附容量, 水样中的大部分DOM均被有效吸附至树脂上。值得注意的是, 在以往的PPL小柱研究中, 当PPL树脂负载过多即所吸附的DOM过多时, 会导致后续被吸附DOM的荧光信号和吸光度发生明显变化, 并导致回收率降低(Kong et al, 2021)。这种树脂过载导致的DOM荧光和化学分馏的变化会影响PPL-DOM后续的分析, 因此PPL-DOM样品比较的前提是保持树脂上的相对DOM负载量相似, 避免吸附率降低导致的化学分级。
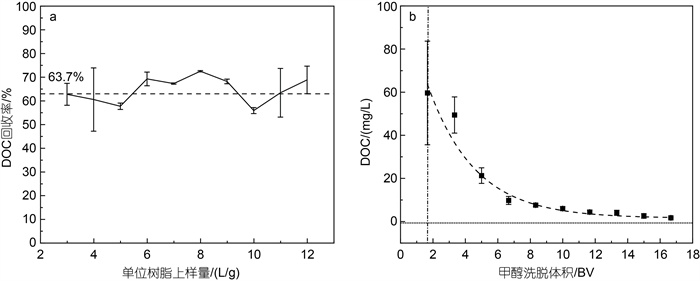 |
| 图 3 定制PPL-树脂柱的DOC回收率随上样海水体积的变化(a); 不同柱体积甲醇洗脱后中PPL-DOM有机碳浓度(b) Fig. 3 The DOC recovery in customized PPL-resin column with increase in seawater loading volume (a); DOC concentration of PPL-DOM in eluent after eluting with different bed volumes of methanol (b) |
采用Dittmar等(2008)的小柱方法中的甲醇作为洗脱溶剂, 甲醇相较于其他常见可与水混溶的有机溶剂(如乙醇、正己烷、乙腈等)极性最高, 可以洗脱PPL树脂上更多的被吸附的DOM组分, 并且在后续旋蒸中极易被去除。每洗脱1.67 BV (即1L)甲醇, 取10 mL的洗脱液, 测定其UV254值, 并根据公式(1)计算得到洗脱液中DOC浓度(图 3b), 通过对图 3b中曲线峰面积进行积分, 计算得用7 BV可以将树脂中75%以上的DOC有效洗脱, 17 BV的甲醇可以洗脱99%的DOM。图 3b中可看出4~6 BV洗脱体积时洗脱效率明显降低, 为得到高浓度浓缩液, 本实验室常选取前4 BV的甲醇洗脱液进行旋蒸冻干, 4 BV后的甲醇洗脱液则被收集重蒸(除去DOM), 重蒸甲醇可用于下一批次树脂的初步清洗。
除上样流速、上样体积以及洗脱溶剂用量等因素, 水样pH值也影响DOC回收率。DOM可以看作是富含多元羧酸的弱电解质(Ramos et al, 1999; Hertkorn et al, 2006), 水样充分酸化后有助于质子化的DOM分子在树脂上的有效吸附和提高回收率。水样酸化(pH=2.0)依照国际腐殖质学会(IHSS)地表水DOM的标准提取方法(Thurman et al, 1981)以及文献方法(Lara et al, 1994; Zhang et al, 2018b)和Dittmar等(2008)的PPL-SPE小柱方法。
2.1.3 树脂重复使用性选择SPE小柱(Bond Elut PPL, 500 mg, 6 mL)测试PPL树脂重复使用性。连续提取洗脱10次北京十三陵水库水(每次1 L)并监测每次固相萃取前后水样的DOC; 结果表明10次重复使用后, PPL-SPE小柱的回收率依然稳定在30%~35%, 并没有随着树脂使用次数增多而下降。使用本文定制PPL柱(1.2小节)多批次提取对近岸海水, 处理海水量在两年内累积达10 000 L以上, 而DOC回收率均稳定在50%以上。
实验数据表明, DOM吸附率和时间相关, 属于动态吸附率。较慢的上样流速(充分吸附)可以提高DOM的回收率, 但吸附效率会下降, 6~8 BV/h可以满足常规要求; 200 g PPL树脂柱实现了2 500L海水DOM的高效富集, 回收率可达60%。以安捷伦提供的PPL树脂可吸附树脂质量 > 5%的目标物计算, 200 g PPL树脂柱可用于5 000 L以上大体积海水[以总有机碳(TOC) 1.5 mg/L、DOM碳含量50%和DOC回收率60%计算]有机碳的富集, 但为避免DOM分子在树脂上负载过大, 尤其饱和吸附影响DOM的吸附和化学分级(Kong et al, 2021), 建议处理水量达到饱和量的50%~80%即可; 长期使用结果表明填充的PPL树脂柱可以反复使用(三年测试均未见同一PPL柱吸附率明显下降)。
2.2 DOM分析表征将该工艺和装置应用于鳌山湾四个季节海水, 处理水量、DOC含量、DOC回收率和PPL-DOM元素分析结果见表 1。上样流速(11~12 BV/h)过快导致有机碳回收率偏低(见春季批次), 流速参数为7.5~8 BV/h时DOC回收率52%~56%, 比文献报道稍低, Green等(2014)用放大的PPL树脂柱法(双柱串联, 每个填装500 g)处理北太平洋和夏威夷海水, DOC回收率61%。
| 批次 | 处理水量 /L |
DOC浓度 /(mg/L) |
RDOC# /% |
流速 /(mL/min) |
C含量 /% |
H含量 /% |
O含量 /% |
N含量 /% |
S含量 /% |
C/N* |
| 春季 | 900 | 2.05 | 38.00 | 112 | 50.10 | 5.98 | 35.2 | 3.13 | 1.26 | 18.70 |
| 夏季 | 1 125 | 1.81 | 56.00 | 75 | 52.00 | 6.61 | 37.6 | 2.94 | 0.84 | 20.50 |
| 秋季 | 2 300 | 2.03 | 53.00 | 80 | 46.70 | 6.11 | 36.8 | 3.00 | 0.88 | 18.20 |
| 冬季 | 4 000 | 2.05 | 52.00 | 80 | 52.10 | 6.59 | 37.3 | 3.04 | 0.92 | 20.00 |
| 注: #: 有机碳回收率RDOC= DOC流出液/DOC原水×100%; *: C/N为碳氮元素摩尔原子比; 元素分析结果已扣除水分及灰分 | ||||||||||
鳌山湾春夏秋冬PPL-DOM样品水分依次为2.59%、4.04%、1.92%、4.70%; 灰分依次为6.21%、6.40%、7.29%、6.82%。PPL-DOM样品灰分含量为6.68%±0.47%。
四个季节PPL-DOM元素分析结果相对稳定, 扣除水分及灰分后, C、H、N、O含量分别在46.7%~52.1%、5.98%~6.95%、2.94%~3.31%、35.2%~37.6%。PPL-DOM的元素分析结果与IHSS用XAD-8/4树脂法提取的淡水溶解性有机质或富里酸(FA)存在一定差异(humic- substances.org), 淡水NOM中H含量更低(一般为4%), N元素含量也较低(一般为1%~2.5%), O元素则较高(一般为40%), C含量与本文所提的PPL-DOM无明显差异; 使用XAD-8/XAD-4法提取的海洋DOM元素组成与本文提取的DOM结果相近(Green et al, 2014)。淡水与海水DOM在H、N、O元素组成上的差异与两水体中有机质的来源差异有关, 淡水DOM中存在大量的丹宁、木质素(贫氧)以及纤维素(贫氮)等物质的降解产物, 海水DOM中则存在更多藻类代谢所产生的类脂质、蛋白质等富氢富氮组分(Emerson et al, 2008)。此外, 鳌山湾PPL-DOM的C/N值(摩尔比)为19.4±1.2, 与Dittmar等(2008)采用PPL-SPE小柱法提取的海水DOM的C/N值(21±1)(挥发甲醇后, 复溶后测定)接近, 也表明使用该相同方法提取的样品与同类方法有很高的可比性。
2.2.2 EEM分析对鳌山湾春冬两季的海水水样及PPL-DOM复溶溶液(浓度5 mg/L)的EEM光谱进行比较, EEM谱图见图 4。海水样品中除了明显的类腐殖质A峰和M峰外(Coble, 1996; 郭卫东等, 2018), 类蛋白B峰和T峰信号也十分明显(Nelson et al, 2013), 而PPL-DOM样品中荧光组分则主要以类腐殖质A峰信号为主, B峰与T峰两种类蛋白荧光信号有明显降低, 表明PPL树脂在对海水DOM吸附过程中可能选择吸附一些有机氮组分, 某些分子量小极性较强的氨基酸类分子难以回收。
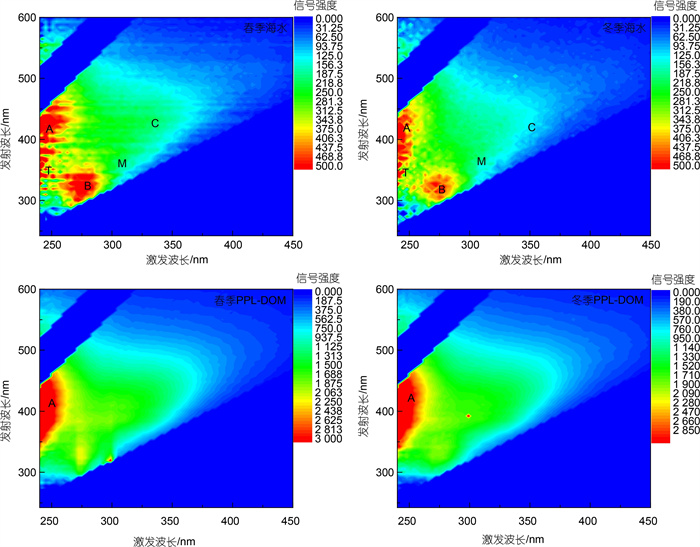 |
| 图 4 鳌山湾春冬两季海水及PPL-DOM复溶液的荧光EEM谱图 Fig. 4 The excitation-emission matrix (EEM) fluorescence spectra of original seawaters in spring and winter batches and two seasonal PPL-DOMs from Aoshan Bay 注: A峰、C峰为陆源类腐殖质荧光峰, M峰为海源类腐殖质荧光峰, B峰为类络氨酸荧光峰, T峰为类色氨酸荧光峰 |
图 5为鳌山湾四个季节PPL-DOM的FTIR谱图, 四个批次PPL-DOM的有机官能团红外吸收峰基本特征十分相似, 但也存在差异。在3 430 cm−1附近均存在一个强吸收峰, 属于酚类、碳水化合物和羧酸类等组分中的羟基缔合羰基后的O-H伸缩振动的吸收峰(Zhang et al, 2018a); 2 960 cm−1处的双峰可归属为长链烷烃类的-CH3和-CH2-, 1 390 cm−1峰也归属于-CH3吸收峰; 春、秋、冬季批次在1 729 cm−1附近均存在一个尖峰(夏季批次光谱在1 719 cm−1发生红移), 可归属为羧酸或羰基的C=O键的伸缩振动(Abdulla et al, 2010); 1 232 cm−1峰为C-O官能团或羧基中OH基团平面变角振动形成的弱峰, 在1 080~1 051 cm−1附近峰为碳水化合物中C-O伸缩振动。
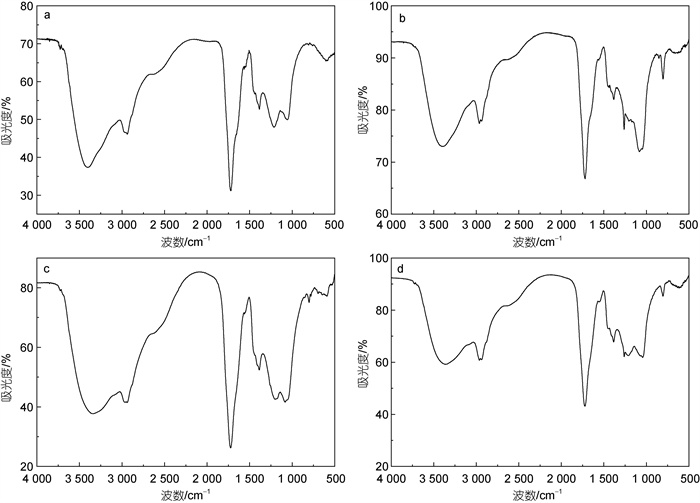 |
| 图 5 鳌山湾四个季节次PPL-DOM的FTIR谱图 Fig. 5 The FTIR spectra of PPL-DOM extracted from water in different seasons of Aoshan bay 注: a. 春季; b. 夏季; c. 秋季; d. 冬季 |
由于DOM成分和结构复杂, 吸收峰重叠, FTIR光谱的定性分析也受到一定限制, 而NMR技术作为一种对样品中有机碳官能团定量的分析技术(Mao et al, 2012b; Tfaily et al, 2013; Venel et al, 2021), 对DOM分析有很大优势, 尤其是固态13C核磁共振分析。图 6展示了鳌山湾冬季、红树林湿地潮沟水以及威海桑沟湾PPL-DOM的固态13C CP/TOSS NMR谱图, 其DD谱图显示了非H-C的碳(non-protonated C)和活动(mobile)甲氧基/甲基(-OCH3/-CCH3)碳(图 6), 谱图积分结果见表 2。
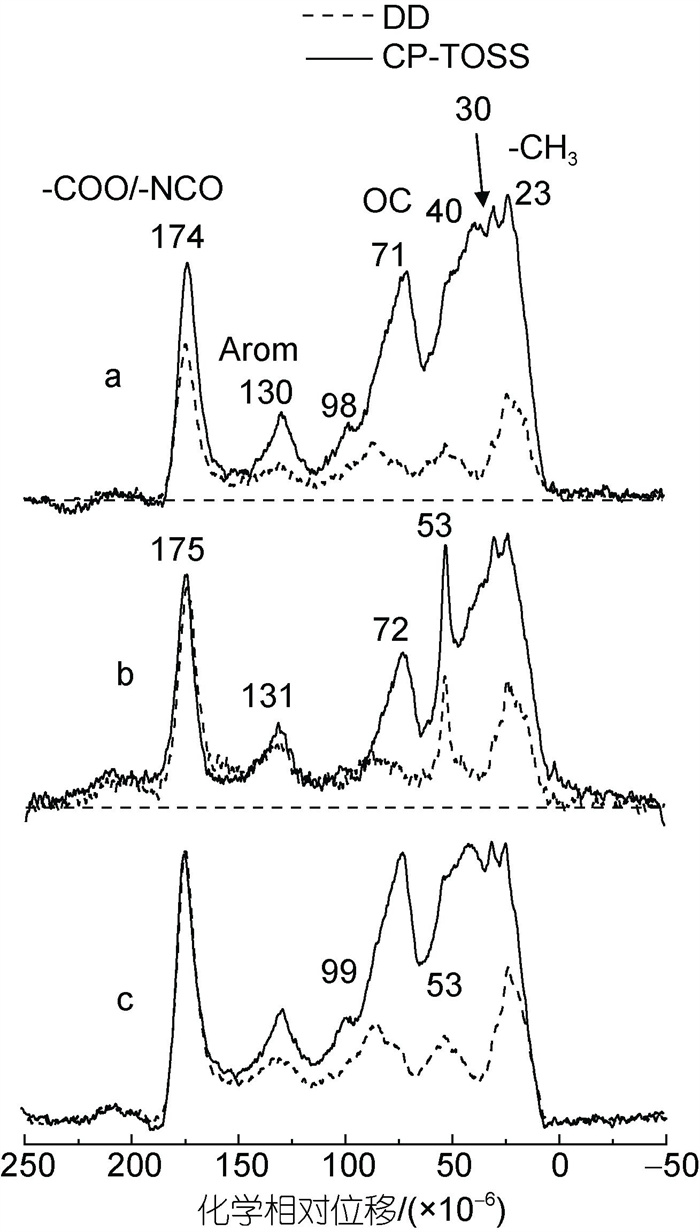 |
| 图 6 PPL-DOM固态13C CP/TOSS NMR谱图 Fig. 6 Solid-state 13C NMR spectra of different PPL-DOM samples 注: a. 鳌山湾冬季海水; b. 红树林湿地潮沟水; c. 桑沟湾养殖海水; 虚线为DD谱图, 实线为CP-TOSS谱图 |
| 化学位移范围/(×10−6) | 不同官能团碳含量/% | #HI | *Arom./% | |||||||
| C=O | NC=O/COO | O-aryl | Aryl C | O-CH-O | O-Alkyl | OCH3/NCH | Alkyl | |||
| 191~230 | 164~191 | 150~164 | 110~150 | 94~110 | 60~94 | 45~60 | 0~45 | |||
| 鳌山湾样品 | 0.43 | 12.0 | 1.19 | 7.88 | 4.00 | 23.0 | 13.2 | 38.8 | 1.14 | 9.07 |
| 红树林湿地样品 | 4.96 | 14.3 | 1.34 | 8.62 | 2.52 | 16.0 | 12.6 | 39.6 | 1.07 | 10.1 |
| 桑沟湾样品 | 0.28 | 11.9 | 1.83 | 10.7 | 11.1 | 25.2 | 13.5 | 31.4 | 1.51 | 12.5 |
| 注: #: 亲水性指数HI = [(45~60) + (60~94) + (94~110) +(150~164) +(164~190) + (191~230)]/[(0~45) +(110~150)]; *: 芳香碳含量Arom.= aryl(110~150) + O-aryl(150~164) | ||||||||||
三个不同来源的PPL-DOMs谱图均显示较强的烷烃、碳水化合物、芳烃、羧基/酰胺信号, 与典型海水DOM基本特征相同(Mao et al, 2012a; Zhang et al, 2018b)。DOM中烷基碳信号(0~45×10−6, 其中30×10−6为长链烷烃的-CH2-)较强, 羰基(醛/酮, 191×10−6~ 230×10−6)在样品中则含量较少。根据表3中DOM的亲水性指数(Hydrophilicity Index, HI)和芳香碳含量(Aromaticity), 桑沟湾PPL-DOM显示更强的亲水性(HI值为1.51), 其芳香族碳含量(12.5%)略高于鳌山湾(9.07%)和红树林(10.1%)样品。湿地和近岸海水PPL-DOM在有机碳组成上也存在明显差异: 红树林湿地PPL-DOM的DD谱图在53×10−6处存在一个明显的尖峰, 该信号归属于木质素中甲氧基的信号, 表明样品中丰富的木质素来源物质, 这些信号来源于湿地红树林植物降解产物(Zhang et al, 2013); 鳌山湾和桑沟湾PPL-DOM存在较高的氧烷基信号(60×10−6~ 94×10−6), 结合98×10−6附近的O-C-O (anomeric C)信号, 表明样品中含较多的碳水化合物, 可能来源于大型藻类(如海带)代谢产生的多糖类物质(房景辉等, 2021)。
使用该放大的PPL-SPE法和装置及优化的工艺提取富集纯化的多批次PPL-DOM结果显示, DOC回收率稳定, 且样品的元素组成与文献结果相近(Dittmar et al, 2008; Green et al, 2014), 样品C含量也与IHSS河水和湖水富里酸(如1R101F、1R105H)相近, 但相比淡水, 海水DOM的O元素含量稍低, 而H、N元素含量稍高, 反映出海水与淡水水体有机质来源的差异; FTIR和NMR结果表明DOM结构组成以羧基、羰基、烷烃类(类脂质)以及碳水化合物等为主。不同水生态系统PPL-DOM的固态13C NMR结果表明不同样品间碳官能团存在明显差异, 显示出DOM陆源和生源前体化合物来源的差异。
比较PPL-DOM与原海水水样荧光EEM谱图, 可以看出PPL树脂对某些含氮组分存在一定的选择吸附。但目前几种常用海水DOM树脂提取方法中, XAD大孔树脂以及C18固相萃取树脂等对海水DOM的回收率明显低于PPL树脂法, 膜法中超滤法也只能实现高分子量DOM的富集, 电渗析耦合反渗透(RD/ED)技术虽然可以实现较高的DOC回收率(70%以上)(Chen et al, 2014), 但该方法制备的固体样品依然灰分很高。综合对比, 放大的PPL树脂固相萃取法能得到纯度较理想的低灰分DOM样品, 同时PPL-DOM中有机成分能代表海水DOM的主要特征。将来可通过多种树脂或技术联用的方法提高DOM的回收率, 如Green等(2014)报道了PPL树脂与电渗析耦合反渗透技术联用。
3 结论本文对PPL固相萃取(小柱)法进行放大, 建立了大体积海水中DOM的提取工艺, 搭建提取装置, 简化调酸步骤, 优化上样和洗脱技术参数, 并成功应用于多批次海水克级DOM的富集提取和纯化。分析表征结果表明PPL-DOM样品性质稳定, 不同来源海水DOM中的前体化合物信息也能得到保留。该技术提取的大体积海水DOM, 可广泛用于数据比对、DOM结构分析、微生物培养实验等工作。PPL-SPE方法是目前DOM富集纯化最为有效的方法之一, 下一步将开展PPL-SPE法与其他提取技术联用的工作以提高方法的回收率。
致谢 感谢山东大学结构成分与物性测量平台董姝丽教授和于群博士在论文中样品的固态13C NMR数据测定和分析中所提供的帮助; 感谢山东大学海洋研究院海洋碳汇仪器测试平台老师和同学的大力协助。
李奕洁, 宋贵生, 胡素征, 等, 2015. 2014年夏季长江口有色溶解有机物(CDOM)的分布、光学特性及其来源探究. 海洋与湖沼, 46(3): 670-678 |
房景辉, 何为, 毛玉泽, 等, 2021. 桑沟湾标准化与传统养殖模式海带的营养成分比较. 渔业科学进展, 42(2): 170-175 DOI:10.19663/j.issn2095-9869.20200109001 |
郭卫东, 王超, 徐静, 等, 2018. 海洋有机质的光谱分析方法评述. 海洋通报, 37(6): 601-614 |
蔡阮鸿, 郑强, 陈晓炜, 等, 2021. 微型生物碳泵研究进展. 厦门大学学报(自然科学版), 60(2): 355-366 |
ABDULLA H A N, MINOR E C, DIAS R F, et al, 2010. Changes in the compound classes of dissolved organic matter along an estuarine transect: a study using FTIR and 13C NMR. Geochimica et Cosmochimica Acta, 74(13): 3815-3838 DOI:10.1016/j.gca.2010.04.006 |
ARAKAWA N, ALUWIHARE L I, SIMPSON A J, et al, 2017. Carotenoids are the likely precursor of a significant fraction of marine dissolved organic matter. Science Advances, 3(9): e1602976 DOI:10.1126/sciadv.1602976 |
CHEN M L, KIM S, PARK J E, et al, 2016. Effects of dissolved organic matter (DOM) sources and nature of solid extraction sorbent on recoverable DOM composition: implication into potential lability of different compound groups. Analytical and Bioanalytical Chemistry, 408(17): 4809-4819 DOI:10.1007/s00216-016-9569-x |
CHEN H M, STUBBINS A, PERDUE E M, et al, 2014. Ultrahigh resolution mass spectrometric differentiation of dissolved organic matter isolated by coupled reverse osmosis- electrodialysis from various major oceanic water masses. Marine Chemistry, 164: 48-59 DOI:10.1016/j.marchem.2014.06.002 |
COBLE P G, 1996. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy. Marine Chemistry, 51(4): 325-346 DOI:10.1016/0304-4203(95)00062-3 |
DITTMAR T, KOCH B, HERTKORN N, et al, 2008. A simple and efficient method for the solid-phase extraction of dissolved organic matter (SPE-DOM) from seawater. Limnology and Oceanography: Methods, 6(6): 230-235 DOI:10.4319/lom.2008.6.230 |
EMERSON S, HEDGES J
, 2008. Chemical Oceanography and the Marine Carbon Cycle. Cambridge: Cambridge University Press
|
GREEN N W, MCINNIS D, HERTKORN N, et al, 2015. Suwannee river natural organic matter: isolation of the 2R101N reference sample by reverse osmosis. Environmental Engineering Science, 32(1): 38-44 DOI:10.1089/ees.2014.0284 |
GREEN N W, PERDUE E M, AIKEN G R, et al, 2014. An intercomparison of three methods for the large-scale isolation of oceanic dissolved organic matter. Marine Chemistry, 161: 14-19 DOI:10.1016/j.marchem.2014.01.012 |
HANSELL D A, 2013. Recalcitrant dissolved organic carbon fractions. Annual Review of Marine Science, 5: 421-445 DOI:10.1146/annurev-marine-120710-100757 |
HERTKORN N, BENNER R, FROMMBERGER M, et al, 2006. Characterization of a major refractory component of marine dissolved organic matter. Geochimica et Cosmochimica Acta., 70(12): 2990-3010 DOI:10.1016/j.gca.2006.03.021 |
KONG X, JENDROSSEK T, LUDWICHOWSKI K, et al, 2021. Solid-Phase Extraction of aquatic organic matter: loading-dependent chemical fractionation and self-assembly. Environmental Science & Technology, 55(22): 15495-15504 |
LARA R J, THOMAS D N, 1994. Isolation of marine dissolved organic matter: evaluation of sequential combinations of XAD resins 2, 4, and 7. Analytical Chemistry, 66(14): 2417-2419 DOI:10.1021/ac00086a032 |
LI Y, HARIR M, LUCIO M, et al, 2016. Proposed guidelines for solid phase extraction of Suwannee River dissolved organic matter. Analytical Chemistry, 88(13): 6680-6688 DOI:10.1021/acs.analchem.5b04501 |
LI P H, TAO J C, LIN J, et al, 2019. Stratification of dissolved organic matter in the upper 2000 m water column at the Mariana Trench. Science of the Total Environment, 668: 1222-1231 DOI:10.1016/j.scitotenv.2019.03.094 |
MAO J D, KONG X Q, SCHMIDT-ROHR K, et al, 2012a. Advanced solid-state NMR characterization of marine dissolved organic matter isolated using the coupled reverse osmosis/electrodialysis method. Environmental Science & Technology, 46(11): 5806-5814 |
MAO J D, JOHNSON R L, LEHMANN J, et al, 2012b. Abundant and stable char residues in soils: implications for soil fertility and carbon sequestration. Environmental Science & Technology, 46(17): 9571-9576 |
NELSON N B, SIEGEL D A, 2013. The global distribution and dynamics of chromophoric dissolved organic matter. Annual Review of Marine Science, 5: 447-476 DOI:10.1146/annurev-marine-120710-100751 |
RAMOS A, LÓPEZ S, LÓPEZ R, et al, 1999. Ionization constants of a soil fulvic acid. Analusis, 27(5): 418-420 DOI:10.1051/analusis:1999270418 |
SONG G X, NOVOTNY E H, RICHARDS K G, et al, 2018. Characteristics of hydrophobic and hydrophilic acid fractions in drainage waters of undisturbed soil lysimeters. Journal of Soils and Sediments, 18(11): 3197-3214 DOI:10.1007/s11368-018-1977-4 |
TFAILY M M, HAMDAN R, CORBETT J E, et al, 2013. Investigating dissolved organic matter decomposition in northern peatlands using complimentary analytical techniques. Geochimica et Cosmochimica Acta, 112: 116-129 DOI:10.1016/j.gca.2013.03.002 |
THURMAN E M, MALCOLM R L, 1981. Preparative isolation of aquatic humic substances. Environmental Science & Technology, 15(4): 463-466 |
VENEL F, NAGASHIMA H, RANKIN A G M, et al, 2021. Characterization of functional groups in estuarine dissolved organic matter by DNP-enhanced 15N and 13C solid-state NMR. ChemPhysChem, 22(18): 1907-1913 DOI:10.1002/cphc.202100334 |
ZHANG Y L, DU J Z, PENG B, et al, 2013. Chemical and spectroscopic characterization of dissolved humic substances in a mangrove-fringed estuary in the eastern coast of Hainan Island, China. Chinese Journal of Oceanology and Limnology, 31(2): 454-463 DOI:10.1007/s00343-013-2138-7 |
ZHANG Y L, YANG K L, DU J Z, et al, 2018a. Chemical characterization of fractions of dissolved humic substances from a marginal sea—a case from the Southern Yellow Sea. Journal of Oceanology and Limnology, 36(2): 238-248 DOI:10.1007/s00343-017-6202-6 |
ZHANG C L, DANG H Y, AZAM F, et al, 2018b. Evolving paradigms in biological carbon cycling in the ocean. National Science Review, 5(4): 481-499 DOI:10.1093/nsr/nwy074 |
 2022, Vol. 53
2022, Vol. 53


