
中国海洋湖沼学会主办。
文章信息
- 王朝晖, 郑虎, 王文婷, 谢昌良, 暨双辉, 张宇宁. 2022.
- WANG Zhao-Hui, ZHENG Hu, WANG Wen-Ting, XIE Chang-Liang, JI Shuang-Hui, ZHANG Yu-Ning. 2022.
- 福建福宁湾表层沉积物中甲藻孢囊分布与多样性研究
- DIVERSITY AND DISTRIBUTION OF DINOFLAGELLATE CYSTS IN SURFACE SEDIMENTS IN FUNING BAY, FUJIAN, CHINA
- 海洋与湖沼, 53(6): 1396-1404
- Oceanologia et Limnologia Sinica, 53(6): 1396-1404.
- http://dx.doi.org/10.11693/hyhz20220200036
文章历史
-
收稿日期:2022-02-19
收修改稿日期:2022-03-29
甲藻是海洋浮游植物的重要组成部分, 约有75%左右的有毒有害赤潮是由甲藻引起(Gómez, 2012)。许多甲藻在其生活史过程中能形成休眠孢囊, 孢囊加厚细胞壁, 并沉入海底成为海洋沉积物的一部分(Bravo et al, 2014)。沉积物中甲藻孢囊可以帮助种群度过恶劣环境, 而孢囊的萌发可为水体提供营养细胞, 被认为是赤潮发生的“种源”(Anderson et al, 2014)。虽然只有10%~20%的甲藻能形成休眠孢囊, 但许多有毒有害赤潮藻类能产生休眠孢囊, 而近岸海域大部分赤潮甲藻特别是循环发生赤潮的藻类均为孢囊形成种类(Matsuoka et al, 2000)。由于具有较厚的耐受性孢囊壁, 孢囊可在海底环境中存活数十年甚至上百年(Ellegaard et al, 2018)。因此, 沉积物中孢囊的分布可反映营养细胞种群动态, 揭示赤潮特别是有毒有害赤潮发生潜势(Anderson et al, 2014)。
福宁湾位于福建省东北部霞浦县, 属中亚热带海洋性季风湿润气候, 季节性特征明显, 地势平坦, 大多为泥沙底质, 沿岸有罗汉溪等河流入海。福宁湾浮游植物群落主要由硅藻、甲藻组成, 优势种包括中肋骨条藻(Skeletonema costatum)、柏氏角管藻(Cerataulina bergonii)和条纹小环藻(Cyclotella striata)等硅藻以及夜光藻(Noctiluca scintillans)和波状角藻(Ceratium trichoceros)等甲藻(全汉锋等, 2015)。福宁湾是霞浦县重要的养殖基地, 21世纪以来福宁湾频发赤潮, 主要为中肋骨条藻、具齿原甲藻(Prorocentrum dentatum)、夜光藻、米氏凯伦藻(Karenia mikimotoi)等赤潮(陈国斌等, 2004; 刘炜等, 2008)。而目前关于福宁湾甲藻孢囊的研究尚未见报道。
为了解福宁湾甲藻孢囊的分布状况, 揭示有毒有害甲藻赤潮发生潜势, 本研究采集了福宁湾表层沉积物样品, 对沉积物中甲藻孢囊的分布规律进行研究, 重点揭示有毒有害甲藻孢囊的分布; 同时测定了沉积物中生源要素含量, 以揭示孢囊分布与生源要素的关系。研究目的旨在阐明福宁湾海域甲藻赤潮发生潜势, 为福宁湾的环境保护和海洋资源可持续发展提供科学依据。
1 材料与方法 1.1 样品采集在福宁湾海域设置了7个采样点(图 1), 于2018年4月用彼得逊抓斗式采样器采集了表层沉积物样品, 取上表层0~2 cm沉积物样品, 混匀后用封口袋密封, 低温避光保存, 带回实验室后−20 ℃避光保存待测。
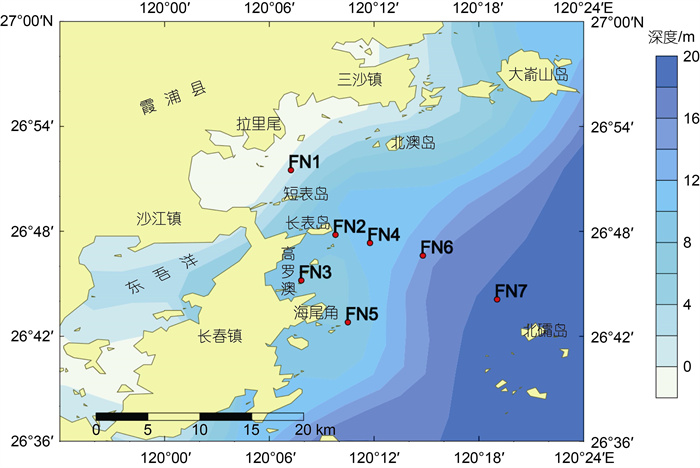 |
| 图 1 福宁湾孢囊研究采样图 Fig. 1 The sampling stations in Funing Bay |
称取约15 g湿沉积物, 于45 ℃烘干至恒重, 研磨后过100 μm网筛后, 放入密封袋中保存待测。总氮(TN)和总有机碳(TOC)的含量使用美国Perkin- Elmer 2400 Series Ⅱ型元素分析仪测定(谷阳光等, 2010), 总磷(TP)含量采用过硫酸盐同步消化法测定(邢殿楼等, 2006), 生物硅(BSi)采用化学连续提取法提取(Liu et al, 2002)。
1.3 孢囊的分析与鉴定称取5 g湿沉积物样品, 置于烧杯中, 加入适量过滤海水充分混合后, 水浴超声处理60 s, 然后先后过125和10 μm孔径筛网, 收集10 μm筛网上的颗粒物, 定容至10 mL, 加入3%福尔马林固定。在倒置显微镜(Nikon ECLIPSE)下对孢囊进行分析鉴定, 每个样品观察分析至少100个孢囊, 孢囊密度以每克干泥中甲藻孢囊数量表示(cysts/g, 以干重计, 下同)。
1.4 数据处理和统计分析孢囊的香农-威尔种类多样性指数(Shannon-Wiener diversity index, H′)、皮卢均匀度指数(Pielou’s evenness index, J)以及孢囊与生源要素的相关关系采用SPSS 23.0软件进行分析计算。采样图及孢囊密度的地理分布图使用软件Sufer 13.0进行绘制, 柱状图及折线图使用Excel 2016软件进行绘制。通过计算每种孢囊的平均密度确定其优势度, 孢囊按优势度排列的分布图使用R4.1.0软件的ggplot2函数包进行绘制。
2 结果与分析 2.1 甲藻孢囊集群结构在福宁湾海域表层沉积物中, 共分析鉴定出甲藻孢囊25种, 其中膝沟藻目孢囊9种、Thoracosphaerales目2种(斯氏藻孢囊)、Suessiales目1种(别什藻孢囊)、裸甲藻目5种、多甲藻类目8种(表 1), 每个站位所鉴定到的孢囊种类数为15~21种(表 1, 图 2a)。本研究分析鉴定出9种有毒有害甲藻的孢囊, 包括麻痹性贝类毒素(paralytic shellfish poisoning, PSP)原因种奥氏亚历山大藻(Alexandrium ostenfeldii)和链状/塔玛亚历山大藻(Alexandrium catenella/tamarense)孢囊复合体、goniodomine A原因种平野亚历山大藻(Alexandrium hiranoi)、虾夷扇贝毒素(yessotoxin, YTX)原因种具刺膝沟藻(Gonyaulax spinifera)和网状原角藻(Protoceratium reticulatum)、产生鱼毒素的哈曼褐多沟藻(Pheopolykrikos hartmannii)以及赤潮藻类Barrufeta bravensis、锥状斯氏藻(Scrippsiella acuminata)和垂裂莱万藻(Levanderina fissa), 其中Barrufeta bravensis、Gonyaulax spinifera和Scrippsiella acuminata分布广泛且密度较高, 而其他有毒有害甲藻孢囊仅在某些站位零星分布(表 1, 图 3)。站位间香农-威尔种类多样性指数(H′)变化不大, 为2.06~2.34; 而均匀度指数(J)则为0.71~0.81(图 2a)。
| 目 | 学名 | 中文名 | 毒素名称 | FN1 | FN2 | FN3 | FN4 | FN5 | FN6 | FN7 |
| 膝沟藻目Gonyaulacales | Alexandrium catenella/tamarense | 链状/塔玛亚历山大藻 | PSP | + | + | + | + | + | + | |
| Alexandrium hiranoi | 平野亚历山大藻 | goniodomine A | + | + | ||||||
| Alexandrium ostenfeldii | 奥氏亚历山大藻 | PSP | + | + | + | + | ||||
| Alexandrium sp. | 亚历山大藻 | + | + | + | ||||||
| Gonyaulax cochlea | 耳蜗膝沟藻 | + | + | + | + | + | + | + | ||
| Gonyaulax elongata | 长膝沟藻 | + | + | + | + | + | + | |||
| Gonyaulax spinifera | 具刺膝沟藻 | YTX | + | + | + | + | + | + | + | |
| Protoceratium reticulatum | 网状原角藻 | YTX | + | + | ||||||
| Sourniaea diacantha | + | + | + | + | + | + | ||||
| Thoracosphaerales | Scrippsiella acuminata (原Scrippsiella trochoidea) | 锥状斯氏藻 | HAB | + | + | + | + | + | + | |
| Scrippsiella crystallina | 水晶斯氏藻 | + | + | + | + | + | + | |||
| Suessiales | Biecheleria tirezensis | 别什藻 | + | + | + | + | + | + | + | |
| 裸甲藻目Gymnodiniales | Barrufeta bravensis | 赤潮 | + | + | + | + | + | + | + | |
| Gyrodinium sp. | 环沟藻 | + | + | + | + | + | + | |||
| Levanderina fissa (原Gyrodinium instriatum) | 垂裂莱万藻(原条纹环沟藻) | HAB | + | + | + | + | ||||
| Polykrikos hartmannii | 哈曼多沟藻 | 鱼毒素 | + | + | + | + | ||||
| Polykrikos schwartzii | 无纹多沟藻 | + | + | |||||||
| 多甲藻目Peridiniales | Heterocapsa niei | 异帽藻 | + | + | + | + | + | + | + | |
| Protoperidinium abei | 安倍原多甲藻 | + | + | + | + | + | + | + | ||
| Protoperidinium claudicans | 窄脚原多甲藻 | + | + | + | ||||||
| Protoeridinium conicum | 锥形原多甲藻 | + | + | + | + | |||||
| Protoperidinium denticulatum | 小齿原多甲藻 | + | + | + | + | + | ||||
| Protoperidinium leonis | 里昂原多甲藻 | + | + | + | + | + | + | + | ||
| Protoperidinium minimum | 微小原多甲藻 | + | + | + | + | |||||
| Protoperidinium pentagonum | 五角原多甲藻 | + | + | + | + | + | + | + | ||
| 孢囊种类数 | 18 | 18 | 19 | 15 | 18 | 20 | 21 | |||
| 注: PSP: 麻痹性贝类毒素; YTX: 虾夷扇贝毒素; HAB: 有害藻华。未标注中文名称的种类表示目前尚无合适的中文名称。“+”: 表示在该站位检出。 | ||||||||||
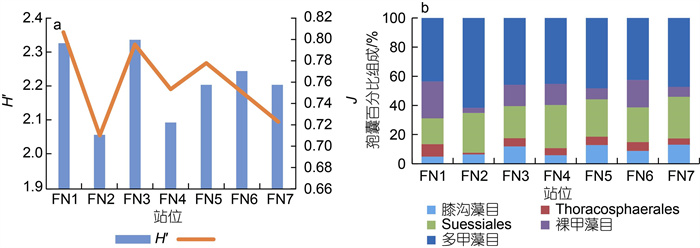 |
| 图 2 福宁湾甲藻孢囊种类多样性指数以及各类孢囊的百分比组成 Fig. 2 Species diversity of dinoflagellate cysts and percentage proportions of cyst groups 注: a: 香农-威尔种类多样性指数(H′)和皮卢均匀度指数(J); b: 不同目的甲藻孢囊百分比组成 |
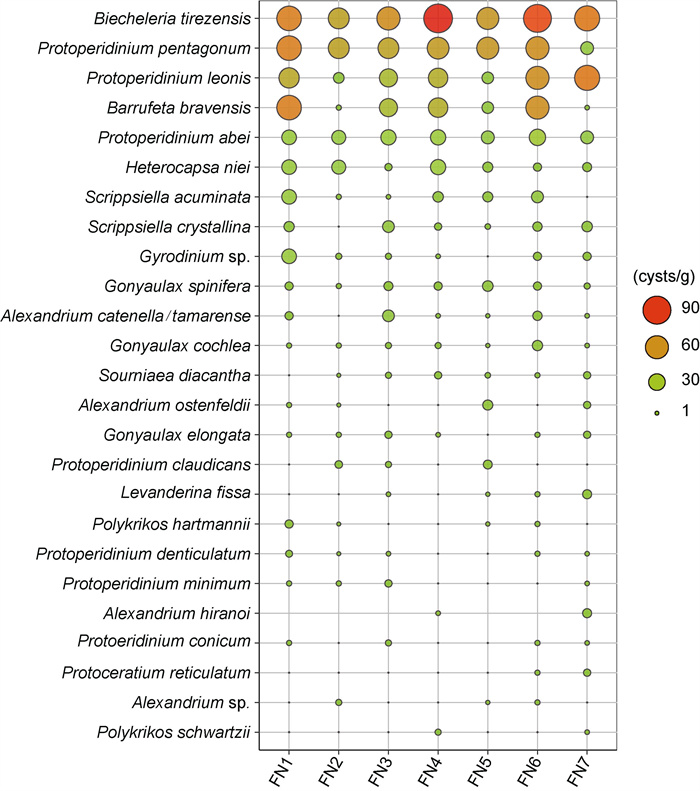 |
| 图 3 甲藻孢囊按平均孢囊密度排列的分布状况 Fig. 3 Distribution of dinoflagellate cysts in average concentrations |
在各类孢囊中, 以多甲藻目的孢囊占据优势(图 2b), 占比为42.5%~61.6%, 平均为47.7%。多甲藻目中大部分为异养型的原多甲藻属的孢囊(表 1), 原多甲藻孢囊占比37.6%~50.0%, 平均为42.5%。Suessiales即别什藻(Biecheleria tirezensis)的孢囊次之, 百分比为17.7%~29.6%, 平均25.0%。裸甲藻目和膝沟藻目的孢囊百分比含量相近, 平均分别为13.0%和9.1%。而Thoracosphaerales (两种斯氏藻)的孢囊平均百分比含量仅为5.2%。
图 3显示了25种甲藻孢囊按照平均孢囊密度排列的分布状况, 有8种孢囊在所有站位均有分布, 分别为别什藻、五角原多甲藻(Protoperidinium pentagonum)、里昂原多甲藻(Protoperidinium leonis)、Barrufeta bravensis、安倍原多甲藻(Protoperidinium abei)、异帽藻、具刺膝沟藻和耳蜗膝沟藻(Gonyaulax cochlea)。此外, 还有6种孢囊在6个站位出现, 说明福宁湾孢囊组成相近。密度最高的前六种孢囊均在所有站位分布, 其中别什藻孢囊平均密度达到69.8 cysts/g (以干重计, 下同); 随后是两种原多甲藻属的孢囊, 平均密度分别为50.1和40.1 cysts/g; Barrufeta bravensis、安倍原多甲藻、异帽藻的孢囊位列密度第4至第6位, 平均密度为13.9~32.0 cysts/g; 其他孢囊的平均密度均小于10 cysts/g。Barrufeta bravensis孢囊平均密度达32.0 cysts/g, 其他8种有毒有害甲藻孢囊密度位于0.96~8.8 cysts/g, 具刺膝沟藻和锥状斯氏藻孢囊密度相对较高。
2.2 孢囊密度的地理分布福宁湾海域甲藻孢囊的地理分布见图 4, 总孢囊密度和各类孢囊密度分布规律相近, 大部分高值区位于在短表岛以北的近岸海域FN1站位以及长表岛外的FN4至FN6一带, 而低值区则位于长表岛附近的FN2以及位于高罗澳的FN3和海尾角附近的FN5。孢囊密度介于178.6~386.3 cysts/g, 平均为286.0 cysts/g, 整体来说呈现东北部偏高、西南部偏低的趋势, 最高值位于FN6, 最低值位于FN2 (图 4a)。膝沟藻孢囊密度介于11.4~33.2 cysts/g, 平均密度为25.0 cysts/g, 最高值位于FN6, FN3和FN7膝沟藻孢囊密度也较高; 低值区位于以FN2为中心的西北角(图 4b)。Thoracosphaerales孢囊包括两种斯氏藻孢囊, 其密度介于2.1~33.2 cysts/g, 平均密度为16.1 cysts/g, 高值区位于FN1, 最低值位于FN2 (图 4c)。Suessiales中仅鉴定出一种别什藻Biecheleria tirezensis孢囊, 孢囊密度介于48.8~95.0 cysts/g, 平均密度为69.8 cysts/g, 高值区位于FN4至FN6, 低值区则位于以FN2为中心的西部海域(图 4d)。裸甲藻目的孢囊密度介于6.2~97.6 cysts/g, 平均密度为42.1 cysts/g, 分布规律与总孢囊密度一致, 高值区位于FN1和FN6, 而低值区位于FN2附近(图 4e)。多甲藻孢囊除了异帽藻Heterocapsa niei孢囊外, 其余全部为原多甲藻孢囊; 多甲藻密度介于103.4~168.2 cysts/g, 平均密度为133.0 cysts/g, 高值区也位于FN1和FN6, 低值区则位于FN5 (图 4e)。
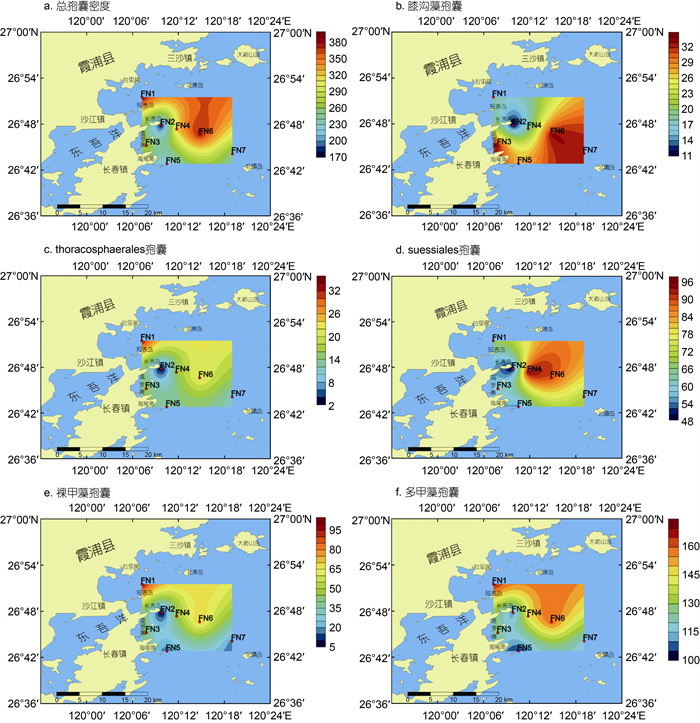 |
| 图 4 总孢囊密度及不同类别孢囊密度的地理分布(单位: cysts/g) Fig. 4 Geographical distribution in concentration of overall cysts and cysts of the five classes (unit: cysts/g) |
表 2列出了福宁湾表层沉积物中甲藻孢囊与生源要素的皮尔森相关性分析结果, 孢囊密度与生源要素一般无明显相关关系, 仅Suessiales孢囊密度与TN呈现出明显的正相关关系(P < 0.05)。总孢囊密度与主要孢囊类别如裸甲藻孢囊、多甲藻孢囊、Thoracosphaerales孢囊和Suessiales孢囊密度均呈明显正相关关系(P < 0.05或P < 0.01), 说明它们是总孢囊密度的重要贡献者。
| TN | TP | BSi | TOC | 孢囊种 类数 |
孢囊密度 | 膝沟藻类密度 | 裸甲藻 密度 |
多甲藻 密度 |
Thor | Sues | |
| TN | 1 | 0.890** | 0.627 | 0.775* | −0.07 | 0.367 | 0.289 | 0.138 | 0.274 | 0.165 | 0.782* |
| TP | 0.890** | 1 | 0.751 | 0.804* | 0.337 | 0.114 | 0.527 | −0.156 | −0.002 | −0.109 | 0.622 |
| BSi | 0.627 | 0.751 | 1 | 0.804* | −0.046 | −0.342 | 0.319 | −0.566 | −0.435 | −0.560 | 0.305 |
| TOC | 0.775* | 0.804* | 0.804* | 1 | −0.088 | −0.101 | 0.471 | −0.306 | −0.274 | −0.170 | 0.378 |
| 孢囊种类数 | −0.07 | 0.337 | −0.046 | −0.088 | 1 | 0.081 | 0.640 | −0.009 | 0.035 | 0.021 | 0.000 |
| 孢囊密度 | 0.367 | 0.114 | −0.342 | −0.101 | 0.081 | 1 | 0.199 | 0.956** | 0.972** | 0.918** | 0.721* |
| 膝沟藻类密度 | 0.289 | 0.527 | 0.319 | 0.471 | 0.640 | 0.199 | 1 | 0.043 | −0.001 | 0.172 | 0.226 |
| 裸甲藻密度 | 0.138 | −0.156 | −0.566 | −0.306 | −0.009 | 0.956** | 0.043 | 1 | 0.958** | 0.965** | 0.505 |
| 多甲藻密度 | 0.274 | −0.002 | −0.435 | −0.274 | 0.035 | 0.972** | −0.001 | 0.958** | 1 | 0.874* | 0.674 |
| Thor | 0.165 | −0.109 | −0.560 | −0.170 | 0.021 | 0.918** | 0.172 | 0.965** | 0.874* | 1 | 0.437 |
| Sues | 0.782* | 0.622 | 0.305 | 0.378 | 0.000 | 0.721* | 0.226 | 0.505 | 0.674 | 0.437 | 1 |
| 注: *: P < 0.05, **: P < 0.01; 粗体字表示相关性明显; Thor、Sues分别表示Thoracosphaerales和Suessiales的孢囊密度, TN、TP、BSi和TOC分别表示总氮、总磷、生物硅和总有机碳的含量(%)。 | |||||||||||
休眠孢囊是很多甲藻生活史的特殊休眠阶段, 约有10%~20%的甲藻能形成休眠孢囊(Head, 1996), 但是许多有害赤潮藻类能产生休眠孢囊, 而近岸海域大部分赤潮甲藻特别是循环发生赤潮的藻类均为孢囊形成种类(Matsuoka et al, 2000), 孢囊被认为是赤潮发生的“种源”(Wang et al, 2007; Anderson et al, 2014)。目前对于许多休眠孢囊的形态特征尚未完全清楚, 一些孢囊与营养细胞的对应关系还属未知(Tang et al, 2021)。因此, 通过显微镜观察得到的休眠孢囊种类多样性和密度常常被低估。虽然如此, 通过传统的形态学分类对孢囊集群进行分析鉴定, 仍是沉积物中孢囊研究的基础。本研究在福建省福宁湾7个站点的表层沉积物中共发现甲藻孢囊25种, 每个站位鉴定的孢囊种类数为15~21种。孢囊的种类多样性与我国及世界其他海域沉积物中的甲藻孢囊种类丰富度相近, 在我国其他海域表层沉积物中甲藻孢囊种类一般为20~40种(黄海燕等, 2010; 王艳等, 2012; Lu et al, 2017)。
福宁湾海域各站点甲藻孢囊密度介于178.6~ 386.3 cysts/g, 孢囊密度与我国其他近岸港湾如胶州湾(李影等, 2017)、北黄海(石雅君等, 2011)、辽东半岛(李大成等, 2019)和深圳湾(赵薇等, 2021)等相近, 且略高于其他近岸海域及河口地区如渤海湾(王艳等, 2012)、长江口海域(黄海燕等, 2010)、珠江口(Lu et al, 2017)以及福建兴化湾(祝跃等, 2008)等。甲藻孢囊通常较易在颗粒大小、沉降性质与之相近的粘土中积累, 一般沉积物粒径较小的黏性沉积物中甲藻孢囊密度较高(Yamaguchi et al, 1995)。福宁湾内整体沉积物颗粒较细, 以泥和砂质泥为主, 仅在近岸区域有较粗的砂质粉砂和粉砂等岛屿侵蚀物质分布(郭俊杰等, 2021), 较细的沉积物更有利于孢囊的沉积。从孢囊的地理分布来看, 大部分高值区位于在短表岛以北的近岸海域以及长表岛外海域, 而低值区则位于长表岛至海尾角的近岸海域。沉积物粒径分析表明, 在长表岛和海尾角附近沉积物粒径较粗, 以砂质泥为主, 而在长表岛南部则以较细的泥质沉积物为主(郭俊杰等, 2021)。此外, 在长表岛东南海域FN2至FN7断面, 水深呈现出明显增加趋势(图 1), 更有利于孢囊沉积。而位于近岸海域的FN1虽然水深较浅, 但该海域初级生产力较高, 浮游植物细胞密度明显高于其他远岸海域(全汉锋等, 2015), 同时沉积物也以较细的泥质为主, 致使该海域孢囊密度也较高。
福宁湾沉积物中甲藻孢囊的第一优势种为别什藻, 平均密度为69.8 cysts/g, 平均百分比为25.0%。别什藻是一种小型薄壁甲藻, 能形成孢囊(Raho et al, 2018)。在世界许多海域沉积物中已经发现别什藻(Sildever et al, 2017; Takahashi et al, 2014), 该藻孢囊在我国华南沿海沉积物中也广泛分布(Liu et al, 2020)。而该藻在福宁湾浮游植物调查中尚未报道, 可能是因为体型微小而被忽略, 其孢囊的广泛而大量分布说明别什藻是福宁湾浮游植物中的常见优势甲藻。有研究表明, 以光能自养型为主要营养方式的某种甲藻的孢囊大幅度上升, 可在一定程度上说明甲藻生产力的上升以及浮游植物和孢囊物种多样性的下降, 如挪威奥斯陆湾沉积物中多纹舌甲藻孢囊密度的增加说明了富营养化程度及初级生产力的上升(Dale et al, 1999), 而大亚湾沉积物中高密度的锥状斯氏藻孢囊说明了海洋富营养化程度和锥状斯氏藻赤潮的发生(Wang et al, 2011)。虽然在本研究中别什藻孢囊是福宁湾沉积物中的优势孢囊类别, 但仅凭一次表层沉积物中的孢囊调查难以揭示浮游植物和富营养化状况的变迁状况, 需要进一步对柱状沉积物中孢囊的垂直分布进行研究, 以追溯福宁湾海洋环境变化历程。
3.2 福宁湾沉积物中有毒有害甲藻孢囊的分布及赤潮发生风险在本研究中有毒有害赤潮藻类孢囊种类丰富, 共鉴定出有毒有害赤潮甲藻孢囊9种。亚历山大藻是麻痹性贝类毒素(PSP)原因种, 亚历山大藻在我国沿海发生了多起赤潮(于仁成等, 2020), 同时亚历山大藻的孢囊也广泛分布在我国沿海沉积物中(Tang et al, 2021), PSP毒素也在浮游植物和贝类样品中被广泛检出(Liu et al, 2017), 而且大亚湾海域亚历山大藻孢囊被认为是贝类体内PSP毒素的重要来源(Wang et al, 2011)。本研究鉴定出三种亚历山大藻孢囊, 另外有一种未鉴定至种的亚历山大藻孢囊, 其中两种(奥氏亚历山大藻和链状/塔玛亚历山大藻)孢囊复合体为PSP毒素原因种。而平野亚历山大藻可产生goniodomine A毒素(Murakami et al, 1998), 该藻营养细胞已经在我国沿海广泛分布(宋伦等, 2021; Yu et al, 2021), 但其孢囊尚属首次在我国沿海沉积物中出现。这些亚历山大藻孢囊仅零星分布且密度较低, 而其他PSP毒素原因种如链状裸甲藻(Gymnodinium catenatum)的孢囊未在本研究中检出, 由此说明福宁湾发生亚历山大藻赤潮和PSP毒素中毒事件的风险较低, 实际上在福宁湾以往的浮游植物调查中也尚未有PSP毒素原因种的记录(陈国斌等, 2004; 全汉锋等, 2015)。
具刺膝沟藻和网状原角藻能产生虾夷扇贝毒素(YTX)(Chikwililwa et al, 2019), 而具刺膝沟藻在福宁湾所有站位均有分布。虽然我国目前尚无YTX毒素原因种的赤潮, 但是这些藻类的孢囊在沉积物中普遍分布(石雅君等, 2011; Tang et al, 2021), YTX类毒素也不时在浮游植物样品和贝类样品中被检出(Jiang et al, 2017; Liu et al, 2021)。锥状斯氏藻是全世界范围内广泛分布的孢囊种类, 在我国南海、东海、南黄海的近岸海域广泛分布(Tang et al, 2021), 其赤潮也常在广东大亚湾发生(Wang et al, 2007), 同时锥状斯氏藻也是福宁湾浮游植物中的常见种类(陈国斌等, 2004), 本研究中其孢囊分布较为广泛而且密度较高。Barrufeta bravensis是一种裸甲藻新属新种, 曾在西北地中海发生赤潮(Sampedro et al, 2011), 我国目前尚未有该种的报道, 本研究中该藻孢囊分布广泛而且密度较高, 需引起关注。
4 结论(1) 在福宁湾表层沉积物中分析鉴定出甲藻孢囊25种, 甲藻孢囊密度介于178.6~386.3 cysts/g, 孢囊密度高值区分布在水深较深、初级生产力较高、沉积物较细的海域。
(2) 别什藻(Biecheleria tirezensis)孢囊是福宁湾沉积物中甲藻孢囊的第一优势种, 并且在所有站位均有分布, 但该藻在福宁湾浮游植物调查中尚未报道, 可能是因为体型微小而被忽略, 其孢囊的广泛而大量分布说明别什藻是福宁湾浮游植物中的常见优势甲藻。
(3) 福宁湾有毒有害甲藻的孢囊种类丰富, 共发现9种有毒有害甲藻孢囊, 大部分有毒有害甲藻孢囊仅零星分布, 但Barrufeta bravensis、具刺膝沟藻和锥状斯氏藻的孢囊分布广泛且密度比较高, 具有引发赤潮的潜势, 需引起关注。
于仁成, 吕颂辉, 齐雨藻, 等, 2020. 中国近海有害藻华研究现状与展望. 海洋与湖沼, 51(4): 768-788 |
王艳, 黄琳, 顾海峰, 等, 2012. 中国渤海海域甲藻孢囊的种类多样性和生态地理分布. 植物学报, 47(2): 125-132 |
石雅君, 刘东艳, 邵红兵, 等, 2011. 北黄海表层沉积物中甲藻孢囊的分布特征. 海洋通报, 30(3): 320-327 DOI:10.3969/j.issn.1001-6392.2011.03.014 |
邢殿楼, 霍堂斌, 吴会民, 等, 2006. 总磷、总氮联合消化的测定方法. 大连水产学院学报, 21(3): 219-225 DOI:10.3969/j.issn.1000-9957.2006.03.005 |
全汉锋, 单秀娟, 戴芳群, 2015. 福宁湾浮游植物的群落结构特征. 渔业科学进展, 36(3): 1-7 |
刘炜, 李奶姜, 李婕, 2008. 福宁湾水质状况及其水体富营养化的初步探讨. 海洋通报, 27(1): 111-115 DOI:10.3969/j.issn.1001-6392.2008.01.016 |
李大成, 邵魁双, 巩宁, 等, 2019. 甲藻孢囊在辽东半岛沿岸海域表层沉积物中的分布. 水产科学, 38(4): 545-549 DOI:10.16378/j.cnki.1003-1111.2019.04.016 |
李影, 汤亚楠, 沈萍萍, 等, 2017. 胶州湾表层沉积物中甲藻孢囊的分布. 海洋与湖沼, 48(4): 760-766 |
谷阳光, 王朝晖, 吕颂辉, 等, 2010. 粤西海域表层沉积物生源要素分布与污染评价. 深圳大学学报理工版, 27(3): 347-353 |
宋伦, 毕相东, 付杰, 等, 2021. 黄海北部真核微藻粒级结构及环境关联. 中国环境科学, 41(3): 1336-1344 DOI:10.3969/j.issn.1000-6923.2021.03.037 |
陈国斌, 戴红, 李伏庆, 2004. 福建省三都湾赤潮监控区福宁湾浮游植物的生态. 台湾海峡, 23(4): 469-480 DOI:10.3969/j.issn.1000-8160.2004.04.011 |
赵薇, 周进, 徐轶肖, 2021. 深圳盐田港海域甲藻孢囊的分布特征[J/OL]. 应用与环境生物学报. [2021-11-26). https://doi.org/10.19675/j.cnki.1006-687x.2021.09016.
|
祝跃, 孙爱梅, 李超, 等, 2008. 福建兴化湾海域沉积物中的甲藻孢囊记录. 台湾海峡, 27(3): 309-316 DOI:10.3969/j.issn.1000-8160.2008.03.007 |
郭俊杰, 胡日军, 陈娟娟, 等, 2021. 福建福宁湾表层沉积物粒度特征及沉积动力环境分区. 海洋湖沼通报, 43(5): 50-59 DOI:10.13984/j.cnki.cn37-1141.2021.05.007 |
黄海燕, 陆斗定, 夏平, 等, 2010. 2006—2007年冬季长江口海域甲藻孢囊的分布及其与环境的关系. 生态学报, 30(20): 5569-5576 |
ANDERSON D M, KEAFER B A, KLEINDINST J L, et al, 2014. Alexandrium fundyense cysts in the Gulf of Maine: long-term time series of abundance and distribution, and linkages to past and future blooms. Deep Sea Research Part II: Topical Studies in Oceanography, 103: 6-26 DOI:10.1016/j.dsr2.2013.10.002 |
BRAVO I, FIGUEROA R I, 2014. Towards an ecological understanding of dinoflagellate cyst functions. Microorganisms, 2(1): 11-32 DOI:10.3390/microorganisms2010011 |
CHIKWILILWA C, MCCARRON P, WANIEK J J, et al, 2019. Phylogenetic analysis and yessotoxin profiles of Gonyaulax spinifera cultures from the Benguela Current upwelling system. Harmful Algae, 85: 101626 DOI:10.1016/j.hal.2019.101626 |
DALE B, THORSEN T A, FJELLSA A, 1999. Dinoflagellate cysts as indicators of cultural eutrophication in the Oslofjord, Norway. Estuarine, Coastal and Shelf Science, 48(3): 371-382 |
ELLEGAARD M, RIBEIRO S, 2018. The long-term persistence of phytoplankton resting stages in aquatic 'seed banks'. Biological Reviews, 93(1): 166-183 DOI:10.1111/brv.12338 |
GÓMEZ F, 2012. A checklist and classification of living dinoflagellates (Dinoflagellata, Alveolata). CICIMAR Oceánides, 27(1): 65-140 DOI:10.37543/oceanides.v27i1.111 |
HEAD M J, 1996. Modern dinoflagellate cysts and their biological affinities [M] // JANSONIUS J, MCGREGOR D C. Palynology: Principles and Applications. Dallas: American Association of Stratigraphic Palynologists: 1197-1248.
|
JIANG T, LIU L, LI Y, et al, 2017. Occurrence of marine algal toxins in oyster and phytoplankton samples in Daya Bay, South China Sea. Chemosphere, 183: 80-88 DOI:10.1016/j.chemosphere.2017.05.067 |
LIU C, JI Y, ZHANG L, et al, 2021. Spatial distribution and source of biotoxins in phytoplankton from the South China Sea, China. Journal of Hazardous Materials, 418: 126285 DOI:10.1016/j.jhazmat.2021.126285 |
LIU L, WANG Z H, LU S H, 2020. Diversity and geographical distribution of resting stages of eukaryotic algae in the surface sediments from the southern Chinese coastline based on metabarcoding partial 18S rDNA sequences. Marine Ecology, 41(3): e12585 |
LIU S M, YE X W, ZHANG J, et al, 2002. Problems with biogenic silica measurement in marginal seas. Marine Geology, 192(4): 383-392 DOI:10.1016/S0025-3227(02)00531-5 |
LIU Y, YU R C, KONG F Z, et al, 2017. Paralytic shellfish toxins in phytoplankton and shellfish samples collected from the Bohai Sea, China. Marine Pollution Bulletin, 115(1/2): 324-331 |
LU X X, WANG Z H, GUO X, et al, 2017. Impacts of metal contamination and eutrophication on dinoflagellate cyst assemblages along the Guangdong coast of southern China. Marine Pollution Bulletin, 120(1/2): 239-249 |
MATSUOKA K, FUKUYO Y
, 2000. Technical Guide for Modern Dinoflagellate Cyst Study. Tokyo, Japan: WESTPAC-HAB, Japanese Society for the Promotion of Science
|
MURAKAMI M, OKITA Y, MATSUDA H, et al, 1998. From the dinoflagellate Alexandrium hiranoi. Phytochemistry, 48(1): 85-88 DOI:10.1016/S0031-9422(97)00756-5 |
RAHO N, FRAGA S, ABAD J P, et al, 2018. Biecheleria tirezensis sp. Nov. (Dinophyceae, Suessiales), a new halotolerant dinoflagellate species isolated from the athalassohaline Tirez natural pond in Spain. European Journal of Phycology, 53(1): 99-113 DOI:10.1080/09670262.2017.1386328 |
SAMPEDRO N, FRAGA S, PENNA A, et al, 2011. Barrufeta bravensis gen. nov. sp. nov. (Dinophyceae): a new bloom-forming species from the northwest Mediterranean Sea. Journal of Phycology, 47(2): 375-392 DOI:10.1111/j.1529-8817.2011.00968.x |
SILDEVER S, KREMP A, ENKE A, et al, 2017. Spring bloom dinoflagellate cyst dynamics in three eastern sub-basins of the Baltic Sea. Continental Shelf Research, 137: 46-55 DOI:10.1016/j.csr.2016.11.012 |
TAKAHASHI K, SARAI C, IWATAKI M, 2014. Morphology of two marine woloszynskioid dinoflagellates, Biecheleria brevisulcata sp. nov. and Biecheleriopsis adriatica (Suessiaceae, Dinophyceae), from Japanese coasts. Phycologia, 53(1): 52-65 DOI:10.2216/13-192.1 |
TANG Y Z, GU H F, WANG Z H, et al, 2021. Exploration of resting cysts (stages) and their relevance for possibly HABs-causing species in China. Harmful Algae, 107: 102050 DOI:10.1016/j.hal.2021.102050 |
WANG Z H, NIE X P, JIANG S J, et al, 2011. Source and profile of paralytic shellfish poisoning toxins in shellfish in Daya Bay, South China Sea. Marine Environmental Research, 72(1/2): 53-59 |
WANG Z H, QI Y Z, YANG Y F, 2007. Cyst formation: an important mechanism for the termination of Scrippsiella trochoidea (Dinophyceae) bloom. Journal of Plankton Research, 29(2): 209-218 DOI:10.1093/plankt/fbm008 |
YAMAGUCHI M, ITAKURA S, IMAI I, 1995. Vertical and horizontal distribution and abundance of resting cysts of the toxic dinoflagellate Alexandrium tamarense and Alexandrium catenella in sediments of Hiroshima Bay, the Seto Inland Sea, Japan. Nippon Suisan Gakkaishi, 61(5): 700-706 DOI:10.2331/suisan.61.700 |
YU R C, ZHANG Q C, LIU Y, et al, 2021. The dinoflagellate Alexandrium catenella producing only carbamate toxins may account for the seafood poisonings in Qinhuangdao, China. Harmful Algae, 103: 101980 DOI:10.1016/j.hal.2021.101980 |
 2022, Vol. 53
2022, Vol. 53

